Introducción
De acuerdo a la Organización Mundial de la Salud (OMS), las bacterias y los parásitos son los causantes de la gran mayoría de las enfermedades humanas a nivel mundial. En particular, la tuberculosis (TB) permanece como una de las principales causas de muertes en el mundo entre las enfermedades infecciosas. La TB es una infección ocasionada por la bacteria Mycobacterium tuberculosis (M. tuberculosis), transmitida de persona a persona vía bacilos tuberculosos de la garganta y pulmones de gente con la enfermedad respiratoria activa. En personas saludables, la infección a menudo no tiene síntomas, dado que el sistema inmunológico actúa como una barrera para la bacteria. Sin embargo, un número creciente de personas contraen la TB, porque su sistema inmunológico está comprometido por diversos factores, como: fármacos inmunosupresores, substancias de abuso, virus de la inmunodeficiencia humana (VIH), entre otros.1,2
En 2009, la OMS estableció un estimado de 9.27 millones de casos de incidencia de TB para 2007, lo cual en previos años fue de 9.24, 8.3 y 6.6 millones de casos para los años 2006, 2000 y 1990, respectivamente. En 2013, 9 millones de personas enfermaron de tuberculosis y 1,5 millones murieron por esta enfermedad. Actualmente, una tercera parte de la población está infectada con M. tuberculosis y la OMS estima que cerca de 30 millones de personas estarán infectadas en los próximos 20 años, no solamente en países subdesarrollados, sino también en países desarrollados, por lo que se considera que esta enfermedad infecciosa esta re-emergiendo.3,4
En México, en el 2008, la Secretaría de Salud (SSA) informó de acuerdo con los datos disponibles en el Sistema Nacional de Vigilancia Epidemiológica (SINAVE) de una disminución en la incidencia de la TB, aunque, la enfermedad continúa presentándose con más de 17 mil casos nuevos y cerca de dos mil defunciones cada año. La TB presenta patrones de concentración bien definidos con tasas de incidencia elevadas en diversos estados, principalmente en el occidente y Golfo de México y con menor incidencia en los estados del centro. Tamaulipas y Baja California duplican la tasa nacional (13.5); Los estados de Veracruz, Chiapas, Nuevo León, Jalisco, Sinaloa, Nayarit, Guerrero, Sonora, Oaxaca y Chihuahua concentran 70% de los casos identificados en el país.5
Los dos principales factores que están ocasionando la epidemia actual de TB incluyen la expansión con el VIH y su asociación con la TB activa y el incremento de cepas resistentes (multi fármaco-resistentes y extensivamente fármaco-resistentes) de M. tuberculosis a los fármacos de primera línea más efectivos. En 2006 se informó que 489,139 (~5%) casos nuevos de TB diagnosticados en ese año fueron resistentes a isoniazida y rifampicina, lo cual representa un incremento del 12% desde 2004 y un 56% desde el año 2000. Además, la OMS en 2012 estimo que ~5.7 de los casos de tuberculosis en el mundo presentan una multi- resistencia a los fármacos antituberculosos.6 Otros factores que contribuyen a la expansión de la TB en la población son: la detección de casos y las pobres tasas de curación en países subdesarrollados, la transmisión activa en lugares con hacinamiento, la inmigración de países con incidencia alta, el uso inadecuado de los fármacos y la falta de vivienda. Además, el alto número de cepas multifármaco-resistentes de M. tuberculosis circulando a nivel mundial ha incrementado la posibilidad que la TB pueda ser una enfermedad incurable.7
Actualmente la terapia de frontera consiste en la administración de uno o dos de los cuatro fármacos (isoniazida, rifampicina, pirazinamida y etambutol) de primera línea por 2 meses, seguidos por 4 meses de terapia con isoniazida y rifampicina, o el uso de fármacos de segunda línea como: etionamida, kanamicina, clofazimina, protionamida, cicloserina, tiacetazon y ácido para-amino salicílico; pero la inefectividad de la terapia se debe a su larga duración, así como al surgimiento de resistencia a los fármacos,8 aunque, recientemente la Food and Drug Administración (FDA) y la European Medicines Agency (EMA) aprobaron a los fármacos bedaquilina y delamanida (Figura 1) para el tratamiento de la tuberculosis multifármaco-resistente.9,10 Además, la eficacia del tratamiento farmacológico de la TB tiene que ver también con el lento desarrollo de las micobacterias, que pueden además generar formas latentes cuya actividad metabólica es tan baja que las convierten en blancos extremadamente difíciles. Por lo cual, una opción para resolver el problema de la resistencia es el desarrollo de nuevos agentes terapéuticos que tengan un mecanismo de acción diferente al de los fármacos antituberculosos actuales.

Figura 1 Estructura de los fármacos recientemente aprobados por la FDA y la EMA para combatir la tuberculosis multifármaco- resistente; Bedaquilina: (1R,2S)-1-(6-Bromo-2-metoxi-3-quinolil)- 4-dimetilamino-2-(1-naftil)-1-fenil-butan-2-ol; Delamanida: (2R)- 2-Metil-6-nitro-2-[(4-{4-[4-(trifluorometoxi)fenoxi]-1-piperidinil} fenoxi)metil]-2,3-dihidroimidazo[2,1-b][1,3]oxazol.
En vista de la importancia de la TB como una enfermedad infecciosa y la creciente incidencia de cepas resistentes a los fármacos de primera y segunda línea, es necesario de manera urgente el desarrollo de nuevos fármacos para el tratamiento de la TB. En este sentido dos principales enfoques están siendo llevados a cabo. Uno de ellos está basado en la síntesis de análogos de fármacos antituberculosos existentes con el objetivo de acortar y mejorar el tratamiento. Así, varios investigadores han desarrollado diversos análogos de pirazinamida, isoniazida y etambutol con una actividad significativa contra la TB.11 La segunda estrategia implica la búsqueda de nuevas estructuras que nunca se han presentado para el tratamiento de la TB. En el contexto del segundo enfoque, en esta revisión hacemos un análisis de los resultados de varios grupos de investigación que se han enfocado en el diseño, síntesis y evaluación biológica in vitro e in vivo de nuevos derivados de 1,4-dióxido de quinoxalina como prometedores agentes antituberculosos, lo cual en un futuro cercano puede mejorar el actual tratamiento quimioterapéutico de la TB.
Quinoxalinas
Las quinoxalinas (Figura 2) son un grupo de compuestos heterocíclicos formado por la fusión de un anillo de benceno y una pirazina; se describen como biososteros de las quinolinas, naftaleno, benzotiofeno y otros anillos aromáticos tales como la piridina y pirazina, que han mostrado interesantes propiedades biológicas; su interés para el desarrollo de nuevos fármacos ha ido en aumento, considerándose una "estructura privilegiada".12 Interesantemente se ha informado de una similitud entre la quinoxalina y fármacos antituberculosos, así como la presencia del fragmento de la quinoxalina en algunos antibióticos de amplio espectro, por lo que se espera que análogos de quinoxalina puedan exhibir una actividad antimicobacteriana.13-15
1,4-Dióxido de quinoxalina
En las últimas dos décadas muchos compuestos heterociclos derivados de mono-óxido y di-óxido de quinoxalina (Figura 2) han sido presentados con diversas actividades biológicas. En general, mientras que los derivados de 2-quinoxalinona han presentado una actividad antifúngica, los derivados de 1-óxido de quinoxalina han mostrado una actividad antibacterial.16 Inicialmente, algunos investigadores indicaron una actividad antibacteriana y antimicobacteriana de varios compuestos derivados de 1,4-dióxido de 2-metilquinoxalina con la presencia de un grupo metil o metil halógeno en la posición 2(3) del anillo, el cual favorece la actividad antimicrobiana. Posteriormente, como una contribución al conocimiento de los compuestos derivados de 1,4-dióxido de quinoxalina, Carta y cols., diseñaron una serie sustituida en las posiciones 6 y/o 7 en el fragmento del benceno con el objetivo de evaluar el efecto de los grupos aceptores y donadores de electrones sobre la actividad biológica. Sus resultados indicaron que el sistema de 1,4-dióxido de quinoxalina es un buen bloque de construcción (scaffold) para el desarrollo de fármacos con actividad antituberculosa, informando del compuesto 1 (Figura 3), con un valor de concentración mínima inhibitoria (CMI) de 0.39 μg/mL. El análisis de relación estructura- actividad de esta serie indicó que la actividad se ve favorecida por la presencia de un grupo tiofenil en la posición 2 asociada con grupos aceptores de electrones (CF3, Cl, y di-F) en el fragmento del benceno, mientras que la combinación con grupos donadores de electrones (CH3, EtO), así como con sustituyentes derivados de bromometil en la posición 3 reducen la actividad.17
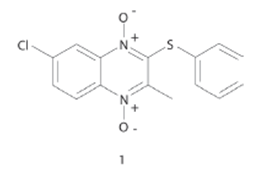
Figura 3 Estructura del compuesto derivado de 1,4-dióxido de quinoxalina con un átomo de Cl en la posición 7, el cual favorece la actividad antituberculosa.
Inicialmente, en el desarrollo de nuevos fármacos antituberculosos el grupo de investigación del Dr. A. Monge cita una serie de derivados de 1,4-dióxido de 2-carbonitriloquinoxalina (Compuesto 2, Figura 4) con valores de inhibición del 99% del crecimiento de M. tuberculosis H37Rv. Posteriormente, llevaron a cabo la síntesis de derivados de 1,4-dióxido de 2-etoxicarbonilquinoxalina (Compuesto 3, Figura 4), en donde sustituyeron el grupo carbonitrilo por un grupo éster con el objetivo de determinar la contribución del grupo carbonitrilo en la actividad antituberculosa, así como de estudiar la importancia del volumen molecular y la hibridación del átomo de carbono de sp a sp2 en la posición 2. Los resultados de la evaluación biológica in vitro indicaron una inhibición del 100% del crecimiento de M. tuberculosis H37Rv, sugiriendo que los derivados de 2-carboxilatoquinoxalina son más solubles que los derivados de 2-carbonitriloquinoxalina.18 Además, los resultados de los derivados de carbonitrilo indicaron cierta toxicidad en líneas celulares Vero, por lo que sugirieron la incorporación de otro tipo de sustituyentes.19 De manera relevante, en este tipo de compuestos se informó que la pérdida de los dos grupos N-óxido generalmente llevan a una pérdida o disminución de la actividad antimicobacteriana,20 lo cual confirma que la presencia de los grupos N-óxido son esenciales para la actividad de los compuestos. Además, indicaron que compuestos con un átomo de cloro en la posición 6 ó 7 del anillo de 1,4-dióxido de quinoxalina y los correspondientes derivados no sustituidos presentaron la mejor actividad antimicobacteriana. Sin embargo, grupos donadores de electrones (CH3) sobre el fragmento del benceno del anillo de la quinoxalina reducen la actividad.21
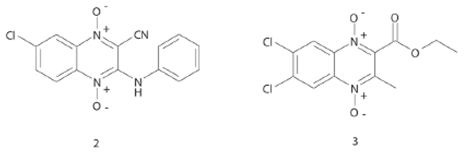
Figura 4 Estructura de los compuestos derivados de 1,4-dióxido de 2-carbonitrilo quinoxalina y 2-carboxilatoquinoxalina con actividad antimicobacteriana.
Adicionalmente, sintetizaron derivados de 1,4-dióxido de 2-carbonilquinoxalina, principalmente con sustituyentes acetil y benzoil en la posición 2. El análisis de la relación estructura-actividad indicó que grupos aceptores de electrones en la posición 7 o en la posición 6 y 7 del anillo del benceno reducen los valores de CMI y concentración inhibitoria 50 (CI50), de manera contraria los grupos donadores de electrones incrementan estos valores. Cabe destacar que los mejores valores de índice de selectividad fueron obtenidos de compuestos no sustituidos o sustituido solo con un grupo en la posición 7.22 Posteriormente, informaron que derivados de 1,4-dióxido de 2-carboxilatoquinoxalina di-sustituidos en la posición 6 y 7 con un grupo metil mostraron una baja actividad, confirmando que los grupos metil o metoxi en posición 7 reducen los valores de CMI y CI50. Adicionalmente, indicaron que la actividad antituberculosa depende del sustituyente en la posición 2, con el siguiente orden: bencil > etil > 2-metoxietil > alil > ter-butil. Finalmente, confirmaron que los mejores valores de índice de selectividad se obtienen de compuestos no sustituidos o con un solo sustituyente en la posición 7.23
Interesantemente, Villar y cols., encontraron que el compuesto 4 (Figura 5), un derivado de 1, 4-dióxido de 2-carboxilatoqui- noxalina presentó una fuerte actividad in vitro (CMI= 0.78 μg/ mL) sobre M. tuberculosis H37Rv comparable a los fármacos usados clínicamente, aunque requirieron de una dosis alta del compuesto para lograr una equivalente reducción en unidades formadoras de colonias (UFC) de M. tuberculosis en pulmón de ratones hembra C57BL/6 infectados vía aerosol a dosis bajas. Sus resultados muestran la gran importancia del átomo de cloro en la posición 7 del fragmento del benceno en la actividad biológica.24 Continuando con el desarrollo de derivados de 1,4-dióxido de 2-carboxilatoquinoxalina, Vicente y cols., evaluaron una nueva serie de compuestos en cepas resistentes de M. tuberculosis, siendo los derivados con un grupo bencilo en el carboxilato los compuestos más activos con valores de CMI de 0.4 μg/mL o menos. Particularmente, encontraron que el compuesto 5 (Figura 5) fue activo contra la cepa de M. bovis resistente al fármaco PA-824, lo cual indica que este tipo de compuestos tienen un mecanismo de acción diferente al del compuesto PA-824, el cual es bioreducido a una forma activa. Se ha descrito que los derivados de dióxido de quinoxalina tienen un nuevo mecanismo de acción no relacionado a los fármacos antituberculosos actuales. Una propuesta de mecanismo de acción indica que las quinoxalinas antimicrobianas previenen la síntesis del RNA por enlace al sitio CpG sobre el DNA.25 Aunque, un reciente estudio de compuestos derivados de 2,3-dicloroquinoxalina indica que pueden ser inhibidores de la enzima corismato mutasa.26 Adicionalmente a los mecanismos de acción descritos, Radwan y cols., han determinado que los compuestos derivados de 1,4-dióxido de quinoxalina son capaces de interactuar con el sitio activo de la ADN girasa de M. tuberculosis.27 El compuesto 5 también fue evaluado bajo condiciones anaeróbicas y aeróbicas para determinar la actividad contra la cepa de M. tuberculosis H37Rv, obteniendo resultados de CMI bajo condiciones aeróbicas de 0.24 μg/mL y bajo condiciones anaeróbicas de 0.42 μg/mL, lo cual indica que este tipo de compuestos tiene una actividad contra bacterias no replicativas, una propiedad única de los compuestos derivados de 1,4-dióxido de quinoxalina. Finalmente, el compuesto 5 presento una actividad in vivo con una adecuada biodisponibilidad oral y un tiempo de vida media de eliminación de 4 a 8 horas.28
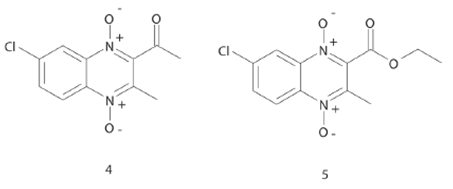
Figura 5 Estructura de los compuestos derivados de 1,4-dióxido de 2-carboxilatoquinoxalina con actividad antimicobacteriana.
Recientemente, Ancizu y cols. determinaron que en derivados de 1,4-dióxido de 3-metilquinoxalina-2-carboxamida, como el compuesto 6, con valores de CMI < 0.2 μg/mL (Figura 6) la introducción de sustituyentes aceptores de electrones en el anillo de quinoxalina resulta en un incremento en la actividad antituberculosa de los derivados. De manera contraria la inserción de grupos donadores de electrones resulta en una reducción de la actividad. Además, la incorporación de grupos metoxi en la posición para del anillo de benceno, llevan a un aumento de la toxicidad, así como la variación en el número de carbonos de la cadena alifática.29
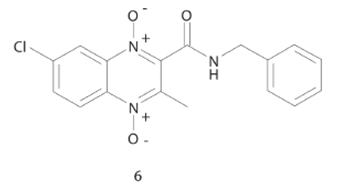
Figura 6 Estructura del compuesto derivado de 1,4-dióxido de 3-metilquinoxalina-2-carboxamida con actividad antituberculosis.
Posteriormente, Moreno y cols. sintetizaron una nueva serie de derivados de 1,4-dióxido de 2-carboxamidaquinoxalina con el objetivo de evaluar de manera más profunda la longitud de la cadena alifática entre el grupo carboxamida y el anillo aromático en la posición 3 del anillo de quinoxalinas. El análisis de relación estructura-actividad confirmo como en previos trabajos que la incorporación de un grupo halogenado en la posición 7 del anillo de la quinoxalina incrementa la actividad antituberculosa,30 principalmente el átomo de cloro, así como se prefieren cadenas de un solo átomo de carbono después del grupo carboxamida. Finalmente, la adición de un grupo fenilo en la posición 3 del anillo de quinoxalina reduce la actividad antituberculosa, siendo mejor en esta posición un grupo metilo.31
De manera innovadora, Torres y cols., diseñaron una nueva serie de compuestos antituberculosos basándose en la hibridación de dos fragmentos ampliamente conocidos con actividad inhibitoria sobre M. tuberculosis: isoniazida y 1,4-dióxido de quinoxalina (Figura 7) con el objetivo de obtener una molécula que pueda ser oralmente biodisponible. Los resultados de actividad biológica de algunos compuestos de esta serie muestran valores de CI90 ≤10 μg/mL con valores de índice de selectividad ≥ 10. Interesantemente, sugieren que este tipo de compuestos pueden tener un mecanismo de acción dual, por una posible reacción de hidrólisis que puede liberar el fragmento de la isoniazida y actuar a través de su conocido mecanismo de acción, así como el fragmento de la quinoxalina puede ejercer su efecto, lo cual sinérgicamente puede contribuir a la acción antimicobacteriana.32
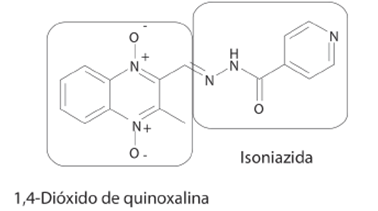
Figura 7 Compuesto con actividad antituberculosis diseñado a través de la hibridación de los fragmentos de isoniazida y 1,4-dióxido de quinoxalina.
Por otra parte, un nuevo enfoque sobre compuestos derivados de 1,4-dióxido de quinoxalina se llevó a cabo por Das y cols., a través del desarrollo de nuevas moléculas que contienen un grupo ceto conjugado α,β-insaturado (cinamoilo) (Compuesto 7, CI50= 1.03 μM, Figura 8) el cual puede interactuar con tioles celulares, teniendo como mecanismo de acción la alteración de funciones mitocondriales y otros procesos bioquímicos, el cual es diferente al de los fármacos antituberculosos actuales. El análisis de la relación estructura-actividad de los compuestos de esta serie llevo a determinar que grupos metoxi en el anillo de benceno llevan a una reducción de la potencia de hasta seis veces, sin embargo, las mono y di-sustituciones en posición meta mantienen la actividad biológica. Adicionalmente, la inserción de uno o dos átomos de cloro aumentaron la actividad biológica. Interesantemente este tipo de compuestos estimulan la respiración en mitocondrias de hígado de rata, lo cual es un indicativo que estos compuestos ejercen su mecanismo de acción a través de una vía diferente a la de los fármacos antituberculosos, lo cual sugiere la posibilidad de usar este tipo de compuestos en cepas fármaco-resistentes.33
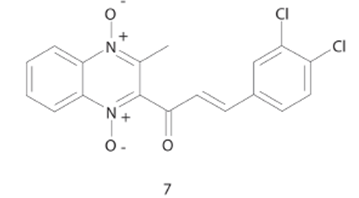
Figura 8 Estructura del compuesto derivado de 1,4-dióxido de quinoxalina con un grupo ceto conjugado α,β-insaturado con actividad antimicobacteriana.
En el contexto de otro tipo de aprovechamiento de las quinoxalinas para el desarrollo de fármacos antituberculosos Tarallo y cols., desarrollaron complejos de 1,4-dióxido de quinoxalina-hierro (Compuesto 8, CMI= 6.2 μg/mL, Figura 9), los cuales fueron evaluados sobre la cepa de M. tuberculosis H37Rv. Los resultados muestran que todos los ligandos y los complejos fueron activos contra M. tuberculosis. Interesantemente, los complejos quinoxalina-hierro resultaron más activos que sus correspondientes ligandos libres, demostrando que la coordinación con metales puede favorablemente modificar el perfil de la actividad antimicobacteriana de los derivados de 1,4-dióxido de quinoxalina. Adicionalmente los compuestos mostraron una baja toxicidad y un alto índice de selectividad.34
Conclusiones
A pesar de los esfuerzos y los recursos implicados en el desarrollo de nuevos fármacos antituberculosos, recientemente, sólo dos nuevos fármacos han sido introducidos durante los últimos 40 años para combatir a la tuberculosis multifármaco-resistente, por lo cual se requieren de más opciones terapéuticas para combatir a la TB. Las quinoxalinas son un bloque de construcción que no solamente es sintéticamente importante, sino que también posee un amplio rango de actividades biológicas, particularmente, el sistema 1,4-dióxido de quinoxalina se ha indicado tiene una actividad antimicobacteriana en modelos in vitro e in vivo comparable a los fármacos en uso clínico, con una baja toxicidad y una alta selectividad, por lo cual pueden ser una opción viable para el desarrollo de nuevos fármacos contra la tuberculosis.
Agradecimientos
Este artículo fue escrito en agradecimiento y homenaje al trabajo realizado por el Dr. Antonio Monge Vega, profesor de la Universidad de Navarra, España. El Dr. Gildardo Rivera, agradece el apoyo otorgado por parte de la Comisión de Operación y Fomento de Actividades Académicas (COFAA) y por los Estímulos al Desempeño de los Investigadores (EDI) del Instituto Politécnico Nacional.











 nueva página del texto (beta)
nueva página del texto (beta)




