Introducción
La urolitiasis es una condición médica en la que aparecen cálculos en el aparato urinario superior; inicialmente se produce la formación de un cristal litiasico y finalmente un cálculo renal, esto es consecuencia de complejos procesos fisicoquímicos como la nucleación, crecimiento y agregación.1 La orina es una solución en la que existen sustancias tales como: sales de calcio, oxalato, ácido úrico, fosfato y cistina. Dependiendo de su concentración, cada sustancia puede alcanzar diversas situaciones en cuanto a su saturación. Si se incrementa progresivamente la concentración, se alcanza un punto denominado sobresaturación urinaria.2 Ésta última da lugar a la formación de cristales a través de la combinación de los iones en solución para formar una fase sólida, proceso denominado nucleación. Posterior a la nucleación, ocurre el crecimiento del cristal y agregación de otros cristales.3 Es el tercer padecimiento más común del tracto urinario cuya etiología implica aspectos epidemiológicos, raciales, geográficos y hereditarios. El factor de riesgo a padecerlo es de 2-5 % en Asia, 8- 15 % en Europa y América y alrededor de un 20 % en Medio oriente.4 Por lo que representa un problema de salud pública por su morbilidad que da lugar a un elevado número de consultas médicas e ingresos hospitalarios con repercusión económica y social5
Este padecimiento ha afectado al ser humano a lo largo de la historia.6 Se tiene registro de diversos hallazgos arqueológicos, como el papiro de Ebers que data del año 1500 a.C, en los que se hace referencia al tratamiento de enfermedades del tracto urinario, incluyendo cólico renal y extracción de cálculos.7 La prevalencia de litiasis en el mundo contemporáneo varía de acuerdo con la población estudiada.8 Afecta a la población tanto de países desarrollados y en vías de desarrollo, observándose un aumento significativo en la incidencia y prevalencia en los últimos años.9,10 La franja etaria más afectada es de 20 a 40 años con un predominio mayor en hombres que en mujeres con 12 y 6 % respectivamente con una elevada tasa recidiva.11 En México se han efectuado pocos estudios epidemiológicos de la urolitiasis; este padecimiento comprende el 13 % de hospitalizaciones por enfermedad renal en el ámbito nacional en el Instituto Mexicano del Seguro Social (IMSS).12
Actualmente el tratamiento para la litiasis urinaria dispone de técnicas para la extracción de cálculos renales tales como la litotricia extracorpórea por ondas de choque, ureteroscopía para cálculo y nefrolitotomía percutánea, sin embargo, son procedimientos quirúrgicos que pueden tener diversos efectos secundarios: Tales como: hipertensión, insuficiencia renal, hematuria, pancreatitis, y fragmentos residuales persistentes que pueden dar lugar a la formación de nuevos cálculos.13 Por otra parte no existe un fármaco eficaz para el tratamiento de esta enfermedad debido a los diversos factores involucrados en esta patogénesis.4 Además es un padecimiento con una tasa recidiva alta, en general después de un año del primer episodio de litiasis, el 15 % de los pacientes presentan nuevos cálculos este índice puede llegar a 35- 40 % a los 5 años y hasta el 50 % a los 10 años.8
Así mismo es un padecimiento en el cual existe el riesgo de desarrollar complicaciones importantes como las infecciones urinarias, ya que se obstruye el flujo de la orina favoreciendo las condiciones para el crecimiento bacteriano. Dentro de las bacterias que con mayor frecuencia se asocian con infecciones urinarias se encuentran Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y Proteus mirabilis. Algunas de ellas han desarrollado diversos mecanismos de resistencia en contra de los agentes antimicrobianos, lo que dificulta el tratamiento de las infecciones del tracto urinario.14 Por otra parte, diversos estudios sugieren que las reacciones que generan radicales libres juegan un papel muy importante como una de las causas de la urolitiasis. Bajo ciertas condiciones patológicas la formación de radicales libres se incrementa, disminuyendo las defensas antioxidantes de las células, lo que eventualmente da lugar a daño celular oxidativo.15 La formación de cálculos renales, en su mayoría constituidos por oxalato de calcio, puede ser causada por el daño celular presente en la membrana, ya que de esta manera se facilita la fijación de los cristales que al irse acumulando dan lugar a la formación del urolito.16 Las plantas medicinales son una alternativa terapéutica, ya que contienen constituyentes químicos, que poseen actividades biológicas diversas.13 Según la Organización Mundial de la Salud (OMS), entre el 65-80 % de la población mundial de países en desarrollo depende esencialmente de medicina tradicional para la atención primaria de su salud, debido a la pobreza y la falta de acceso a la medicina "moderna". Las plantas medicinales son su recurso más abundante, accesible y conocido de la medicina tradicional mexicana, cuyos orígenes se remontan a la época prehispánica y con influencia de otras culturas. Sin embargo es necesario determinar los efectos tóxicos de las sustancias contenidas en las plantas, ya que pueden ser peligrosas y causar efectos adversos en el ser humano. Por lo tanto la evaluación de las propiedades tóxicas de una sustancia es crucial para el uso seguro de las especies vegetales.17
En el presente estudio se seleccionó Berberis trifoliata (Familia Berberidaceae) para evaluar la actividad biológica relacionada con enfermedades renales, debido a información etnobotánica respecto al uso como: laxante y diurético en el noreste de México. Es un arbusto de 1-4.5 m de altura con tronco amarillento, hojas alternadas, estipiladas (3-5 cm de longitud), pinadas, usualmente dentadas, flores amarillas, posee frutos rojos en forma de grano, y es conocida con diferentes nombres vulgares tales como: agrito, agrillo y palo amarillo.18 Los principales compuestos encontrados en especies del género Berberis, son alcaloides como la bereberina y la berbamina, además se han reportado la presencia de taninos, esteroles, triterpenos y compuestos fenólicos.19
El objetivo de este trabajo fue evaluar la actividad antiurolítica in vitro, reflejándose como la inhibición en el proceso de nucleación en la litiasis, así como la capacidad de captura de radicales libres, actividad antimicrobiana y tóxica del extracto metanólico de B. trifoliata; procesos que están íntimamente relacionados con enfermedades renales.
Material y método
Material vegetal
Se utilizó la parte aérea de Berberis trifoliata, la cual fue colectada en la localidad de Casa Blanca, ubicada en el municipio de Santa Catarina, Nuevo León. (25°39'08.23'' Lat. N, 100°42'40.14'' Long. O. 1169 m snm). La planta fue identificada en la Facultad de Ciencias Biológicas de la UANL por el Dr. Jorge Armando Verduzco Martínez.
Obtención del extracto
El material vegetal fue secado a temperatura ambiente y posteriormente triturado utilizando un molino para grano manual (Victoria). La extracción del material vegetal se llevó a cabo mediante maceración a temperatura ambiente (23 ± 2 °C) con agitación constante utilizando 71.5 g de planta y 300 mL de metanol como disolvente. El extracto fue filtrado y concentrado mediante presión reducida en un rotavapor (Yamato Scientific CO. LTD. RE 200). Una vez eliminado el disolvente en su totalidad, se procedió a obtener el rendimiento del extracto utilizando la siguiente fórmula:
Donde:
PE = Peso del extracto obtenido
PI = Peso inicial del material vegetal
Actividad antiurolítica in vitro
La capacidad inhibitoria del extracto sobre la nucleación de cristales de oxalato de calcio se determinó mediante un método espectrofotométrico.20,21 Para lo cual se prepararon dos soluciones una con cloruro de calcio dihidratado (CaCl2 2H2O) (Sigma-Aldrich), a una concentración de 5 mM y otra de oxalato de sodio (Na2C2O4) (Sigma-Aldrich), a una concentración de 7.5 mM, posteriormente fueron ajustadas a un pH de 6.5. Ambas soluciones fueron filtradas tres veces, utilizando un filtro de membrana con tamaño de poro de 0.22 μm (Millipore). La inhibición de la nucleación se llevó a cabo mezclando 1450 μL de la solución de cloruro de calcio con 100 μL de las diferentes concentraciones (100-1000 μg/mL) del extracto de B. trifoliata, paralelo a esto se empleó citrato de potasio (C6H5K3O7) (Sigma-Aldrich) (1000-4000 μg/mL), el cual fue utilizado como control positivo. Una vez preparadas, las mezclas fueron mantenidas a 37 °C y en agitación constante durante 10 min a 800 rpm utilizando barras magnéticas de 2 x 7 mm (Bel-Art). Posteriormente se añadieron 1450 μL de oxalato de sodio como agente precipitante, manteniendo las condiciones antes descritas. Por último se midió la densidad óptica (DO) a 620 nm en un espectrofotómetro (Thermo Fisher Scientific Genesys 20). El porcentaje de inhibición de la nucleación fue calculado utilizando la siguiente fórmula:
Capacidad de captura de radicales libres
La capacidad de captura de radicales libres se determinó utilizando el método del DPPH (2, 2-Difenil-1-picrilhidrazilo).22 Para este ensayo, se colocaron 1900 μL (20 μg/mL) de una solución metanólica de DPPH (Sigma-Aldrich Chemistry), en tubos de ensaye de 12 x 75 mm, los cuales contenían 100 μL del extracto a diferentes concentraciones (5-50 μg/mL) o 100 μL de una solución (5-25 μg/mL) de vitamina E (Sigma-Aldrich Chemistry), utilizada como control positivo. Después se procedió a incubar las muestras a temperatura ambiente durante 20 min en oscuridad. Transcurrido el tiempo de incubación los cambios en la densidad óptica fueron medidos a 517 nm en un espectrofotómetro (Thermo Fisher Scientific Genesys 20). La disminución en la densidad óptica de la mezcla de la reacción, indicó la capacidad de captura de radicales libres. Finalmente los resultados se expresaron como la concentración efectiva media (CE50) en la cual una muestra causa un decremento del 50 % de la concentración inicial de DPPH.
Actividad antimicrobiana
Se utilizaron aislados clínicos de Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae y Proteus mirabilis, bacterias Gram negativas responsables de infecciones en tracto urinario. Las cepas bacterianas se obtuvieron de la colección del Laboratorio de Química Analítica y Química de Productos Naturales de la Facultad de Ciencias Biológicas, UANL.
Las cepas bacterianas fueron activadas en tubos de ensaye de 12 x 75 mm que contenían 3 mL de caldo de cultivo C. Rivas (patente No. 9810892), el medio fue preparado pesando 8.5 g por cada 100 mL de agua destilada y el pH fue ajustado a 7.0 ± 0.2 el medio se esterilizó bajo condiciones estándar (15 lb/15 min) para posteriormente ser sometidos a prueba de esterilidad en una incubadora (Felisa) a 37 °C por 18 a 24 h.
Para evaluar la actividad antimicrobiana del extracto metanólico de B. trifoliata, se utilizó el método de difusión del pozo en agar (C. Rivas);23 para lo cual se tomaron 100 μL de los cultivos previamente activados (1 x 106 UFC/mL en la escala de McFarland), los cuales fueron sembrados por extensión con la ayuda de un asa Digralsky. Posteriormente se realizaron pozos en el agar, de aproximadamente 5 mm de diámetro, utilizando un tubo de ensaye invertido, el agar fue retirado con la ayuda de una espátula estéril y posteriormente los pozos fueron llenados con 50 μL de diferentes concentraciones (20,40 y 60 mg/mL) del extracto. Como control positivo se utilizaron 50 μL de gentamicina a una concentración de 0.04 mg/mL y como blanco 50 μL de metanol. Las placas fueron incubadas a 35 ± 2 °C por 24 h, después de este tiempo se procedió a medir los halos de inhibición, los datos fueron expresados en milímetros, considerando el diámetro total del halo sin restar el diámetro del pozo.
Análisis fitoquímico cualitativo
Para determinar la presencia de compuestos y grupos funcionales en el extracto B. trifoliata, se realizó un análisis fitoquímico cualitativo utilizando las siguientes pruebas químicas: 2, 4-dinitrofenilhidrazina (grupo carbonilo), antrona (carbohidratos), Baljet (sesquiterpenlactonas), bicarbonato de sodio (grupo carboxilo), cloruro férrico (taninos), Dragendorff (alcaloides), Liebermann-Burchard (esteroles y triterpenos), permanganato de potasio (dobles enlaces), Shinoda (flavonoides), hidróxido de sodio (cumarinas), Bornträger (quinonas) y bicarbonato de sodio (saponinas).24
Ensayo de letalidad sobre Artemia salina
Se preparó agua de mar artificial utilizando 20 g de sal de mar y 6 mg de levadura de cerveza, disueltos en 500 mL de agua destilada a pH 7.8. Previo a la realización del ensayo, el agua de mar artificial fue acondicionada suministrando aire mediante una bomba para acuario por 24 h. Para la eclosión de los nauplios de A. salina, se adecuó un recipiente de vidrio rectangular con medidas de 17 cm x 14 cm x 7cm, el cual consta de un área oscura en donde se incuban los quistes y dos áreas iluminadas que permiten mediante fototropismo obtener solo nauplios eclosionados. Transcurrido un periodo de incubación de 48 h bajo condiciones de temperatura ambiente (23-25 °C) aireación y luz constante, se procedió a llevar a cabo el ensayo utilizando microplacas estériles de 96 pozos (Costar, Corning, NY, USA), 25 en los cuales se depositaron en un volumen final de 200 μL por pozo 10 nauplios y diferentes concentraciones (100-10000 μg/mL) del extracto de B. trifoliata.
Se utilizó dicromato de potasio (K2Cr2O7) al 5 % y agua de mar como control positivo y negativo respectivamente. La microplaca fue incubada por 24 h bajo las condiciones antes mencionadas. Posteriormente, utilizando un estereoscopio, se realizó el conteo de nauplios muertos en cada pozo de la microplaca.26 El ensayo fue realizado por triplicado. Por último se realizó un análisis Probit utilizando el paquete estadístico SPSS 17 para determinar la CL50.
Resultados y discusión
El proceso de extracción de Berberis trifoliata por maceración presentó un rendimiento de 5.40 % (p/p). En la obtención de extractos vegetales, pueden ser utilizadas una amplia gama de técnicas dentro de las cuales se encuentran las que utilizan calor, cuyo principal inconveniente es la posible degradación de los productos.27 Por tal motivo se procedió a realizar la extracción por maceración a temperatura de 23 ± 2 oC con agitación constante.
Otro factor importante en el proceso de extracción es la elección del disolvente en donde deben considerarse aspectos relacionados con la solubilidad, selectividad, facilidad de manipulación, además del grado y pureza del disolvente.28 Los más utilizados son los alcoholes alifáticos de hasta 3 carbonos o mezclas de éstos con agua ya que estos logran extraer la gran mayoría de las sustancias naturales de interés.29 Lo antes mencionado se debe a la capacidad que poseen los alcoholes alifáticos para aumentar la permeabilidad de la pared celular, facilitando la extracción de compuestos de diferente polaridad. Otras de las ventajas que presentan es su bajo punto de ebullición facilitando la separación del disolvente; además previene la contaminación con microorganismos del extracto.30
En el ensayo de nucleación de cristales de oxalato de calcio, el extracto de B. trifoliata presentó un porcentaje de inhibición dosis-dependiente (Figura 1), encontrando que a una concentración de 1000 μg/mL se obtuvo una inhibición de 93 ±0.01% y para el citrato de potasio (control positivo) y se requieren 3750 μg/mL para obtener el mismo efecto que el arrojado por el extracto (Figura 2). Estos resultados sugieren que el extracto en estudio posee constituyentes químicos capaces de inhibir el proceso de nucleación de los cristales de oxalato de calcio, pudiendo prevenir de esta forma la urolitiasis. Los reportes de compuestos naturales aislados de plantas con actividad antiurolítica son muy escasos, y a pesar de que no se encontró información de la especie B. trifoliata, Byahatti et al,31 reportaron la presencia de un compuesto fenólico aislado de la planta Bergenia ciliata, al cual se le atribuyeron capacidades antiurolíticas. En tanto al citrato de potasio se ha reportado el mismo comportamiento dosis-dependiente en la inhibición de la nucleación de cristales de oxalato de calcio.32

Figura 1 Porcentaje de inhibición del extracto metanólico de B. trifoliata sobre la nucleación de cristales de oxalato de calcio.
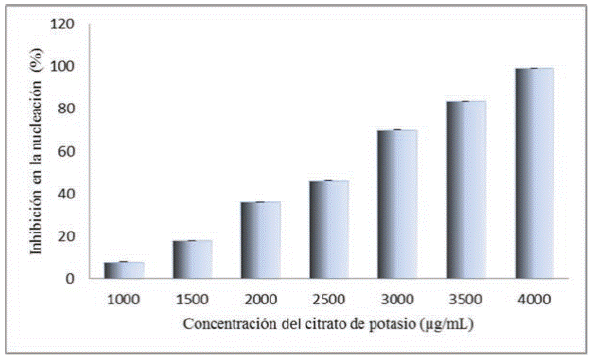
Figura 2 Porcentaje de inhibición del citrato de potasio (C6H5K3O7) sobre la nucleación de cristales de oxalato de calcio.
El ensayo in vitro con el radical libre DPPH (1,1-Difenil-2-Picril-Hidrazilo) se considera representativo entre los diversos métodos que han sido desarrollados para evaluar la capacidad de captura de radicales libres.29 Se determinó una concentración efectiva media (CE50) de 12.84 y 6.36 μg/mL para el extracto en estudio y la vitamina E respectivamente. Tanto el control positivo vitamina E como el extracto presentaron un comportamiento dosis-dependiente, en base a su CE50, el extracto metanólico de B. trifoliata posee una moderada capacidad de captura de radicales libres respecto al control positivo. Se ha reportado capacidad de captura de radicales libres en plantas pertenecientes a la familia Berberidaceae atribuido a la presencia de pigmentos flavonoides denominados antocianinas.33
En cuanto a la actividad antimicrobiana, a diferencia de lo reportado en extractos hidroalcohólicos de diversas plantas de la familia Berberidaceae34 el extracto metanólico de B. trifoliata no presentó actividad relevante frente a las bacterias evaluadas. Hay que considerar al evaluar la actividad biológica de extractos vegetales una serie de factores que pueden generar diferencia en los resultados tales como: variaciones fisiológicas, condiciones ambientales, variación geográfica, factores genéticos y de evolución;35 otro factor importante es el origen de las cepas bacterianas. En comparación con este trabajo, que fue llevado a cabo con la parte aérea de otra especie, con microorganismos de aislados clínicos, en el de referencia el material vegetal fue colectado en India, las plantas son de la misma familia y género; mas no de la misma especie y las partes utilizadas fueron tallo y raíz y las cepas ATCC.
Es indispensable la evaluación de la toxicidad de extractos vegetales para validar su uso en la medicina tradicional, ya que estos pueden contener sustancias tóxicas que causen efectos adversos a la salud.36,37 El ensayo de letalidad sobre A. salina es utilizado como una prueba para determinar toxicidad; confiable, de bajo costo, sencilla y rápida.38 El grado de toxicidad de un extracto se precisa en función del valor de su CL50 tomando en cuenta el siguiente criterio: 0 - 100 μg/mL alta, 100 - 500 μg/mL moderada, 500 - 1000 μg/mL ligera y un valor superior a 1000 μg/mL no tóxico.25 Para el extracto en estudio se obtuvo una CL50 de 925 μg/mL, es ligeramente tóxico.
El análisis fitoquímico permite determinar cualitativamente los principales grupos de constituyentes químicos presentes en una planta.24 Siguiendo esta metodología el extracto de B. trifoliata presentó una diversidad de compuestos y grupos funcionales tales como: carbohidratos, cumarinas, dobles enlaces, flavonoides, grupo carboxilo, sesquiterpenlactonas, alcaloides y taninos. Es necesario realizar un estudio químico más detallado del extracto en el cual se lleve a cabo el fraccionamiento, purificación y posterior análisis espectroscópico, para identificar los compuestos que le confieren actividad antiurolítica y antirradical.
Conclusiones
El extracto metanólico de Berberis trifoliata no mostró actividad sobre los microorganismos evaluados; posee la capacidad de inhibir el proceso de nucleación in vitro de cristales de oxalato de calcio hasta en un 93 % a una concentración de 1000 μg/mL, posee la capacidad de captura de radicales libres con una CE50 12.84 μg/mL; muestra una toxicidad ligera sobre Artemia salina con una CL50 de 925 μ g/mL, presentó una diversidad de compuestos y grupos funcionales tales como: carbohidratos, cumarinas, dobles enlaces, flavonoides, grupo carboxilo, sesquiterpenlactonas, alcaloides y taninos. Con los resultados obtenidos concluimos que el extracto de B. trifoliata podría ser una alternativa como coadyuvante en el tratamiento y/o prevención de la urolitiasis, ya que posee la capacidad de inhibir el proceso de nucleación y la capacidad de captura de radicales libres ya que ambos procesos favorecen el control de dicho padecimiento.











 nueva página del texto (beta)
nueva página del texto (beta)




