Introducción
Se sabe que la población mundial ha incrementado de manera exponencial. Debido a este hecho, se presenta una mayor demanda de servicios y por lo tanto, aumentan todas las necesidades, como la vivienda, además se requiere más energía, más agua potable, más transporte y finalmente, se producen gran cantidad de desechos. Este último hecho lleva al complejo problema de contaminación ambiental.1 De tal manera que la contaminación ambiental comienza con el mismo hombre.
La contaminación es la introducción de algún tipo de sustancia que atenta contra el normal funcionamiento y el balance del medio externo que finalmente, produce daño en todos los seres vivos (plantas, animales y humanos). La contaminación que se da sobre y contra el medio ambiente se denomina contaminación ambiental, siendo la presencia en el ambiente, de algún tipo de agente físico, químico o biológico, o la combinación de alguno de éstos. La contaminación puede darse exclusivamente en el suelo, el aire o el agua, aunque también puede darse simultáneamente en estos tres ámbitos. La contaminación se puede producir por productos que intervienen en los procesos de combustión, la presencia de compuestos químicos elaborados por el hombre y los desechos que tiran la mayoría de las fábricas o industrias.2
A pesar de que las diversas organizaciones, especialmente la "Agency for Toxic Substances and Disease Registry"3 da a conocer los valores de los mínimos niveles toxicológicos,4 en América Latina y el Caribe los residuos peligrosos por lo general, se eliminan utilizando métodos inadecuados y por tanto Los lugares donde los residuos peligrosos son manejados sin medidas de prevención ambiental, se convierten entonces en fuentes de contaminación.5
Dentro de los compuestos contaminantes se ha encontrado, que existen gran cantidad de sustancias de reconocida toxicidad como los disolventes, entre los que se encuentra el tetracloruro de carbono y muchos otros. (6 Estas sustancias pueden ser evaporadas al ambiente o son vertidas a los vertederos urbanos.
En el caso del tetracloruro de carbono se sabe que es un líquido claro que se evapora con mucha facilidad. La mayor parte del tetracloruro de carbono que se vierte al medio, se encuentra en forma de gas. Los niveles de fondo de este compuesto en agua, aire y suelo son muy bajos sin embargo, existe exposición a niveles mayores en sitios industriales específicos.2
Con respecto a su toxicidad se han realizado numerosos estudios, así la inhalación puede provocar efectos sistémicos respiratorios (edema pulmonar), cardiovasculares (arritmias cardiacas), gastrointestinales (náuseas y vómitos), hematológicos, neurológicos (depresión del sistema nervioso central) y hepáticos.7
Debido a que el tetracloruro de carbono continúa eliminándose de manera incontrolada al aire, agua y suelo, se requiere encontrar un tratamiento para prevenir o disminuir los síntomas provocados por intoxicaciones domésticas e industriales.8
En nuestro país existen más de 200 000 especies de hongos,9 sin embargo, no existen reportes de sus propiedades. Los hongos han sido utilizados como una fuente alimenticia y en la medicina tradicional de diversos países.10,11 En los últimos años, se ha incrementado el interés en los compuestos activos presentes en los hongos, ya que ofrecen grandes beneficios para la salud.12,13,14Trametes versicolor también es conocido como Coriolus versicolor y Polyporus versicolor, es un hongo saprofito, se desarrolla en bosques templados sobre madera muerta y pertenece a la familia Poliporaceae.15 Se ha demostrado que la producción de metabolitos secundarios de los hongos a partir del micelio, no muestra diferencias con aquellos producidos, en el cuerpo fructífero silvestre.16,17 Esta propiedad los convierte en un buen modelo biotecnológico para la producción de metabolitos activos.18,19 Trametes versicolor presentan compuestos, como el polisacárido PSK, que es un agente estimulador del sistema inmune,20 tiene propiedades anticancerígenas21 y presenta actividad antioxidante.22
El hígado es uno de los órganos más importantes del organismo. Participa en la regulación de metabolitos energéticos y realiza una amplia variedad de funciones importantes como la biotransformación de xenobióticos y otras sustancias químicas que ingresan al organismo. Así, el daño al hígado provocado por agentes hepatotóxicos tiene graves consecuencias.23 Por tanto es importante contribuir al desarrollo de nuevas terapias que ayuden a contrarrestar el daño hepático. El modelo biológico del tetracloruro de carbono (CCl4) se ha utilizado como un modelo de hepatotoxicidad aguda,24,25 debido a que induce hepatitis y cirrosis con características muy similares a las mismas enfermedades humanas. Los productos que se generan de su biotransformación a través del citocromo CYP2E, forman el radical triclorometilo (CCl3•) el cual, reacciona fácilmente con el oxígeno molecular, para formar el radical triclorometil-peroxilo (CCl3O2•).26 Estos radicales libres inician el daño celular a través de la peroxidación de lípidos23 dañando la constitución de las membranas celulares y también se disminuye la capacidad neutralizante del sistema antioxidante, con esto se incrementa la generación de especies reactivas del oxígeno (ROS) culminando con daño celular, desarrollo de fibrosis hepática,27 posteriormente cirrosis hepática, cáncer hepático y la muerte.28
En el presente trabajo se determinó si las moléculas antioxidantes presentes en los extractos del micelio de Trametes versicolor son capaces de neutralizar los radicales libres formados por el metabolismo del CCl4, y con esto disminuye el daño tisular generado por la intoxicación con este disolvente.
Material y métodos
Obtención de la cepa y micelio del hongo
Se recolectaron ejemplares de Trametes versicolor la mañana del 12 de octubre de 2008 en el estado de Colima; se identificó por el Dr. Ricardo Valenzuela Garza experto en hongos de la Escuela Nacional de Ciencias Biológicas de Instituto Politécnico Nacional (ENCB del IPN). Un ejemplar se depositó en la colección de hongos "Dr. Gastón Guzmán Huerta del herbario de la ENCB del IPN. El cuerpo fructífero del hongo se creció en medio de papa dextrosa (PDA) y se almacenó en el cepario del Laboratorio de Neurobiología del Departamento de Fisiología de la ENCB del IPN. Posteriormente, se resembró cuidando de no exceder 5 generaciones de resiembra en medio líquido (8 L) rico para hongos, con los siguientes elementos en (g/l): 8g de malta, 4g de extracto de lavadura, 5g de glucosa, 0.58g de peptona, 4.96g de fosfato ácido de potasio, 1g de sulfato de magnesio, 1.6g de cloruro de calcio, 0.017g de sulfato ferroso, 0.01g de cloruro de zinc, 0.06g de cloruro de sodio a pH 5.5. Se inocularon 2 fracciones de micelio de 38.5 mm2 a temperatura constante, durante 15 días, luego de este tiempo, se filtró al alto vacío para obtener el micelio.22
Obtención de sub-fracciones del extracto etanólico
El micelio seco se colocó en 450 mL de etanol al 96 % para realizar la extracción durante cinco días en refrigeración y recipientes de color ámbar. Al término de este plazo se filtró, el micelio remanente fue colocado en 150 mL de etanol a 96 % para una re-extracción bajo las mismas condiciones posteriormente, se evapora el solvente bajo presión reducida hasta sequedad (64 oC) con ayuda de un rotavapor BÜCHI (modelo B-481).
Obtención del extracto etanólico
Al extracto obtenido se le realizó la sub-fracción hexánica, utilizando hexano grado HPLC, dicha fracción se evaporó con ayuda de un rotavapor. Del remanente, se continuó la extracción con acetato de etilo grado HPLC posteriormente, se evaporó el disolvente en un rotavapor BÜCHI (modelo B-481).
Pruebas químicas preliminares Alcaloides
Se colocaron 2 gotas del extracto y se le agregó 5 mL de ácido clorhídrico al 10 %. Se calentó a ebullición por 5 minutos, se enfrió a temperatura ambiente y posteriormente, se filtró.
El filtrado se dividió en cuatro tubos de ensayo. Se realizaron las siguientes pruebas para la identificación preliminar de alcaloides: Dragendorf (que emplea yodo bismuto de potasio), Sonnenschain (que emplea fosfomolibdato de amonio) y la precipitación con ácido silicontugstíco.29
Flavonoides
En tres tubos de ensayo se colocaron 0.5 mL del extracto, se agregaron dos gotas de ácido clorhídrico concentrado y se observó el cambio de coloración a un color rojo, lo que demuestra la presencia de auronas y charconas. Cuando no se presenta cambio de color, se adiciona un trozo de magnesio metálico. Si se presenta una coloración naranja se trata de flavonas; si el color es rojo, indica la presencia de flavonoles; el color magenta indica flavonas. En un segundo tubo de ensayo se adicionaron tres gotas de hidróxido de sodio al 10 %, si se presenta una coloración amarilla o roja indica la presencia de xantonas y flavonas, si la coloración es café a naranja indica flavonoles; el color púrpura a rojizo charconas y azul antocianinas.
Glucósidos cianogénticos
En un tubo de ensayo se colocaron 0.5 mL de extracto a los que se adicionó 1 mL de ácido clorhídrico a 10 % y 1 mL de cloroformo. Se calentó el tubo en baño María y con una tira de papel filtro impregnado con picrato de sodio, se observa la aparición de una mancha de color rosa o roja, lo que indica la presencia de glucósidos cianogénticos.
Azúcares reductores
Para determinar los azúcares reductores, se procedió a realizar la reacción de Fehling y Benedict.
Saponinas
Se realizó la prueba de la espuma. Ésta consiste en agitar 1 mL de cada extracto y si la espuma formada se mantiene a una altura de 8 a 10 mm por 30 min, se le considera una prueba positiva.
Quinonas
En una cápsula de porcelana se concentró el extracto a consistencia siruposa (de jarabe) y se dividió en tres porciones; a la primera se le agregó una gota de hidróxido de amonio concentrado, la coloración rojiza en los primeros dos minutos, indica la presencia de antoquinonas. A la segunda porción, se le agregaron 0.5 mL de ácido sulfúrico concentrado, el color rojo se considera positivo para antraquinonas. La tercera porción se diluyó con 3 mL de agua, se filtró y se le añadieron 3 mL de hidróxido de potasio al 5 %, se calentó hasta ebullición por 3 min se dejó enfriar, se agregaron 3 mL de cloroformo, se eliminó la fase acuosa y a la clorofórmica se le adicionaron 2 mL de hidróxido de potasio al 5 %, si la fase acuosa alcalina presenta coloración roja se considera la presencia de benzoquinonas.
Si en la última reacción se presenta una coloración amarillo-verdosa, se adiciona una gota de peróxido de hidrógeno al 6%, el cambio a una tonalidad rojiza se considera positiva para antrona.
Taninos
Para la determinación de taninos a 1 mL del extracto se le adicionan 2 mL de agua y tres gotas de cloruro de sodio al 2 %, se calienta a ebullición un minuto, se enfría a temperatura ambiente y se filtra. Este filtrado se divide en dos tubos. A uno se le agregan dos gotas de gelatina; la presencia de un precipitado, significa que la reacción es positiva para taninos. Al segundo tubo se le agrega una gota de cloruro férrico al 1 %, la formación de coloración azul o negra indica la presencia de catecol. Luego se agrega una gota de ferrocianuro de potasio al 1 %, la coloración azul indica la presencia de compuestos fenólicos.
Cumarinas
Se empleó la reacción con el ácido sulfanílico. Se hace reaccionar 1 mL del extracto con una gota de ácido clorhídrico concentrado y 1 mL del ácido sulfanílico al 5 %. La presencia de una coloración naranja considera la presencia de cumarinas.
Gluscósidos cardiacos
Se concentraron 2 mL de extracto hasta conservar la tercera parte de su volumen. A éste se adicionan dos gotas de piridina, una gota de nitroprusiato de sodio al 0.5 % y cuatro gotas de hidróxido de potasio al 10 %. La presencia de una coloración roja se considera una prueba positiva.
Modelo de hepatotoxicidad aguda
Todos los procedimientos experimentales descritos en este estudio, se realizaron con base en las Leyes y Códigos descritos en el Capítulo Séptimo del Reglamento de la Ley General de Salud en Materia de Investigación para la Salud.
Los animales fueron proporcionados por el bioterio de la Escuela Nacional de Ciencias Biológicas del IPN. Siguiendo la NOM-062-ZOO-1999, que se refiere a las especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio.
Se emplearon 48 ratones macho de la cepa NIH con peso de 25-35 g, los cuales se mantuvieron con alimento y agua ad libitum, en una cámara con temperatura regulada (21 ± 1 °C), humedad relativa de 40 a 60 % y ciclos de luz-oscuridad de 12:12h.
Los animales fueron divididos en 8 grupos (cada uno constituido por 6 animales), quedando de la siguiente forma: 1. Control administrado con aceite vegetal vía intragástrica (ig) + aceite vegetal vía intraperitoneal (ip); 2. EtOH recibió aceite vegetal (ip) + extracto etanólico (100 mg/Kg) (ig); 3. AcEt administrado con aceite vegetal (ip) + fracción de acetato de etilo (100 mg/Kg) (ig); 4. Hex recibió aceite vegetal (ip) + fracción hexánica (100 mg/Kg) (ig); 5. CCl4 administrado con 20 mg/Kg CCl4 (ip) + aceite vegetal (ig); 6. EtOH+CCl4 recibió CCl4 (20 mg/Kg) (ip) + extracto etanólico (100 mg/Kg) (ig); 7. AcEt+CCl4 administrado con CCl4 (20 mg/Kg) (ip) + extracto de acetato de etilo (100 μg/Kg) (ig); 8. Hex+CCl4 recibió CCl4 (20 mg/Kg) (ip) + extracto hexánico (100 μg/Kg) (ig).
El día 1 se administraron los extractos, 30 min antes de la intoxicación con CCl4, el día 2 los animales sólo recibieron los extractos. Finalmente, el día 3 se administraron los extractos y ocho horas después, se realizó el sacrificio de los animales por dislocación cervical. Se obtuvieron los hígados, dividiéndolos cada uno en dos porciones, una porción se congeló a -70 °C para realizar las pruebas bioquímicas (peroxidación lipídica, cuantificación de las especies reactivas del oxígeno, glutatión reducido y glutatión oxidado). Otra porción se colocó en solución de Bouin para realizar el estudio histológico. Los tejidos se procesaron por la técnica convencional de inclusión en parafina. Con ayuda de un microtomo se obtuvieron cortes de 7 μm y se tiñeron con hematoxilina-eosina. La descripción de la estructura histológica, se realizó a doble ciego, empleándose un microscopio óptico.
Lipoperoxidación
La peroxidación de lípidos30 se realizó homogenizando las muestras de tejido hepático con 5 mL de regulador de fosfato 10 mM pH 7.4, tomando una alícuota de 1 mL del homogenizado y se adicionaron 4 mL de una mezcla de cloroformo-metanol (2:1 v/v), posteriormente se agitaron en vortex durante 10 s, para permitir la separación de las fases acuosa y clorofórmica, las muestras se mantuvieron a 4 °C durante 30 min, protegidas de la luz, luego de este tiempo, la fase acuosa se aspiró y se desechó con ayuda de una bomba de vacío. Finalmente, se tomaron 2 mL de la fase orgánica (cloroformica) y se determinó la fluorescencia empleando un espectrofluorómetro RF-5000 (SHIMADZU CORPORATION), a longitudes de onda de 370 nm de excitación y 430 nm de emisión. La sensibilidad del espectrofotómetro se ajustó a 140 unidades de fluorescencia con una solución de quinina a una concentración de 0.001 mg/mL. Los resultados se expresaron como unidades relativas de fluorescencia (URF/mg de proteínas).
Cuantificación de las especies reactivas del oxígeno (ROS)
Las ROS se cuantificaron empleando el método del di acetato de 2 ́7 ́ ́ - dicloroflourescina (DCFH-DA), el cual es desesterificado por la presencia de peróxido de hidrógeno produciendo una molécula más oxidada la 2 ́7 ́- dicloroflouresceina (DCF), la cual presenta fluorescencia. Para esto, se tomaron 10μL del homogenizado de hígado y se colocaron en 1950 μL de regulador TRIS:HEPES (18:1).
La fracción diluida se incubo con 50 μL de DCFH-DA por 1 h a 37°C con agitación constante. La reacción se detiene colocando las muestras inmediatamente en hielo, se realiza la lectura de la fluorescencia en un espectrofluorómetro RF-5000 (SHIMADZU CORPORATION), a longitudes de onda de 488 nm de excitación y 525 nm de emisión. Los resultados se expresaron como DCF formada/h/mg proteínas.30
Evaluación del sistema oxidante
Se colocan 100 μL del homogenizado de hígado en tubos de ensayo y se adicionan 15μL de H3PO4 al 30 % posteriormente, se centrifuga a 12, 000 g por 30 min y temperatura de 4 °C. Para la cuantificación de GSH, se toman 30 μL del sobrenadante previamente diluido 1:10 con regulador de fosfatos 100 mM en EDTA 5 mmol (FEDTA) a un volumen final de 1.9 mL y se agregan 100 μL de o-oftaldialdehído (OPT). Se determinó la fluorescencia de la muestra empleando un espectrofluorometro RF-5000 (SHIMADZU CORPORATION) con una longitud de onda emisión de 420 nm y 350 nm de excitación, Para determinar la concentración de GSSG se tomaron 75 μL del sobrenadante (obtenido luego de centrifugar) y se mezclaron con 35 μL de N-etilmaleimida, se tomaron 60 μL de esta mezcla y se agregó 1.9 mL de FDTA. Finalmente, se adicionaron 100μ L de OPT y se determinó la flourescencia bajo las mismas condiciones de GSH.30 Los resultados se expresaron como ng de GSH o GSSG/mg de proteínas.
Resultados y discusión
Para evaluar las propiedades del micelio de Trametes versicolor, sobre el estrés oxidativo y el daño tisular, generados por la intoxicación con CCl4, se obtuvieron el extracto etanólico y sus fracciones de acetato de etilo y hexánica. Posteriormente, se realizó el análisis preliminar de cada una de las fracciones. En este análisis se encontró la presencia de alcaloides, azúcares reductores, taninos, cumarinas y glucósidos cardiacos (Tabla 1). En estudios previos diversos autores han reportado que estos compuestos presentan actividad antioxidante.31-36 Las especies químicas con actividad antioxidante tienen la capacidad de actuar como agentes reductores neutralizando las especies reactivas producidas por el metabolismo del CCl4.
Durante este metabolismo se forman los radicales libres triclorometilo (CCl3) y triclorometilo-peroxilo (CCl3O2), que inician el proceso de daño celular, a través de la inestabilidad de la membrana celular de los hepatocitos, el desbalance de la concentración de calcio extracelular y el desbalance del ambiente óxido-reducción de la célula.37 Estos procesos se ocasionan por la unión covalente entre los radicales libres y los enlaces disulfuro de las proteínas, generando además, estrés del retículo endoplásmico.38 Este hecho se corroboró al determinar la concentración de ROS y el grado de lipoperoxidación, los cuales fueron mayores en el grupo tratado con CCl4, mientras que los grupos que recibieron el tratamiento con los extractos tuvieron valores parecidos a los grupos tratados con vehículo (Figura 1, páneles A y B). Así, la presencia de antioxidantes39 presentes en los extractos contrarrestan el estrés oxidativo, específicamente los taninos y las cumarinas podrían ser los responsables de dicho efecto.40 También, se ha reportado que algunos compuestos con actividad nucleofílica, como el radical alcoxi41 son capaces de neutralizar las especies reactivas.42,43
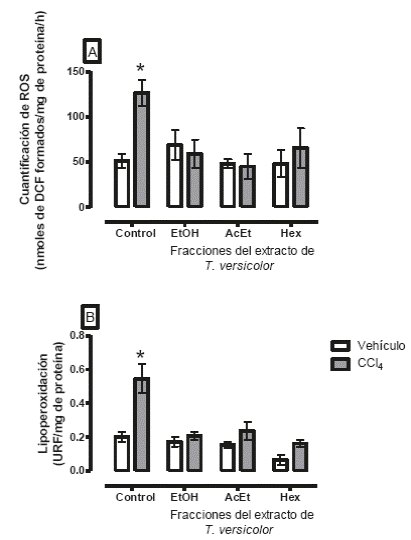
Figura 1 Cuantificación de especies reactivas del oxígeno (A) y lipoperoxidación (B) como marcadores bioquímicos del estrés oxidativo, provocado por la intoxicación con CCl4.
Las reacciones de oxidación que se realizan en el hígado, son muy importantes para producir energía en los organismos vivos sin embargo, la sobre-producción de radicales libres (las producidas por el metabolismo normal más las producidas por el CCl3 y el CCl3O2) altera el ambiente óxido-reducción de las células. Dentro de los mecanismos no enzimáticos, más efectivos para contrarrestar el estrés oxidativo se encuentra el glutatión.44 Se tienen evidencias que demuestran que el GSH se oxida para neutralizar los radicales libres.45
Los resultados encontrados en el grupo tratado con CCl4 muestran una menor concentración GSH y una mayor concentración de GSSG, mientras que el índice se encuentra totalmente disminuido (Figura 2), páneles A, B y C). Esto nos indica que la intoxicación con este disolvente, produce un estado oxidado, que modifica el ambiente óxido-reducción celular.38, 46 Por otro lado, los grupos que recibieron el extracto etanólico y las subfracciones no modifican el GSH, ni el GSSG y por lo tanto, el hígado de estos animales no presentan alteraciones del índice GSH2/GSSG.
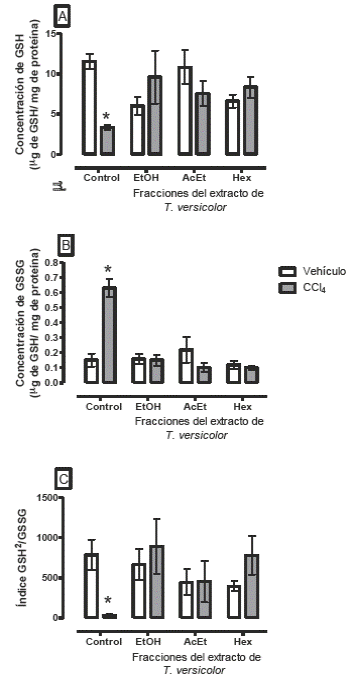
Figura 2 Determinación de la concentración de (A) Glutatión reducido (GSH), (B) glutatión oxidado GSSG e (D) índice GSH2/GSSG, como indicadores del ambiente óxido-reducción.
Los hallazgos encontrados en el estudio histológico de los hígados, se corresponden con los resultados bioquímicos (ROS, lipoperoxidación y ambiente óxido-reducción). Así, los grupos que recibieron el extracto etanólico y las sub-fracciones obtenidas del micelio de Trametes versicolor presentan al igual que el grupo control, una citoarquitectura normal, la cual es radial a la vena centrolobulillar. Pueden observarse lobulillos que están formados por cordones de hepatocitos, los cuales tienen núcleo esférico, mientras que en el caso del grupo administrado con CCl4 puede observarse pérdida de la distribución radial, discontinuidad celular, alteraciones de la relación núcleo citoplasma, núcleos picnóticos y necrosis celular (Figura 3). El daño celular presente en el hígado de este grupo, se puede atribuir a los radicales libres CCl3 y el CCl3O2.47,48,49
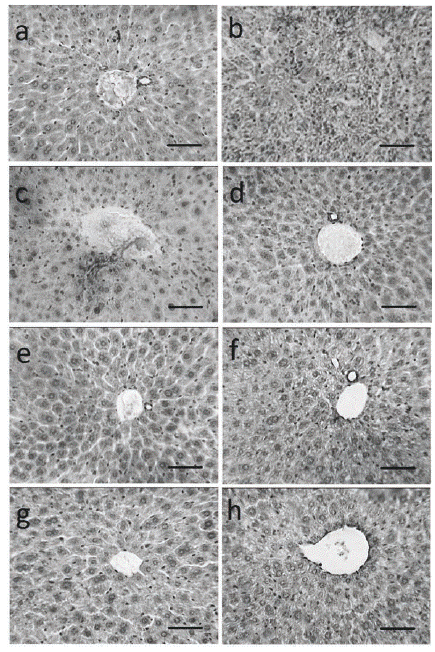
Figura 3 Fotomicrografías representativas de cortes de hígado. Control (a); CCl4 (b); EtOH (c); EtOH + CCl4 (d); AcEt (e); AcEt + CCl4 (f); Hex (g), Hex + CCl4 (h). La barra representa 50 μm.
Los resultados encontrados en este trabajo son muy alentadores ya que el hígado de los animales tratados con el extracto etanólico y sus subfracciones presentan marcadores bioquímicos y una citoarquitectura normal. De tal manera que el tratamiento de los individuos que viven en las inmediaciones de áreas industriales, con el micelio de Trametes versicolor, permitirá paliar los efectos tóxicos del CCl4, debido a sus propiedades antioxidantes y citoprotectoras.
Conclusiones
El extracto etanólico y las sub-fracciones de acetato de etilo y hexánica obtenidas del micelio de Tramentes versicolor:
Disminuyen el estrés oxidante provocado por los radicales libres del CCl4.
Contribuyen a conservan el ambiente óxido-reducción del tejido hepático. Evitan el daño hepático causado por la intoxicación con CCl4.











 nueva página del texto (beta)
nueva página del texto (beta)


