Introducción
Los esteroides (stereos=sólidos) son compuestos orgánicos derivados de los alcoholes, los cuales se encuentran ampliamente distribuidos en el reino animal y vegetal. Su esqueleto base presenta 17 átomos de carbono en un sistema de anillos tetracíclicos conocido como perhidrociclopentanofenantreno (gonano, esterano). En dicho grupo de sustancias se agrupan compuestos vitales para la vida, tales como el colesterol, los ácidos biliares, hormonas sexuales, vitamina D, corticoesteroides, agliconas cardiacas, antibióticos, entre otras. Algunas de las más potentes toxinas son alcaloides esteroidales; además, son responsables de importantes funciones biológicas en la célula, por ejemplo los esteroides derivados del androstano, pregnano y estrano tienen actividad hormonal,1-5 los ácidos biliares son importantes para la digestión y absorción de las grasas y las agliconas cardiotónicas son empleadas para el tratamiento de enfermedades del corazón. Los esteroles son constituyentes de la membrana celular, esenciales para su estabilidad y desarrollo celular; además, de ser los precursores de los ácidos biliares y hormonas esteroidales. Un amplio número de esteroides son empleados como agentes anti-inflamatorios,6 inmunosupresores, progestacionales, diuréticos, anabólicos y como anticonceptivos.7-9 Algunos han sido usados para el tratamiento de cáncer de próstata y mama,10-11 insuficiencia suprarrenal,12 en la prevención de enfermedades del corazón,13 como agentes anti-fúngicos,14 como ingredientes activos para el tratamiento de la obesidad15 y SIDA.16 Recientemente, se ha determinado la actividad anti-viral frente al virus del herpes simple tipo I de algunos glicósidos esteroidales.17 La acción terapéutica de algunas hormonas esteroidales ha sido asociada a su interacción con receptores intracelulares, los cuales actúan como factores de transcripción en la regulación de la expresión genética.18 Hace un tiempo, se informó que algunos esteroides, tales como dehidroepiandrosterona (DHEA), progesterona, pregnalona y sus derivados sulfatados;19,20 así como, el 17β-estradiol, la allopregnanolona y sus derivados sintéticos alfoxolano y ganaxolano son considerados neuroesteroides, por su acción que ejercen a nivel del SNC.19 La actividad fisiológica de los esteroides depende de su estructura, por ejemplo; del tipo, número, orientación espacial y reactividad de los diferentes grupos funcionales presentes en el núcleo del esterano; así como, del estado de oxidación de los anillos. Por ejemplo, la presencia de una función oxigenada en el C-11β es crucial para su actividad anti-inflamatoria, la función hidroxilo en C-17β determina sus propiedades androgénicas, la aromatización del anillo A en su efecto estrogénico; los corticosteroides tienen al grupo 3-ceto-5-eno y la cadena lateral del pregnano en C-17.21,22 Actualmente, se conocen cerca de 300 fármacos esteroidales, y este número tiende a crecer, su producción representa la segunda categoría dentro del mercado farmacéutico después de los antibióticos.23 La producción anual de esteroides excede el millón de toneladas y el mercado global es de alrededor de diez billones de dólares.24
La producción de fármacos esteroidales y hormonas es uno de las mejores ejemplos de las aplicaciones que tiene las biotransformaciones a escala industrial.3,21 Las transformaciones microbiológicas son una herramienta efectiva para la preparación de diversos compuestos,25 los cuales pueden ser difíciles de obtener por métodos químicos convencionales y han sido extensamente usadas en la bioconversión de esteroides.24 Alrededor de 1950, se dan a conocer los efectos farmacológicos del cortisol y progesterona; además de la hidroxilación de esta última en C-11α por especies de Rhizopus, iniciándose una etapa muy importante en el desarrollo de la síntesis de esteroides con actividad biológica.4-5 Actualmente, se reconoce la gran versatilidad de los sistemas microbianos en la industria farmacéutica para la producción comercial de esteroides y otros fármacos.26-27 En la literatura se han informado de varios cientos de transformaciones microbiológicas de esteroides; además, muchas bioconversiones se han incorporado en numerosas síntesis parciales de nuevos compuestos para su evaluación como hormonas o fármacos.21,28-31 Los derivados químicos de algunos esteroides han mostrado poseer mejores ventajas terapéuticas que el material de partida. Sin embargo, los objetivos principales en la investigación y desarrollo de la industria de los fármacos esteroidales actualmente consiste en la detección y aislamiento de cepas microbianas con actividad novedosa o capacidad de transformación más eficiente, donde pueden jugar un papel destacado la ingeniería genética y la ingeniería metabólica de bacterias, hongos y plantas.32-35
En la presente revisión, sin ser una revisión muy exhaustiva, se pretende enfatizar la importancia que tiene las biotransformaciones con microrganismos en la obtención de sustancias químicas esteroidales con interés farmacéutico, como una estrategia químico-biológica alterna a la transformación o síntesis química y destacando la reacción química que efectúan los diferentes tipos de microrganismos en la funcionalización del esqueleto esteroidal.
Transformaciones microbiológicas de hormonas esteroidales
Desde el punto de vista de la química verde las biotransformaciones constituyen una metodología importante en química orgánica.36 Las transformaciones microbiológicas en los esteroides ha sido una herramienta química indispensable para la preparación de muchos intermediarios y en la generación de nuevas drogas, donde la funcionalización química −hidroxilación, oxidación de Bayer-Villiger, reducción de cetonas, reducción, isomerización, adiciones de Michael y reacciones de condensación− se pueden llevar a cabo en diferentes posiciones del esqueleto del esteroide de manera quimio, regio y estereo-selectiva, lo cual resulta complicado y en muchas ocasiones imposible de funcionalizar por métodos químicos. Actualmente, cualquier centro estereogénico del esqueleto esteroidal puede ser estéreo específicamente hidroxilado. Hoy en día, las hidroxilaciones en C-11α, C-11β, C-15α y C-16α se realizan industrialmente vía una hidroxilación microbiana con buenos rendimientos y exceso enantiomérico (ee). A continuación se ejemplifican algunas transformaciones microbiológicas realizadas a diferentes esteroides naturales y sintéticos.24
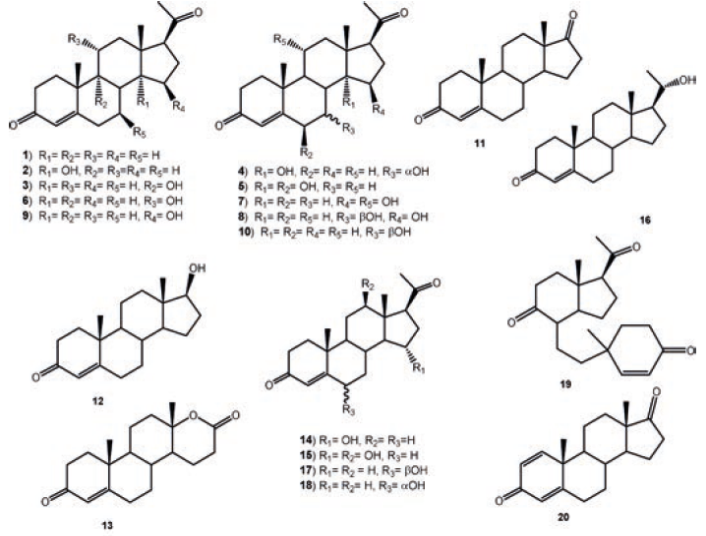
En la literatura se encuentra bien documentada la hidroxilación regio y estéreo-selectiva en C-14 con orientación α en la progesterona (1) y otros esteroides por diversos hongos con un buen rendimiento, como Thamnostylum piriforme (ATCC 8992), Mucor griseocyanus (ATCC 1207a), Actinomucor elegans (MMP 3132) y Zygodesmu ssp (ATCC 14716). De la incubación de 1 con T. piriforme se obtuvieron 14 α-hidroxiprogesterona (2, 32 %) y 9α-hidroxiprogesterona (3, 1.4 %), mientras que de 1 con M. griseocyanus se obtuvieron 2 (13.4 %), 7α,14α-dihidroxiprogesterona (4, 6.5 %) y 6β,14 α-dihidroxiprogesterona (5, 2.8 %). De la transformación de 1 con A. fumigatus después de 24 horas de incubación, se obtuvieron diferentes productos monoy dihidroxilados; 11 α-hidroxiprogesterona (6, 33%), 11α,15β-dihidroxiprogesterona (7, 17%), 7β,15β-dihidroxiprogesterona (8, 14 %), 15 β-hidroxiprogesterona (9), 7β-hidroxiprogestererona (10), donde 9 y 10 se detectaron en mínima cantidad. Finalmente, a las 72 horas los productos principales fueron 7 (48%) y 8 (25 %), observándose que las posiciones 11α y 15β se hidroxilan más fácilmente que la posición 7β en 1.37,38 De la incubación de 1 con Saprolegnia hypogyna se obtuvieron 4-androsten-3, 17-diona (11), testosterona (12) y testolactona (13).39 Los compuestos 15α-hidroxiprogesterona (14, 47%) y 12β, 15 α-dihidroxiprogesterona (15, 25%) fueron aislados de la biotransformación de 1 con Fusarium culmorum.40 De la biotransformación de 1 con la bacteria termofílica Bacillus stearothermophilus fueron aislados tres productos de monohidroxilación, 20α-hidroxiprogesterona (16, 61%), 6 β-hidroxiprogesterona (17, 21%) y 6α-hidroxiprogesterona (18, 14%) y 9, 10-seco-pregnen-3, 9, 20-triona (19, 4%).41 Recientemente, se informó de la biotransformación de 1 con Penicillium aurantiogriseum durante diez días para dar 11 y androsta-1, 4-dien-3,17-diona (86), dichos productos fueron observados en la biotransformación de 1 con Bacillus sphaericus, observándose principalmente lahidrólisis de la cadena en C-17, ver Figura 1.42-43
En la biotransformación de la 5β-pregnan-3,20-diona (20) con T. piriforme se caracterizaron a la 14α-hidroxi-5β-pregnan-3, 20-diona (21, 11.8%), 3β, 14α-dihidroxi-5β-pregnan-20-ona (22, 0.5%) y 14α,15β-dihidroxi-5β-pregnan-3, 20-diona (23, 0.4%), mientras que en la biotransformación de 3β-hidroxi-5 β-pregnan-20-ona (24) se aislaron 22 (0.6%) y 3β,9α,14 α-trihidroxi-5β-pregnan-20-ona (25, 16%) después de 96 h de incubación, observándose que 24 es biotransformado más lentamente que 20 por dicho hongo. La transformación microbiológica de 24 con Actinomucor elegans produjo la mezcla de los compuestos 22 y 25 en menor rendimiento que T. piriforme y un producto minoritario que fue identificado como 3β,9α-dihidroxi-5β-pregnan-20-ona (26), Figura 2.37
De la biotransformación del 3β-hidroxi-5β,17(αH)-etianicato de metilo (27) con T. piriforme se obtuvo la mezcla de 3β,14 α-dihidroxi-5β,17(αH)-etianicato de metilo (28, 9%) con 9α, 14α-dihidroxi-derivado (29, 12%) y dos productos minoritarios 14α,15α-dihidroxi (30) y 15β-hidroxi (31), ver Figura 3. El compuesto 28 fue identificado como producto de biotransformación con A. elegans, M. griseocyamus y Zygodesmus sp.37
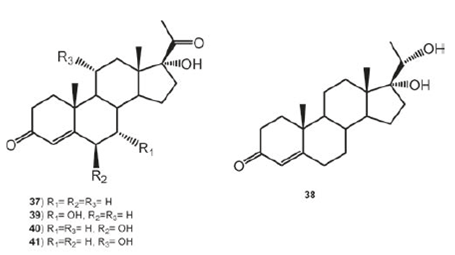
Se ha informado de la biotransformación de la 16-dehidroprogesterona (32) con Mucor piriformis para dar el producto de hidroxilación en C-14α a 24 h de biotransformación (14α-hidroxi- pregnan- 4, 16- dien- 3, 20- diona, 33); mientras que los microsomas obtenidos de 33 en presencia de NADPH, transformaron 32 en 48 h a 7α, 14α- dihidroxi- pregnan- 4, 16- dien- 3, 20- diona (34, 78%), 3β, 7α, 14α- trihidroxi- 5α- pregnan- 16- en- 20- ona (35, 3%) y 3α, 7 α, 14α- trihidroxi- 5α- pregnan- 16- en- 20- ona (36, 2%), ver Figura 4.44 Por otro lado, de la biotransformación de la 17α- hidroxiprogesterona (37) con el mismo microrganismo después de 48 h de incubación se obtuvieron los compuestos 17α, 20α- dihidroxipregnan- 4- en- 3- ona (38, 19%), 7α, 17α- dihidroxipregnan- 4- en- 3, 20-diona (39, 20%), 6β, 17α, 20α- trihidroxipregnan- 4- en- 3- ona (40, 18%) y 11α, 17α, 20α- trihidroxipregnan- 4- en- 3- ona (41, 25%), observándose que M. piriformis es capaz de hidroxilar las posiciones C-6, C-7, C-11 y C-14 de manera estereoespecífica; además de reducir el sistema 4-en-3-ona en el anillo A y el grupo ceto del C-20.44 La biotransformación 37 con Fusarium culmorum, condujo a la formación de 14 (47%) y 15 (12β, 15α-dihidroxiprogesterona, 25%) como se ilustra en la Figura 5.40
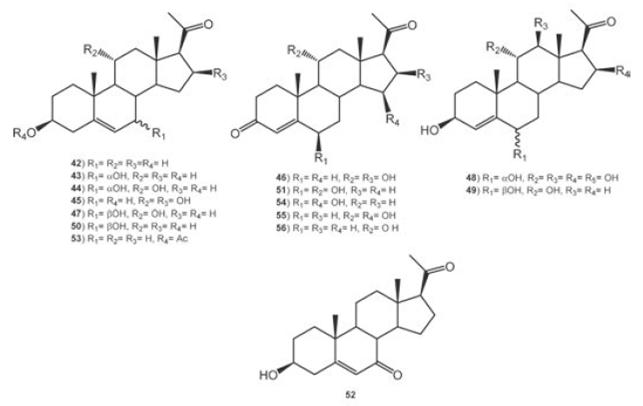
La pregnenolona (3β-hidroxipregn-5-en-20-ona, 42) precursora de muchas hormonas esteroidales, fue biotransformada por Mucor piriformis para obtener dos metabolitos, 3β, 7α- dihidroxipregn- 5- en- 20- ona (43) y 3β, 7α, 11α- trihidroxipregn- 5- en- 20- ona (44),45 donde 44 (46.4%) es también producto de bioconversión de 42 con Mucor circinelloides var. lusitanicus.46 La transformación de 42 con Botrytis cinerea se obtuvieron 3β, 11α, 16β- trihidroxipregn- 5- en- 20- ona (45, 39%) y 11α, 16β-dihidroxipregn-4-en-3, 20-diona (46, 6%), la formación de los productos de hidroxilación en C-11 y C-16 por B. cinerea puede estar determinado por la presencia del grupo acetilo en C-20.47 La biotransformación de 42 con diferentes microrganismos: Cunninghamella elegans, Rhizopus stolonifer y Gibberella fujikuroi, fue informada por Choudhary et. al. (2005).48 La incubación de 42 con C. elegans produjo los productos 3β, 7β, 11α- trihidroxipregn- 5- en- 20- ona (47, 28%), 3β, 6α, 11α, 12β, 15β- pentahidroxipreg- 4- en- 20- ona (48, 4%) y 3β, 6β, 11α- trihidroxipregn- 4- en- 20- ona (49, 2%), mientras que la incubación con G. fujikuroi se obtuvieron dos productos 3β, 7β- dihidroxipregn- 5- en- 20- ona (50, 3%) y 6β, 15β- dihidroxipregn- 4- en- 3, 20- diona (51, 2%). De la biotransformación de 42 con diferentes cepas de Bacillus se obtuvieron como productos mayoritarios 43, 50, y 7-oxo-pregnenolona (52),49 mientras con Fusarium oxysporum var. cubense produjo como único producto 43, ver Figura 6.50 La biotransformación del acetato de la pregnenolona (53) con C. elegans generó 42, androsta1, 4dien3, 17diona (86), 6β, 15β- dihidroxiandrosta- 4- en- 3, 17- diona (54) y 11α, 15β- dihidroxipregn- 4- en- 3, 20- diona (55), mientras con R. stolonifer se obtuvieron los productos 11α- hidroxipregn- 4- en- 3, 20- diona (56) y 51.48
La transformación microbiológica de la mezcla racémica del 13- etil- 17β- hidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (57) fue ensayada con diferentes hongos Rhizopus nigricans, R. arrhizus, Aspergillus niger, A. ochraceus y Curvularia lunata.51 La bioconversión de la mezcla racémica de 57 por R. arrhizus produjo una mezcla de (±)- 13- etil- 10β, 17β- dihidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (58, 28.4%) como único producto; mientras que R. nigricans, A. niger y C. lunata biotransformaron 57 a 58 de manera más lenta e ineficiente. La mezcla racémica (±)- 13- etil- 7β, 17β- dihidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (59, 4.3%) fue obtenida como productos de la incubación de la mezcla 57 con A. ochraceus, ninguno de los hongos ensayados fueron capaces de diferenciar a los dos enantiómeros de 57 en el curso de la reacción de hidroxilación; además, la ausencia del derivado hidroxilado en C-11 se pudo explicar debido a la presencia del grupo etilo en C-13 o el grupo etinil en C-17. La transformación microbiológica de la mezcla racémica y del enantiómero dextro del compuesto 57, se ha descrito empleando diferentes especies de Cunninghamella.52 Por ejemplo, la transformación de la mezcla racémica de 57 por Cunninghamella blakesleeana produjo 58 (5.3%), 13- etil- 6β, 17β- dihidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (60, 3.6%), 13- etil- 15α, 17β- dihidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (61, 3.0%) y 13- etil- 6β, 10β, 17β- trihidroxi- 18, 19- dinor- 17α- pregn- 4- en- 20- in- 3- ona (62, 3.6%), ver Figura 7. Por otro lado, de la biotransformación del enantiómero (dextro) con el mismo hongo, se obtuvieron 58 (3.5%), 60 (1.0%) y 62 (4.8%).
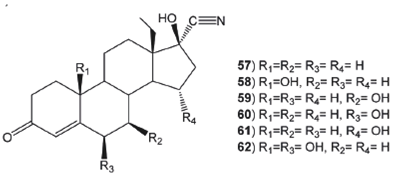
Figura 7 Productos de biotransformación de (+_ ) -13- etil- 17β- hidroxi- 18- 19 dinor- 17α- pregn- 4- en- 3- ona (57).
De la biotransformacion del danazol (17β- hidroxi- 17α- pregna- 2, 4- dien- 20- ino- [2, 3- d]isoxazole, 63) con Fusarium lini, Aspergillus niger y Cephasloporium aphidicola se obtuvieron 17β- hidroxi- 2- (hidroximetil)- 17α- pregn- 4- en- 20- in- 3- ona (64) y 17β- hidroxi- 2- (hidroximetil)- 17α- pregn- 1, 4- dien- 20- in- 3- ona (65), ver Figura 8; mientras con Bacillus cereus se obtuvo 65, como único producto.53
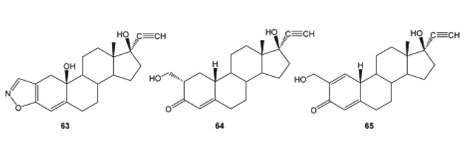
Figura 8 Productos de biotransformación del danzol (17β- hidroxi- 17α- pregna- 2, 4- dien- 20- ino- [2, 3d] isoxazole, 63).
La noretisterona (noretindrona, 66) es un potente progestano utilizado como agente anticonceptivo, su biotransformación con Cephalosporium aphidicola produjo 17α-etinilestradiol (67); mientras que 67 fue biotransformado por Cunninghamella elegans para dar los compuestos 19- nor- 17α- pregna- 1, 3, 5 (10)- trien- 20- in- 3, 4, 17β- triol (68), 19- nor- 17α- pregna- 1, 3, 5 (10)- trien- 20- in- 3, 7α, 17β- triol (69), 19- nor- 17α- pregna- 1, 3, 5 (10)- trien- 20- in- 3, 11α, 17β- triol (70), 19- nor- 17α- pregna- 1, 3, 5 (10)- trien- 20- in- 3, 6β, 17β- triol (71) y 6β- metoxi- 19- nor- 17α- pregna- 1, 3, 5 (10) trien- 20- in- 3, 17β- diol (72), Figura 9.54
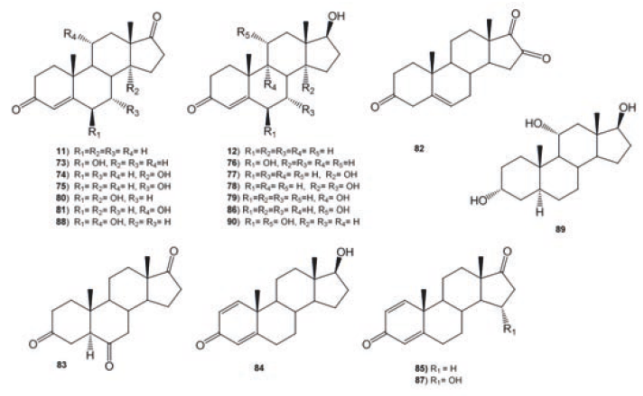
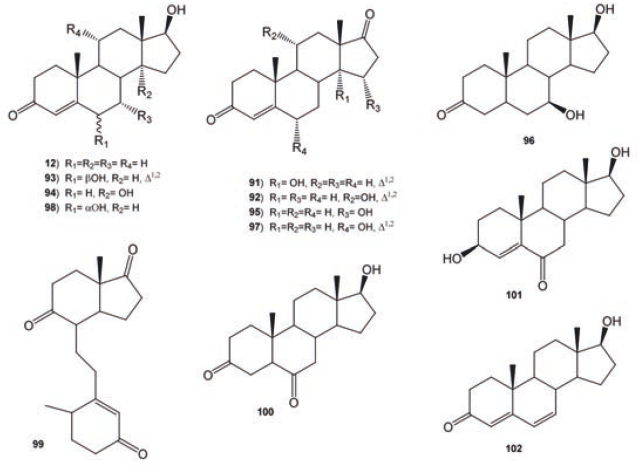
La androst-4-en-3,17-diona (11) sustancia que juega un papel importante en el metabolismo de fármacos, entre otras muchas funciones, fue biotransformada con M. piriformis para dar como producto principal la 6β-hidroxiandrost-4-en-3,17-diona (73, 13 %), además de cuatro productos minoritarios 14α- hidroxiandrost- 4- en- 3, 17- diona (74, 2%), 7α-hidroxiandrost-4-en-3, 17-diona (75, 2%), testosterona (12, 3%), 6β- hidroxitestosterona (76, 1%). De la biotransformacion de 11 con M. griseocyamus se obtuvieron 74 (9%), 75 (4%) y 14α- hidroxitestosterona (77, 9%) como productos mayoritarios; asimismo, se identificaron a 11 y 73 en la mezcla de productos de biotransformación.55 A partir de la incubación de 11 con M. piriformis se obtuvieron 74-77, y 7α, 14α- dihidroxitestosterona (78).37 Los esteroides hidroxilados en C-9 son importantes intermediarios en la síntesis de fármacos anti-inflamatorios altamente efectivos. La transformación microbiológica de 11 a 9 α- hidroxiandrost- 4- en- 3, 17- diona (79) fue estudiada con Rhodococcus sp en un medio de cultivo bajo en nutrientes a pH fijo, Figura 10.56
La incubación de 11 con Bacillus strain HA- V63 produjo los metabolitos 12, 73-76, 6β, 14α- dihidroxiandrost- 4- en- 3, 17- diona (80), 11α- hidroxiandrost- 4- en- 3, 17- dione (81), androst- 4- en- 3, 6, 17- triona (82) y 5α- androsta- 3, 6, 17- triona (83) como lo describen Schaaaf et. al., (1998), Figura 10.57
De la bioconversión de 11 con C. aphidicola se obtuvieron 73 y 74,58 mientras que de la fermentación de 11 con Curvularia lunata, se obtuvieron los productos 81 (4%), 17β- hidroxiandrost- 1, 4- dien- 3- ona (84, 4.4%), androsta- 1, 4- dien- 3, 17- diona (86, 3%), 11α, 17β- dihidroxiandrost- 4- en- 3- ona (86, 4%) y 87 (15α- hidroxiandrost- 1, 4- dien- 3, 17- dione, 2.8%).59 La biotransformación de 11 con el hongo Beauveria bassiana fue estudiada en tiempos y con medios de cultivo a diferentes pH (pH= 6 y 7).60 A pH= 6 se obtuvieron dos productos: 86 y 6β, 11α- dihidroxiandrost- 4- en- 3, 17- dione (88), donde se observa la hidroxilación estereoselectiva en C- 11α y C- 6β; mientras a pH =7 se obtuvieron los compuestos 12, 86, 3 α, 11α, 17β- trihidroxi- 5α- androstano (89) y 6β, 11α, 17β- trihidroxi-androst- 4- en- 3- ona (90), observándose que la reducción del grupo carbonilo en C-17 es más rápida que la hidroxilación en C-11α, siendo la reducción del grupo carbonilo regioselectiva. Los productos 73 (14%) y 74 (75%) fueron aislados de la biotransformación de 11 con Chaetomium sp., Figura 10.61
La obtención de derivados hidroxilados en una posición específica es un objetivo de la industria de los esteroides, por ejemplo los 14α- hidroxiesteroides han mostrado poseer actividad antiinflamatoria, anticonceptiva y antitumoral. La biotransformación de 11 y 85 con diferentes cepas del hongo Curvularia lunata permitió en el caso de 11, obtener como producto mayoritario 74; mientras con 85 se obtuvo 14α- hidroxiandrost- 1, 4- dien- 3, 17- diona (91, 70%), Figura 10.62
La testosterona (12) fue metabolizada por M. griseocyamus y T. piriforme. De la biotransformación de 12 con M. griseocyamus se obtuvieron 77 (35%) y otros productos, donde se identificó a 74 como producto mayoritario. Contrariamente, la transformación microbiológica de 12 con T. piriforme produjo a las 24 horas como producto principal 77 (10%), después de 72 h de biotransformación se obtuvieron cuatro productos: 73 (13%), 76 (7%), 77 (13%) y 91 (5%), observándose que T. piriforme produce en menor cantidad los derivados 14α-hidroxi-derivados, ver Figura 10.37
La biotransformación de 12 con Nectria haematococca se aislaron cuatro sustancias, cuyo rendimiento estuvo en función del tiempo de incubación; siendo los productos mayoritarios a las 72 h, los derivados hidroxilados en C- 11 con orientación α y deshidrogenación en C1- C2 para darlos compuestos: 11α- hidroxi-androst- 1, 4- dien- 3, 17- diona (92, 8%), 11α, 17β- dihidroxiandrost- 1, 4- dien- 3- ona (93, 4.3%). 81 (1.9%) y 84 (2.3%).63 La incubación de 12 con Fusarium culmorum produjo 73 (10%) y 76 (32%) con hidroxilación en C- 6β; además de los productos 15α, 17β- dihidroxiandrost- 4- en- 3- ona (94, 22%) y del 15α- hidroxi-androst- 4- en- 3, 17- diona (95). La hidroxilación selectiva en el C-6 con una orientación β y en posición alílica al sistema 3- ceto- insaturado en 95 es favorecida por el sistema π y la presencia del grupo hidroxilo en C- 17, mientras que la hidroxilación en C- 15 para los compuestos 11 y 12, es un proceso muy frecuente realizado por hongos del género Fusarium.40 Los metabolitos 11, 76, 94 y 95, fueron obtenidos como productos de oxidación e hidroxilación de 12 con el hongo F. oxysporum var. cubense.50 El hongo Cephalosporium aphidicola hidroxiló a 12 para dar los productos 76 (47%) y 77 (3%), con hidroxilación en C- 6β y C- 14α respectivamente.58 La incubación de 12 con C. lunata y Pleurotus oestreatus se obtuvieron los compuestos 11 (17%) y 95 (13%) respectivamente.64 El hongo fitopatógeno Botrytis cinerea produjo el 7 β, 17β- dihidroxi- androsta- 3-ona (96, 73%), como único producto de biotransformación de 12, al parecer la presencia del grupo hidroxilo en C- 17 en el esqueleto del androstano dirigió la hidroxilación en C- 7 con una orientación β, ver Figura 11.47
De la biotransformación de 12 por Bacillus stearothermophilus −bacteria termófila− se obtuvo como producto mayoritario 11 (90.2%), generado por la oxidación del C-17, y los derivados hidroxilados de 11 en C-6 (73, C-6β, 1.1%) y (97, C-6α, 0.9%); además, dos derivados monohidroxilados de 12, 76 (C-6β, 3.9%) y 98 (C-6α, 3.9%); sugiriendo que la hidroxilación con orientación α en el C-6, puede ser un acción común de algunas bacterias termófilas.65 La biotransformacion de 11 con B. stearothermophilus en presencia de inductores de hidrolasas −ácido salicílico, cloranfenicol, ciclodextrina, dexametasona, riboflavina y rifampicina− permitió obtener una mayor concentración de los compuestos: 9, 10- seco- 4- androsten- 3, 9, 17- triona (99), 5α- androstan- 3, 6, 17- triona (83), 17β- hidroxi- 5α- androstan- 3, 6- diona (100), 3β, 17β- dihidroxiandrost- 4- en- 6- ona (101) y 17β- hidroxiandrost- 4, 6- dien- 3- ona (102). Por ejemplo, la presencia de glucosa y ciclohexamida favoreció la obtención de 101, mientras la producción de 102 se logró en presencia de rifampicina.66 Los productos aislados de la biotransformación de 12 con Chaetomium sp fueron 73 (21%), 74 (39%) y 76 (19%), a las 24 horas de incubación se detectado la presencia de 11. Janeczkoa, et al. (2009), 61 concluyeron que los factores estéricos asociados con el sustrato determinan la localización y orientación del grupo hidroxilo. Por ejemplo, el grupo carbonilo en C- 17 en 11, dirige la entrada del grupo hidroxilo en C- 14 con orientación alfa; mientras que la hidroxilación en C-6β, se ve favorecida por la presencia del grupo hidroxilo en C- 17, como en 12. En el caso de la progesterona (1), la cual posee un grupo acilo se observaron derivados dihidroxilados en C- 6 y C- 14, ver Figura 11.61
La metiltestosterona (103) es un anabólico esteroidal, fue biotransformado por Mucor racemosus en cinco días para producir dos productos monohidroxilados en los C-7 (7α-hidroximetiltestosterona, 104, 35%) y C-15 (15α- hidroximetiltestosterona, 105, 21%), además de un producto dihidroxilado (12, 15α- dihidroximetiltestosterona, 106, 22%). Se ha informado del aislamiento de productos de hidroxilacion en diferentes carbonos a partir de 103 con diferente orientación, C- 6β, C- 7β, C- 9α, C- 11α, C- 12β y C- 15α, ver Figura 12.67
La dehidroepiandrosterona (3β- hidroxiandrost- 5- en- 17- ona, 107) prohormona endógena secretada por las glándulas suprarrenales, es precursora de los andrógenos y estrógenos. La incubación 107 con M. pririformis permitió el aislamiento de cinco compuestos: 3β, 17β- dihidroxiandrost- 5- eno (108), 3β, 7α- dihidroxiandrost- 5- en- 17- ona (109), 3β- hidroxiandrost- 5- en- 7, 17- diona (110), 3β, 17β- dihidroxiandrost- 5- en- 7- ona (111), y 3β, 7α, 17β- trihidroxiandrost- 5- eno (112), la acción de dicho hongo fue la hidroxilación estereoespecífica en C-7α (109 y 112) y la reducción del grupo carbonilo en C-17.45 De la bioconversión de 107 con Rhizopus stolonifer se aislaron siete productos: 108 (20%), 109 (12%), 112 (20%), 3β, 17β- dihidroxiandrost- 4- eno (113, 12%), 17β- hidroxiandrost- 4- en- 3- ona (114, 34%), 3β, 11β- dihidroxiandrost- 4- en- 17- ona (115, 15%).68Fusarium oxysporum biotransformó a 107 en una mezcla de cuatro derivados hidroxilados (108 a 110 y 112), los cuales fueron caracterizados como sus derivados acetilados; observando la hidroxilación favorablemente en C-7 de manera estéreoespecífica (orientación α) en los 3β- hidroxi- ∆5- esteroides, mientras que Colletotrichum musae biotransformó a 107 a 108 mediante la reducción del grupo carbonilo en C-17, ver Figura 13.50
La transformación microbiológica de la dehidroepiandrosterona (107) con Penicillum griseopurpureum y P. glabrum produjo derivados hidroxilados de 107 en C-7α (75), C-14α (74) y C-15α (95) y como principal producto 11. Además, P griseopurpureum generó los productos de oxidación de Baeyer Villiger para dar el anillo de la lactona D (testolactona, 13) y su derivado hidroxilado en C-15α (15α- hidroxi- 17a- oxa- D- homo- androst- 4- en- 3, 17- diona, 116), mientras P. glabrum generó los compuestos 3β- hidroxi- 17a- oxa- D- homo- androst- 5- en- 17- ona (117) y 3β- hidroxi- 17a- oxa- D- homo- androstan- 17- ona (118).69
Se ha descrito la biotransformación de la 17α- etinil- 17β- hidroxiandrost- 4- en- 3- ona (ethisterona, 119) y 17α- etil- 17β- hidroxiandrost- 4- en- 3- ona (120) con los hongos Cephalosporium aphidicola y Cunninghamella elegans. La bioconversión de 119 con C. aphidicola produjo 17α- etinill- 17β- hidroxiandrosta- 1, 4-dien-3-ona (121, 5.5%), mientras que con C. elegans se obtuvo 17α- etinil- 11α, 17β-dihidroxiandrost- 4- en- 3- ona (122, 3.4%). La biotransformación de 120 con C. aphidicola generó la 17α- etil- 17β- hidroxiandrosta- 1, 4-dien- 3- ona (123, 2.2%); por otra parte, al incubar 120 con C. elegans se obtuvieron dos nuevos productos 17α- etil- 11α, 17β-dihidroxiandrost- 4- en- 3- ona (124, 2.8%) y 17α- etil- 6α, 17β- dihidroxi- 5α- androstan- 3- ona (125, 1.6%), ver Figura 14.70
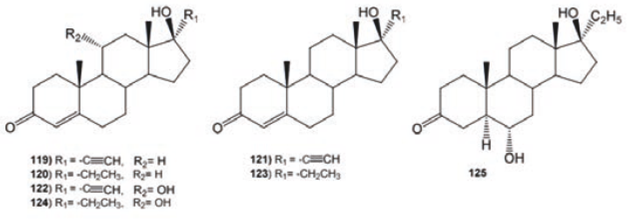
Figura 14 Productos de biotransformación de la 17α- etinil- 17β- hidroxiandrost- 4- en- 3- ona (119) y 17α- etil- 17β- hidroxiandrost- 4- en- 3- ona (120).
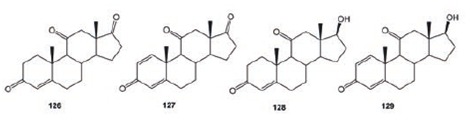
La adrenosterona (126) es un inhibidor de la enzima estrógeno sintetasa responsable de la formación de estrógenos y con gran aplicación clínica. La biotransformación de 126 con C. aphidicola generó androsta-1, 4-dien-3, 11, 17-triona (127, 3%), 17β- hidroxiandrost- 4- en- 3, 11-diona (128, 2%) y 17β- hidroxiandrosta-1, 4- dien- 3, 11- diona (129, 17%). Por otro lado, de la biotransformación de 126 con Fusarium linise obtuvieron 127 (11.2%) y 12 (8.1%), mientras 128 (36.8%) fue obtenido de la biotransformación de 126 con Trichothecium roseum, Figura 15.71
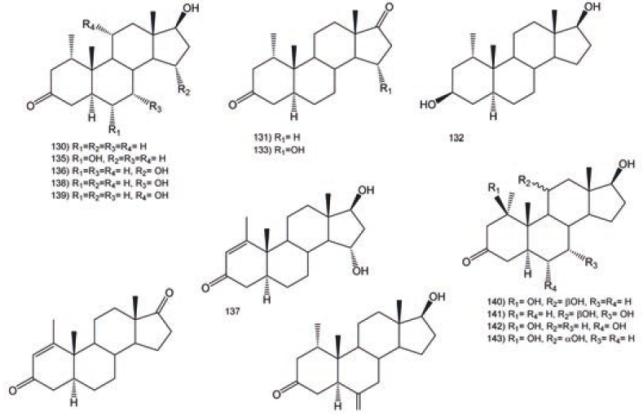
La biotransformación de la mesterelona (1α- metil- 17β- hidroxi- 5α- androstan- 3- ona, 130), es un esteroide androgénico sintético, fue realizada con diferentes hongos como describe Choudhary et al. (2005).70 De la biotransformación de 130 con C. aphidicola se obtuvieron los compuestos 1α- metil- 5α- androstan- 3, 17- diona (131), 1α- metil- 5α- androstan- 3, 17- diol (132) y 1α- metil- 15α- hidroxi- 5α- androstan- 3, 17-diona (133). La incubación de 130 con Fusarium lini produjo los compuestos 133, 1- metil- 5α- androstan1- en- 3, 17-diona (134), 1α- metil- 6α, 17β- dihidroxi- 5α- androstan- 3- ona (135), 1α- metil- 15α, 17β- dihidroxi- 5α- androstan- 3- ona (136) y 1- metil- 15α, 17β- dihidroxi- 5α- androstan- 1en- 3- ona (137). Los productos obtenidos de la biotransformación de 130 con Rhizopus stolonifer fueron 131, 135, 137, 1α- metil- 7α, 17β- dihidroxi- 5α- androstan- 3- ona (138) y 1α- metil- 11α, 17β- dihidroxi- 5α- androstan- 3- ona (139), Figura 16.72
La bioconversión de 130 con Cunninghamella blakesleeana produjo siete productos de biotransformacion, como 135, 138.139; además del 1α-metil-1β, 11β, 17β- trihidroxi- 5α- androstan- 3- ona (140), 1α- metil- 7α, 11β, 17β-trihidroxi- 5α- androstan- 3- ona (141), 1α- metil- 1β, 6α, 17β- trihidroxi- 5α- androstan- 3- ona (142), 1α- metil- 1β, 11α, 17β- trihidroxi- 5α- androstan- 3- ona (143), Macrophomina phaseolina biotransformó a 130 en 1α- metil-17β- hidroxi- 5α- androstan- 3, 6- diona (144), ver Figura 16.73
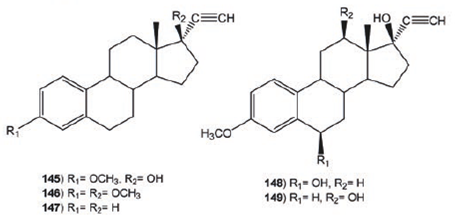
El mestranol (145) y el 17β- metoximestranol (146) son los derivados mono- y dialquilados del 17α- etinilestradiol (147), respectivamente. De la incubación de 145 con Cunninghamella elegans se obtuvieron dos compuestos hidroxilados: 6β-hidroximestranol (148, 2.78%) y 6β, 12β-dihidroximestranol (149, 3.61%), deduciéndose que la presencia del grupo metoxilo en C-3 reduce el número de productos de biotransformación e introduce grupos hidroxilo en los C-6 y C-12 con orientación β; mientras 148 no fue biotransformado debido a la presencia del grupo metoxilo en C-17, Figura 17.72
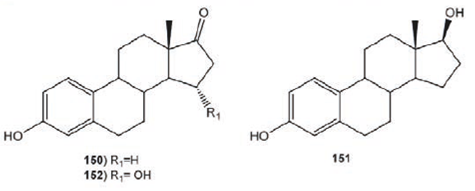
De la biotransformación de la 3- hidroxiestra-1, 3, 5 (10)- trien- 17- ona (150) con Fusarium oxysporum var. cubense se aislaron los compuestos de reducción en C-17 (3, 17β- dihidroxiestra- 1, 3, 5 (10)- trieno, 151 e hidroxilación en C-15 (3, 15α- dihidroxiestra- 1, 3, 5 (10)-trieno, 152), Figura 18.50
La prednisona (153) es un corticosteroide sintético (profármaco) utilizada para el tratamiento de enfermedades autoinmunitarias, inflamatorias y del riñón, entre otras. La biotransformación de 153 por C. elegans ocurrió mediante la hidrogenación de Δ4, 5 y reducción de C-20, para producir los compuestos 17α, 21- dihidroxi- 5α- pregn- 1- en- 3, 11, 20-triona (154, 15.8%) y 17α, 20S, 21- trihidroxi- 5α- pregn- 1- en- 3, 11- diona (155, 6.5 %), mientras que como único producto de biotransformación de 153 con Fusarium lini (5.2%), Rhizopus stolonifer (5.5%) y Curvularia lunata (6.2%) fue 1, 4- pregnadien- 17α, (20S), 21- triol- 3, 11- diona (156), Figura 19.74
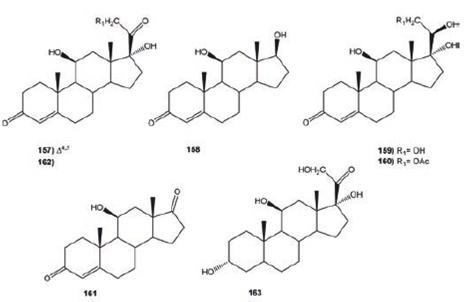
Las principales transformaciones químicas realizadas por diferentes especies del género Acremonium en diversos compuestos esteroidales han sido oxidaciones, reducciones, hidroxilaciones en distintas posiciones, isomerizaciones e hidrólisis de la cadena en C-17. La hidrocortisona (157) es un importante anabólico, usado clínicamente como antiinflamatorio y anti-alérgico; además de ser materia prima para la síntesis de muchas hormonas esteroidales. La biotransformación con Acremonium strictum de 157 generó los productos 11β, 17β- dihidroxiandrost- 4- en- 3- ona (158, 8%), 11β, 17α, 20β, 21- tetrahidropregn- 4- en- 3- ona (159, 11.2%) y 21- acetoxi- 17β, 17α, 20- trihidroxipregn- 4- en- 3-ona (160, 7.6%), observándose que la acción de dicha especie fue la reducción, acetilación y degradación de la cadena en C-17, sin modificación de la cetona-α, β-insaturada. Figura 20.75
La biotransformación de 157 con Gibberella fujikuruoi produjo 11β- hidroxiandrost- 4- en- 3, 17- diona (161, 41%), mientras con Bacillus subtilis y Rhizopus stolonifer se obtuvieron 159 (15%). Los productos 11β, 17α, 21- trihidroxi- 5α- pregnan- 3, 20- diona (162, 45%) y 3α, 11β, 17α, 21- tetrahidroxi- 5α- pregnan- 20- ona (163, 31%) fueron obtenidos de la bioconversión de 157 con Bacillus cerus, Figura 20.76
La incubación 17β- metoxi- 5α- androstan- 3- ona (164) Cephalosporium aphidicola produjo 17β- metoxi- 5α- androstan- 3β- ol (165) y 6β, 11α- dihidroxi- 17β- metoxi- 5α- androstan- 3- ona (166); mientras la biotransformación del 17β- metoxiestra- 4- en- 3- ona (167) con C. aphidicola dio como metabolito mayoritario al 6β- hidroxi- 17β- metoxiestra- 4- en- 3- ona (168). Similarmente, la transformación microbiológica del 3β- metoxiandrostan- 5- en- 17- ona (169) dio una mezcla de productos: 7α- hidroxi- 3β- metoxiandrostan- 5- en- 17- ona (170) y 7β- hidroxi- 3β- metoxiandrostan- 5- en- 17- ona (171), Figura 21.77
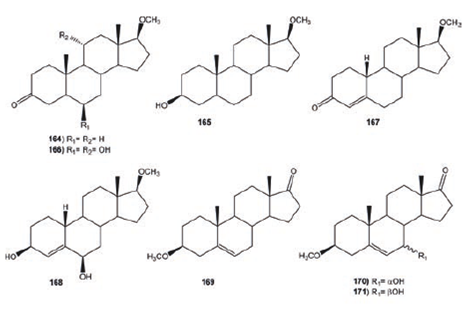
Figura 21 Productos de biotransformación 17β- metil- 5α- androsten- 3- ona (164) 17β- metoxiestra- 4- en- 3- ona (167) y 3β- metoxiandrostan- 5- rn- 17- ona (169).
En la literatura se han descrito varias especies de hongos pertenecientes a los géneros Aspergillus, Fusarium, Mortierella y Penicillum capaces de hidroxilar de manera esteroselectiva el C15 en diversos esteroides. Por ejemplo, Jekkel et al. (1998)78describen la evaluación de más de 3000 hongos para hidroxilar la posición C-15 en la 13β- etil- 4- gonan- 3, 17- diona (172), siendo el género Fusarium y en particular Fusarium nivale, el hongo que hidroxila preferentemente 172 con una orientación alfa (15α- hidroxi- 13β- etil- 4- gonan- 3, 17- diona, 173, 77%) y C-7β (7β,15α- dihidroxi- 13β- etil- 4- gonan- 3,17-diona, 174). Por otro lado, la biotransformación de 172 con Mortierella pusilla produjo 173, 175 (10β- hidroxi- 13β- etil- 4- gonan-3, 17-diona) y 176 (6β- hidroxi- 13β- etil- 4- gonan-3, 17-diona), Figura 22.78
El diacetato del etinodiol (177) es una derivado sintético 1, utilizado como anticonceptivo oral debido a que inhibe el proceso de la ovulación. La transformación microbiológica del 177 con Cunninghamella elegans produjo tres compuestos hidroxilados que fueron caracterizados como: 17α- etinilestra- 4- en- 3β, 17β- diacetoxi- 6α- ol (178, 0.5%), 17α- etinilestra- 4- en- 3β, 17β- diacetoxi- 6β- ol (179, 1%), 17α- etilestra- 4- en- 3 β, 17β- diacetoxi- 10β- ol (180, 0.5%) y 17α- etinil- 17β- acetoxiestra- 4- en- 3- ona (181, 1.4%), ver Figura 23.79
Los fármacos mexrenona (182) y canrenona (183) son esteroides con una espirolactona en el C-17 y son potentes antagonistas de los mineralocorticoides.80 La biotransformación de 182 y 183 con una amplia diversidad de microrganismos resultó en la obtención de productos monohidroxilados en diferentes posiciones, donde Beauveria bassiana generó a la 11α- hidroximexrenona (184, 67%) como producto mayoritario, mientras que la 12β- hidroximexrenona (185, 50%) y 6β- hidroximexrenona (186, 33%) se obtuvieron con Mortierella isabellina. El producto de deshidrogenación (Δ1, 2mexrenona, 187, 15%) fue favorecido con Bacterium cyclo-oxidans; además de Rhodococcus equi, Nocardia aurentia y Comomonas testosteroni. De la biotransformación de 183 con Corynespora cassicola se obtuvo 9α-hidroxicanrenona (188, 30 %), Figura 24.81
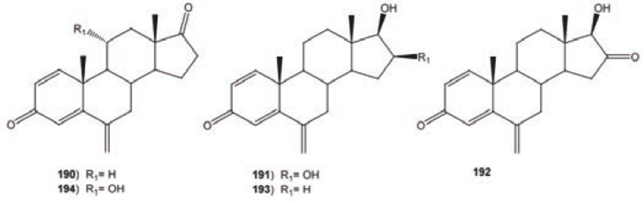
Uno de los esteroides utilizados en el tratamiento del cáncer de mama es el exemestano (190)− aromasin, inhibidor de la aromatasa esteroidal−. De la transformación de 190 con Macrophomina phaseolina se obtuvieron la 16β, 17β- dihidroxi- 6- metilen- androsta- 1, 4- dien- 3- ona (191) 17β- hidroxi- 6- metilen- androsta- 1, 4- dien- 3, 16- diona (192) y 17β- hidroxi- 6- metilen- andros- 1, 4-dien-3-ona (193) mientras con Fusarium lini se obtuvo como único producto a la 11α- hidroxi- 6- metilen- androsta- 1, 4- dien- 3, 17-diona (194), ver Figura 25.82
Dianabol (Metandrostenolona, 17α- metil- 17β- hidroxilandrosta- l.4- dien- 3- on, 195) es un esteroide anabolizante oral que promueve la síntesis de las proteínas (aumento del tejido muscular). De la biotransformación de 195 con Cunningamella elegans se obtuvieron cinco productos de bioconversión: 6β, 17β- dihidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3- ona (196), 15α, 17β- dihidroxi- 17αmetil- 5α- androsta- 1, 4- dien- 3- ona (197), 11α, 17β- dihidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3- ona (198), 6β, 12β, 17β- trihidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3- ona (199), 6β, 15α, 17β- trihidroxi- 17α- metil- 5α- androsta-1, 4- dien- 3- ona (200). Los productos 17β- hidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3, 6- diona (201), 7β, 17β- dihidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3- ona (202), 15β, 17β- dihidroxi- 17α- metil- 5α- androsta-1, 4- dien- 3- ona (203), 17β- hidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3, 11- diona (204), 11β, 17β- dihidroxi- 17α- metil- 5α- androsta- 1, 4- dien- 3- ona (205), fueron obtenidos de la biotransformación de 195 con Macrophomina phaseolina, ver Figura 26.83Se ha informado de la biotransformación de 195 con varios microrganismos, por ejemplo Penicillum notatum84 transformó 195 en 196 y 197, mientras Trichoderma hamatum85 produjo 198. Similarmente Beauveria bassiana,86Aspegillus ochraceus, Colletotrichum lagenarium y Sporotrichum sulfurescens dan como producto de biotransformación 198. Absidia glauca87 metabolizó 195 en los compuestos 195, 201 y 202, por el contrario, la biotransformación de 195 con A coerua88 produjo 204 junto con 7α, 17β- dihidroxi- 17α- metilandrosta- 1.4- dien- 3- ona (205), mientras con Botrytis cinereae89 se obtuvo 205, como único producto, ver Figura 26.

Figura 26 Productos de biotransformación del dianabol (17β- hidroxi- 17α- metil- androst- 1.4- dien- 3- ona, 195).
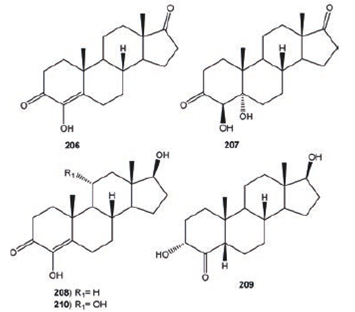
El formestano (4- hidroxiandrost- 4- en- 3, 17- diona, 206) es un inhibidor de la enzima aromatasa esteroidal que convierte los andrógenos en estrógenos, actualmente es usado en el tratamiento de cáncer de pecho y ovario en mujeres postmenopaúsicas. De la transformación microbiológica de 206 con Rhizopus oryzae se obtuvo 4β, 5α- androstan- 3, 17- diona (207, 8.6%), mientras que la biotransformación de 206 con Beauveria bassiana produjo la 4, 17β- dihidroxiandrost- 4- en- 3- ona (208, 5.3%), 3α, 17β- dihidroxi- 5β- androstan- 4- ona (209, 0.9%) y 4, 11α, 17β- trihidroxiandrost- 4- en- 3- ona (210, 2.4%), ver Figura 27.90
Conclusiones
Los procesos de biotransformación de diferentes sustancias esteroidales descritas en esta revisión, si bien no son exhaustivos, pretenden resaltar la importancia que tiene las biotransformaciones por medio de diferentes microrganismos, como una herramienta químico-biológica útil para la obtención de derivados químicos novedosos desde diferentes aspectos, tanto a nivel de investigación, como industrial. Como por ejemplo, la obtención de compuestos esteroidales para la industria farmacéutica.
La biotransformaciones de esteroides se ha implementado de manera importante en la síntesis parcial de nuevos esteroides, para su evaluación como hormonas y fármacos. Actualmente, existe una amplia variedad de esteroides usados como diuréticos, anabólicos, anti-inflamatorios, anti-androgénicos, anti-conceptivos, anti-tumorales, entre otras aplicaciones.
La funcionalización química en los diferentes átomos de carbono del esqueleto del esterano se encuentra relacionada con la actividad biológica de la molécula, razón por la cual las transformaciones microbiológicas juegan un papel importante en la obtención de dichos compuestos mediante transformaciones químicas, como la oxidación del grupo hidroxilo en C-3 y C-17, isomerización del doble enlace Δ5-6 a Δ4-5, hidrogenación de dobles ligaduras Δ1-2 y Δ4-5, reducción del grupo carbonilo en C-17 y C-20 con orientación β.
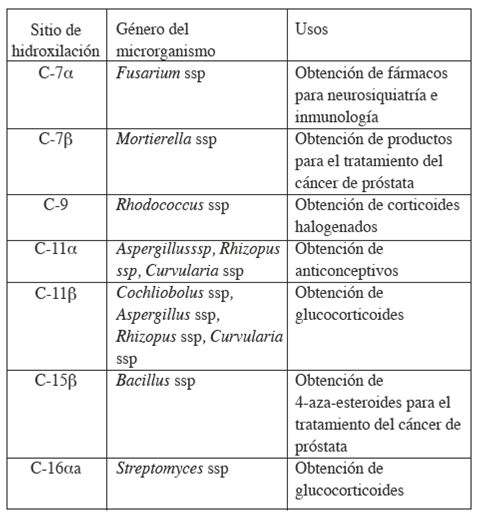
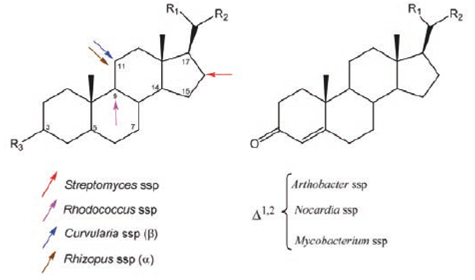
Las "biohidroxilaciones" efectuadas en diferentes posiciones del esqueleto esteroidal−C-11α, C-11β, C-15β y C-16α− utilizando diferentes especies de hongos de los géneros Rhizopus, Aspergillus, Curvularia, Cunninghamella y Streptomyces con altos rendimientos, son una transformación química importante en muchos esquemas de síntesis de nuevos esteroides con una actividad biológica determinada (Tabla 1), ver Figura 28.
La hidroxilación de esteroides −progesterona, testosterona, 17 α- metiltestosterona y 4- androsten- 3, 17-diona− que presentan el sistema 4-en-3-ona, procede con una alta estéreo y regioselectividad en los C-6 y C-11, con una orientación β en C-6 y con orientación alfa en C-11. La presencia del grupo metilo en C-10 es necesaria para la hidroxilación en el C-11, como se puede observar en los derivados de la 19-nortesterona.
El interés por las biotransformaciones de compuestos esteroidales ha venido incrementándose en los últimos años, debido a la obtención de nuevos y útiles compuestos farmacológicamente activos. Aunado al desarrollo de nuevas cepas genéticamente modificadas, al incremento en la disponibilidad de enzimas inmovilizadas y a la manipulación de los medios de cultivo.
Las biotransformaciones de los esteroides procede con rendimientos de bajos a moderados en general, una de las principales causas es su baja solubilidad en agua. Actualmente, se desarrollan metodologías que permitan la incorporación de sustancias químicas −surfactantes, líquidos iónicos, ciclodextrinas, liposomas, entre otros− que coadyuven a mejorar los rendimientos de cada proceso de biotransformación. Además, de contribuir al desarrollo de procesos amigables con el medio ambiente.











 nueva página del texto (beta)
nueva página del texto (beta)