Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.45 no.4 Ciudad de México oct./dic. 2014
Trabajo científico
Optimización de un método para determinación de fitoesteroles y escualeno en ácidos grasos destilados usando la metodología de superficie de respuesta y su validación
An optimization method of quantification for phytosterols and squalene in distillated fatty acids using response surface methodology and its validation
José Rodríguez-Rodríguez,1 Carlos Amaya-Guerra,1 Porfirio Caballero-Mata,2 María Guadalupe Alanís-Guzmán,1 Carlos Aguilera-González,1 Juan Báez-González,1 Sergio Moreno Limón,1 Adriana Núñez-González1
1 Universidad Autónoma de Nuevo León, Facultad de Ciencias Biológicas, México.
2 Instituto Tecnológico y de Estudios Superiores de Monterrey, Monterrey, N.L. México.
Correspondencia:
MC. José Rodríguez Rodríguez
Departamento de Alimentos
Facultad de Ciencias Biológicas
Universidad Autónoma de Nuevo León
Av. Universidad s/n Cd. Universitaria
San Nicolás de los Garza, N. L, C.P. 66451. México
Tel 81 83294110 Ext. 3653
e-mail: jrr@itesm.mx
Fecha de recepción: 14 de agosto de 2014
Fecha de recepción modificaciones: 02 de febrero de 2015
Fecha de aceptación: 26 de febrero de 2015
Resumen
Se optimizaron las condiciones de purificación simultánea de fitoesteroles y escualeno para su análisis en ácidos grasos destilados de soya, un subproducto de la industria de refinación de aceite. Se estudió el efecto combinado del volumen de eluente, cantidad de adsorbente y de compuestos en la muestra usando un arreglo factorial completo 23 en un diseño compuesto central. Los dos primeros influenciaron principalmente (p< 0.05) la purificación de los fitoesteroles, no así el tercero. Se validó el método analítico, obteniendo precisión y exactitud aceptables en condiciones de reproducibilidad. La concentración de fitoesteroles totales, fitoesteroles libres, esterificados y escualeno fue de 17.19, 15.16, 2.03, y 2.17 % p/p respectivamente lo que hace a dicho subproducto una fuente potencial de estos compuestos para la industria alimentaria, farmacéutica y cosmética.
Palabras clave: Optimización, Validación, Metodología de Superficie de Respuesta, Fitoesteroles, Ácidos Grasos Destilados de Aceite de Soya.
Abstract
Simultaneous purification conditions of phytosterols and squalene were optimized for its analysis in soybean oil deodorizer distillate, a by-product of the oil refining industry. The combined effect of the eluent volume, the amount of silica gel and amount of compounds in the sample were studied using a complete factorial arrange 23 in a central compound design. The purification of phytosterols was mainly influenced by the first two factors (p<0.05) but not by the third factor. The analytical method was validated, obtaining precision and accuracy that were acceptable in reproducibility conditions. The concentrations of total phytosterols, free and esterified phytosterols and squalene, were: 17.19, 15.16, 2.03, y 2.17 % p/p respectively, making this by-product a potential source of said compounds for the food, pharmaceutical and cosmetic industry.
Key words: Optimization, Validation, Response Surface Methodology, Phytosterols, Soybean Oil Deodorizer Distillate.
Introducción
La deodorización de los aceites vegetales tiene la finalidad de eliminar sustancias que imparten sabores y olores indeseables a los mismos. Esta operación es una de las etapas finales en el proceso de refinación química utilizada actualmente y se lleva a cabo por destilación, mediante arrastre con vapor de los compuestos más volátiles presentes en el aceite crudo.1 Junto con dichas sustancias, (productos de oxidación como aldehídos, cetonas, ácidos grasos libres, etc.) se destilan, algunos componentes minoritarios entre los que destacan, tocoferoles, fitoesteroles, escualeno, mono y diglicéridos, hidrocarburos pesados y algunos triglicéridos. Este destilado es un subproducto conocido como ácidos grasos destilados (AGD's); particularmente, el proveniente de la refinación de aceite de soya (AGDAS) es de especial interés por su alto contenido de sustancias bioactivas como los son los tocoferoles, fitoesteroles y escualeno, por lo que representa una potencial fuente natural de éstos. Se han reportado valores para tocoferoles y fitoesteroles de 2-10 y 3-15 %p/p, respectivamente2 y para escualeno 5.5 % p/p.3 Sin embargo, las condiciones de temperatura, presión y tiempo de residencia en el deodorizador influyen en la composición de dicho subproducto.1 En consecuencia, resulta necesario cuantificar dichas sustancias para establecer el valor de este para su posible aprovechamiento.
El escualeno (E) es un hidrocarburo terpenoide que se encuentra en importante proporción en hígado de especies marinas, como ballenas y tiburones. Generalmente se utiliza en su forma natural o hidrogenada en la formulación de cosméticos por sus propiedades como humectante o agente emoliente. Sin embargo, su uso en aplicaciones cosméticas ha sido limitado ya que existe una preocupación por la conservación de las especies marinas a nivel internacional. Por lo cual, resulta importante establecer fuentes alternas para el suministro de este hidrocarburo.4
Los fitoesteroles se utilizan actualmente como ingredientes de alimentos funcionales, debido a sus efectos protectores, especialmente β-sitosterol, en contra de cáncer de colon, próstata, mama, aunado a su ya bien conocido efecto hipocolesterolemico.5 De hecho, los ensayos clínicos controlados han demostrado que el consumo de fitoesteroles (2-3 g/d) resultan en la reducción del colesterol de aproximadamente el 10%.6,7
Los fitoesteroles libres (FL) y esterificados (FE) son componentes esenciales de las membranas de las células vegetales y se encuentran ampliamente distribuidos junto con los fosfolípidos y otros glicolipidos.8 El contenido, tipo y proporción de FL y FE es característico de cada tipo de aceite; por ejemplo, el aceite de oliva tiene altos niveles de β-Sitoesterol y Δ7-Avenasterol mientras que el aceite de girasol es rico en Δ7-Estigmaesterol.9
Particularmente los FE tienen mayor interés en la industria alimentaria por ser más biactivos y liposolubles que los FL, por lo que es fácil incorporarlos en productos grasos para la producción de alimentos funcionales.10 Con base en lo anterior, es importante establecer una metodología analítica que permita la cuantificación de los FE en cualquier fuente natural.
Con respecto a los métodos para el análisis de fitoesteroles por cromatografía de gases, existe información que cita la etapa previa de derivatización, específicamente la sililación, la cual consiste del remplazo de un hidrógeno ácido por un alquilsililo dentro de una molécula, con lo cual se mejora la volatilidad, estabilidad térmica y la detección del analito;11 sin embargo, para esta etapa se utilizan reactivos como la piridina y N,O-bis(trimetilsilil) trifluoroacetamida con 1% de trimetil cloro silano (TMCS), los cuales son de difícil manejo en el laboratorio y representan un costo extra para su correcta disposición, la derivatización tiene también la desventaja de que las condiciones y los tiempos de reacción llegan a ser hasta de 2 h. Por lo anterior, se hace necesario evaluar estadísticamente la posibilidad de eliminar la etapa previa de derivatización para el análisis de los compuestos de interés.
Por otra parte, por ser los AGDAS una matriz compleja (un concentrado de ácidos grasos libres, diglicéridos y triglicéridos), resulta indispensable también, establecer protocolos de purificación previa a la cuantificación para la eficiente separación de los FL de los FE, además de la eliminación de algunas interferencias. Existen reportes que refieren el uso de 15 g sílica gel como adsorbente empacado en columnas de vidrio (300 x 20 mm) y 75 mL de eluente fracción polar para la elución de los FL y otros 75 mL de fracción no polar, para la elución de los FE, para cada muestra.12 Este procedimiento requiere cantidades importantes de reactivos y genera una dificultad para el correcto manejo y disposición de los residuos, aunado a la complejidad en la manipulación del material de vidrio utilizado en la purificación. Existen estudios en los que se utilizan 500 mL de una mezcla de metanol: cloroformo (1:2 v/v) para la extracción y purificación de los fitoesteroles libres y esterificados en semillas,8 en este caso, el cloroformo por ser un compuesto organoclorado, es un solvente de difícil manejo en el laboratorio, potencialmente tóxico, además de que se generan costos extra para su correcta disposición.
Otros autores, reportan el uso de un sistema en línea Cromatografía de líquidos-Cromatografía de gases (CL-CG) para el análisis de FL, FE y FT. En el cromatógrafo de líquidos los FL se separan de los triglicéridos para su posterior identificación y cuantificación en el Cromatógrafo de gases (CG). Para la determinación de los FT, la muestras son saponificadas y los insaponificables, se extraen con éter etílico, el extracto se inyecta al sistema CL-CG y los FE se estiman de forma indirecta,9 esta técnica genera una alta cantidad de residuos y es de alto costo por involucrar las dos técnicas analíticas cromatográficas.
Con respecto al análisis estadístico, entre las técnicas multivariantes de mayor relevancia utilizadas en la optimización de procesos analíticos, está la metodología de superficie de respuesta (RSM). Ésta involucra la aplicación de técnicas matemáticas y estadísticas con el objetivo de ajustar a una ecuación polinomial los datos experimentales, lo cual permite describir el comportamiento de un conjunto de valores con el objetivo de hacer predicciones estadísticas. Se puede aplicar cuando se tiene una respuesta de interés o un conjunto de éstas que son influenciadas por diversas variables. El objetivo es optimizar simultáneamente los niveles de dichas variables para conseguir el mejor rendimiento en el proceso.
Previo a la aplicación de la metodología de RSM se requiere elegir un diseño experimental que defina los ensayos a realizarse en la región experimental de estudio. Para este fin, los diseños para los modelos de primer orden (por ejemplo, los factoriales) se pueden usar cuando el conjunto de datos no presenta curvatura. Sin embargo, para los datos experimentales que no pueden ser descritos por funciones lineales, existen diseños para respuestas de superficies cuadráticas, como factorial de tres niveles, Box-Behnken, compuesto central y Doehlert.13,14
Por lo anterior, el propósito de este estudio fue establecer una metodología optimizada con el uso de herramientas estadísticas como el método de superficie de respuesta y su posterior validación, para la simultanea purificación y cuantificación de escualeno, fitoesteroles libres y esterificados en ácidos grasos destilados de aceite de soya, que represente una opción viable para la disminución de costo, tiempo y generación de residuos y que permita evaluar la factibilidad del aprovechamiento de dicho subproducto como fuente natural de estas sustancias bioactivas. Asimismo, dicha metodología permitirá establecer la calidad y originalidad de los aceites vegetales.
Material y métodos
Los ácidos grasos destilados provienen del proceso de refinación de aceite de soya (AGDAS), fueron obtenidos de una industria de refinación de aceite vegetal de la localidad Monterrey Nuevo León México. Todas las muestras fueron almacenadas a -15 °C hasta su análisis. Escualeno, β-sitoesterol, campesterol, estigmaesterol, colesterol y sílica gel grado cromatográfico 100-200 malla fueron obtenidos de Sigma Aldrich (St. Louis, MO, USA). El resto de los reactivos y solventes fueron de grado analítico marca Fisher Scientific (Monterey N.L. Mex.). Para las etapas de optimización y validación se utilizó el producto Vegapure 95 FF lote GR83057002 obtenido de BASF The chemical company como matriz de trabajo por tener este una composición grasa semejante a la matriz en estudio, con concentración conocida de fitoesteroles esterificados de 97 % p/p que expresados como fitoesteroles libres equivale al 60 % p/p.
Optimización de la purificación de fitoesteroles libres, esterificados y escualeno usando el método de superficie de respuesta en un diseño compuesto central (DCC)
La purificación de los fitoesteroles y escualeno se realizó en una columna de sílica gel utilizando como eluente para la fracción no polar, hexano:acetato etilo (90:10) y para la polar hexano:éteretílico:etanol (25:25:50) para obtener los fitoesteroles esterificados, escualeno y los fitoesteroles libres respectivamente. Para evaluar la capacidad de la fracción polar se utilizó el colesterol como analito, ya que su estructura química es similar a los FL. El volumen de eluente, la cantidad de sílica gel y cantidad de fitoesteroles, escualeno y colesterol (factores independientes X1, X2 y X3 respectivamente) fueron variados para optimizar la etapa de purificación mediante el método de superficie de respuesta en un diseño compuesto central (DCC). Para determinar la mejor combinación de los tres parámetros de purificación en función del incremento de la recuperación de los FE, escualeno y colesterol se usaron cinco niveles (-1.68, -1, 0, + 1 y 1.68) en el DCC (Tabla 1).El número de tratamientos en el diseño fue de N=2K+2k+n0. El punto central fue replicado seis veces para obtener los grados de libertad de cinco y así calcular el error experimental. Los valores óptimos de las condiciones experimentales fueron determinados aplicando la ecuación polinomial de segundo orden (Ecuación2) y analizando la gráfica de contornos de la superficie de respuesta. Las variables fueron codificadas de acuerdo a la ecuación 1.


Donde Xi es el valor codificado de la variable i;xi el valor real no codificado de una variable independiente;x0 el valor de Xi en el punto central;y Ax es la diferencia de cambio entre los niveles 0 y 1.

Donde:
Y es el % de recuperación del compuesto a evaluar;β0es la constante del coeficienteβi es el coeficiente linear;βii es el efecto del coeficiente cuadradoβij es el coeficiente del efecto de la interacción;Xi y Xj son los valores codificados de las variables i y j; respectivamente.
El trabajo del diseño experimental, análisis de datos, gráficas de superficie de respuesta y de contornos fue realizado en el programa estadístico Design Expert trial-version 7(Stat-Ease Inc., Minneapolis, MN).
Tratamiento a la fracción no polar12
La fracción no polar proveniente de la purificación que contiene los FE y escualeno, se concentró a 2 mL aproximadamente, se saponificó añadiendo 20 mL de solución de KOH en etanol al 6 % p/p en baño maría a 75 °C por 1h. Posteriormente se realizó una extracción líquido-líquido en un embudo de separación de 250 mL con dos porciones de éter etílico de 25 mL, luego, la fracción de éter se lavó con KOH 0.25M (50 mL) y con agua destilada (50 mL), la fracción de éter se colectó pasando por Sulfato de Sodio en un matraz bola de 100 mL y se concentró a 3 mL aproximadamente, finalmente se aforó a 10 mL con hexano.
Tratamiento a la fracción polar.12
La fracción polar que contiene el colesterol y representa a los FL se concentró a aproximadamente 3.0 mL y finalmente se aforó a 10 mL con hexano.
Todas las concentraciones fueron realizadas a presión reducida en rotavapor (Heildoph, Caframo LTD VV 2000) a 150 rpm, temperatura de 50 °C.
Validación del método analítico
Se prepararon 15 muestras sintéticas de concentración conocida de fitoesteroles pesando 0.15 g de Vegapure 95 FF aforando a 10 mL con hexano y una solución de escualeno de 2760 mg/L. De cada una de las soluciones se añadieron 0.1 mL a los cartuchos de sílica para la aplicación de la metodología de purificación y análisis previamente optimizada y obtener así las concentraciones experimentales. Con los datos obtenidos y utilizando las ecuaciones estadísticas correspondientes (3, 4, 5, 6 y 7) se calcularon los siguientes parámetros de Validación:
Límite de detección (LDM) y cuantificación (LCM), precisión en condiciones de reproducibilidad y repetibilidad, exactitud expresada como sesgo, recuperación, incertidumbre y rango de trabajo.
Cálculo de la precisión inicial del método
Dado que la precisión del método está en función de la variabilidad de las mediciones, ésta se calculó en términos del porcentaje de desviación estándar relativa Sr a partir de los resultados analíticos obtenidos, mediante la ecuación 3.15
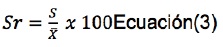
Donde:
s: Desviación estándar
 : Valor promedio de las concentraciones de las 15 réplicas
: Valor promedio de las concentraciones de las 15 réplicas
Cálculo de la exactitud o sesgo del método
La exactitud o sesgo es una medida de la proximidad existente entre la medida de la tendencia central y el teórico o el valor esperado, μ. La exactitud se representa como un error relativo porcentual Er, mediante la siguiente ecuación 4.15

Donde:
 : Valor promedio de las concentraciones de las 15 réplicas
: Valor promedio de las concentraciones de las 15 réplicas
μ: Valor teórico o esperado
Incertidumbre
En consideración de que la incertidumbre de una medición, se define como el intervalo estadístico dentro del cual se tiene una probabilidad de que se encuentre el valor verdadero, ésta es en cierta medida subjetiva y se debe tomar como la duda que se tiene del resultado de la medición, debido a los errores que se cometen y que no se corrigen.
Para el cálculo de la incertidumbre se consideraron todas las fuentes de ésta que afectan a la medición y se incluyeron en la fórmula de la propagación de las incertidumbres estándar usando la ecuación 5.15

 Incertidumbre combinada relativa al nivel de concentración.
Incertidumbre combinada relativa al nivel de concentración.
 Sumatoria de cada una de las fuentes de incertidumbre relativa al nivel de medición de cada fuente, para conocer la contribución de cada fuente a la incertidumbre combinada.
Sumatoria de cada una de las fuentes de incertidumbre relativa al nivel de medición de cada fuente, para conocer la contribución de cada fuente a la incertidumbre combinada.
La incertidumbre combinada obtenida se multiplicó por el factor de cobertura k=2 para obtener así la incertidumbre expandida para un nivel de confianza del 95 %, finalmente se reporta relativa a la concentración promedio experimental con la que se estimó.
Cálculos para el LDM y LCM
Estos parámetros están relacionados con la sensibilidad del método. El límite de detección (LDM) se define como la cantidad de analito presente que se deriva de la menor señal analítica que puede detectarse con certeza razonable.
Como la señal del blanco debe coincidir con el intercepto de la curva de calibración, puesto que es la que se obtendrá a una concentración del analito igual a cero. El LDM se calculó con la ecuación 6.16

Sa : Desviación estándar de la ordenada.
b : Pendiente en la curva de calibración.
El LCM se define como la cantidad de analito presente derivada de la menor señal analítica que puede ser medida con precisión y exactitud. De manera análoga al LDM, la IUPAC propone como LCM al valor obtenido en la ecuación (7).16

Evaluación de dos modalidades de cuantificación y la etapa de derivatización para fitoesteroles totales
Para esta etapa se trabajó con los extractos obtenidos en la validación pero variando las modalidades de la cuantificación y pre tratamiento anteriormente mencionadas. Con el fin de establecer una metodología que impacte en la disminución de costos, tiempo y generación de residuos peligrosos sin detrimento en la calidad de los resultados analíticos, se evaluaron con la prueba de t de student, utilizando el modelo de muestras pareadas, dos modalidades de cuantificación: estándar interno utilizando el colesterol y estándar externo (realizando la curva de calibración para cada uno de los fitoesteroles a cuantificar); así como la evaluación de la metodología incluyendo la etapa de derivatización y sin derivatizar.
La derivatización se realizó con N,O-bis(trimetilsilil) trifluoroacetamida con 1 % de triclorometil silano (TMCS) con las condiciones óptimas reportadas.17
Análisis de Muestras
Con la metodología optimizada y validada, se realizó la cuantificación de los FL, FE, y E en AGDAS.
Determinación del contenido de fitoesteroles y escualeno
El análisis se realizó en un Cromatógrafo de Gases 6890N acoplado a un espectrómetro de masas 5973N con una columna capilar HP 5MS:30m*0.25mm*0.25μm (Agilent Technologies, Alemania). Se determinó el contenido de fitoesteroles esterificados y escualeno en el extracto de la fracción no polar y los fitoesteroles libres en el extracto de la fracción polar. Las condiciones cromatográficas fueron: temperatura de la columna 190 °C, se mantuvo por 1 min, después se alcanzó la temperatura de 300 °C con una rampa de 15 °C, se mantuvo por 10 min. Temperatura del inyector y detector 270 °C y 230 °C respectivamente, gas acarreador helio con un flujo de 0.8 mL/min.
Evaluación de la precisión obtenida en condiciones de reproducibilidad
La evaluación de la precisión se realizó con la ecuación del coefieciente de HorRat,18 que dedujo una expresión para predecir el valor de precisión a partir de la concentración del analito C, (Ecuación 8).


Resultados y discusiones
Optimización de la purificación
Evaluación del método de superficie de respuesta (MSR) en un diseño compuesto central (DCC).
El grado de ajuste al modelo cuadrático fue determinado por el análisis de varianza (ANOVA), tablas 2a, 2b, y 2c para FE, E y FL (colesterol), respectivamente, donde se puede observar la significancia estadística del modelo (p< 0.05). También se observa una concordancia en la significancia de efecto lineal para los factores gramos de sílica gel y volumen de eluente para cada uno de los compuestos; por lo tanto el % de recuperación puede ser explicado por los modelos de la ecuaciones 10,11 y 12 para E, FL y FE, respectivamente, que establecen que éste es dependiente de los dos factores antes mencionados y no así de los miligramos de los compuestos (p> 0.05).
Además el ajuste de los datos experimentales al modelo de regresión se comprobó con el coeficiente de determinación (R2),encontrándose valores de 0.867, 0.877 y 0.898 en los modelos para los FL (colesterol), E y FE respectivamente, lo cual indica que el 87, 88 y 90 % de las variaciones en los % de recuperación de los compuestos es atribuido a los factores significativos (variables independientes), tablas 2a, 2b, y 2c. Aunque estos valores pudieran parecer bajos en estadística aplicada, es preciso mencionar que en el proceso evaluado (purificación de FE, E y FL) se trabajó con una matriz de la misma complejidad que la de la muestra real (AGDAS) que es prácticamente un concentrado de impurezas,como son ácidos grasos libres, digliceridos y triglicéridos lo que implicó añadir al proceso las etapas de saponificación, extracción, concentración y análisis después de la purificación. Por otra parte en su trabajo Pinho etal, 2011,19 enfatizan en la aceptación de cualquier modelo cuando R2 > 0.75.
Además el valor de la precisión adecuada fue de 8.4, 8.0 y 9.9 citadas en el mismo orden que se hizo anteriormente, indicando que el modelo puede ser usado para explorarse en el espacio del diseño.



La combinación óptima de los factores que proporcionaron el máximo porcentaje de recuperaeión en la purificación del FL (colesterol), E y FE del material graso que se utilizó como matriz de ensayo se muestran en las figuras de contornos 1a, 1b y 1c respectivamente para cada modelo. Donde los valores estimados bajo la combinaeión óptima se señalan y corresponde a 21.0 mililitros del eluente (fase polar y no polar) y 3.0 g de síliea gel, los euales representan una disminución substancial (72 y 80 % respectivamente) respecto a los valores referenciados12 que utilizan 75 mililitros y 15 gramos respectivamente para muestras de aceite vegetal.
Validación del Método
15 muestras de concentración conocida de fitoesteroles esterificados y escualeno fueron analizadas con las condiciones óptimas seleccionadas de purificación y análisis. Aplicando las ecuaciones 3-7 se calcularon los parámetros de validación correspondientes los cuales se representan en la tabla 3. Como se observa los % de recuperación obtenidos están en los rangos de 81.3-110 estos valores son mayores a los % de recuperación obtenidos con los parámetros seleccionados como óptimos en el diseño. La mejora se atribuye al número de réplicas que se realizaron para la validación (15) en contraste con el diseño que solo se realizó un duplicado por tratamiento. El presente estudio resalta así, la necesidad que existe en los procesos de química analítica, de evaluar mediante el protocolo de validación de métodos analíticos, las condiciones óptimas encontradas, ya sea por DCC o cualquier otro método estadístico.

La precisión encontrada fue evaluada mediante el coeficiente de HorRat (Ecuación 9) los resultados se muestran en la tabla 4. En la práctica los resultados de HorRat aceptables oscilan entre 0.5 y 2,20 los valores obtenidos están dentro de dicho rango por lo que se puede establecer que se obtuvo un método con precisión en condiciones de reproducibilidad aceptable.

Evaluación de dos Modalidades de Cuantificación y la etapa de derivatización para Fitoesteroles totales
No se encontró diferencia significativa entre las dos modalidades de cuantificación ni entre el pretratamiento de derivatizaeión y sin derivatizar, eomo se muestra en la figura 2a y 2b respeetivamente. En base a lo anterior, se propone la metodología de euantifieaeión con estándar interno y eliminando el pretratamiento de derivatizaeión, lo que signifiearía una disminueión de eosto, tiempo y residuos tóxieos sin detrimento en la ealidad de los resultados analítieos, a diferencia de otros autores que han reportado metodologías donde citan la derivatización como un pretratamiento del extracto antes de su análisis por cromatografía de gases. Yang etal., 201221 cita la utilización de anhídrido acético y piridina para la derivatización, Wen-Hui et al., 200822 utilizó bis(trimetetilsilil)trifluoroacetamide (BSTFA) y piridina, otros autores para evitar la derivatización utilizan la técnica de cromatografía de líquidos con detector de UV,23 la cual resulta ser más costosa y menos robusta con respecto a la técnica de cromatografía de gases. Sí bien es cierto que ya existen referencias del uso de la cuantificación con estándar interno, ninguna de estas la avala realizando un análisis estadístico de comparación contra la de estándar externo.8,24

Análisis de Muestras
La metodología analítica optimizada y validada se aplicó para la cuantificación de FT, FL FE, y E en AGDAS provenientes del grado de refinación premium, los valores promedio de cinco replicas fueron 17.19, 15.16, 2.03 y 2.17 % p/p respectivamente. La concentración de fitoesteroles totales reportadas son mayores a las referenciadas por otros autores,2 quienes reportan concentraciones en un rango de 3-15 %. La concentración de escualeno encontrada está por debajo del 5.5 % reportado3 y superior del 1.19 % citado por Pramparo y Martinello 2005.4 Estas variaciones son debidas a factores que propician cambios en la composición de los AGDAS tales como procedencia de la soya, condiciones de cultivo y grado de calidad de aceite a obtener en el proceso de refinación (premium o genérico).
Conclusiones
Se estableció un modelo polinomial de segundo orden usando el método de superficie de respuesta con el diseño compuesto central para optimizar la purificación de fitoesteroles libres, fitoesteroles esterificados y escualeno. Los valores obtenidos de 0.87, 0.90 y 0.88, respectivamente; indican similitud entre los valores experimentales y los estimados, además que el modelo tiene buen ajuste.
En el proceso de validación donde se utilizaron los valores óptimos de volumen de eluente 21 mL y cantidad de sílica gel 3.0 g, se obtuvieron porcentajes de recuperación de los compuestos cuantificados mayores o iguales a 81.0.
La cuantificación de los fitoesteroles con estándar interno y sin derivatización por la técnica de Cromatografía de gases representa una opción viable.
Se estableció un protocolo de purificación y análisis simultaneo de fitoesteroles y escualeno para ácidos grasos destilados de aceite de soya, con precisión aceptable, económicamente viable y con mínima generación de residuos y se documentaron sus parámetros de validación.
La concentración de fitoesteroles totales, fitoesteroles libres, fitoesteroles esterificados y escualeno en ácidos grasos destilados de aceite de soya fue de 17.19, 15.16, 2.03 y 2.17 % p/p, respectivamente. Por lo que se considera que dicho subproducto es una fuente potencial de estos compuestos con actividad biológica para su posible uso en la industria farmacéutica, alimentaria y cosmética.
Referencias
1. O'Brien Richard D. Fats and Oils: Formulating and Processing for Applications. Third Edition. New Orleans, Luisiana: CRC Press, 2000, p. 235-268.Nalan A. [ Links ]
2. Akgün NA, Gece G, Tekneci E. Strategies to obtain tocopherols, phytosterols and squalene from deodorizer distillates and acid oils using supercritical fluids. Recent Res Devel Lipids. 2013; 9:67-84. [ Links ]
3. Dumont MJ, Narine SS. Characterization of Flax and Soybean Soapstocks, and Soybean Deodorizer Distillate by GC-FID. J Am Oil Chem Soc. 2007; 84:1101-1105. [ Links ]
4. Pramparo PM, Prizzon S, Martinello MA. Estudio de la purificación de ácidos grasos , tocoferoles y esteroles a partir del destilado de desodorización. Grasas y aceites. 2005; 56: 228-234. [ Links ]
5. García-Llatas G, Rodríguez-Estrada MT. Current and new insights on phytosterol oxides in plant sterol-enriched food. Chem Phys Lipids. 2011; 164:607-624. [ Links ]
6. Hernández-Mijares A, Bañuls C, Rocha M, Morillas C, Martínez-Triguero ML, Víctor VM, Lacomba R, Alegría A, Barberá R, Farré R, Lagarda M J. Effects of phytosterol ester-enriched low-fat milk on serum lipoprotein profile in mildly hypercholesterolaemic patients are not related to dietary cholesterol or saturated fat intake. Br J Nutr. 2010; 11:1-8. [ Links ]
7. Marangoni F, Poli A. Phytosterols and cardiovascular health. Pharmacol Res. 2010; 61:193-199. [ Links ]
8. Breinhölder P, Mosca L, Lindner W. Concept of sequential analysis of free and conjugated phytosterols in different plant matrices. J Chromatogr B. 2002; 777: 67-82. [ Links ]
9. Toledano RM, Cortes J, Rubio-Moraga A, Villen J, Vázquez A. Analysis of free and esterified sterols in edible oils by online reversed phase liquid chromatography-gas chromatography (RPLC-GC) using the through oven transfer adsorption desorption (TOTAD) interface. Food chem. 2012;135: 610-615. [ Links ]
10. Teixeira ARS, Santos JLC, Crespo JG. Production of Steryl Esters from Vegetable Oil Deodorizer Distillates by Enzymatic Esterification. Ind Eng Chem Res. 2011; 50:2865-2875. [ Links ]
11. Lin DL, Wang SM, Wu CH, Chen BG, Liu RH. Chemical Derivatization for the Analysis of Drugs by GC- MS-A Conceptual Review. J Food Drug Anal. 2008; 16:1-1. [ Links ]
12. Verleyen T, Forcades M, Verhe R, Dewettinck K, Huyghebaert A, De Greyt E. Analysis of free and esterified sterols in vegetable oils. J Am Oil Chem Soc. 2002; 79:117-122. [ Links ]
13. Almeida-Bezerra M, Erthal - Santell R, Padua - Oliveiraa E, Silveira- Villara L, Amélia-Escaleira L. Response surface methodology (RSM) as a tool for optimization in analytical chemistry. Talanta. 2008; 76: 965-977. [ Links ]
14. Leardi R, Experimental design in chemistry: A tutorial, Anal Chim Acta. 2009; 652: 161-172. [ Links ]
15. Harvey D. Evaluación de datos analíticos. Química Analitica Moderna, No. 1.; Madrid, España: McGRAW-HILL, 2002, p.41-75. [ Links ]
16. González AG, Herrador MA. A practical guide to analytical method validation, including measurement uncertainty and accuracy profiles. Trends in Anal Chem, 2007;26: 227-238. [ Links ]
17. Kumirska J, Migowska N, Caban M, Plenis A, Stepnowski P. Chemometric analysis for optimizing derivatization in gas chromatography-based procedures. J Chemometr. 2011; 25: 636-643. [ Links ]
18. Horwitz W, Albert RJ. The Horwitz ratio (HorRat): A Useful Index of Method Performance with Respec to Precision. Assoc off Anal Chem. 2006; 89: 1095-1109. [ Links ]
19. Pinho C, Melo A, Mansilha C, Ferreira IM. Optimization of conditions for anthocyanin hydrolysis from red wine using response surface methodology (RSM). J Agric Food Chem. 2011; 59:50-55. [ Links ]
20. Rivera-Orozco CA, Rodriguez-Baez M del R. Uso de la ecuación de Horwitz en laboratorios de ensayo NMX-EC-17025-IMNC-2006. Simposio de Metrología 2010. [ Links ]
21. Yan F, Yang H, Li J, Wang H. Optimization of Phytosterols Recovery from Soybean Oil Deodorizer Distillate. J Am Oil Chem Soc. 2012, 89: 1363-1370. [ Links ]
22. Wen-Hui L, Guo-Ping Y, Li F, Shao-Kun W, Hai-Jun B, Jia-He J,Shao-Min L. Free and Conjugated Phytosterols in Cured Tobacco Leaves: Influence of Genotype, Growing Region, and Stalk Position. J Agric Food Chem. 2008; 56:185-189. [ Links ]
23. Khatoon S, Raja-Rajan RG, Gopala-Krishna AG. Physicochemical Characteristics and Composition of Indian Soybean Oil Deodorizer Distillate and the Recovery of Phytosterols. J Am Oil Chem Soc. 2010; 87:321-326. [ Links ]
24. Yan F, Yang H, Wu D, Huo M, Li J. Recovery of Phytosterols from Waste Residue of Soybean Oil Deodorizer Distillate. Soybean-Applications and Technology. Prof. Tzi-Bun Ng, In Tech, 2011.p. 330-340. [ Links ]





![[ARTÍCULO RETRACTADO]El inhibidor de los receptores para interleucina-1 anakinra restaura parcialmente la disfunción endotelial presente en la diabetes tipo I experimental](/img/es/next.gif)








