Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.45 no.3 Ciudad de México jul./sep. 2014
Trabajo científico
Evaluación citotóxica de los extractos etanólicos de Azadirachta indica (A. Juss) sobre diferentes líneas celulares
Cytotoxic evaluation of Azadirachta indica (A. Juss) ethanolic extracts against differents cells lines
Joaquín Ávalos-Soto,1,3 Jaime Fco. Treviño-Neávez,3 Ma. Julia Verde-Star,3 Catalina Rivas-Morales,3 Azucena Oranday-Cárdenas,3 Javier Moran-Martínez,2 Luis Benjamín Serrano-Gallardo,2 Ma. Eufemia Morales-Rubio3
1 Facultad de Ciencias Químicas de la Universidad Juárez del Estado de Durango.
2 Departamento de Biología Celular y Ultra-estructura. Centro de Investigación Biomédica de la Universidad Autónoma de Coahuila.
3 Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León.
Correspondencia:
Dra. Ma. Eufemia Morales Rubio
Facultad de Ciencias Biológicas
Universidad Autónoma de Nuevo León
6 de enero 245, Col. Del Roble, San Nicolás de los Garza
N.L. CP. 66450
Tel. (81) 83-29-41-10, Ext. 6468
e-mail: mmorales1132000@yahoo.com
Fecha de recepción: 28 de abril de 2014
Fecha de recepción de modificaciones: 08 de diciembre de 2014
Fecha de aceptación: 24 de diciembre de 2014
Resumen
Se evaluó la actividad citotóxica de los extractos etanólicos de semilla y hoja de Azadirachta indica (Neem) originaria de la India contra tres líneas celulares MCF7, HaCaT y CaLo. Los extractos de neem se clasificaron en: Semilla, cáscara de semilla, hoja y semilla con cáscara. Se determinó la toxicidad sobre Artemia salina presentando la mayor actividad el extracto de semilla DL50 476 μg/mL; la mayor actividad citotóxica sobre las líneas celulares se presentó en el extracto de hoja con una IC50 22.03 µg/mL sobre MCF7, se obtuvieron dos particiones, la partición hexánica de hoja mostró mayor actividad IC50 25.17 µg/mL sobre MCF7. Se concluye que la partición hexánica de hoja de neem es la que presenta mayor actividad citotóxica sobre MCF7. Estos resultados son prometedores para continuar con futuras investigaciones, para el desarrollo de nuevos agentes quimioterapéuticos.
Palabras clave: actividad citotóxica, Azadirachta indica, línea celular, toxicidad.
Abstract
Cytotoxic activity of ethanol extract of seeds and leaves of Azadirachta indica (Neem) originating in India was evaluated against MCF7, HaCaT and CaLo cells lines. The extracts of neem were classified as: seed, seed peel, leaf and seed with peel. Toxicity of extracts on Artemia salina was determined; the most active extract was seed with an LD50 476 µg/mL; the cytotoxic activity on different cell lines was: neem leaf extract most active IC50 22.03 µg/mL on line MCF7. Hexane and chloroform partitions were obtained and the highest activity was as follows: Partition hexane neem Leaf IC50 25.17 µ/mL on the MCF7. We conclude that the hexane partition neem leaf is the one with greater cytotoxic activity on MCF7. These results are promising to continue with further research, for the development of new chemotherapeutic agents.
Keywords: cytotoxic activity, Azadirachta indica, cell line, toxicity.
Introducción
Azadirachta indica A. Juss es un árbol de tamaño mediano a grande pertenece a la familia Meliaceae y es conocida comúnmente como margosa y paraíso de la india en español y como Neem en inglés e hindú,1 es tradicionalmente empleado en la India, su uso y propiedades se encuentran descritas en el antiguo sánscrito desde hace 4000 años, en la India se refieren al Neem como la "farmacia de la aldea" o la "botica del pueblo" debido a sus muchos fines medicinales para curar y prevenir distintas enfermedades.2
Los principales compuestos que han sido aislados del Neem son triterpenos y tetranotriterpenoide como ejemplo de ellos es la azadiractina y limonoides entre otros.1 Todas las partes del árbol de neem: hojas, flores, semillas, frutas, raíces y corteza se han utilizado tradicionalmente para el tratamiento de inflamaciones, infecciones, fiebre, enfermedades de la piel, trastornos dentales, inmunomoduladores, antiinflamatorias, antihiperglicémicos, antiulcerosos, antimaláricos, antifúngicos, antibacterianos, antivirales, antioxidantes, propiedades antimutagénicas y anticancerígena.3
Desde sus orígenes las plantas con propiedades benéficas para la salud humana han acompañado al hombre, existe evidencia que desde hace 60,000 años las usaba con fines medicinales. Se desconoce cómo se empezaron a utilizar, alrededor del año 2800 a.C., se encuentra el primer documento escrito que registra el uso de plantas medicinales perteneciente a la cultura de los sumerios.4
En la actualidad se ha incrementado el interés por el uso de plantas medicinales como una alternativa para obtener nuevos fármacos, debido a su gran variedad y complejidad de sus metabolitos secundarios.5 Estas se han utilizado para el tratamiento de una amplia gama de enfermedades desde tiempos antiguos, a pesar del gran avance observado en la medicina moderna en las últimas décadas, todavía hacen una importante contribución a la salud.6 Hoy en día muchos de los medicamentos empleados para el tratamiento de diversas enfermedades incluyendo el cáncer, son obtenidos de especies vegetales.7,8 La actividad biológica puede provenir de cualquiera de sus partes (hojas, tallos, raíces, flores o semillas) que producen sustancias químicas llamadas metabolitos secundarios o principios activos.6
Los ensayos de citotoxicidad, son capaces de detectar mediante diferentes mecanismos celulares conocidos, los efectos adversos de interferencia con estructura y/o propiedades esenciales para la supervivencia celular, proliferación y/o funciones. Dentro de estos se encuentran la integridad de la membrana y del citoesqueleto, metabolismo, síntesis y degradación, liberación de constituyentes celulares o productos, regulación iónica y división celular.9 Con el desarrollo de mejores y nuevas herramientas como son los bioensayos de toxicidad (Artemia salina) y citotóxicos in vitro empleando líneas celulares, se realizó con mayor exactitud y rapidez los estudios citotóxicos que permiten el aislamiento de nuevos fitofármacos.10
Un bioensayo involucra organismos vivos, permite realizar mediciones experimentales del efecto de agentes químicos en sistemas biológicos, El bioensayo de "letalidad de larvas de Artemia salina" consiste en la determinación de la DL50 (Dosis Letal Media) de los extractos de las plantas; se ha encontrado una correlación entre ensayos in vitro y en vivo (r = 0,85 p < 0.05), empleando artemia y ratones, este método es una herramienta útil para predecir la toxicidad oral aguda en extractos de plantas.11,12
Una línea celular es un grupo de células de tipo único (animal o vegetal) que se han adaptado para crecer continuamente in vitro y que se usan en investigación.13 Las líneas celulares derivadas de neoplasias humanas, se han convertido en una de las principales herramientas de apoyo para realizar evaluación citotóxica de extractos vegetales, siendo una técnica sensible, que genera resultados reproducibles y válidos.14,15 Por estas razones las muestras cancerígenas in vivo fueron remplazadas por un sistema in vitro el cual comprende cerca de 60 líneas celulares de tumores cancerígenos humanos.16
A pesar de que esta planta tiene muchos estudios sobre su actividad biológica, los resultados obtenidos sobre estas líneas celulares no han sido reportados.
Materiales y métodos
Material biológico
Vegetal
Hoja y semilla de neem importada de Coimbatore, Tamil Nadu, India, en las coordenadas 11° 0' 0 N 76° 58' 0 E, con una altitud de 379 m sobre el nivel del mar. Certificado Fitosanitario de Importación SEMARNAT Folio No. 09/2012-01773, Permiso Sanitario de Importación COFEPRIS SSA No de Autorización 123301109A0907.
Líneas celulares
Línea celular MCF7 (Cáncer de mama)
Línea celular HaCat (Queratinocitos humanos)
Línea celular CaLo (Cáncer cervicouterino)
Donadas por el Instituto de Química de la Universidad Nacional Autónoma de México
Nauplios de Artemia salina
Para el bioensayo de letalidad de A. salina, se adquirieron huevecillos en Estados Unidos (Brine Shrimp Eggs San Francisco Bay Brand INC).
Obtención de extractos
El material vegetal se colocó en un desecador con aireación por un periodo de 5 d a 45 °C, una vez seco se molió en un molino mecánico (Wiley) obteniendo un polvo fino.17
Para la obtención del extracto etanólico se pesaron en una balanza analítica (Ohaus) 30 g de material vegetal seco triturado y se adicionaron 300 mL de etanol (CTR Scientific) grado reactivo en un matraz Erlenmeyer, se tapó con papel parafilm y se agitó a baja velocidad en un agitador (Dual Action Shaker Lab- Line) y temperatura ambiente por 24 h, el macerado se filtró en papel filtro (Whatman International LTD. England) de poro grueso en matraz Kitazato con bomba de vacío (Auto Science), repitiendo el proceso tres veces utilizando la misma cantidad de solvente nuevo en cada ocasión. El filtrado del macerado se destiló en un Rotaevaporador (LEV211-V) para separar el solvente, el extracto crudo se llevó a sequedad completa en una estufa de aire caliente (Riossa) a temperatura menor a 50 ºC. Los extractos secos se almacenaron en refrigeración a 4 ºC en frasco ámbar hasta su utilización.18
Análisis fitoquímico preliminar para identificación parcial de metabolitos secundarios
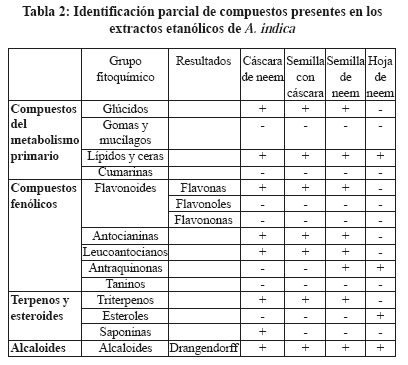
Para la determinación inicial de los principales principios activos presentes en los extractos etanólicos de A. indica A. Juss, se realizaron pruebas químicas de identificación. Las soluciones de los extractos se prepararon a una concentración de 50 mg/mL disueltos en etanol. Se utilizaron placas de cerámica de 12 pozos para las reacciones con el propósito de identificar compuestos de metabolismo primario, compuestos fenólicos, Terpenos, esteroides alcaloides.19
Toxicidad del extracto etanólico de A. indica A. Juss sobre A. salina
Se valoró la actividad tóxica del extracto etanólico de A. indica A. Juss con nauplios de A. salina,20 Para la eclosión de los huevecillos de A. salina, se colocaron 40 g de sal de mar (Instant Ocean®, Acuarium System), 0.006 g de levadura de cerveza (Mead Johnson) en 700 mL de agua bidestilada y se aforó a un litro.
Se pesaron 0.1 g de huevecillos de A. salina (Brine Shrimp Eggs San Francisco Bay Brand INC) y se depositaron en un recipiente de vidrio de color negro dividido por una pared intermedia con un espacio en la parte baja de 2 mm, con 100 mL de agua de mar artificial, se mantuvieron en condiciones de oscuridad y oxigenación. Uno de los compartimentos se iluminó con una lámpara de 20 watts de luz blanca. Después de 48 h de incubación se tomaron 10 nauplios con micropipeta (LabMate Soft) para transferirlos a una microplaca de 96 pozos, se adicionaron 100 µL de la suspensión de nauplios/pozo más 100 µL de las diluciones de los extractos diluidos en agua de mar. Se utilizaron 50, 100, 250, 500 y 1000 µg/mL de extracto en cinco repeticiones. Como control positivo se utilizó dicromato de potasio a concentración de 400 ppm y agua de mar como control negativo. Después de 24 h y con la ayuda de un microscopio estereoscópico (Labomed), se contaron los nauplios vivos y muertos por concentración, y se calculó la Dosis letal media (DL50) del extracto utilizando el método estadístico Probit de Finney.21,22
Determinación de citotoxicidad del extracto y particiones en líneas celulares
Para evaluar la citotoxicidad de los extractos se emplearon las líneas celulares MCF7 (Cáncer de mama), HaCat (Queratinocitos Humanos) y CaLo (Cáncer cervicouterino). Las células se propagaron en el medio de cultivo DMEM (Dulbecco's Modified Eagle's Medium, Cellgro, Herndon Sigma®) suplementado con 2 mL de glutamina (Sigma®-Aldrich, St. Louis, USA), gentamicina 50 mg (Sigma®-Aldrich, St. Louis, USA) y 10 % de suero fetal bovino (SFB, SIGMA®). 16 Se utilizaron cultivos confluentes (80-90%) de la línea celular, realizando la exclusión con azul de tripano (Sigma®-Aldrich, St Louis, USA) para comprobar su viabilidad se colocaron 3,000 células/pozo en un volumen de 100 μL de medio DMEM en microplacas de 96 pozos (Corning Inc. Costar®), posteriormente se incubaron por 24 h a 37 °C en atmósfera húmeda y 5 % de CO2 en incubadora de cultivo (Lab-line Mod 485). Los extractos de A. indica A. Juss se disolvieron en dimetil sulfóxido (DMSO) a una concentración final de 1.0 μg/mL. Posteriormente se prepararon diluciones de los extractos en DMEM a una concentración (10-100.0 μg/mL), se adicionaron 100 μL/pozo de cada dilución, el ensayo se realizó por cuadruplicado. El Taxol se utilizó como control positivo y se evaluó individualmente para citotoxicidad de forma similar a los extractos, las placas se incubaron durante 72 h en atmósfera de 5 % CO2 a 37 ºC. Luego de 72 h se adicionaron 20 μL MTT (bromuro de 3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazolio) (Sigma®-Aldrich, St Louis, USA). Al cabo de 4 h en atmósfera de 5 % CO2 a 37 ºC se decantó el medio, se adicionaron 200 μL/pozo de DMSO y se leyó la densidad óptica (DO) en un lector de microplacas de ELISA (Dynatech®MR5000) a 560 nm y 630 nm como referencia. El porcentaje de células muertas se determinó a partir del promedio de las absorbancias obtenidas de pozos tratados y no tratados. Se graficaron los valores de concentración de los extractos contra el porcentaje de viabilidad para obtener la IC50.23,24,25
Resultados y discusión
La elección de la planta fue debido a que existe actividad comprobada que ésta presenta en las hojas y semillas efectos analgésicos, antihelmínticos antipiréticos, antisépticos, antisifilíticos, astringentes, demulcentes, diuréticos, emenagógicos, emolientes y purgantes así mismo se ha demostrado que los extractos de neem poseen propiedades antibacteriana, antidiabética, antifúngica, antiviral y antiproliferativa contra la línea celular cancerígena PC-3 (Cáncer de Próstata).3,26
Se prepararon cuatro distintos extractos de hoja y semilla de neem el rendimiento de los extractos etanólicos fue el siguiente: cáscara de neem 4.23 % (peso de extracto/peso seco de material vegetal x 100), semilla con cáscara de neem 7.2 %, semilla de neem 7.35 % y hoja de neem 12.15 % (Tabla 1). En las pruebas fitoquímicas realizadas a los extractos de A. indica se identificaron compuestos del metabolismo primario, fenólicos, terpenos, esteroides y alcaloides (Tabla 2). Los principales compuestos que han sido aislados del neem son triterpenos y tetranortriterpenoide como ejemplo de ellos es la azadiractina y limonoides entre otros.1
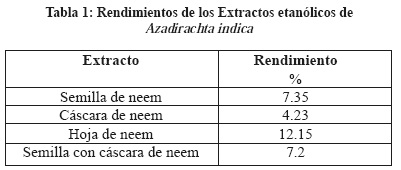
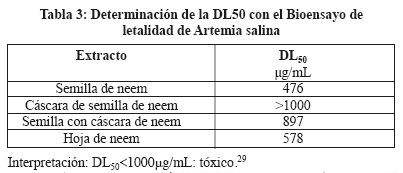
El extracto de etanólico de semilla de neem fue el que presentó mayor actividad con una DL50 de 476 μg/mL (Tabla 3), este es un ensayo ampliamente utilizado para seleccionar extractos crudos con potencial biológico, debido a que ha demostrado, que el crustáceo es sensible a un amplio rango de compuestos.20
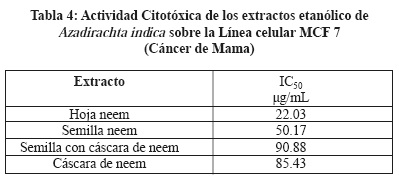
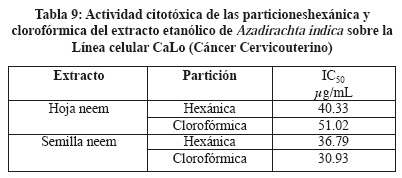
Se determinó el efecto citotóxico de los extractos de A. indica, se utilizaron 3 líneas celulares MCF7, CaLo y HaCat, utilizando el reactivo MTT que mide la capacidad metabólica de la célula como indicativo de daño citotóxico, siendo las Concentraciones Inhibitorias Medias (IC50) más importantes las siguientes: Extracto de hoja de neem IC50 22.03 µg/mL sobre la línea MCF7 (Tabla 4), extracto de hoja de neem IC50 155.23 µg/mL sobre la línea HaCaT (Tabla 5) y extracto de semilla de neem IC50 32.17 µg/mL sobre la línea CaLo (Tabla 6), se obtuvieron dos particiones hexánica y clorofórmica y la mayor actividad fue en las siguientes: Partición hexánica de hoja de neem IC50 25.17 µg/mL sobre la línea celular MCF7 (Tabla 7), partición clorofórmica de hoja de neem IC50 98.09 µg/mL sobre la línea celular HaCaT (Tabla 8) y partición clorofórmica de semilla de neem IC50 30.93 µg/mL sobre la línea celular CaLo (Tabla 9).26,27 En un trabajo realizado por miembros de este grupo de investigación, se encontró una IC50 del extracto acuoso y etanólico de A. indica > 500 mg/L, para células Vero, considerándolo no tóxico.24
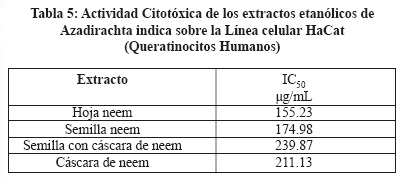
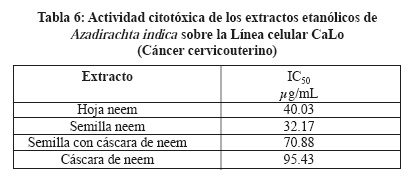
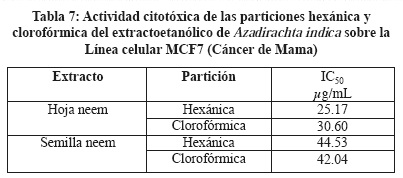
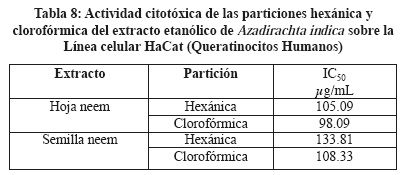
El uso de las plantas medicinales utilizadas en forma empírica tiene hoy una base científica con nuevas herramientas analíticas lo que nos permite validar su acción biológica, se han utilizado las líneas celulares en la búsqueda de extractos vegetales para determinar citotoxicidad y asociarla con la actividad antineoplásica.19,25,28
Conclusiones
En este estudio se demostró que los extractos etanólicos de A. indica mostraron actividad tóxica y citotóxica, siendo el extracto etanólico de semilla de neem el que presentó mayor actividad toxica con una DL50 de 476 μg/mL sobre los nauplios de A. salina, con respecto a la actividad citotóxica el extracto crudo de hoja de neem fue el que presento una mayor actividad con una IC50 de 22.03 µg/mL sobre la línea MCF7 (Cáncer de mama), la partición hexánica de hoja de neem fue la más activa sobre la Línea Celular MCF7 (Cáncer de mama) con una IC50 25.17 µg/mL; estos resultados nos permiten considerarlo como un potencial coadyuvante en el tratamiento de esta enfermedad.
Referencias
1. López PY, Angulo EM, Martínez RC, Soto BJ, Chaidez QC. "Efecto antimicrobiano de extractos crudos de Neem (Azadirachta indica A. Juss) y venadillo (Swietenia humilis Zucc) contra E. coli, S. aureus y el bacteriófago P22". Bioq. 2007; 32 (4):117-125. [ Links ]
2. Conrick, J. Neem. The ultimate herb. Hopeful Communications. Alchua, Florida, U.S.A. 1994, p 60. [ Links ]
3. Subapriva R, Nagini S. Medicinal properties of Neem leave: A review Curr Med Chem Anticancer Agents. 2005; 5(2):149-6. [ Links ]
4. Barquero AA. Plantas sanadoras: pasado, presente y futuro. Rev Quím Viva. 2007; 2:1-35. [ Links ]
5. Saxena S, Gomber C. Antimicrobial potential of Callistemon rigidus. Pharm Biol. 2006; 44(3):194-201. [ Links ]
6. Balandrin MF, Kinghorn AD, Farnsworth NR. Plant-Derived Natural Products in Drug Discovery and Development: An Overview. Human Medicinal Agents form Plants. (A. D. Kinghorn, M. F. Balandrin, Editores.) ACS Symposium Series 534; American Chemical Society: Washington, D.C. 1993; p 2-12. [ Links ]
7. Silva-Belmares Y, Rivas -Morales C, Viveros -Valdez E, De la Cruz-Galicia G. Antimicrobial and cytotoxic activites from Jatropha dioica roots. Pakistan J of Biol Sci. 201417(5): 748-750. [ Links ]
8. Meyer BN, Wall ME, Wani MC , Taylor HL . Plant antitumor agents, 21. Flavones, coumarins, and an alkaloid from Sargentia greggii. J Nat Prod. 1985; 48(6):952-6. [ Links ]
9. Arencibia DF, Rosario LA, Curveco DL. Principales ensayos para determinar la citotoxicidad de una sustancia, algunas consideraciones y su utilidad. Rev Toxi. 2003; 40-52. [ Links ]
10. EPA. Methods for measuring the acute toxicity of effluents and receiving waters to freshwater and marine organisms. Firth edition: País EUA. Editorial U.S. Environmental Protection Agency Office of Water. 2002, p 275. [ Links ]
11. Lagarto PA, Silva YR, Guerra SI, Iglesias BL. "Comparative study of the assay of Artemia salina L. and the estimate of the medium lethal dose (LD50 value) in mice, to determine oral acute toxicity of plant extracts" Phytomed. 2001; 8 (5): 395-400. [ Links ]
12. McLaughlin JL, Lingling LR, Anderson JE. The use of biological assays to evaluate botanicals. Drug Info J. 1998; 32:513-524. [ Links ]
13. INC. Instituto Nacional del Cáncer. Diccionario Digital. 2010. http://www.cancer.gov/diccionario/?CdrID=44016. Acceso Septiembre del 2010. [ Links ]
14. Lieberman MM, Patterson GM, Moore RE, In vitro bioassays for anticancer drug screening: Effects of cell concentration and other assay parameters on growth inhibitory activity. Cancer Letters. 2001; (173): 21. [ Links ]
15. Atta-ur- Rahman, Muhammad Iqbal Choudhary, William J. Thomsen.Bioassay Techniques for Drug Development Antiviral and Anticancer Assays. Harwood Academic Publishers. 2001, p 223. [ Links ]
16. Freshney RI. Culture of Animal Cells, a Manual of Basic Technique. Ed. Wiley-Liss: Nueva York. 2000, p. 101,182, 309. [ Links ]
17. Kakuko Y, Fumiko A, Ariaki N, Hikaru O, Lozada L, López E, Estrada E, Aguilar A, Reyes R. Antibacterial activity of crude extracts from Mexican medicinal plants and purified coumarins and xanthones. J Ethnopharm. 2005; 97(2):293-299. [ Links ]
18. Umeh EU, Oluma H, Igoli J. Antibacterial Screening of Four Local Plants Using an Indicator-Based Microdilution Technique. Afr. J. Trad Complement and Alter Med. 2005; 2(3):238-243. [ Links ]
19. Harborne JB. Phytochemical Methods a guide to modern techniques of plant analysis. 3a Ed. Chapman & Hall, London. 1998, p. 1-32. [ Links ]
20. Molina-Salinas G, Fernández-Said S. A modified microplate cytotoxicity assay with brine shrimp larvae (Artemia salina). Pharmacol on line. 2006; (3):633-638. [ Links ]
21. Vega-Menchaca MC, Verde-Star J, Oranday-Cárdenas A, Morales-Rubio ME, Núñez-González A, Rivera-Guillen MA, Serrano-Gallardo LB, Rivas-Morales C. Actividad antibacteriana y citotóxica de Leucophyllum fruscescens (Berl) I.M. Johnst del Norte de México contra Staphylococcus aureus de aislados clínicos. Rev Mex Cienc Farm. 2013; 44(2):24-30. [ Links ]
22. Anderson JE, Goetz CM, McLaughlin JL, Suffness M. A blind comparison of simple bench-top bioassay and human tumour cell cytotoxicities as antitumor prescreens. Phytochem Analysis. 1991; (2):107-111. [ Links ]
23. Hamid R, Rotshteyn Y, Rabadi L, Parikh R, Bullock P. Comparison of Alamar blue and MTT assays for high through-put screening. Toxicol in Vitro. 2004; 8(5):703-710. [ Links ]
24. García BL, Rivas MC, Oranday CA, Castro GJ, Carranza RP, Cruz VD. Efecto citotóxico in vitro de extractos de Azadirachta indica (neem) sobre la línea celular MCF-7 humana de origen tumoral. RESPYN. 2005; (8). [ Links ]
25. National Committee for Clinical Laboratory Standards. (NCCLS). Performance standards for antimicrobial susceptibility testing. XII Informational Supplement. M100-S12. Wayne, Pennsylvania; 2002. [ Links ]
26. Manal Mohamed Elhassan Taha , Siddig Ibrahim Abdel Wahab , Fauziah Othman , Parichehr Hanachi , Ahmad Bustamam Abduland Adel Sharaf Al-Zubairi. In vivo Anti-tumor Effects of Azadirachta indica in Rat Liver Cancer. Res J Biol Sci. 2009; 4(1) 48-53. [ Links ]
27. Suresh Kumar, PK Suresh, M.R. Vijayababu, A. Arunkumar, J. Arunakaran. Anticancer effects of ethanolic Neem leaf extract on prostate cancer cell line (PC-3). J Ethnopharmacol. 2006; (105):246-250 [ Links ]
28. Sagar SM, Yance D, Wong RK. Natural health products that inhibit angiogenesis: a potential source for investigational new agents to treat cancer-Part 1 and 2. Curr Oncol. 2006; 13 (1):14-26. [ Links ]
29. Meyer BN, Ferrigni NA, Putnam JE, Jacobsen LB, Nichols DE and McLaughlin J L. Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents. Plant Res Med. 1982; 45 (31-34). [ Links ]














