Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.45 no.3 Ciudad de México jul./sep. 2014
Revisión bibliográfica
Nanogeles poliméricos: una nueva alternativa para la administración de fármacos
Polymeric nanogels: a new alternative for drug delivery
Oscar Escalona Rayo y David Quintanar Guerrero
Laboratorio de Investigación y Posgrado en Tecnología Farmacéutica , División de Estudios de Posgrado, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México.
Correspondencia:
Dr. David Quintanar Guerrero
Laboratorio de Investigación y Posgrado en Tecnología
Farmacéutica
División de Estudios de Posgrado
Facultad de Estudios Superiores Cuautitlán
Universidad Nacional Autónoma de México
Av. 1° de Mayo s/n, Cuautitlán Izcalli, Estado de México,
C.P. 54743
Tel: 5623-2065. Fax: 5893-8675
E-mail: quintana@unam.mx
Fecha de recepción: 15 de enero de 2014
Fecha de recepción de modificaciones: 08 de agosto de 2014
Fecha de aceptación: 30 de septiembre de 2014
Resumen
Los nanogeles son hidrogeles de tamaño submicrónico formados por polímeros reticulados. Presentan propiedades únicas como alto contenido de agua, estructura tridimensional, biocompatibilidad y la más importante su grado de hinchamiento que permite la liberación de fármacos mediante las condiciones ambientales externas al nanogel como por ejemplo; la temperatura y el pH. En ésta revisión se analiza el potencial, las ventajas y desventajas de los nanogeles como sistemas de administración de fármacos y macromoléculas, así como su capacidad para lograr una localización específica en los tejidos o células diana. También nos enfocaremos a describir las dos rutas de síntesis y preparación de los nanogeles: la reticulación de polímeros y la polimerización reticulación de monómeros. Finalmente, se revisan las técnicas más utilizadas para su caracterización: dispersión de luz, viscosimetría, microscopía y espectroscopía.
Palabras clave: nanogeles, hinchamiento, sistemas de administración de fármacos, reticulación, polimerización.
Abstract
The nanogels are cross-linked polymer particles of submicron size with unique properties like high water content, three-dimensional structure, biocompatibility and the most important, its swelling degree which permits drug release by external environmental conditions to the nanogel like for example; the temperature and pH. In this review we analyze the potential, advantages and disadvantages of nanogels as drug delivery systems and macromolecules, in particular to achieve a specific location in tissues or target cells. Also we will focus on describe the two synthetic routes and preparation of nanogels: cross-linking of polymers and cross-linking polymerization monomers. Finally, we review the most widely used techniques for its characterization: light scattering, viscometry microscopy and spectroscopy.
key words: nanogels, swelling, drug delivery systems, cross-linked, polymerization.
Introducción
Los nanomateriales poliméricos blandos tienen una amplia gama de aplicaciones tales como espumas, lubricantes, adhesivos, cauchos y geles, además son un tópico central dentro de la investigación interdisciplinaria en las áreas de física y química de polímeros, ciencia de los materiales, farmacia y medicina.1-2
En los últimos años, se ha incrementado el interés por sistemas poliméricos de tamaño submicrónico. Algunos hidrogeles de tamaño en nanómetros denominados nanogeles son capaces de regular la liberación de fármacos en respuesta a estímulos externos de naturaleza física, química y biológica. Esta nanoestructura ofrece muchas características avanzadas como sistema de administración de fármacos (SAF), incluyendo simplicidad de formulación, estabilidad excepcional de la dispersión y almacenamiento en forma liofilizada para su posterior dispersión en medios acuosos, por citar algunas.3
El diseño de nanogeles poliméricos con nuevas propiedades representa un campo de constante interés para la industria farmacéutica y biomédica, debido a su estructura tridimensional, propiedades mecánicas, alto contenido de agua y biocompatibilidad, representan una excelente opción en: ingeniería de tejidos, agentes de diagnóstico, inmovilización celular, separación de biomoléculas o células, implantes biomédicos y como SAF.4-5 En esta revisión, se describen y se discuten los diferentes métodos de síntesis de nanogeles y su caracterización, así como la evolución reciente de éstos como nanovehículos de fármacos y otros agentes bioactivos con aplicaciones biológicas y biomédicas.
Definición de términos
Un gel es una red polimérica tridimensional reticulada capaz de absorber una gran cantidad de disolvente sin disolverse debido a los enlaces físicos o químicos formados entre sus cadenas.6-7 Si el disolvente es agua, el gel se denomina hidrogel. Los hidrogeles son redes tridimensionales reticuladas producidas por una reacción de uno o más monómeros o mediante la asociación de polímeros a través de puentes de hidrógeno o por interacciones electrostáticas. Los polímeros formadores de hidrogeles típicamente contienen grupos hidrofílicos tales como: -OH, -COOH, NH2, -CONH2, -CONH-, -SO3H. Así mismo, estos materiales existen en un estado entre sólido y líquido característico, que los diferencía de otros estados de la materia.1-5-8
Los hidrogeles se pueden clasificar de muchas maneras, las más utilizadas son las siguientes:
1) Por el tipo de enlaces. Los enlaces son importantes para mantener la estructura de la red tridimensional y para prevenir la disolución de las cadenas hidrofílicas.9 Existen dos clases:
a) Hidrogeles físicamente reticulados. Este tipo de hidrogeles dan lugar al concepto de hidrogeles reversibles, los cuales experimentan a una transición de su estructura tridimensional estable a una solución de polímero. Los enlaces entrecruzados se forman a partir de fuerzas de atracción no covalentes entre las cadenas poliméricas. Estas fuerzas son a menudo puentes de hidrógeno, interacciones hidrófobas y electrostáticas.10
b) Hidrogeles químicamente reticulados. Estos hidrogeles son generalmente más estables que los físicamente reticulados porque las reticulaciones se forman por enlaces covalentes. Las reticulaciones químicas son estructuras permanentes, a menos que se introduzcan intencionalmente enlaces químicos lábiles.9
2) Los hidrogeles también pueden ser clasificados como hidrogeles estímulo-sensibles y estimulo-no sensibles. Los hidrogeles estimulo-no sensibles, como su nombre lo indica, son materiales que simplemente se hinchan por la absorción de agua. Por otra parte, los hidrogeles estímulo-sensibles han sido denominados materiales "inteligentes" porque ante alteraciones sutiles del medio ambiente, tales como: la temperatura, pH, fuerza iónica, luz, campo eléctrico, y biomoléculas responden cambiando su grado de hinchamiento. La respuesta de los hidrogeles esta determinada por el tipo de monómero o polímero utilizado y/o cualquier post-modificación realizada.10
3) Hidrogeles por tipo de carga. Los grupos funcionales presentes en las cadenas de los polímeros que conforman a los hidrogeles pueden ser: no iónicos, catiónicos, aniónicos y anfotéricos.3
4) Otra clasificación de hidrogeles es en función de su tamaño.10 Los hidrogeles pueden estar en forma de redes macroscópicas o confinados a dimensiones más pequeñas, tales como los microgeles o nanogeles.4,11 Estos dos últimos por lo general se definen como dispersiones acuosas de partículas o redes coloidales de tamaño micro o nanométrico. Los microgeles son en su mayoría partículas con diámetro medio comprendido entre 50 nm a 10 µm. Cuando el tamaño de los microgeles se encuentra en el rango submicrónico, se les conoce como nanogeles.2,11-14 La figura 1 representa la diferencia en tamaño de nanogeles con respecto a sus homólogos de tamaño más grande.15

Proceso de hinchamiento en nanogeles
Los nanogeles estímulo-sensibles tienen la propiedad de experimentar transiciones de fase cuando hay pequeños cambios en las variables externas. Estas transiciones se traducen en un cambio en el volumen del nanogel debido a que puede hincharse bruscamente a muchas veces su tamaño original o colapsarse a una masa compacta.6 Por lo tanto, el hinchamiento representa la propiedad más importante de estos nanogeles en comparación con otros sistemas coloidales.16
El hinchamiento de nanogeles en medio acuoso está controlado por:
1) La estructura del nanogel (estructura química del monómero o polímero, el grado de reticulación, la densidad de carga en geles polielectrolitos).12
2) Los parámetros ambientales (pH, fuerza iónica, la naturaleza química de iones para nanogeles polielectrolitos, así como la temperatura para nanogeles termo-sensibles) (Figura 2).12

El hinchamiento se describe generalmente en el marco de la teoría de Flory-Rehner, que se extendió por Wu et al.17-21 Como los nanogeles son partículas reticuladas sus enlaces entrecruzados reducen drásticamente la movilidad de las cadenas y su entropía conformacional. Sin embargo, la reticulación permite obtener nanogeles con arquitectura más compleja, dando paso a la introducción de grupos funcionales en diferentes posiciones de su interior, lo cual puede afectar el grado total de hinchamiento.16 Es bien sabido que un equilibrio entre la presión osmótica y la elasticidad del polímero determina las dimensiones físicas de una partícula de nanogel.21-22 La presión osmótica resulta de la diferencia neta entre la concentración de los iones móviles del interior de la partícula del nanogel y la solución exterior. Para nanogeles con polímeros iónicos los grupos cargados atraen contraiones hidratados que tienden a expandir al nanogel, mientras que la elasticidad de la entropía conformacional de las cadenas poliméricas reticuladas se opone a esta expansión. La neutralización del nanogel reduce la diferencia de concentración neta de iones. Esta reducción da como resultado la deshidratación del nanogel y la disminución de su volumen.6
Los nanogeles pH-sensibles que contienen grupos funcionales ácidos o básicos responderán a los cambios de pH.16 En nanogeles termo-sensibles se observan principalmente dos tipos de transiciones de hinchamiento; la transición de temperatura crítica de solución superior (UCST) (generalmente para derivados de ácido acrílico) y la transición de temperatura crítica de solución inferior (LCST) (para derivados de N-isopropilacrilamida).18,23 Los nanogeles de tipo LCST se hinchan abruptamente a temperaturas por debajo de un punto crítico y los nanogeles tipo UCST se hinchan bruscamente a temperaturas por encima de un punto crítico (Figura 3).12 El rango de temperaturas en el cual el nanogel pasa de un estado hinchado a colapsado se denomina temperatura de transición de fase de volumen (VPTT). Nanogeles termo-sensibles de PNIPAAm-co-AAm disminuyen su tamaño conforme aumenta la temperatura; a 20°C tienen un diámetro hidrodinámico promedio de 230 nm y a 35°C es de aproximadamente 120 nm.24

Métodos de síntesis de nanogeles
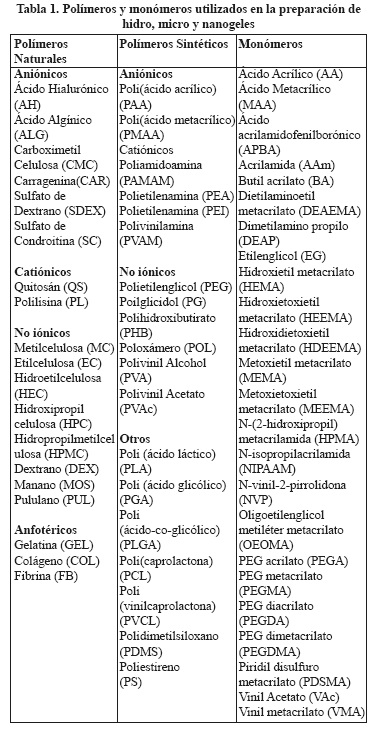
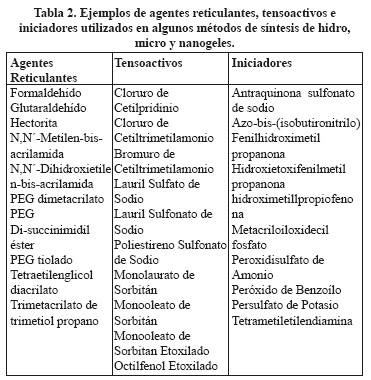
Los métodos utilizados para la preparación de hidrogeles se pueden aplicar para sintetizar micro y nanogeles. No obstante, en los nanogeles algunos aspectos especiales como la estabilidad coloidal juegan un papel muy importante. Estos métodos de síntesis se dividen según el mecanismo de formación de partículas en dos grupos: reticulación de polímeros y polimerización reticulación de monómeros (Figura 4). Ambos enfoques se pueden realizar en solución o en compartimentos bien definidos tales como sistemas micelares, micro y nanoemulsiones, dispositivos microfluidificados o en nanomoldes.2,12,25 Los polímeros comúnmente utilizados en la preparación de hidro, micro y nanogeles con aplicaciones farmacéuticas y biológicas, son de origen natural y sintético. Ejemplos de polímeros y monómeros son resumidos en la Tabla 1. Además, en algunos métodos de síntesis se utilizan agentes reticulantes, tensoactivos e iniciadores. En la tabla 2 se resumen algunos ejemplos. 6,12-13,20,26
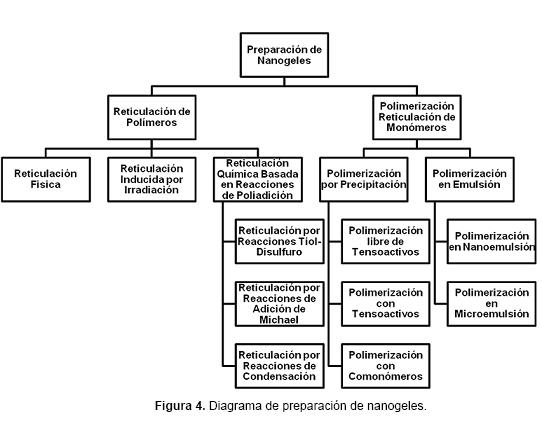
a) Nanogeles obtenidos por reticulación de polímeros
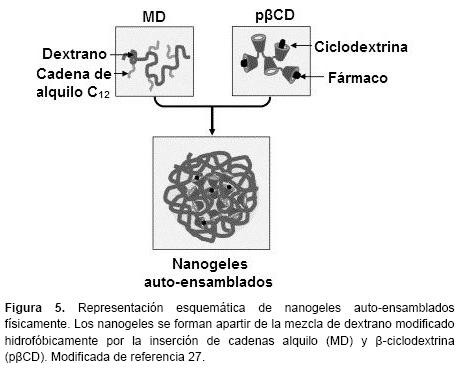
Reticulación física. Los nanogeles pueden ser preparados por reticulación física o química de polímeros de origen natural o sintético en fase homogénea o heterogénea.25 Este método por lo general implica la agregación controlada de polímeros hidrofílicos capaces de tener interacciones hidrofóbicas, electrostáticas y/o puentes de hidrógeno entre sí. El auto-ensamblaje de polímeros hidrofílicos permite la encapsulación de macromoléculas y es útil para la preparación de nanogeles cargados con proteínas.22 Se han desarrollado nanogeles auto-ensamblados físicamente mediante la mezcla de una solución acuosa de β-ciclodextrina (β-CD) con una solución acuosa de dextrano hidrofóbicamente modificado con injertos alquilo. Los restos alquilo en el carbono 12 formar complejos de inclusión con ciclodextrinas (CDs), dejando también CDs libres accesibles para la inclusión de fármacos. Se obtuvieron nanogeles de alrededor de 120-150 nm (Figura 5).27
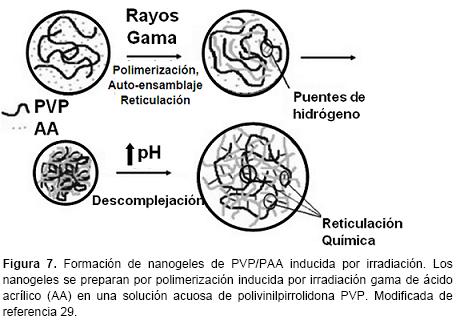
Reticulación inducida por irradiación. La reticulación de polímeros naturales y sintéticos por irradiación, es un método importante para la preparación de nanogeles. Se utilizan diferentes tipos de irradiación: rayos gamma, rayos X, electrones acelerados, haces de iones y rayos ultravioleta. Para algunos propósitos especiales, incluso puede ser útil una combinación de diferentes irradiaciones.12 Este método permite sintetizar nanogeles utilizando cadenas de polímeros lineales y agua como componentes de partida sin la necesidad de monómeros, agentes reticulantes, iniciadores, tensoactivos, etc. El concepto general se presenta a continuación. Cuando un polímero en una solución acuosa se somete a una radiación ionizante, la mayor parte de la energía de irradiación es absorbida por el agua, generando especies reactivas de vida corta, por ejemplo: hidroxilos, protones, electrones solvatados, peróxido de hidrógeno, los cuales pueden reaccionar con el polímero.28 En tales condiciones, se producen radicales no apareados en las cadenas poliméricas lo que permite una recombinación al azar. Dependiendo de las tasas relativas de recombinación y de escisión, un polímero irradiado puede ser reticulado o degradado en fragmentos más pequeños. La influencia de la irradiación de polímeros depende de su estructura química, peso molecular, concentración y las condiciones de irradiación. Dependiendo de la concentración de polímero y la tasa de dosis de irradiación, pueden tener lugar dos tipos de reacciones de reticulación: reticulaciones inter o intramoleculares. Si el número promedio de radicales por una sola cadena es bajo, se puede produce la recombinación intermolecular. Mediante el aumento de la tasa de dosis de irradiación, el número promedio de radicales por cadena también aumenta, la probabilidad de que ocurra una recombinación intramolecular es mayor (Figura 6). La irradiación de soluciones diluidas de polímero conduce a la reticulación intramolecular porque los polímeros se encuentran separados y la recombinación sólo se produce internamente. Por el contrario, mediante la irradiación de soluciones de polímero a una concentración media o alta, principalmente se forman reticulaciones intermoleculares.12

Nanogeles pH-sensibles se prepararon directamente por polimerización inducida por radiación gama de ácido acrílico (AA) en una solución acuosa de polivinilpirrolidona (PVP) (Figura 7). La fuerza impulsora de la formación de nanogeles de PVP/PAA se atribuyó a la formación de complejos entre PAA (donador de protones) y PVP (aceptor de protones) a través de puentes de hidrógeno. Además, los nanogeles se estabilizan a mediante enlaces covalentes, resultado del proceso de reticulación inducido por irradiación. A pH 4 los nanogeles presentan un diámetro medio de 83 nm; mientras que a pH 7 tienen un diámetro medio de 446 nm.29
Reticulación química basada en reacciones de poliadición
a) Síntesis de nanogeles con enlaces tiol-disulfuro. Generalmente, dos rutas de síntesis se utilizan para preparar nanogeles disulfuro reticulados:
Incorporación de enlaces disulfuro directamente en la red polimérica. Estos grupos disulfuro son introducidos simultáneamente con la polimerización de radicales de los monómeros precursores. La ventaja de este método de síntesis es la fácil eliminación de los monómeros que no reaccionan, lo que reduce la citotoxicidad de las redes, requisito esencial para los polímeros producidos a partir de agentes precursores potencialmente dañinos.
Modificación de polímeros con cadenas laterales que contienen tioles seguido de reticulación química, es decir, la oxidación de los grupos tiol para establecer reticulaciones intermoleculares. Como método general, un compuesto de tipo poli(ácido carboxílico) se activa para preparar a grupos funcionales más reactivos. Los restos de ácidos carboxílicos son activados por una carbodiimida soluble en agua, a un pH controlado. En el segundo paso, los grupos amida se forman entre las unidades de repetición del polímero y un tipo de amina, para producir un poliácido tiol-modificado. Estos polímeros modificados, por lo general son purificados por diálisis y por liofilización. Esta estrategia de síntesis es de utilidad para la preparación de cualquier tipo de polímeros tiol-injertados a partir de poli (ácidos carboxílicos) a través de la formación de enlaces amida.
La gran ventaja de la formación de disulfuros de la forma tiolada sobre la incorporación directa de disulfuros es que la modificación de los polímeros se puede ajustar con precisión durante la síntesis (concentración de polímero, la relación molar de tiol-polímero y el pH).30
b) Adición de Michael. La adición de Michael entre un nucleófilo (una amina o un tiol) y un grupo vinilo es otra opción de reticulación química, la cual es particularmente útil para la reticulación in situ de nanogeles debido a su tiempo de reacción, su flexibilidad en la formación de múltiples tipos de enlaces, y su relativa inercia biológica de los precursores poliméricos.31 Se prepararon nanogeles ensamblados con forma de frambuesas con un alto potencial como vehículo para la entrega de proteínas (Figura 8). Un polímero de acrilato pululano sustituido con colesterol reticulado con polietilenglicol modificado con grupos tiol (PEGSH) por adición de Michael, produjo nanogeles ensamblados colesterol-pululano con estrecha distribución de tamaños y diámetros medios entre 40 y 120 nm.32 El ensamblaje supramolecular de manano anfifílico, sintetizado por la adición de Michael de 1-hexadecanotiol al manano metacrilato de vinilo, originó en medio acuoso la formación de un nanogel, estabilizado por interacciones hidrófobas entre las cadenas alquilo, con un diámetro hidrodinámico que oscila entre 50 y 140 nm.33

c) Reacciones de Condensación. Las reacciones de condensación entre los grupos hidroxilo o aminas con ácidos carboxílicos o sus derivados, se aplican con frecuencia en la síntesis de polímeros para producir poliésteres y poliamidas, respectivamente. Estas reacciones se pueden utilizar para la preparación de nanogeles. Crescezi et al. describen la síntesis de hidrogeles de polisacáridos a través de las reacciones de condensación de Passerini y de Ugi.34-35 En la condensación de Passerini un ácido carboxílico y un aldehído o cetona se condensan con isocianuro para producir α-(acriloxi)amida. En la condensación de Ugi se añade una amina a esta mezcla de reacción, obteniendo α-(acilamino)amida. La reacción puede llevarse a cabo en agua, a pH ligeramente ácido y a temperatura ambiente.9 La síntesis de nanogeles mediante reacciones de condensación se da principalmente utilizando glutaraldehído o formaldehído como agentes reticulantes de partículas de QS, GEL, CMC, AH.36
b) Nanogeles obtenidos por polimerización reticulación de monómeros
Técnicas de polimerización adecuadas para la síntesis de micro y nanogeles son la polimerización por precipitación y la polimerización de micro y nanoemulsión.12
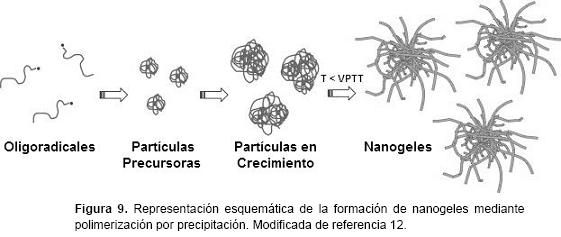
Polimerización por precipitación. Este método es muy útil para la preparación de nanogeles termo-sensibles. En tal sistema, todos los ingredientes incluyendo monómeros, agente reticulante y el iniciador se disuelven en agua. La formación de partículas de nanogel se produce por un mecanismo de nucleación homogénea. A la temperatura de polimerización (50-70 °C), el iniciador se descompone produciendo radicales libres. En el caso del iniciador persulfato, la descomposición da lugar a la formación de radicales sulfato que atacan a los monómeros seguidos de la propagación del radical y crecimiento de la cadena.12 Cuando NIPAAm o VCL son utilizados como monómeros, el crecimiento de las cadenas de polímero colapsa, si alcanzan una longitud crítica de formación de partículas precursoras. Esto ocurre porque la temperatura de polimerización está muy por encima de la LCST de los polímeros formados. Las partículas precursoras formadas pueden crecer mediante los siguientes mecanismos: (a) agregarse para formar una gran partícula de polímero coloidalmente estable; (b) depositarse en la superficie de las partículas de polímero existentes, y (c) crecer mediante la adición de monómeros o macrorradicales. Una vez que las partículas de nanogel alcanzan el tamaño crítico, éstas son estabilizadas electrostáticamente. Las cargas provienen de los fragmentos del iniciador incorporados en las cadenas de polímero durante la nucleación y el proceso de crecimiento. En esta etapa, las partículas de nanogel están en un estado de colapso, pero aún contienen una gran cantidad de agua. Esta es una diferencia principal de la polimerización de monómeros insolubles en agua tales como estireno o acrilato de butilo, donde se forman partículas de látex con estructura compacta durante el proceso de polimerización.37 Cuando se completa la polimerización y la mezcla de reacción se enfría a temperatura ambiente, las partículas de nanogel hinchadas (temperatura por debajo de VPTT) adquieren una morfología "peluda". A estas temperaturas, los nanogeles se estabilizan por un mecanismo estérico debido a la formación de puentes de hidrógeno entre segmentos del polímero y moléculas de agua. La Figura 9 muestra el mecanismo simplificado para la polimerización por precipitación.12
Nanogeles termo- y pH-sensibles de poli(NIPAAm-co-AAm) fueron sintetizados mediante polimerización por precipitación. El fármaco Doxorrubicina en medio acuoso se ioniza adquiriendo carga positiva y se encapsula en nanogeles con cargas negativas mediante interacciones electrostáticas a un pH de 7.4. El diámetro medio de estos nanogeles fue de 162 nm.38
a) Síntesis libre de tensoactivos. El tipo y la concentración de agente reticulante utilizado para la síntesis de nanogeles da la posibilidad adicional de influir en su tamaño y propiedades de hinchamiento sin utilizar agentes tensoactivos. El aumento de la concentración de agente reticulante en la mezcla de reacción disminuye el grado de hinchamiento. Por otra parte, la estabilización también puede ser proporcionada por el monómero y/o polímero. Esto se puede realizar en al menos dos maneras: el iniciador de la polimerización por radicales libres es un ion que, cuando se incorpora a la cadena creciente oligomérica, hace que esta molécula tenga actividad superficial, o bien el sustrato para la polimerización son oligómeros insaturados que llevan grupos ionizados en uno o dos extremos. También la forma en que se preparan, la relación entre los comonómeros y la concentración total de monómeros debe elegirse cuidadosamente para evitar la formación de aglomerados. Una propiedad común de la síntesis por polimerización libre de tensoactivo es la presencia de grupos iónicos en la superficie del nanogel que se pueden utilizar para su modificación adicional, unión de varios compuestos o la reticulación intermolecular.2 Se reportó la síntesis de nanogeles de PAA libres de tensoactivo utilizando como plantilla soluciones acuosas de HPC a temperatura ambiente o mayor. Los PAA unidos por puentes de hidrógeno a cadenas de HPC colapsaron formando los nanogeles. Todos los nanogeles PAA presentan una estrecha distribución de tamaño con diámetros que van de 60 a 600 nm.39
b) Síntesis con tensoactivos. Para preparar nanogeles, las partículas precursoras en crecimiento deben ser estabilizadas eficazmente en las primeras etapas del proceso de polimerización. La estabilización proporcionada por los residuos de iniciadores iónicos incorporados en las cadenas del polímero en algunos casos no es suficiente para estabilizar la gran superficie de estas partículas. Para este problema, se puede añadir a la mezcla un agente tensoactivo para incrementar la estabilidad y minimizar el crecimiento por agregación. Al mismo tiempo, el tensoactivo disminuye la tensión interfacial que conduce finalmente a la reducción de tamaño del nanogel.12,22
c) Síntesis con comonómeros. Una buena alternativa para el uso de estabilizadores durante la preparación de nanogeles puede ser con comonómeros reactivos funcionales. Estos participan en el proceso de polimerización y se unen covalentemente a las cadenas de polímero de la red del nanogel. Los comonómeros pueden mejorar la estabilidad coloidal y ayudar a regular sus tamaños. Así mismo, los nanogeles pueden ser copolimerizados para obtener funcionalidades externas, estos "desencadenadores" adicionales pueden incluir: comonómeros pH, termo y foto-sensibles.40
Polimerización en emulsión, micro y nanoemulsiones. Una emulsión es un sistema heterogéneo que consiste en dos fases liquidas inmiscibles, una fase dispersa en pequeñas gotas y una fase continua que las rodea. Además, un tercer componente, tensoactivos, necesarios para estabilizar la emulsión.41 Las reacciones de polimerización que resultan en la formación de nanogeles se pueden llevar a cabo en emulsiones agua en aceite (W/O) o aceite en agua (O/W). Figura 10.
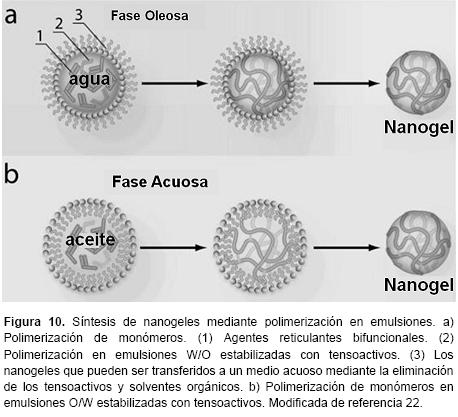
Los métodos de emulsión inversa (W/O) son los más utilizados para la preparación de nanogeles, estos involucran la polimerización de monómeros hidrofílicos en presencia de agentes reticulantes en gotas acuosas que consecuentemente son emulsionadas en una fase hidrófoba continua. El uso de agentes reticulantes en la mezcla de monómeros conduce a la formación del nanogel , manteniendo su identidad después de ser transferidos una fase acuosa continua.22 En el caso de polimerización en nanoemulsión, las gotitas acuosas son generadas por sonicación en un disolvente orgánico como fase continua en presencia de tensoactivos liposolubles. La emulsión termodinámicamente inestable se forma generalmente a una concentración de tensoactivo por debajo o cerca de su concentración micelar crítica. Con las nanoemulsiones se obtienen tamaños de nanogeles entre 150 y 300 nm. El enfoque de nanoemulsión W/O ha sido utilizado para la aplicación de diferentes técnicas de polimerización de radicales controlados: Polimerización por Adición, Fragmentación y Transferencia de Cadena Reversible (RAFT), Polimerización por Transferencia Radical Atómica (ATRP). La polimerización en microemulsión inversa W/O, forma emulsiones termodinámicamente estables. Esto requiere el uso de una gran cantidad de tensoactivos. Por lo general, los nanogeles preparados por este método tienen un diámetro inferior a 100 nm.12
Una serie de nanogeles definidos con diámetro entre 20-120 nm se sintetizaron por polimerización en una nanoemulsión mediante apertura epóxica por catálisis ácida y posterior adición al glicerol. Alcoholes multifuncionales se utilizaron como monómeros y di, tri-epóxidos como agentes reticulantes (Figura 11).42 Nuevos nanogeles con redes poliméricas interpenetradas (IPN) compuestos de PAA y GEL fueron sintetizados por nanoemulsión W/O. El AA estabilizado alrededor de la GEL en cada gota, se polimerizó utilizando persulfato de amonio (PSA) y tetrametiletilendiamina (TEMED) a una relación molar 1:5 y reticulados con N,N'-metilene-bis-acrilamida para formar nanogeles semi-IPN, que secuencialmente fueron reticulados con glutaraldehído (Glu) para formar nanogeles IPN. Además se empleó monolaurato de sorbitán al 2%. El diámetro medio de los nanogeles fue de 355 nm (Figura 12).43


Nanogeles basados en sulfato de condroitina y anhidro maleico, fueron sintetizados por polimerización en microemulsión inversa. El tamaño de estos nanogeles se encuentra en el intervalo de 145-340 nm.44 Nanogeles multifuncionales que encapsulan DEX marcado con fluorescencia y nanopartículas monodispersas de Fe3O4, fueron desarrollados por polimerización de monómeros en microemulsión inversa con un agente reticulante disulfuro. Estos nanogeles tienen un tamaño aproximadamente de 110 nm en solución salina y su tamaño permaneció sin cambios durante más de 6 meses.45
Los nanogeles núcleo-corteza son un subconjunto de nanogeles. En muchos casos su preparación se lleva a cabo en dos pasos: Una partícula de látex compuesta de poliestireno (PS) o de otros polímeros se sintetiza a través de polimerización en emulsión. Una pequeña cantidad de monómero NIPAAm se copolimeriza en este paso, en el cual se crea una capa delgada de PNIPAAm sobre las partículas del núcleo. En un segundo paso la red PNIPAAm se polimeriza en núcleos-PS, por polimerización en emulsión o por precipitación. Debe tenerse en cuenta que esta segunda etapa se lleva a cabo a temperatura mayor a la LCST de NIPAAm en el que la capa adopta un estado de colapso. La suspensión de partículas de núcleo-corteza, sin embargo, sigue siendo estable incluso a temperaturas por encima de la transición de fase de volumen. Esto es debido a las cargas superficiales residuales procedentes de la primera polimerización en emulsión. Estas cargas superficiales por lo tanto, desempeñan un papel importante durante la síntesis de las partículas.40
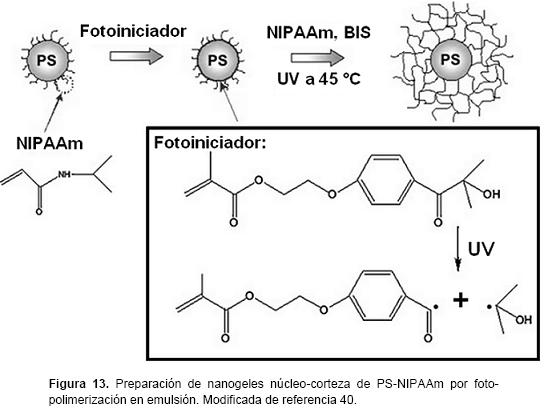
La síntesis de nanogeles núcleo-corteza mediante la polimerización en emulsión presenta algunas dificultades, la más importante es que algunos agentes reticulantes como es el caso de N,N'-metilene-bis-acrilamida tienen una polimerización más alta que los monómeros. Por lo tanto, las partículas del nanogel no crecen de manera uniforme. La distribución del agente reticulante disminuye radialmente en las partículas, lo que influye fuertemente en sus propiedades. La iniciación fotoquímica presenta una solución a este problema. La irradiación UV ha sido empleada para sintetizar nanogeles termo-sensibles bien definidos. Se ha utilizado foto-polimerización en emulsión para preparar partículas núcleo-corteza de PS-NIPAAm. Esta técnica se puede utilizar para añadir cadenas de polímero lineales a las partículas coloidales básicas o para generar capas densas de cadenas aniónicas y catiónicas de polielectrolitos sobre núcleos-PS con el fin de obtener "cepillos" de polielectrolitos esféricos. La síntesis se lleva acabo en tres pasos: primero las partículas de núcleo-PS que contienen NIPAAm se sintetizan mediante una polimerización en emulsión convencional. El paso siguiente es que estas partículas de núcleo son cubiertas por una capa fina del foto-iniciador hidroximetillpropiofenona etilenglicol metacrilato, el cual actúa también como monómero. El último paso es la foto-polimerización en emulsión que se lleva a cabo por el resplandor de luz UV sobre una suspensión de estas partículas, de este modo se generan radicales en su superficie. La polimerización se inicia por estos radicales directamente sobre la superficie de las partículas del núcleo. Las cadenas reticuladas de PNIPAAm generadas se encuentran totalmente injertadas en la superficie de los núcleos (figura 13).40,46
Las ventajas de las técnicas de micro y nanoemulsión en comparación con la polimerización por precipitación se originan a partir de que las reacciones son producidas en gotitas muy pequeñas que en realidad determinan el tamaño de las partículas coloidales. En tales condiciones, se pueden preparar nanogeles extremadamente pequeños y un amplio espectro de monómeros puede ser utilizado para el proceso de polimerización.47
Métodos usados para el estudio de nanogeles
Las propiedades de hidrogeles de tamaño micro y nanométrico pueden ser estudiadas convenientemente mediante métodos desarrollados para macromoléculas en solución. De manera general de entre las diversas técnicas que se utilizan para la caracterización de los nanogeles las más importantes son: dispersión de luz, cromatografía de permeación en gel, viscosimetría, calorimetría, microscopía y espectroscopía.
Dispersión de luz. La dispersión de luz se basa en las leyes descubiertas y métodos desarrollados por Rayleigh, Debye, Mie y Zimm. Se encuentra entre las técnicas experimentales más versátiles en el estudio de las propiedades de macromoléculas o de los nanogeles. Esta técnica se basa en la interacción de la radiación electromagnética al chocar con pequeñas partículas de tipo coloidal o incluso molecular. De estas interacciones se obtiene información sobre la estructura y la dinámica molecular de las partículas coloidales en estudio.43 Cabe señalar que la dispersión de luz es una técnica esencial para caracterizar materiales blandos, tales como; nanopartículas, micro y nanogeles, macromoléculas naturales y sintéticas ya sea en solución o en estado solido.48
En la Dispersión de Luz Estática (DLE) también conocida como difracción láser, un haz de luz es dirigido a través de una solución de macromoléculas o nanogeles, y la intensidad de luz dispersada es medida (en un escala de tiempos del orden del segundo), en relación a la intensidad del haz incidente, a varios ángulos, para diferentes concentraciones en la muestra. La doble extrapolación de estos datos a ángulo cero y concentración cero se obtiene el peso molecular promedio en peso. El rango de medición de tamaño de partículas es de 10 nm a 3.5 mm. Con DLE, también se puede obtener el radio de giro (un parámetro muy importante en el análisis de nanogeles) y el segundo coeficiente del virial, el cual es útil en la investigación de las interacciones polímero-solvente y polímero-polímero. Por ejemplo, un valor negativo de éste parámetro indica la tendencia de las cadenas de polímero o nanogel de sufrir una agregación reversible en un solvente dado.2
La Dispersión de Luz Dinámica (DLD) también llamada espectroscopia de correlación de fotones se basa en la medición de las fluctuaciones dependientes del tiempo en la intensidad de la luz dispersada por partículas bajo movimiento browniano aleatorio. La dispersión dinámica trabaja en una escala de tiempos del orden de magnitud de 1 microsegundo, que es el rango temporal del movimiento difusivo de las partículas en el seno de una dispersión coloidal.48-49 La DLD, produce valores promedios y distribuciones de coeficientes de difusión. Estos datos pueden ser recalculados en valores promedios y distribuciones de diámetros hidrodinámicos en un intervalo de tamaño de partículas de 1 nm a 6 µm, además, puede ser utilizada para el estudio en tiempo real de cinéticas de formación de nanogeles. Cabe destacar que, la relación entre la media del radio de giro determinada por DLE y la media del diámetro hidrodinámico calculada por DLD es un indicador valioso de la estructura de un nanogel. Los efectos de carga superficial como la movilidad electroforética pueden ser investigados mediante la medición del potencial zeta.2
En la técnica Dispersión de Neutrones de Bajo Ángulo (SANS por su siglas en inglés), los neutrones de un intervalo de energía adecuado son dispersados mediante núcleos atómicos de una muestra polimérica y dan lugar a patrones de dispersión similares a los obtenidos en la dispersión de luz. Es una herramienta bien establecida para la caracterización de nanoestructuras como los nanogeles, la razón principal es la posibilidad de generar contraste por el intercambio de hidrógeno y deuterio. Este método permite la detección de diferencias estructurales en geles de la misma composición química pero sintetizados mediante diferentes métodos. El rango de trabajo es desde 1 nm hasta 600 nm.50
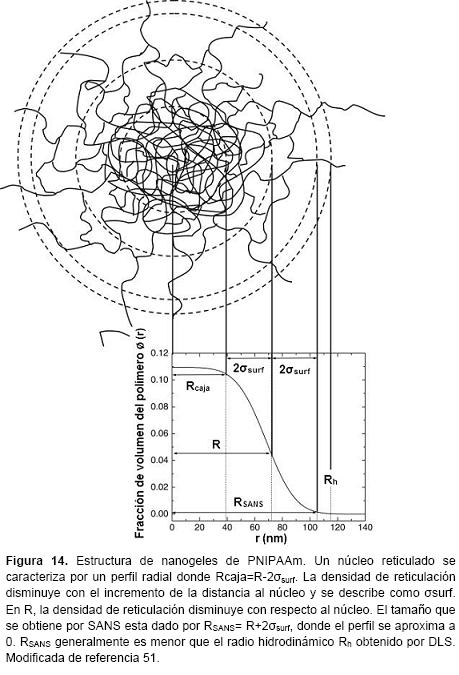
El factor de forma y la "vellosidad" de la superficie de los nanogeles se pueden determinar por métodos de dispersión SANS y DLD. En la figura 14 se representa como ejemplo el perfil radial de nanogeles de PNIPAAm.16,51
Cromatografía de Permeación en Gel (CPG). Este método es utilizado rutinariamente en la investigación y en la industria para determinar la distribución y el peso molecular en peso y peso molecular promedio en número de polímeros. La CPG requiere la calibración con estándares de polímeros monodispersos de pesos moleculares conocidos, ya que, las macromoléculas y los nanogeles son segregados en columnas de acuerdo a su tamaño (volumen hidrodinámico) y no por su peso molecular, ya que los estándares de polímeros lineales y nanogeles del mismo peso molecular pueden tener dimensiones y volúmenes de retención muy diferentes. Esto en parte se puede solucionar con el uso de equipos modernos de CPG que cuentan con un detector de dispersión de luz que en principio permite una absoluta determinación del peso molecular para cada polímero o fracción de nanogel.2
Viscosimetría. Cambios relativos en dimensiones hidrodinámicas de nanogeles, relacionados con su peso molecular promedio, estructura y tamaño, pueden ser monitoreados mediante mediciones de viscosidad en soluciones diluidas.2 Mediante la viscosidad intrínseca [Ƞ] de una solución de polímero se puede determinar el peso molecular promedio en viscosidad (Mη). La correlación entre estos valores es la muy conocida ecuación de Mark-Houwink: [Ƞ] = KMηα donde K y α son parámetros los cuales son constantes por el par linear dado polímero/solvente a una temperatura definida y que puede ser encontrada en diferentes referencias.52 Como las partículas de nanogeles son más compactas que la forma espiral del mismo polímero lineal, la viscosidad de los nanogeles es menor en comparación con las macromoléculas lineales de igual concentración, como resultado de esto, las mediciones de viscosidad de nanogeles (valores de α para algunos nanogeles 0.09-0.25) no dan valores apropiados de peso molecular, al menos cuando se utilizan los valores de k y α para cadenas lineales en un buen disolvente (valores de α 0.5-0.8). Esto se debe a que la dependencia real de la viscosidad con el peso molecular esta influenciada por la densidad de reticulación, forma de síntesis, etc. Por lo tanto puede variar de una preparación a otra.2
Las mediciones de viscosidad son también frecuentemente utilizadas para seguir los cambios de tamaño de los nanogeles durante la síntesis, a menudo en paralelo con otros métodos, indicando los cambios en el peso molecular. En estudios de reología se puede obtener información a partir de la relación de compactación y rigidez de partículas de nanogel y su susceptibilidad a una deformación, la permeabilidad del solvente, así como las interacciones entre las partículas.2
Calorimetría Diferencial de Barrido (CDB). Es una técnica experimental dinámica que nos permite determinar la cantidad de calor que absorbe o libera una sustancia, cuando es mantenida a temperatura constante, durante un tiempo determinado, o cuando es calentada o enfriada a velocidad constante, en un determinado intervalo de temperaturas. La CDB es eficaz para caracterizar las propiedades físicas de los polímeros que componen a los nanogeles. Esto nos permite determinar las temperaturas de fusión, cristalización, y temperaturas de transición de fases (LCST, UCST o VPTT) y los correspondientes cambios de entalpía y entropía, la transición vítrea y otros efectos que muestran cambios en la capacidad calorífica o de calor latente. Además, se puede determinar la presencia de agua asociada a los nanogeles y la no asociada, lo que podría ser de utilidad para conocer el grado de hinchamiento.53
Microscopía. La visualización de nanogeles puede ser realizada por varias técnicas microscópicas. Los estudios son basados en:
Microscopía Electrónica de Barrido (MEB) tiene la capacidad de producir imágenes de alta resolución (aproximadamente de 3-4 nm) de la superficie de los nanogeles. Las imágenes MEB tienen una apariencia tridimensional que las caracteriza y son útiles para la investigación de la estructura superficial de micro y nanogeles.1 La preparación de la muestra no es sencilla, requiere de recubrimiento con una capa delgada de un material conductor y condiciones de vacío. Figura 15.54

La Microscopía Electrónica de Transmisión (MET) proporciona imágenes en segunda dimensión con una resolución aproximadamente de 0.2 nm. La preparación de la muestra no es complicada. En un típico procedimiento, una gota de una dispersión de nanogel diluida es colocada sobre un soporte adecuado (a menudo una malla de cobre recubierta con una película de carbono) y se seca a temperatura ambiente. Con este método se pueden observar partículas de geles individuales y/o sus monocapas.55 No obstante, MET solo es adecuada para analizar partículas en estado seco y por lo tanto no brinda ninguna información acerca del grado de hinchamiento de los nanogeles a diferentes temperaturas. Para esto, se encuentran disponibles diferentes técnicas criogénicas en la que una capa delgada de la muestra acuosa es congelada aproximadamente a la temperatura de ebullición del nitrógeno líquido (-196 °C). La congelación de la muestra es muy rápida lo que permite incluso congelarse a temperaturas elevadas. Esta técnica se denomina crio-MET.40
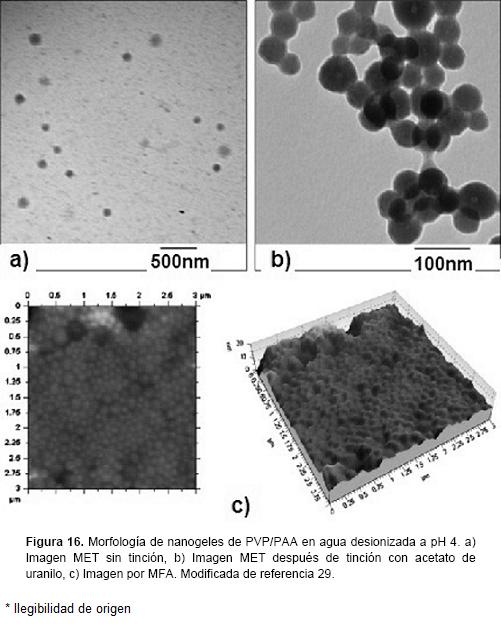
La Microscopía de Fuerza Atómica (MFA) tiene la capacidad de proporcionar imágenes en tercera dimensión (con una resolución menor a 1 nm) acerca de la estructura de los nanogeles a un nivel atómico y molecular, y es por lo tanto complementaria a otras formas de microscopia. La preparación de la muestra es sencilla, no necesita espolvoreado catódico de metales ni condiciones de vacío, lo que permite la visualización de la estructura del nanogel en su ambiente natural. La MFA ha sido utilizada por ejemplo, para el estudio de la topología de la superficie de micro y nanogeles, también permite la medición de las fuerzas entre partículas y la determinación de las propiedades elásticas de micro y nanopartículas.55 En la figura 16 se muestran micrografías de nanogeles de PVP/PAA obtenidas por MET y MFA.
Espectroscopía. La composición química de los nanogeles puede ser determinada mediante espectroscopía regularmente utilizada para polímeros. La Espectroscopía UV-Visible y la Espectroscopía infrarroja, son empleadas en el control de la conversión de monómeros durante la síntesis del nanogel. El uso de la espectroscopia infrarroja puede ser favorecida por el hecho de que muchos nanogeles forman películas que pueden ser analizadas directamente.2
La espectroscopía de resonancia de espín electrónico (REE) es una técnica que detecta las transiciones inducidas por la radiación electromagnética entre los niveles de energía de espínes electrónicos en presencia de un campo magnético estático. El método puede ser aplicado al estudio de nanogeles para conocer la concentración, el comportamiento de las especies radicales o especies paramagnéticas durante los procesos de polimerización y/o reticulación, con el fin de obtener información sobre la estructura y la dinámica de su entorno en escalas de longitud de hasta 10 nm.56-57
La espectroscopía de resonancia magnética nuclear (RMN) es un método espectral donde núcleos atómicos situados bajo la influencia de un campo magnético exterior de intensidad determinada absorben selectivamente energía del rango de radiofrecuencias pasando a un estado excitado. Al cesar el aporte energético externo estos mismo núcleos devuelven la energía absorbida para regresar a su situación de equilibrio termodinámico, en un proceso de relajación que se puede ser captado, medido y cuantificado permitiendo la identificación de la molécula donde se ubican pues la liberación ocurre de forma característica según el tipo de átomos que los rodean y los enlaces establecidos con esos átomos. Además, en la señal de relajación pueden identificarse sus coordenadas espaciales de origen, lo que proporciona información morfológica de la estructura donde se ha originado. Se utiliza para la determinación de la estructura química, composición, tacticidad y el grado de hinchamiento de los nanogeles.58
Aplicaciones de los nanogeles
Los nanogeles son actualmente objeto de intensa investigación para la administración y liberación controlada de fármacos, análogos de nucleósidos, péptidos, proteínas, genes y vacunas.59-81 Véase tabla 3. Los nanogeles presentan varias ventajas sobre los hidrogeles. Dado el tamaño nanométrico, los nanogeles tienen potencial en zonas donde los hidrogeles no lo poseen, por ejemplo, en la administración parenteral. También pueden ofrecer oportunidades en otras vías de administración como la oral y nasal.82
Uno de los aspectos clave es la administración de fármacos de liberación controlada. Aunque tal control se puede lograr con los hidrogeles, los nanogeles logran un control temporal más preciso sobre las tasas de liberación debido a su mayor área superficial y también son útiles en sistemas que requieren una liberación rápida o explosiva (efecto Burst), ya que, estos pueden entrar en las células y responder a señales intracelulares.25 Como se mencionó anteriormente, los nanogeles estímulo-sensibles tienen la propiedad única de someterse a cambios bruscos de tamaño en respuesta a los factores ambientales, tales como, la temperatura y el pH, por lo tanto, la liberación de fármacos depende de las propiedades del propio fármaco y del polímero en el diseño del nanogel.3 Paralelamente, el contenido de agua y la densidad de reticulación también pueden determinar la transferencia del fármaco dentro y fuera del nanogel.83 Además, puesto que, los nanogeles pueden circular en el cuerpo después de haber sido inyectados, tienen la capacidad para tratar la enfermedad en el sitio donde ésta ocurre. Otro aspecto importante, es la capacidad de carga de fármaco que se puede esperar para nanogeles, la cual es mayor que las observadas normalmente para otros nanovehículos (micelas poliméricas, liposomas, nanopartículas, etc.). La razón principal de ello, radica en que los nanogeles se componen principalmente de agua y por lo tanto proporcionan un espacio más grande para la incorporación de fármacos y/o macromoléculas.22
Las principales desventajas y/o desafíos de los nanogeles son; debido a que son hidrofílicos, la falta de dominios hidrofóbicos hace que no sean muy eficientes en la solubilización de fármacos hidrofóbicos no ionizables. Los nanogeles son más eficaces en la solubilización de fármacos hidrofílicos y/o ionizables o cuando el fármaco se encuentra disperso en otro sistema. Los nanogeles cargados con péptidos, proteínas y otras biomacromoléculas a menudo presentan distribuciones no homogéneas de las mismas dentro del nanogel, en el caso de las proteínas una adsorción irregular en la superficie del mismo, además, rendimientos bajos de carga de fármaco y una liberación incompleta de biomacromoléculas. Sin embargo, estos desafíos se pueden superar con un mayor entendimiento de las propiedades de los nanogeles. Una desventaja de los nanogeles es que en su preparación podrían quedar trazas de disolventes, tensoactivo o productos de degradación de monómeros y polímeros sintéticos que podrían causar algún grado de toxicidad. Además, la obtención de estos sistemas como producto final es muy costosa para un posible escalamiento a la industria farmacéutica.82,84-85
Vectorización de nanogeles. Los nanogeles proporcionan un modo único para la administración dirigida de fármacos a través de la circulación sanguínea. Estos nanovehículos son más pequeños que los glóbulos típicos, tales como eritrocitos o linfocitos (7-10 µm). Después de la inyección intravenosa, estos pueden flotar libremente en el torrente sanguíneo en los vasos más pequeños y capilares, alcanzando el sitio o tejido específico mediante la explotación de los mecanismos fisiológicos de depuración. La liberación del fármaco se produce después de la absorción de los nanogeles dentro de las células del tejido diana. Desafortunadamente, la mayoría de los SAF son eliminados por el sistema retículoendotelial en cuestión de minutos después de la inyección. Los SAF se acumulan en los macrófagos del hígado y en el bazo por fagocitosis y su captación es causada por la absorción de proteínas de la sangre tales como inmunoglobulinas o componentes del sistema de complemento opsoninas en su superficie. Para reducir las interacciones con las proteínas séricas, lograr un tiempo de circulación prolongado en la sangre y evitar la acumulación de nanogeles en sitios no específicos, se puede modificar la superficie de los nanogeles con polímeros hidrofílicos inertes tales como polímeros de óxido de etileno.22,86-87
La orientación y la acumulación de los nanogeles en las células tumorales se basa en dos mecanismos: focalización pasiva y activa (Figura 17). En la focalización pasiva, el transporte de los nanogeles es a través de espacios intracelulares hacia el intersticio tumoral y su posterior acumulación en estos tejidos. El llamado efecto de permeabilidad y retención incrementados (EPR) explica este fenómeno. Este efecto se fundamenta en la fisiología característica del endotelio de los capilares del tumor, cuyas células se encuentran frecuentemente separadas por espacios de entre 200 y 600 nm, permitiendo así el paso de los nanogeles a través de ellas. Además, la acumulación de los mismos en el tejido tumoral se ve favorecido por la pobre circulación linfática en este ambiente y la capacidad endocítica de las células tumorales hacia los nanogeles. La focalización activa hace referencia a la orientación activa del nanogel, y sólo una simple acumulación en los tejidos tumorales, motivada por su marcada especificidad hacia las células diana. Ésta especificidad se consigue a través de procesos de reconocimiento celular aprovechando la sobreexpresión de varios tipos de receptores en la superficie de las células tumorales. La acumulación de los nanogeles en el tumor ha demostrado incrementar significativamente la efectividad terapéutica de los fármacos asociados, reduciendo a su vez la aparición de daños colaterales.25

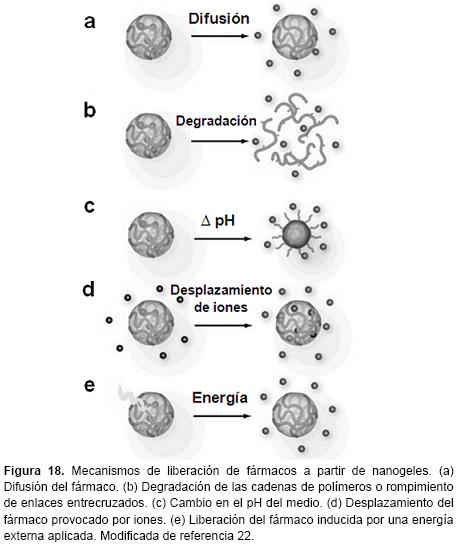
Los diferentes mecanismos de liberación de agentes terapéuticos a partir de los nanogeles se ilustran en la Figura 18. Por ejemplo, la liberación de fármacos se puede disminuir mediante la reticulación de las cadenas poliméricas, por la introducción de enlaces entrecruzados que se pueden ajustar para ser sensibles a cambios ambientales. Además, esta tecnología ofrece la posibilidad de controlar los perfiles de liberación de fármacos. En contraste a los liposomas y nanopartículas insolubles, los nanogeles hidrofílicos así como se hinchan se libera el fármaco, lo que sostiene la liberación desde las capas internas. Esto se puede utilizar para modificar o eliminar la liberación por reventamiento o incluso para lograr una cinética de liberación del fármaco de orden cero a partir de nanogeles depositados en el sitio de la enfermedad.88-89
Nanogeles cargados con pequeños agentes terapéuticos. Se ha logrado un avance significativo en los últimos años en su aplicación como sistemas de administración de pequeñas moléculas biológicamente activas. Estas moléculas generalmente contienen sólo una pequeña cantidad de grupos iónicos, que son capaces de interactuar con los nanogeles.3 La incorporación de varios pequeños agentes terapéuticos puede llevarse acabo mediante la formación de complejos intermoleculares.12 Por ejemplo, el ácido retinoico (anticancerígeno) se encapsula en nanogeles de PEG-cl-PEI.90 Una formulación similar de ácido valproico también se preparó en estos nanogeles. En tal caso, el transporte de ácido valproico a través de la barrera hematoencefálica se caracterizó mediante un modelo in vitro.
La permeabilidad de estos sistemas a través de monocapas de células endoteliales de los microvasos de cerebro bovino (BBMEC) se aumenta en al menos 70% en comparación con ácido valproico libre, lo que sugiere que los nanogeles pueden ser útiles para la administración de este fármaco en el cerebro (Figura 19).22 En otro estudio, N-hexilcarbamoil-5-fluorouracilo, un profármaco anticancerígeno de 5-FU, se encapsuló en nanogeles de PNIPAAm-co-VP recubiertos con monooleato de sorbitán polietoxilado. La liberación del fármaco a partir de este vehículo es pH y temperatura dependiente. Así mismo, se acumulan en cerebros de conejos.3 Como se mencionó previamente, con los nanogeles se puede lograr una liberación sostenida de fármacos. Por citar un ejemplo, la liberación in vitro de metronidazol (MTZ) en medios gastrointestinales simulados a partir de nanogeles compuestos de PMAA es sostenida como se observa en la figura 20, además, estos sistemas disminuyen la citotoxicidad del MTZ.91
Una aplicación prometedora de nanogeles implica la entrega de análogos de nucleósidos. Mediante el uso de nanogeles PEG-cl-PEI fue posible entregar directamente fluradabina, zidovudina y citarabina en diversas líneas de células cancerosas. Estos sistemas tienen mayor citotoxicidad que cuando se administran solamente los análogos.3

Nanogeles cargados con biomacromoléculas terapéuticas. Los nanogeles pueden acomodar diferentes biomacromoléculas que penetran en sus poros o formar una especie de envoltura polimérica que rodea a las biomacromoléculas.3 La adsorción de proteínas sobre la superficie de nanogeles podría ser impulsada por interacciones hidrófobas y/o electrostáticas. Sin embargo, se ha reconocido que la adsorción es particularmente complicada y necesita ser confirmada. Cabe destacar, que para comprender los mecanismos que controlan el proceso de adsorción se deben considerar dos propiedades; los cambios de porosidad y de hidrofilicidad. Kawaguchi et al. encontraron que el grado de adsorción de proteínas se define por la hidrofilicidad de la superficie del nanogel. Nanogeles termo-sensibles de PNIPAAm favorecieron la adsorción de proteínas (gama globulina humana) cuando la superficie disminuye drásticamente su hidrofilicidad a temperaturas por encima de la LCST. Así mismo, las proteínas adsorbidas pueden ser desorbidas parcialmente mediante la reducción de la temperatura por debajo de la LCST.92
Los nanogeles también pueden ser utilizados como sistemas de entrega de genes. Tanto el ADN como el ARN son macromoléculas fuertemente aniónicas, el efecto biológico de los cuales (después de la administración) se reduce drásticamente por la degradación en la incorporación celular. Dickerson et al. sugieren que la administración de genes mediante nanogeles puede ser una estrategia prometedora para incrementar la eficacia de la quimioterapia para el tratamiento del cáncer.93-94 La formación de complejos con especies catiónicas puede representar una manera de lograr una alta internalización celular de pADN y ARNpi.80 Los policationes débiles, tales como poli(etilenimina) y poli(amidoamina) ofrecen oportunidades para el escape endosomal, y por lo tanto lograr la localización de los genes en su sitio de acción en el citosol, y al mismo tiempo reducir la degradación por catálisis ácida.82 Utilizando este enfoque, Tamura et al. investigaron sistemas de entrega de ARNpi mediante nanogeles núcleo-corteza compuestos con núcleo de DEAEMA y PEG como corteza. Se demostró que las especies polianiónicas son de gran importancia para mejorar la circulación sanguínea de complejos de ARNpi debido a la abundancia de proteínas séricas aniónicas.95 Blackburn et al. investigaron nanogeles núcleo-corteza compuesto de N-isopropilmetacrilamida como núcleo y metacrilato de aminopropilo como corteza con péptidos en la superficie. Como resultado, la unión no covalente de ARNpi y una liberación específica de oligonucleótidos en líneas celulares cancerosas de ovario en presencia de suero.96 Otras formulaciones con ARNpi son: Glico-nanogeles termo-sensibles,97 nanogeles de AH98 y nanogeles de DEX recubiertos con PEG.99
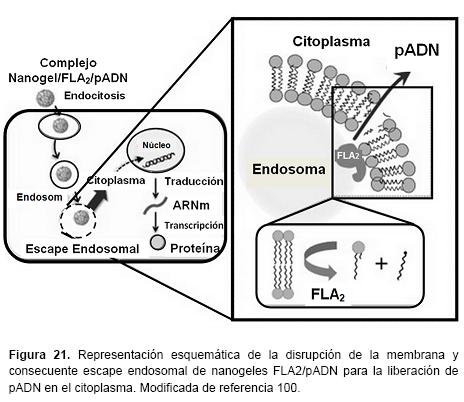
Algunas formulaciones de oligonucleótidos incorporados en nanogeles muestran atravesar las barreras celulares. Vinogradov et al. incorporaron un oligonucleótido fosforotioato en un nanogel catiónico de PEG-cl-PEI lo que resulta en un aumento drástico de la permeabilidad transcelular del oligonucleótido en monocapas de células polarizadas Caco-2 utilizadas como modelo in vitro del epitelio gastrointestinal. Así mismo, no se afecta la permeabilidad en las monocapas de las células con respecto a H-manitol, un marcador paracelular. Esto sugiere, que los nanogeles cargados con oligonucleótidos se transportan a través de las células, en forma de difusión pasiva mediante una ruta paracelular. Además, en contraste con un oligonucleótido libre que se degrada en las células, el oligonucleótido en el nanogel se encuentra protegido. Esto indica que los nanogeles son vehículos prometedores para la administración oral de oligonucleótidos.101 Similar a los oligonucleótidos, un plásmido de ADN inmovilizado en nanogeles catiónicos puede ser protegido de la degradación enzimática. Se desarrolló un sistema de administración de pADN a partir de nanogeles catiónicos compuestos de cicloamilosa modificado con grupos hexadecilo y fosfolipasa A2 (FLA2) para ayudar a la disrupción endosomal al hidrolizar los fosfolípidos de la membrana. Este nanogel se forma por interacciones hidrófobas y electrostáticas con FLA2 y pADN. Tanto el plásmido como la fosfolipasa se incorporan eficazmente en las células con ayuda de este nanovehículo, además, el nivel de expresión de pADN mejoró cuando se compleja con concentraciones específicas de FLA2. También se mostró un actividad hemolítica similar contra los eritrocitos de la sangre a la observada utilizando sólo FLA2. Estos resultados sugieren que el complejo Nanogel/pADN/FLA2 posee capacidad de disrupción de la membrana cuando se entrega en células y provoca la posterior liberación de pADN desde el endosoma al citoplasma (Figura 21). Este es el primer informe de co-administración de pADN y FLA2 utilizando el mismo vehículo para la administración eficaz de genes.100
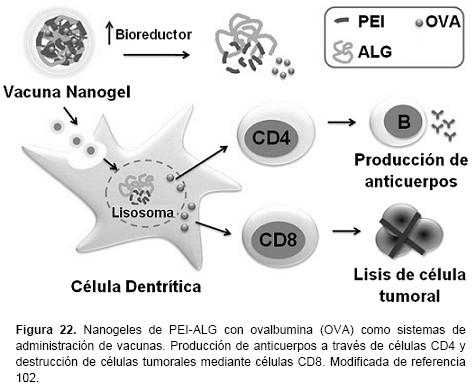
Existe un creciente interés en el campo de la administración de fármacos por los efectos farmacológicos de excipientes poliméricos y nanomateriales en combinación con fármacos. Particularmente en polímeros sintéticos, se ha demostrado que interactúan con algunos de los sistemas de transporte de fármacos y activan vías de señalización celular, provocando alteraciones en las respuestas farmacológicas, genómicas e inmunes de agentes biológicos. Fréchet y cols. utilizaron nanogeles pH-sensibles para la presentación de antígeno in vitro y la vacunación in vivo. Estos autores encontraron que los nanogeles pueden ser diseñados para generar respuestas inmunes para el desarrollo de vacunas.101 Ping y cols. desarrollaron nanogeles catiónicos de ALG-PEI como un nuevo sistema de administración de vacunas. Los nanogeles tienen una gran capacidad de carga de antígeno y citotoxicidad mínima, lo que los promueve como potentes adyuvantes para mejorar las vacunas y producir respuestas inmunes humorales y celulares (Figura 22).102 Shimizu y cols. utilizaron un nanogel basado en pululano sustituido con colesterol, para la administración subcutánea en ratones de interleucina-12, como una nueva tecnología en la inmunoterapia para la liberación sostenida de citoquinas contra tumores malignos.103 Démoulins y cols. analizaron la capacidad inmunomoduladora de nanogeles de QS recubiertos con ALG en sangre porcina y humana, cuando se aplican en vacunas como adyuvantes en células dendríticas. Los nanogeles influyeron diferencialmente en las características inmunomoduladoras de receptores tipo Toll (RTT).104
Nanogeles cargados con nanopartículas. Las nanopartículas (NPs) son estructuras sólidas y esféricas que tienen un tamaño menor a 1 µm y se preparan a partir de metales o polímeros. Se ha incrementado el interés por el uso de nanogeles como plantillas para la síntesis, almacenamiento y transporte de NPs. Las ventajas son las siguientes: la síntesis controlada de las NPs (localización de sitios reactivos, crecimiento controlado, distribución homogénea); propiedades de las NPs (tamaño, morfología, estabilidad, mayor área superficial).
Desafortunadamente, algunos de los efectos no deseados que se pueden esperar de una alta carga en el nanogel por otro material, son las interacciones especificas entre el material y las cadenas de polímero del nanogel lo que puede conducir a la reducción de la movilidad de las cadenas, el cambio en la transición de volumen, así como la desestabilización coloidal.105
Los nanogeles que contienen NPs metálicas y/o magnéticas son de sumo interés en biomedicina por sus aplicaciones en diagnóstico y, en particular, como agentes terapéuticos. Una vez que las nanopartículas se unen a tejidos o a células cancerosas, se puede inducir su calentamiento mediante la aplicación de un campo magnético de baja intensidad (para NPs magnéticas) o por irradiación con luz infrarroja (para NPs metálicas).
A pesar de que los mecanismos son diferentes, en ambos casos el calentamiento provoca la destrucción de las células tumorales por hipertermia, sin afectar a las células o tejidos sanos que las rodea. Por otro lado, la posibilidad de utilizar atracción magnética externa o la funcionalización de las NPs con moléculas que reconocen dianas sobre las que actúan, hace posible el guiado de las NPs hacia las zonas de interés, donde se produce la liberación de fármacos.45,106-107 Figura 23.

Recientemente, se han multiplicado los esfuerzos para desarrollar nanogeles que contienen NPs metálicas y/o magnéticas para la transfección y la vacunación.3,12
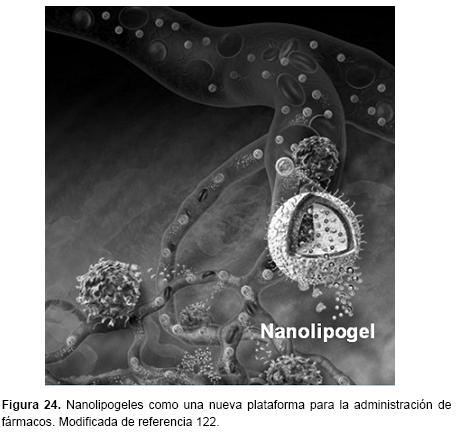
Una amplia variedad de agentes terapéuticos pueden ser entregados utilizando NPs poliméricas. Estas también logran una administración dirigida a órganos o células específicas y/o una liberación controlada.108-110 Nuestro grupo ha reportado la preparación y caracterización de NPs. Algunos ejemplos son: NPs de PLGA, Eudragit® y monooleína cargadas de carbamazepina,111 triclosán102 y omapatrilat,113-114 respectivamente. Los nanogeles también presentan un alto potencial como vehículos de otros sistemas de administración nanoestructurados, por ejemplo: NPs poliméricas,115-116 NPs Lipídicas Solidas,117 Liposomas,118-119 Nanocristales120 y Nanotubos de Carbono.121 Sin embargo, existen muy pocos trabajos. En la Figura 24 se observa una nueva generación de nanogeles, estos son denominados nanolipogeles.122
Nanogeles mucoadhesivos. Los nanogeles compuestos de polímeros mucoadhesivos se pueden utilizar para diseñar nuevos tipos de vehículos para la administración de fármacos.123-125
Las interacciones entre las superficies de polímeros hidrofílicos y las mucinas conduce a una mejor adherencia. Por otra parte, la decoración de la superficie de un nanogel con copolímeros lineales o en bloques que contienen restos aniónicos o tiolados proporcionar la interpenetración y el anclaje en el moco.3
Conclusiones
En esta revisión hemos analizado los diferentes tipos de nanogeles y sus aplicaciones en la nanotecnología, particularmente como sistemas de entrega de fármacos y otras moléculas activas. Los métodos más generales para síntesis de nanogeles son: la reticulación de polímeros, donde principalmente se utilizan biopolímeros debido a sus propiedades únicas; no toxicidad, solubilidad en agua, biocompatibilidad, biodegradabilidad y alto grado de funcionalidad. El segundo método de síntesis de nanogeles es por polimerización reticulación de monómeros. Con éste método se obtienen nanogeles termo- y pH-sensibles. La caracterización de los nanogeles se realiza utilizando las siguientes técnicas: dispersión de luz, viscosimetría, microscopía y espectroscopia. Por lo mencionado anteriormente, los nanogeles proporcionan importantes contribuciones a las ciencias farmacéuticas, específicamente, para la administración de fármacos.
Uno de los retos más interesantes para el futuro de estos sistemas es su uso como vehículos que contengan otros sistemas nanoestructurados, por ejemplo; la introducción de nanopartículas de diferente naturaleza, como tratamientos innovadores, eficaces, específicos y selectivos. Otro reto es, desarrollar nanogeles que contengan nanopartículas de oro, este sistema tiene afinidad por ciertos fármacos, especialmente por el ácido fólico y metotrexato, aumentando la eficacia de la terapia contra el cáncer y mejorando la recuperación de las células cancerosas. Por otro lado, un sistema de tercera generación son los nanogeles incluidos en liposomas (nanolipogeles o nanogeliposomas), estos sistemas son prometedores vehículos de fármacos anticancerígenos capaces de reducir la citotoxicidad del fármaco así como controlar la liberación del mismo. Sin embargo, se debe tener un control cuidadoso sobre la estabilidad, es decir, evitar interacciones fármaco-nanovehículo-nanogel que pueden provocan inestabilidad coloidal, lo cual guiará a la optimización de estos sistemas. Finalmente, el estado del arte con nanogeles obliga a realizar más estudios detallados sobre citotoxicidad, inmunogeneicidad y farmacocinética para considerarlos como una importante opción para aplicaciones bionanotecnológicas.
Referencias
1. Matzelle T, Reichelt R. Review: Hydro-, Micro- and Nanogels studied by complementary measurements based on SEM and SFM. Acta Microsc. 2008; 17(1):45-61. [ Links ]
2. Ulanski P, Rosiak J. In: Nalwa HS, Editor. Polymeric Nano/Microgels, Encyclopedia of Nanoscience and Nanotechnology. Vol. VIII. Stevenson Ranch, CA, USA: Am Sci Publishers, ISBN 1-58883-064-0;2004. [ Links ]
3. Vinogradov S. Colloidal Microgels in drug delivery applications. Curr Pharm Des. 2006;12(36):4703-4712. [ Links ]
4. Bencherif S, Siegwart D, Srinivasan A, Horkay F, Matyjaszewski K. Nanostructured hybrid hydrogels prepared by a combination of atom transfer radical polymerization and free radical polymerization. Biomater. 2009;30(29):5270-5278. [ Links ]
5. Hoare T, Kohane D. Hydrogels in drug delivery: Progress and challenges. Polym. 2008;49(8):1993-2007. [ Links ]
6. Vinogradov S, Bronich T, Kabanov A. Nanosized cationic hydrogels for drug delivery: preparation, properties and interactions with cells. Adv Drug Deliv Rev. 2002;54(1):135-147. [ Links ]
7. Weitai W, Shuiqin Z. Hybrid micro-/nanogels for optical sensing and intracellular imaging. Nano Rev. 2010;1-17. [ Links ]
8. Peppas N, Hilt J, Khademhosseini A, Langer R. Hydrogels in Biology and Medicine: From Molecular Principles to Bionanotechnology. Adv Mater. 2006;(18):1345-1360. [ Links ]
9. Hennink W, Van Nostrum C. Novel crosslinking methods to design hydrogels. Adv Drug Deliv Rev. 2002;54(1):13-36. [ Links ]
10. Nayak S, Lyon L. Soft nanotechnology with soft nanoparticles. Angew Chem Int Ed Engl. 2005;44(47):7686-7708. [ Links ]
11. Kwon Oh J, Drumright R, Siegwart D, Matyjaszewski K. The development of microgels/nanogels for drug delivery applications. Prog Polym Sci. 2008;33(4):448-477. [ Links ]
12. Pich A, Richtering W. Polymer Nanogels and Microgels. Polym Sci: Comp Ref. 2012;(6):309-350. [ Links ]
13. Kwon Oh J, Ik Lee D, Park JM. Biopolymer-based microgels/nanogels for drug delivery applications. Prog Polym Sci. 2009;34(12):1261-1282. [ Links ]
14. Kwon Oh J, Bencherif SA, Matyjaszewski K. Atom transfer radical polymerization in inverse miniemulsion: A versatile route toward preparation and functionalization of micro/nanogels for targeted drug delivery applications. Polym. 2009;50(19):4407-4423. [ Links ]
15. Yallapu M, Jaggi M, Chauhan S. Design and engineering of nanogels for cancer treatment. Drug Discovery Today. 2011;16(9-10):457-463. [ Links ]
16. Lang P, Viassopoulos D, Richtering W. Polymer/Colloid Interactions and Soft Polymer Colloids. Polym Sci: Compr Ref. 2012;(1):315-338. [ Links ]
17. Wu J, Huang G, Hu Z. Interparticle potential and the phase behavior of temperature-sensitive microgel dispersions. Macromol. 2003;(36):440-448. [ Links ]
18. Peppas N, Slaughter B, Kanzelberger M. Hydrogels. Polym Sci: Compr Ref. 2012;(9):385-395. [ Links ]
19. Flory P, Rehner J. Statistical Mechanics of Crosslinked polymer networks I. Rubberlike elasticity. J Chem Phys. 1943;(11):512-520. [ Links ]
20. Pelton R. Temperature-sensitive aqueous microgels. Adv Colloid Interface Sci. 2000;(85):1-33. [ Links ]
21. Rieka J, Tanaka T. Swelling of ionic gels: Quantitative performance of Donnan Theory. Macromol. 1984;(17):2916-2921. [ Links ]
22. Kabanov A, Vinogradov S. Nanogels as Pharmaceutical Carriers: Finite Networks of Infinite Capabilities. Angew Chem Int Ed. 2009;48(30):5418-5429. [ Links ]
23. Constantin M, Ascenzi P, Fundueanu G. Lower critical solution temperature versus volume phase transition temperature in thermoresponsive drug delivery systems. eXPRESS Polym Lett. 2011;5(10):839-848. [ Links ]
24. Wang Q, Xu H, Yang X, Yang Y. Drug release behavior form in situ gelatinized thermosensitive nanogel aqueous dispersions. Int J Pharm. 2008;361(1-2):189-193. [ Links ]
25. Chacko RT, Ventura J, Zhuang J, Thayumanavan S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Deliv Rev. 2012;64(9):836-851. [ Links ]
26. Hamidi M, Azadi A, Rafiei P. Hydrogel nanoparticles in drug delivery. Adv Drug Deliv Rev. 2008;(60):1638-1649. [ Links ]
27. Daoud-Mahammed S, Couvreur P, Gref R. Novel self-assembling nanogels: Stability and lyophilisation studies. Int J Pharm. 2007;332(1-2):185-191. [ Links ]
28. Kadlubowski S, Ulanski P, Rosiak J. Synthesis of tailored nanogels by means of two-stage irradiation. Polym 2012;53(10):1985-1991. [ Links ]
29. Abd El-Rehim H, Hegazy E-SA, Hamed A, Swilem A. Controlling the size and swellability of stimuli-responsive polyvinylpyrrolidone poly(acrylic acid) nanogels synthesized by gamma radiation-induced template polymerization. Eur Polym J. 2013;49(3):601-612. [ Links ]
30. Gyarmati B, Némethy Á, Szilágyi A. Reversible disulphide formation in polymer networks: A versatile functional group from synthesis to applications. Eur Polym J. 2013;49(6):1268-1286. [ Links ]
31. Hoare T, Kohane D. Hydrogels in drug delivery: Progress and challenges. Polym. 2008;49(8):1993-2007. [ Links ]
32. Hasegawa U, Sawada S, Shimizu T, Kishida T, Akiyoshi K. Raspberry-like assembly of cross-linked nanogels for protein delivery. J Control Release. 2009;140(3):312-317. [ Links ]
33. Ferreira S, Pereira P, Sampaio P, Coutinho J, Gama F. Supramolecular assembled nanogel made of mannan. J Colloid Interface Sci. 2011;361(1):97-108. [ Links ]
34. EJ de Nooy A, Masci G, Crescenzi V. Versatile Synthesis of Polysaccharide Hydrogels Using the Passerini and Ugi Multicomponent Condensations. Macromol. 1999;(32);1318-1320. [ Links ]
35. EJ de Nooy A, Capitani D, Masci G, Crescenzi V. Ionic Polysaccharide Hydrogels via the Passerini and Ugi Multicomponent Condensations: Synthesis, Behavior and Solid-State NMR Characterization. Biomacromol. 2000;1(2):259-267. [ Links ]
36. Oyrton A, Monteiro Jr, Airoldi C. Some studies of crosslinking chitosan-glutaraldehyde interaction in a homogeneous system. Int J Biol Macromol. 1999;26(2-3):119-128. [ Links ]
37. Tauer K, Hernandez H, Kozempel S, Lazareva O, Nazaran P. Towards a consistent mechanism of emulsion polymerization-new experimental details. Colloid Polym Sci. 2008;286(5):499-515. [ Links ]
38. Su S, Wang H, Liu X, Wu Y, Nie G. iRGD-coupled responsive fluorescent nanogel for targeted drug delivery. Biomater. 2013;34(13):3523-3533. [ Links ]
39. Liao Q, Shao Q, Wang H, Qiu G, Lu X. Hydroxypropylcellulose templated synthesis of surfactant-free poly(acrylic acid) nanogels in aqueous media. Carbohydr Polym. 2012;87(4):2648-2654. [ Links ]
40. Lu Y, Ballauff M. Thermosensitive core-shell microgels: From colloidal model systems to nanoreactors. Prog Polym Sci. 2011;36(6):767-792. [ Links ]
41. Schramm L. Emulsions, foams and suspensions. 1ª Ed. Germany. Wiley-VCH;2005,4. [ Links ]
42. Zhou H, Steinhilber D, Schlaad H, Sisson AL, Haag R. Glycerol based polyether-nanogels with tunable properties via acid-catalyzed epoxide-opening in miniemulsion. React Funct Polym. 2011;71(3):356-361. [ Links ]
43. Koul V, Mohamed R, Kuckling D, Adler P, Choudhary V. Interpenetrating polymer network (IPN) nanogels based on gelatin and poly(acrylic acid) by inverse miniemulsion technique: Synthesis and characterization. Colloids Surf B: Biointerfaces. 2011;83(2):204-213. [ Links ]
44. Xi J, Zhou L, Dai H. Drug-loaded chondroitin sulfate-based nanogels: Preparation and characterization. Colloids Surf B: Biointerfaces. 2012;100(1):107-115. [ Links ]
45. Zhang L, Xue H, Cao Z, Keefe A, Jiang S. Multifunctional and degradable zwitterionic nanogels for targeted delivery, enhanced MR imaging, reduction-sensitive drug release, and renal clearance. Biomater. 2011;32(20):4604-4608. [ Links ]
46. Xiangli Q, Zhenjia Z, Side Y. Preparation of initiator and cross-linker-free poly(N-isopropylacrylamide) nanogels by photopolymerization. J Photochem Photobiol A: Chem. 2006;177(2-3):191-196. [ Links ]
47. Raemdonck K, Demeester J, De Smedt S. Advanced nanogel engineering for drug delivery. Soft Mater. 2009;(5):707-715. [ Links ]
48. Álvarez M, Estructuras Supramoleculares derivadas por Ácidos Biliares y Ciclodextrinas, España: Universidad Santiago de Compostela; 2007, p.403-412. [ Links ]
49. Nose T, Chu B. Light Scattering. Polym Sci: Compr Ref. 2012;(2) :301-329. [ Links ]
50. Richter D, Monkenbusch M, Schwahn D. Neutron Scattering. Polym Sci: Compr Ref. 2012;(2) :331-361. [ Links ]
51. Stieger M, Richtering W, Pedersen J, Lindner P. Small-angle neutron scattering study of structural changes in temperature-sensitive microgel colloids. J Chem Phys. 2004;120(13):6197-6206. [ Links ]
52. Mark J. Physical Properties of Polymers Handbook, 2ª Ed. New York: Springer; 2007.305-318. [ Links ]
53. Schick C. Calorimetry. Polym Sci: Compr Ref. 2012;793-819. [ Links ]
54. Marek S, Conn C, Peppas N. Cationic nanogels based on diethylaminoethyl methacrylate. Polym. 2010;51(6):1237-1243. [ Links ]
55. Misra G, Gil E, Lowe T. In the Biomedical Arena. In: Polymer Grefting and Crosslinking. Bhattacharya A, Rawlins J, Ray P, editores. New Jersey: Wiley; 2009.145-176. [ Links ]
56. Schlick S, Jeschke G. Electron Spin Resonance Spectroscopy. Polym Sci: Compr Ref. 2012;(2) :221-253. [ Links ]
57. Anseth K, Anderson K, Bowman C. Radical concentrations, environments, and reactivities during crosslinking polymerizations. Macromol Chem Phys. 1996;(197):833-848. [ Links ]
58. Mathur A, Scranton A. Characterization of hydrogels using nuclear magnetic resonance spectroscopy. Biomater. 1996;17(6):547-557. [ Links ]
59. Patnaik S, Shama A, Garg B, Gandhi R, Gupta K. Photoregulation of drug release in azo-dextran nanogels. Int J Pharm. 2007;342(1-2):184-193. [ Links ]
60. Abu N, Williams N, Heard C. Nanogel particulates located within diffusion cell receptor phases following topical application demonstrates uptake into and migration across skin. Int J Pharm. 2010;401(1-2):72-78. [ Links ]
61. Abu Samah N, Heard C. Enhanced in vitro transdermal delivery of caffeine using a temperature- and pH-sensitive nanogel, poly(NIPAM-co-AAc). Int J Pharm. 2013;453(2):630-640. [ Links ]
62. Vijayaraghavalu S, Labhasetwar V. Efficacy of decitabine-loaded nanogels in overcoming cancer drug resistance is mediated via sustained DNA methyltransferase 1 (DNMT1) depletion. Cancer Lett. 2013;331(1):122-129. [ Links ]
63. Muk N, Taek K, Baik H, Lee B, Lee S. A self-organized 3-diethylaminopropyl-bearing glycol chitosan nanogel for tumor acidic pH targeting: In vitro evaluation. Colloids Surf B: Biointerfaces 2010;78(1):120-126. [ Links ]
64. Meng-Hsuan H, Larsson M, Larsson A, Evenbratt H, Dean-Mo L. Design and characterization of novel amphiphilic chitosan nanocapsule-based thermo-gelling biogel with sustained in vivo release of the hydrophilic anti-epilepsy drug ethosuxumide. J Controlled Release. 2012;161(10):942-948. [ Links ]
65. Montanari E, D'Arrigo G, Di Meo C, Virga A, Matricardi P. Chasing bacteria within the cells using levofloxacin-loaded hyaluronic acid nanohydrogels. Eur J Pharm Biopharm. 2014;87(3):518-523. [ Links ]
66. Singka G, Samah N, Zulfakar M, Yurdasiper A, Heard CM. Enhanced topical delivery and anti-inflammatory activity of methotrexate from an activated nanogel. Eur J Pharm Biopharm. 2010;76(2):275-281. [ Links ]
67. Abandansari H, Reza M, Tabatabaei S, Niknejad H. pH-sensitive nanogels base on Boltorn H40 and poly(vinylpyridine) using mini-emulsion polymerization for delivery of hydrophobic anticancer drugs. Polym. 2014;1-12. [ Links ]
68. Zhou T, Xiao C, Fan J, Chen S, Wu W. A nanogel of on-site tunable pH-response for efficient anticancer drug delivery. Acta Biomater. 2013;9(1):4546-4557. [ Links ]
69. Galmarini C, Warren G, Senanayake M, Vinogradov S. Efficient overcoming of drug resistance to anticancer nucleoside analogs by nanodelivery of active phosphorylated drugs. Int J Pharm. 2010;395(1-2):281-289. [ Links ]
70. Vinogradov S, Zeman A, Batrakova E, Kabanov A. Poliplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Controlled Release. 2005;(107):143-157. [ Links ]
71. Senanayake T, Warren G, Vinogradov S. Novel anticancer nanogel conjugates of activated nucleoside analogs. Polym. 2011;52(2):12-13. [ Links ]
72. Matsumoto N, González-Toro D, Chacko R, Maynard H, Thayumanavan S. Synthesis of nanogel-protein conjugates. Polym Chem. 2013;4(8):2464-2469. [ Links ]
73. Wu Z, Zhang X, Guo H, Li C, Yu D. An injectable and glucose-sensitive nanogel for controlled insulin release. J Mater Chem. 2012;(22):22788-22796. [ Links ]
74. Carvalho V, Castanheira P, Faria T, Goncalves C, Gama M. Biological activity of heterologous murine interleukin-10 and preliminary studies on the use of a dextrin nanogel as a delivery system. Int J Pharm. 2010;400(1-2):234-242. [ Links ]
75. Dorwal D. Nanogel as novel and versatile pharmaceuticals. Int J Pharm Pharm Sci. 2012;4(3):67-74. [ Links ]
76. Alles N, Soysa N, Hussain A, Tomomatsu N, Akiyoshi K. Polysaccharide nanogel delivery of a TNF-α and RANKL antagonist peptide allows systemic prevention of bones loss. Eur J Pharm Sci. 2009;37(2):83-88. [ Links ]
77. Naeye B, Deschout H, Röding M, Rudemo M, Raemdonck K. Hemocompatibility of siRNA loaded dextran nanogels. Biomater. 2011;32(34):9120-9127. [ Links ]
78. Mimi H, Ho K, Siu Y, Wu A, Li P. Polyethyleneimine-based core-shell nanogels: a promising siRNA carrier for argininosuccinate synthetase mRNA knockdown in HeLa cells. J Controlled Release. 2012;158(1):123-130. [ Links ]
79. Khondee S, Yakovleva T, Berkland C. Low Charge Polyvinylamine Nanogels Offer Sustained, Low-Level Gene Expression. J Appl Polym Sci, 2010;118(4):1921-1932. [ Links ]
80. Yang H, Choi J, Park J, Jeon S, Keun-Hong P. Differentiation of endothelial progenitor cells into endothelial cell by heparin-modified supramolecular pluronic nanogels encapsulating bFGF and complexed with VEGF165 genes. Biomater. 2014;35(16):4716-4728. [ Links ]
81. Démoulins T, Milona P, McCullough K. Alginate-coated chitosan nanogels differentially modulate class-A and class-B CpODN targeting of dendritic cell and intracellular delivery. Nanomed: Nanotechnol, Biol Med. 2014;1-11. [ Links ]
82. Malmsten M, Bysell H, Hansson P. Biomacromolecules in microgels — Opportunities and challenges for drug delivery. Curr Opin Colloid Interface Sci. 2010;(15):435-444. [ Links ]
83. Fernández-Barbero A, Suárez I, Sierra-Martín B, Fernández-Nieves A, López-Cabarcos E. Gels and microgels for nanotechnological applications. Adv Colloid Interface Sci. 2009;(147-148):88-108. [ Links ]
84. Sultana F, Imran-UI-Haque M, Arafat M, Sharmin S. An overview of nanogel drug delivery system. J Appl Pharm Sci. 2013;3(8):95-105. [ Links ]
85. Coelho J, Ferreira P, Alves P. Drug delivery systems: Advanced technologies potentially applicable in personalized treatments. EPMA J. 2010;(1):164-209. [ Links ]
86. De Jaeghere F, Allemann E, Feijen J, Kissel T, Doelker E. Cellular uptake of PEO surface modified nanoparticles: Evolution of nanoparticles made of PLA:PEO diblock and triblock copolymers. J Drug Target. 2008;8(3):143-153. [ Links ]
87. Oupicky D, Ogris M, Howard K, Dash P, Seymour L. Importance of lateral and steric stabilization of polyelectrolyte gene delivery vectors for extended systemic circulation. Mol Ther. 2002;5(4):463-472. [ Links ]
88. Zhang Y, Guan Y, Zhou S. Permeability control of glucose-sensitive nanoshells. Biomacromol. 2007;8(12):3842-3847. [ Links ]
89. Ng E, Ng W, Chiam S. Optimization of nanoparticle drug microcarrier on the pharmacokinetics of drug release: a preliminary study. J Med Syst. 2008;32(2):85-92. [ Links ]
90. Bronich T, Vinogradov S, Kabanov A. Interaction of nanosized copolymer networks with oppositely charged amphiphilic molecules. Nano Lett. 2001;1(10):535-540. [ Links ]
91. Chen T, Chen L, Li H, Chen Y, Guo L. Design and in vitro evaluation of a novel poly(methacrylicacid)/metronidazole antibacterial nanogel as an oral dosage form. Colloids Surf B: Biointerfaces. 2014;(118):65-71. [ Links ]
92. Kawaguchi H, Fujimoto K, Mizuhara Y. Hydrogel microspheres III. Temperature-dependent adsorption of proteins on poly-N isopropylacrylamide hydrogel microspheres. Colloid Polym. 1992;(270):53-57. [ Links ]
93. Soni G, Yadav K. Nanogels as potential nanomedicine carrier for treatment of cancer: A mini review of the state of the art. Saudi Pharm J. 2014;1-7. [ Links ]
94. Dickerson E, Blackbum W, Smith M, Kapa L, McDonald J. Chemosensitization of cancer cells by siRNA using targeted nanogel delivery. BMC Cancer. 2010;10(10):1-11. [ Links ]
95. Tamura A, Oishi M, Nagasaki Y. Enhanced cytoplasmic delivery of siRNA using a stabilized polyion complex based on PEGylated nanogels with a cross-linked polyamine structure. Biomacromol. 2009;10(7):1818-1827. [ Links ]
96. Blackburn W, Dickerson E, Lyon A. Peptide-Functionalized Nanogels for Targeted SiRNA Delivery. Bioconjugate Chem. 2009;20(5):960-968. [ Links ]
97. Ahmed M, Wattanaarsakit P, Nararin R. Cationic glyco-nanogels for epidermal growth factor receptor (EGFR) specific siRNA delivery in ovarian cancer cells. Polym Chem. 2013;(4):3829-3836. [ Links ]
98. Lee H, Mok H, Lee S, Yu-Kyoung O, Park T. Target-specific intracellular delivery of SiRNA using degradable hyaluronic acid nanogel. J Controlled Release. 2007;119(2):245-252. [ Links ]
99. Vinogradov S, Batrakova E, Kabanov A. Poly(ethylene glycol)-polyethyleneimine Nanogel (TM) particles: novel drug delivery systems for antisense oligonucleotides. Colloids Surf B: Biointerfaces. 1999;16(1-4):291-304. [ Links ]
100. Toita S, Sawada S, Akiyoshi K. Polysaccharide nanogel gene delivery system with endosome-escaping function: Co-delivery of plasmid DNA and phospholipase A2. J Controlled Release. 2011;155(1):54-59. [ Links ]
101. Murthy N, Xu M, Schuck S, Kunisawa J, Fréchet J. A macromolecular delivery vehicle for protein-based vaccines: Acid-degradable protein-loaded microgels. PNAS. 2003;100(9):4995-5000. [ Links ]
102. Ping L, Zichao L, Liu P, Ningning G, Yifan M. Bioreducible alginate-poly(ethylenimine) nanogels as an antigen-delivery system robustly enhance vaccine-elicited humoral and cellular immune responses. J Controlled Release. 2013;168(3):271-279. [ Links ]
103. Shimizu T, Kishida T, Hasegawa U, Ueda Y, Mazda O. Nanogel DDS enables sustained release of IL-12 for tumor immunotherapy. Biochem Biophys Res Commun. 2008;367(2):330-335. [ Links ]
104. Démoulins T, Bassi I, Thomann-Harwood L, Jandus C, McCullough KC. Alginate-coated chitosan nanogel capacity to modulate the effect of TLR ligands on blood dendritic cells. Nanomed: Nanotechnol, Biol Med. 2013;9(6):806-817. [ Links ]
105. Karg M, Hellweg T. Smart inorganic/organic hybrid microgels: Synthesis and characterization. J Mater Chem. 2009;(19):8714-8727. [ Links ]
106. Cai H, Yao P. In situ preparation of gold nanoparticle-loaded lysozyme-dextran nanogels and applications for cell imaging and drug delivery. Nanoscale. 2013;(5):2892-2900. [ Links ]
107. Jong-Bae C, Jong-Seok P, Myung-Seob K, Hui-Jeong G, Young-Chang N. Characterization and Antimicrobial Property of Poly(Acrylic Acid) Nanogel Containing Silver Particle Prepared by Electron Beam. Int J Mol Sci. 2013;(14):11011-11023. [ Links ]
108. Danhier F, Ansorena E, Silva J, Coco R, Préat V. PLGA-based nanoparticles: An overview of biomedical applications. J Controlled Release. 2012;161(2):505-522. [ Links ]
109. Hillaireau H, Couvreur P. Nanocarriers entry into the cell: relevance to drug delivery. Cell Mol Life Sci. 2009;(66):2873-2896. [ Links ]
110. Hans M, Lowman A. Biodegradable nanoparticles for drug delivery and targeting. Curr Opin Solid State Mater Sci. 2002;6(4):319-327. [ Links ]
111. Rodríguez I, Domínguez C, Escobar J, Ganem A, Quintanar D. Nanoparticle infiltration to prepare solvent-free controlled drug delivery systems. Int J Pharm. 2009;371(1-2):177-181. [ Links ]
112. Domínguez C, Rodríguez I, Escobar J, Quintanar D, Ganem A. Preparation and characterization of triclosan nanoparticles intended to be used for the treatment of acne. Eur J Pharm Biopharm. 2011;79(1):102-107. [ Links ]
113. Ganem A, Quintanar D, Buri P. Monoolein: A Review of the Pharmaceutical Applications. Drug Dev Ind Pharm. 2000;26(8):809-820. [ Links ]
114. Tamayo D, Ganem A, Martínez A, Rodríguez S, Quintanar D. Evaluation of the enhanced oral effect of omapatrilat-monolein nanoparticles prepared by the emulsification-diffusion method. J Nanosci Nanotechnol., 2006:6(9-10):3134-3138. [ Links ]
115. Wanakule P, Liu G, Fleury A, Roy K. Nano-inside-micro: Disease-responsive microgels with encapsulated nanoparticles for intracellular drug delivery to the deep lung. J Controlled Release. 2012;(162):429-437. [ Links ]
116. Murphy E, Majeti B, Mukthavaram R. Targeted Nanogels: A versatile Platform for Drug Delivery to Tumors. Mol Cancer Ther. 2011;(10):972-982. [ Links ]
117. Khurana S, Bedi P, Jain N. Preparation and evaluation of solid lipid nanoparticles based nanogel for dermal delivery of meloxicam. Chem Phys Lipids. 2013;(175-176):65-72. [ Links ]
118. Kazakov S, Levon K. Liposome-Nanogel Structures for Future Pharmaceutical Applications. Curr Pharm Des. 2006;(12):4713-4728. [ Links ]
119. Elnaggar Y, El-Refaie W, El-Massik M, Abdallah O. Lecithin-based nanostructured gels for skin delivery: An update on state of art and recent applications. J Controlled Release. 2014;(180):10-24. [ Links ]
120. Yang Y, Song Q, Gao K, Ma H, Li T. LaF3 : Eu3+ nanocrystal/PNIPAAm nanogels: Preparation, thermosensitive fluorescence performance and use as bioprobes for monitoring drug release. J Appl Polym Sci. 2014;131(4). [ Links ]
121. Sankar R, Seeni K, Samanta D, Jithendra P, Jaisankar S. The pH-sensitive polyampholyte nanogels: Inclusion of carbon nanotubes for improved drug loading. Colloids Surf B. 2013;(112):120-127. [ Links ]
122. Yale Scientific. Nanoscale "smart bombs": A two-in-one attack on cancer. 2013. http://www.yalescientific.org/2013/04/nanoscale-smart-bombs-a-two-in-one-attack-on-cancer/. Acceso 20 Jul 2014. [ Links ]
123. Alpar H, Somavarapu S, Atuah K, Bramwell V. Biodegradable mucoadhesive particulates for nasal and pulmonary antigen and DNA delivery. Adv Drug Deliv Rev. 2005;57(3):411-430. [ Links ]
124. Chowdary K, Rao Y. Mucoadhesive microspheres for controlled drug delivery. Biol Pharm Bull. 2004;27(11):1717-1724. [ Links ]
125. Peppas N, Huang Y. Nanoscale technology of mucoadhesive interactions. Adv Drug Deliv Rev. 2004;56(11):1675-1687. [ Links ]














