Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.45 no.1 Ciudad de México ene./mar. 2014
Trabajo científico
Marcador molecular de actinomicetos utilizado para detectar micobacterias en muestras de esputo
Actinomycetes molecular marker used for detecting mycobacteria in sputum samples
Adrian Zaragoza Bastida,1 Miguel Ángel Karam Calderón,1 Lilia Patricia Bustamante Montes,1 Ángel Horacio Sandoval Trujillo,2 Ninfa Ramírez Durán1
1 Facultad de Medicina, Universidad Autónoma del Estado de México.
2 Departamento de Sistemas Biológicos. Universidad Autónoma Metropolitana-Xochimilco.
Correspondencia:
Dra. Ninfa Ramírez Durán
Facultad de Medicina. Universidad Autónoma del Estado de México.
Paseo Tollocan s/n esquina con Jesús Carranza, C.P. 50180,
Toluca, Estado de México.
Teléfono (01722) 2773326
e-mail: nramirezd@uaemex.mx
Fecha de recepción: 07 de octubre de 2013
Fecha de recepción de modificaciones: 03 de abril de 2014
Fecha de aceptación: 05 de mayo de 2014
Resumen
La tuberculosis es una enfermedad crónica diagnosticada por baciloscopía. En 1992, Roller y col. identificaron un marcador molecular característico de bacterias Gram positivas con alto contenido de guanina y citosina. El objetivo de este artículo fue amplificar este marcador molecular en muestras de esputo para detectar la presencia de micobacterias. Se recolectaron 28 muestras de esputo, se les amplificó el marcador molecular, se inocularon en los medios de cultivo Lowenstein-Jensen y Stonebrink y a las cepas aisladas se les amplificó el gen rRNA 16S para su identificación. Seis muestras amplificaron el marcador molecular. Cinco cepas tuvieron una semejanza del 100% con el complejo tuberculosis y una cepa 99% con Mycobacterium conceptionense. Con la amplificación del marcador molecular, se logró detectar la presencia de micobacterias en muestras de esputo.
Palabras clave: Tuberculosis, marcador molecular, muestras de esputo, micobacterias.
Abstract
Tuberculosis is a chronic disease diagnosed by smear. In 1992, Roller et al. identified a molecular marker characteristic of Gram-positive bacteria with high content of guanine and cytosine. The aim of this article was to amplify the molecular marker in sputum samples to detect mycobacteria. Were collected 28 sputum samples, were amplified molecular marker, the samples were inoculated into the culture media and Stonebrink Lowenstein-Jensen and isolates were ampliied 16S rRNA gene for identification. Six samples amplified molecular marker. Five strains had 100% similarity with tuberculosis complex and one strain had 99% similarity with Mycobacterium conceptionense. With molecular marker amplification was possible detect the presence of mycobacteria in sputum samples.
Key words: Tuberculosis, molecular marker, sputum samples, mycobacteria.
Introducción
Los actinomicetos son bacterias Gram positivas, con alto contenido de guanina y citosina (HGC), presentan filamentos ramificados que pueden fragmentar en estructuras cocoidales o bacilares.1 Los géneros de este grupo de bacterias son muy diversos e incluyen algunos patógenos para el hombre, los más importantes son: Corynebacterium, Nocardia, Rhodococcus, Gordonia, Tsukamurella, Actinomadura y Mycobacterium2 Los géneros antes mencionados incluyen especies responsables de enfermedades como Actinomicetoma,3 Actinomicosis y la Tuberculosis.4,5 La tuberculosis (TB) es una enfermedad de evolución crónica que persiste en la población humana, el agente causal de esta enfermedad es Mycobacterium tuberculosis, especie perteneciente a la Familia Mycobacteriaceae y al Orden de los Actinomycetales.4 Actualmente, uno de los principales problemas para disminuir la incidencia de esta enfermad es el diagnóstico.6
El diagnóstico de la tuberculosis pulmonar se realiza en primera instancia por medio de la tinción de Ziehl-Neelsen para la búsqueda de bacilos ácido alcohol resistentes (BAAR), sin embargo este método es muy criticado debido a su baja sensibilidad.7 Con la incorporación de la biología molecular en el diagnóstico de la TB, se han buscado metodologías que permitan hacer más eficiente el diagnóstico de esta enfermedad ya que de este resultado depende el tratamiento adecuado para el paciente.6
Actualmente con el crecimiento de la investigación genética, se han desarrollado herramientas importantes, como los marcadores moleculares, para la identificación y clasificación de bacterias. Los marcadores moleculares se definen como fragmentos de una secuencia de DNA que están asociados a un genoma y estos son utilizados para identificar una secuencia de DNA en particular.8 Los marcadores moleculares relacionados a una característica específica son de particular interés porque permiten identificar individuos que contengan esa característica y diferenciarlos de los que no la posean, es decir que dan información sobre la diversidad genética.9
Sin embargo en la identificación de cepas bacterianas, el gen más utilizado es el rRNA 16S, debido a que está distribuido universalmente en las bacterias, es estable, conservado y tiene una longitud adecuada, con el análisis de la secuencia de este gen es posible conocer el género y la especie de las bacterias.10
En 1992, Roller y col. identificaron un "inserto específico" de 100 pares de bases (pb) situado en el gen rRNA 23S característico de bacterias Gram positivas con HGC, el cual es considerado un marcador molecular este marcador ha sido localizado en 64 especies de actinomicetos tales como, Actinomyces suis, Corynebacterium callunae, Nocardia caccinii y Mycobacterium gordonae entre otras.11 De acuerdo a los resultados reportados por Roller y col., las especies que presentaron el marcador molecular amplificaron un fragmento de ±350 pb (actinobacterias) y las especies carentes de este marcador amplificaron ±250 pb (eubacterias).
En otros estudios, diferentes autores han utilizado la presencia del marcador molecular con diferentes propósitos. Maunuksela y col. 1999, aislaron cepas a partir de raíces de plantas, utilizaron el marcador molecular para seleccionar bacterias Gram positivas de HCG y por medio de la reacción en cadena de la polimerasa (PCR) e iniciadores específicos para el género Frankia, así confirmaron que las bacterias seleccionadas pertenecían a este género.12 Matsumoto y col. 2006 describieron una metodología que les permitió aislar bacterias del suelo y seleccionar solo bacterias Gram positivas con HGC por medio del marcador molecular de 100 pb.13
El marcador molecular se ha utilizado para caracterizar nuevas especies bacterianas, que tienen altas probabilidades de pertenecer al grupo de los actinomicetos tal es el caso Oryzihumus leptocrescens bacteria Gram positiva con HGC en la cual está presente el marcador molecular de 100 pb a diferencia de Conexibacter woesei bacteria Gram positiva con HGC en la cual está ausente el marcador molecular.14,15
Por otro lado el estudio realizado por Hinrikson y col. 2000 demuestra que el marcador molecular puede ser utilizado con fines de diagnóstico, ya que analizaron su presencia en diferentes aislamientos de bacterias asociadas a la enfermedad de Whipple, para proponerlo como una alternativa de diagnóstico en conjunto con una PCR específica para Tropheryma whippelii, agente causal de dicha enfermedad.16 Por su parte Ramírez y col. 2006 utilizaron el marcador molecular como un criterio de purificación en la preparación de DNA de actinomicetos.17
El objetivó de este artículo fue detectar el marcador molecular inserto en el gen rRNA 23S de bacterias Gram positivas con HGC, presentes en muestras de esputo de pacientes con cuadros clínicos asociados a TB, para detectar la presencia de micobacterias.
Material y método
Pacientes
En este estudio se incluyeron pacientes adscritos a 5 clínicas del Instituto Mexicano del Seguro Social (IMSS) del Estado de México, los cuales accedieron a participar firmando una carta de consentimiento informado.
Criterios de inclusión
Pacientes adscritos al IMSS del Estado de México con un cuadro clínico asociado a TB y diagnosticados positivos a TB por BAAR, quienes al firmar la carta de consentimiento informado estuvieron de acuerdo en participar en el estudio aportando cuando menos una muestra de esputo antes de iniciar un tratamiento con antifímicos.
Criterios de no inclusión
Pacientes adscritos al IMSS del Estado de México con un cuadro clínico asociado a TB y diagnosticados negativos a TB por BAAR. Pacientes que no firmaron la carta de consentimiento informado. Pacientes que no aportaron muestra de esputo antes de iniciar su tratamiento. Pacientes que cumplieron con las características de los criterios de inclusión, excepto que hubieran iniciado un tratamiento con antifímicos.
Obtención de muestras
Se recolectaron 28 muestras de esputo de pacientes con cuadros clínicos asociados a tuberculosis, los cuales incluían: fiebre, diaforesis, disnea, tos productiva hemoptoica por más de dos semanas y en algunos casos pérdida de peso. Todos los pacientes habían sido diagnosticados como positivos a TB por baciloscopia. Estando los pacientes en estado de ayuno, se recolectaron las muestras en frascos estériles de boca ancha de aproximadamente 5 mL, rotulándolos con la información del paciente.
Procesamiento de la muestra
Para observar la presencia de bacilos ácido alcohol resistentes (BAAR), a las muestras colectadas se les realizó la tinción de Ziehel-Neelsen antes y después de ser sometidas a un proceso de descontaminación.18 Con la finalidad hacer una licuefacción de los restos orgánicos y disminuir la carga bacteriana de las muestras se les realizó una descontaminación utilizando la técnica de N-acetil-L-cisteína-NaOH.19
Amplificación del marcador molecular presente en el gen rRNA 23S
A las muestras ya descontaminas se les realizó la extracción de DNA utilizando el Kit comercial Wizard Genomic DNA Purification (Promega A1120). Se amplificó el marcador molecular de 100 pb localizado en el gen rRNA 23S según la metodología descrita por Roller y col.,11 los iniciadores utilizados fueron:
23S Insf, 5'-(AC)A(AGT)GCGTAG(AGCT)CGA(AT)GG-3' y
23S InsR 5'-GTG(AT)CGGTTT(AGCT)(GCT)GGTA-3'.
La reacción se llevó a cabo utilizando la enzima Taq DNA polimerasa comercial (Promega M1661). Las condiciones en el ciclo térmico fueron: un ciclo de pre-desnaturalización durante 5 minutos (94 °C); desnaturalización, 30 segundos (94 °C); acoplamiento, 45 segundos (46 °C); elongación, 50 segundos (72 °C); repetir 29 ciclos y un ciclo de post elongación de 5 minutos a (72 °C). Los fragmentos amplificados se observaron en un gel de agarosa al 2% teñido con bromuro de etidio (SIGMA 46065).
Aislamiento de micobacterias
Las 28 muestras descontaminadas fueron inoculadas en los medios selectivos para el aislamiento y cultivo de microbacterias.
Los medios utilizados fueron: Lowenstein-Jensen (BD BBL 0196675) y Stonebrink (BD BBL 220504),19 los medios se incubaron a 37 °C por 12 semanas y se revisaron periódicamente cada 7 días, debido a que algunas bacterias Gram positivas de HGC son de crecimiento lento. El aspecto y pigmentación se consideraron criterios de selección morfológica para las colonias aisladas. Para comprobar la presencia de BAAR, a las colonias observadas se les realizó la tinción de Ziehel-Neelsen. Las colonias observadas fueron purificadas en cajas Petri con medio Middlebrook 7H10 agar (DIFCO, USA) con enriquecimiento OADC (BD BBL 212351), el cual aporta los nutrientes necesarios para el desarrollo y conservación de micobacterias. La incubación se llevo a cabo a 37 °C.
Amplificación del gen rRNA 16S
Para la obtención de biomasa las cepas fueron inoculadas en medio liquido Middlebrook 7H9 (DIFCO, USA). Se realizó la extracción de DNA a las cepas aisladas utilizando el Kit comercial Wizard Genomic DNA Purification (Promega A1120). Se amplificó el gen rRNA 16S a las cepas aisladas, los iniciadores utilizados fueron:
8f: AGAGTTTGATCMTGGCTCAG y
1492r: TACGGYTACCTTGTTACGACTT.
La reacción se llevó a cabo utilizando la enzima Taq DNA polimerasa comercial (Promega M1661). Las condiciones en el ciclo térmico fueron: un ciclo de pre-desnaturalización, 5 minutos (94 °C); desnaturalización, 30 segundos (94 °C); acoplamiento, 20 segundos (52 °C); elongación 1:30 minutos (72 °C). Los fragmentos amplificados se observaron en un gel de agarosa al 1% teñido con bromuro de etidio (SIGMA 46065). Los productos de esta amplificación fueron purificados utilizando el kit® Amicon Ultra filter (Millipore UFC901008), se observaron en un gel de agarosa al 1% para verificar su presencia y calidad.
Identificación de especies de Mycobacterium sp
Los productos amplificados del gen rRNA 16S fueron enviados al servicio de secuenciación de Macrogen Sequenciation Service, Maryland USA.
Las secuencias obtenidas fueron analizadas y corregidas utilizando el programa BioEdit,20; se construyeron secuencias consenso a partir de los fragmentos forward y reverse, las cuales fueron comparadas con secuencias ya depositadas en el GenBank del Centro Nacional de Información Biotecnológica (NCBI) por medio el programa BLAST.21
Resultados y discusión
Procesamiento de la muestra
Se observaron bacilos acido alcohol resistentes (BAAR) antes y después del proceso de descontaminación en 24 muestras de las 28 colectadas. Se observó una disminución de BAAR en seis muestras después de ser sometidas al proceso de descontaminación (Tabla 1).
Amplificación del marcador molecular a la muestra
Se observó la amplificación de dos bandas (±250 y ±350 pb) en seis muestras y una banda de 250 pb en las 22 muestras restantes (Tabla 1 y Figura 1).
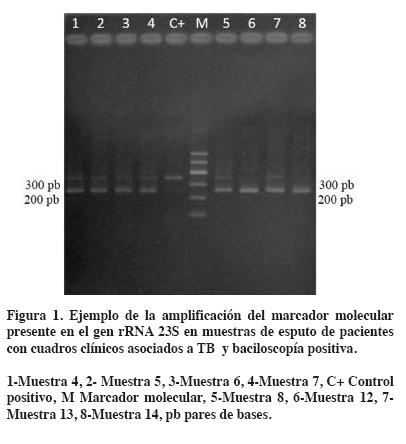
Aislamiento de micobacterias
Se observó crecimiento bacteriano en las seis muestras que amplificaron las dos bandas (±250 y ±350 pb), a las cuales se le amplificó el gen rRNA 16S. En las 22 muestras restantes que amplificaron ±250 pb no se observó crecimiento bacteriano en los medios de cultivo después de 12 semanas de incubación.
Las seis cepas aisladas fueron positivas a la tinción de Ziehl Neelsen, en cinco cepas se observó un crecimiento después de 14 días de incubación y en la restante se observó crecimiento a los 7 días de incubación. Las seis cepas tenían un aspecto seco, no presentaron pigmentación y fueron recuperadas a partir del medio Stonebrink, solo una cepa creció en ambos medios (Stonebrink y Lowenstein Jensen). Las seis cepas desarrollaron crecimiento en Middlebrook sólido y líquido.
Identificación de especies de Mycobacterium sp
Se obtuvieron secuencias consenso de aproximadamente 1400 pb, las cuales al ser comparadas con las secuencias depositadas en el GenBank a través del programa Blast, se observó que cinco de ellas tuvieron una semejanza de 100% con los integrantes del complejo tuberculosis (M. tuberculosis, M bovis, M. africanum, M. microti y M. canetti); la secuencia restante tuvo un 99% de semejanza con M. conceptionense.
El marcador molecular descrito por Roller y col. 1992 se ha utilizado en diferentes investigaciones en el estudio de los actinomicetos.
Nuestros resultados en la identificación de las seis cepas por medio del análisis de la secuencia de gen rRNA 16S indican que cinco tuvieron una semejanza del 100% con los integrantes del complejo tuberculosis y una cepa una semejanza del 99% con Mycobacterium conceptionense, por lo que la utilización del marcador molecular presente en el gen rRNA 23S nos permitió identificar las muestras en las que existía mayor probabilidad de contener micobacterias ya que en las 22 muestras que no lo amplificaron, no se observó crecimiento bacteriano, a pesar de que contenían bacilos ácido-alcohol resistentes.
La metodología descrita en este artículo se propone como un protocolo de análisis de muestras de esputo con posible presencia de micobacterias (Figura 2). Otras metodologías que han surgido con la biología molecular y que están siendo utilizadas en pruebas de diagnóstico de micobacterias, como los fragmentos de restricción de longitud polimórfica (RFLP) dirigidos a las secuencias de inserción (IS) IS6110, se llevan a cabo a partir de cepas aisladas.8 El protocolo que proponemos en este artículo inicia con la búsqueda de un marcador molecular desde la muestra de esputo; si el marcador molecular no está presente en la muestra, se puede detener el proceso de aislamiento e identificación orientado hacia la búsqueda de bacterias Gram positivas de HGC. El protocolo propuesto resulta ser más preciso cuando se complementa con una basiloscopía y un medio selectivo para el aislamiento de micobacterias, si a este nivel de desarrollo del protocolo los resultados son negativos tenemos argumentos para descartar la muestra de esputo de un proceso de búsqueda e identificación de micobacterias.

Conclusión
Con la amplificación del marcador molecular inserto en el gen rRNA 23S de bacterias Gram positivas con alto contenido de guanina y citosina, se logró detectar en muestras de esputo la presencia de micobacterias ya que se recuperaron seis cepas del género Mycobacterium, cinco con una semejanza del 100% con los integrantes del complejo tuberculosis y una cepa con una semejanza del 99% con Mycobacterium conceptionense.
Agradecimientos
Al Instituto Mexicano del Seguro Social del Estado de México, por su apoyo en el desarrollo de esta investigación.
Referencias
1. Hidrin N, Goodfellow M, Boiron P, Moreno M, Serrano JA. Los estreptomices: Actualización y revisión didáctica. Rev Soc Ven Microbiol. 2001; 21:36-8. [ Links ]
2. Serrano José Antonio y Sandoval Ángel Horacio. Identificación y Diagnóstico de Actinomicetales Patógenos. Universidad de los Andes, Vicerrectorado Académico. Editorial Venezolana C.A. 2005. [ Links ]
3. Rodríguez-Nava V, Couble A, Molinard C, Sandoval H, Boiron P, Laurent F. Nocardia mexicana sp. nov., a New Pathogen Isolated from Human Mycetomas. J Clin Microbiol. 2004; 42(10):4530-5. [ Links ]
4. Huang C, Turki A. Actinomycosis of the urinary blader. Can Urol Assoc J. 2013; 7(5-8). [ Links ]
5. Lawn SD, Zumia AI. Tuberculosis. Lancet. 2011; 378(9785):57-72. [ Links ]
6. Ponce de León A. Revolución en el control de la tuberculosis. Salud Pública Mex. 2007; 49:208-10. [ Links ]
7. Steingart KR, Ng V, Henry M, Hopewell PC, Ramsay A, Cunningham J, et al. Sputum processing methods to improve the sensitivity of smear microscopy for tuberculosis: a systematic review. Lancet Infect Dis. 2006; 6(10):664-74. [ Links ]
8. Acosta SR, Estrada CC, Milián SF. Tipificación de cepas de Mycobacterium bovis. Tec Pecu Mex. 2009; 47(4): 389-412. [ Links ]
9. Liu W, Li L, Khan MA, Zhu F. Popular molecular markers in bacteria. Mol Gen Mikrobiol Virusol. 2012; 3:14-7. [ Links ]
10. Clarridge JE. Impact of 16S rRNA Gene Sequence Analysis for Identification of Bacteria on Clinical Microbiology and Infectious Diseases. Clin Microbiol Rev. 2004; 17(4):840-62. [ Links ]
11. Roller C, Ludwig W, Schleifer K. Gram-positive bacteria with a high DNA G+C content are charaterized by a common insertion within their 23s rRNA genes. J Gen Mocrobiol. 1992; 138:1167-75. [ Links ]
12. Maunuksela L, Zepp K, Koivula T, Zeyer J, Haahtela K, Hahn D. Analysis of Frankia populations in three soils devoid of actinorhizal plants. FEMS Micro Ecol. 1999; 28(1):11-21. [ Links ]
13. Matsumoto A, Takahashi Y, Iwai Y, Omura S. Isolation of Gram-positive Bacteria with High G+C from Inside Soil Aggregates. Actinomycetologica. 2006; 20(2):30-4. [ Links ]
14. Kageyama A, Takahashi Y, Seki T, Tomoda H, Ōmura S. Oryzihumus leptocrescens gen. nov., sp. nov. Int J Syst Evol Microbiol. 2005; 55(6):2555-9. [ Links ]
15. Monciardini P, Cavaletti L, Schumann P, Rohde M, Donadio S. Conexibacter woesei gen. nov., sp. nov., a novel representative of a deep evolutionary line of descent within the class Actinobacteria. Int J Syst Evol Microbiol. 2003; 53(2):569-76. [ Links ]
16. Hinrikson HP, Dutly F, Altwegg M. Analysis of the actinobacterial insertion in domain III of the 23S rRNA gene of uncultured variants of the bacterium associated with Whipple's disease using broad-range and 'Tropheryma whippelii'-specific PCR. Int J Syst Evol Microbiol. 2000; 50(3):1007-11. [ Links ]
17. Ramírez-Durán N, Ramírez-Saad H, Melgoza-Contreras LM, Sandoval H. Amplification of the specific insertion in the rRNA 23S gene, as a criterion of purity in preparation of actinomycetes DNA. J Med Mycol. 2006; 16(1):26-9. [ Links ]
18. Organización Panamericana de la Salud. Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y guía técnica. Parte I Baciloscopía. 2008. 1-100. [ Links ]
19. Organización Panamericana de la Salud. Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y guía técnica. Parte II Cultivo. 2008. 1-103. [ Links ]
20. Hall TA. BioEdit: a user friendly biological sequence alignment editor analysis program for Windows 95/98/NT. Nucleic Acids Symp Ser. 1999; 41(41):95-8. [ Links ]
21. Zhang Z, Schwartz S, Wagner L, Miller W. A greedy algorithm for aligning DNA sequences. J Comp Biol. 2000; 7(1-2):203-14. [ Links ]














