Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.4 Ciudad de México oct./dic. 2013
Trabajo científico
Estudios preliminares sobre la actividad hipoglicémica y antihiperlipidemica de nanomatrices de TiO2 con extracto de Stevia rebaudiana bertoni en ratas diabéticas inducidas con aloxano
Hypoglucemic and antihyperlipidemic activity of TiO2 nanostructured-conjugated Stevia rebaudiana bertoni in a model of diabetes mellitus in rats
Alfonso Díaz,1 Oscar Villegas,1 Alejandra Castro Lino,3 Samuel Treviño,4 Genaro Carmona-Gutiérrez,2 Marco Antonio González-Coronel,1 José Albino Moreno-Rodríguez2
1 Departamento de Farmacia, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla
2 Departamento de Química General, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla
3 Departamento de Química Bioinorgánica, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla
4 Laboratorio de Investigaciones Químico-Clínicas. Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla
Correspondencia:
MC. Marco Antonio González Coronel
Departamento de Farmacia
Facultad de Ciencias Químicas
Benemérita Universidad Autónoma de Puebla
14 sur y Av. San Claudio, Colonia San Manuel, CP.
72570, Puebla, México
Tel: 2295500. Ext. 7549
e-mail: marantglezcor_10@hotmail.com
Fecha de recepción: 29 de abril de 2013
Fecha de recepción de modificaciones: 29 de agosto de 2013
Fecha de aceptación: 9 de octubre de 2013
Resumen
Actualmente, la nanotecnología farmacéutica se enfoca al desarrollo de formulaciones de agentes terapéuticos en nanocomplejos biocompatibles como las nanomatrices. En este proyecto se evaluó el efecto antidiabético de las nanomatrices de óxido de titanio (TiO2) con extracto de Stevia rebaudiana bertoni (TiO2-SrB), una planta con propiedades hipoglucemiantes y antihiperlipidemicas en ratas diabéticas inducidas con aloxano (200 mg/kg, ip). Los resultados muestran la disminución significativa en la concentración de glucosa desde las 24 horas y hasta los 30 días posteriores a la administración de TiO2-SrB. Así mismo, la concentración de insulina, hemoglobina glicosilada, colesterol y triglicéridos mostraron una recuperación significativa a sus niveles normales. Los resultados sugieren que las nanomatrices de TiO2-SrB muestran una actividad hipoglucemiante y antihiperlipidemica prolongada, considerándose como una opción terapéutica para la diabetes Mellitus (DM).
Palabras clave: Diabetes, Stevia rebaudiana, nanomatrices, hipoglucémico, antihiperlipidemico.
Abstract
Stevia Rebaudina Bertoni (SrB) is a plant with properties hypoglycemic and antihyperlipidemic. SrB has become a lead candidate for the treatment of Diabetes Mellitus (DM). Importantly, nanostructures in general and titanium dioxide (TiO2) in particular have become effective tools for drug delivery. This project evaluated antidiabetic effect of TiO2 nanostructured-conjugated SrB (TiO2-SrB) when given in animal model of DM. Male rats DM-phenotype was induced by alloxan (200 mg/kg, ip). The coadministration of TiO2-SrB induced a significant decrease in the glucose concentration at 24 hours and 30 days. Likewise, the concentrations of insulin, glycosylated hemoglobin, cholesterol, and triglycerides showed a significant recovery to basal levels. These results suggest that the TiO2-SrB has a potent activity and prolonged as hypoglycemic and antihyperlipidemic. TiO2-SrB can be considered as an effective treatment option for DM.
Key words: : Diabetes, Stevia rebaudiana, nanostructures, hypoglycemic, antihyperlipidemic.
Introducción
La Diabetes Mellitus (DM) es un trastorno metabólico crónico de múltiples etiologías, caracterizado por la hiperglucemia consecuencia de una alteración en la secreción y/o acción de la insulina, que además afecta el metabolismo de los lípidos y las proteínas.1 La importancia de esta patología deriva de su frecuencia y de sus complicaciones crónicas, constituyendo una de las principales causas de morbilidad y mortalidad prematura en la mayoría de los países desarrollados y sub-desarrollados.2
De acuerdo a la Federación Mexicana de Diabetes (FMD) en México la población con diabetes fluctúa entre los 6.5 millones y 10 millones. La prevalencia nacional de diabetes en personas de 20 a 79 años, en 2009 fue de 10.1%. La DM afecta actualmente a más de 285 millones de personas en el mundo y se espera que alcance los 438 millones en 2030 a menos que se tomen medidas preventivas urgentes.3
La medicina tradicional deriva principalmente de las plantas, las cuales actualmente, representan un potencial terapéutico para la DM.4,5 La organización mundial de la salud ha recomendado la evaluación del tratamiento con extractos de plantas medicinales para dicha patología, ya que son eficaces, con menos efectos secundarios y se considera que son excelentes candidatos para la terapia oral. Recientemente, se ha demostrado por estudios experimentales y clínicos, que muchas plantas poseen actividad hipoglucemiante así como una disminución o la nula aparición de alteraciones secundarias, propias de la enfermedad.6
La Stevia rebaudiana bertoni (SrB), conocida también como "hierba dulce", es una planta arbustiva perenne perteneciente a la familia Asteraceae que se propaga naturalmente en el noreste de Paraguay.7 Las hojas de SrB contienen aproximadamente el 4 - 15 % de steviosidos, los cuales han sido aislados y caracterizados por estudios químicos y espectrales.8, 9 Estos compuestos son intensamente dulces (150-300 veces más dulce que el azúcar) pero no son calorigénicos. Las hojas se han utilizado tradicionalmente desde hace cientos de años en Paraguay y Brasil para endulzar tés y como medicina tradicional.10
La SrB presenta diversas propiedades farmacológicas incluyendo la actividad antioxidante, antihipertensiva, antihiperlipidemica y cardiovascular.10,11 Recientes estudios han demostrado que la SrB estimula la secreción de insulina de las células β-pancreáticas y causa normoglicemias y normolipidemias en ratas diabéticas tratadas con aloxano.12, 13 En este sentido la SrB proporciona evidencia de su uso tradicional en el control de la DM. Sin embargo, se ha demostrado que se requieren administraciones continuas de SrB para causar el efecto normoglucemiante.14 Una manera de combatir este problema es desarrollar un sistema de liberación controlada de SrB, con la finalidad de reducir la dosis y hacer que la SrB esté disponible en los sitios diana y que su actividad sea prolongada. Una gran variedad de sistemas han sido desarrollados y utilizados, incluyendo liposomas, micelas, dendrímeros, y copolímeros.
Actualmente, los nanomateriales de óxido de titanio (TiO2) han llamado la atención como posibles sistemas de liberación.15 Las nanomatrices de TiO2, son químicamente inertes, hidrofílicas y de fácil síntesis, además de poseer alta resistencia mecánica y baja toxicidad.16 Recientemente han sido implantados en amígdala de ratas con epilepsia inducida mediante cirugía estereotáxica obteniendo resultados óptimos, encontrando que las matrices porosas de TiO2 liberan su contenido de forma controlada y por un periodo aproximado de 500 horas.17 En este sentido, nosotros realizamos la síntesis de las nanomatrices de TiO2 con el extracto de SrB para emplearlo como un sistema de liberación controlada del extracto. De ahí que el objetivo de este trabajo fue evaluar la actividad hipoglucemiante y la antihiperlipidemica de las nanomatrices de TiO2-SrB administradas por vía intraperitoneal en ratas diabéticas.
Material y método
Extracción del extracto de SrB
Las hojas de SrB se recolectaron en una zona suburbana de Paraguay y fueron autentificadas por el personal experto del jardín botánico de la Benemérita Universidad Autónoma de Puebla (BUAP). Las hojas de SrB se secaron (40° C), se pulverizaron y maceraron exhaustivamente con etanol al 96% (2:50, planta : solvente). Después de filtrar, el extracto se concentró a 65° C a través de un rotavapor. El producto concentrado fue empleado para formar las nanomatrices de TiO2-SrB.
Preparación de las nanomatrices de TiO2-SrB
En un sistema por reflujo con agitación constante y a una temperatura de 70° C, se preparó una solución homogénea con 150 mL de alcohol butílico, 10 mL de agua desionizada, 0.5 g de polivinilpirrolidona y 20 µL de estrato de SrB. A 70o C de reflujo se agregó (a la solución) gota a gota 21.5 mL de solución n-butóxido de titanio (97%, Sigma-Aldrich). La solución final con propiedades de gel se sumergió en un recipiente con hielo por 15 min a 3° C. Se elimina el solvente en un rotavapor a 50° C con vacío. Se obtiene las nanomatrices de TiO2-SrB.18
Las nanomatrices de TiO2-SrB se caracterizaron por espectroscopia UV - visible (UVVIS), espectroscopia infrarroja (FTIR), difracción de rayos X (DRX) y microscopia electrónica de barrido (SEM).
Animales
Se utilizaron ratas macho de la cepa Long Evans (n = 21) proporcionadas por el Bioterio Claude Bernard de la BUAP. El rango de peso fue de 300 a 400 gramos. El uso y cuidado de los animales se realizó en concordancia con lo establecido en la norma 062-ZOO-1999, a los ordenamientos establecidos en la guía National Research Counsel (NRC) y al comité de investigación de usos de animales de laboratorio de la BUAP.
Protocolo de administración
Se formaron tres grupos experimentales (n = 7 por grupo): 1) Control + nanomatrices de TiO2 vacías (Control + TiO2); 2) Aloxano + nanomatrices de TiO2 vacías (Aloxano + TiO2) y 3) Aloxano + nanomatrices de TiO2 con SrB (Aloxano + TiO2-SrB).
El aloxano (200 mg / kg en buffer de citratos 0.1 M, pH 4.5) se administró por vía intraperitoneal (i.p.) durante tres días consecutivos previo a la administración de las nanomatrices. La dosis de aloxano fue seleccionada en base a diversos reportes.12,20
Finalizada la administración de aloxano se tomaron muestras de sangre y se determinaron los niveles de glicemia. Los animales que presentaron concentraciones mayores a 150 mg / dL de glucosa se consideraron como diabéticos.
Posteriormente, las nanomatrices vacías (1g / Kg, en agua estéril a 37° C) y con SrB (1g / Kg, en agua estéril a 37° C) se administraron por vía i.p. respectivamente.
Para evaluar el curso temporal del efecto hipoglucemiante de las nanomatrices con SrB, se determinaron los niveles de glucosa en sangre a las 0, 4, 8, 16 y 24 horas, así como a los 4, 8 16, 20, 24 y 30 días después la administración de cada uno de los tratamientos respectivos, con previo ayuno de 8 horas. La determinación de glucosa se desarrolló mediante el uso de un glucómetro digital (marca ACCU-CHEK active), basándose en la reacción glucosa oxidasa/peroxidasa.
Evaluación del efecto de las nanomatrices de TiO2 con Stevia sobre la hiperglicemia e hiperlipidemia inducida por aloxano
Trascurridos 31 días de la administración de TiO2 y TiO2-SrB, los animales de cada grupo experimental fueron sacrificados por dislocación y por punción cardiaca se recolectaron muestras de sangre para cuantificar glucosa, insulina, hemoglobina glicosilada, colesterol y triglicéridos. Las muestras colectadas fueron centrifugadas a 3.000 rpm durante 5 minutos. Las determinaciones séricas fueron determinadas por los métodos enzimáticos colorimétricos respectivos siguiendo los protocolos marcados por el proveedor según las técnicas específicas para cada determinación con reactivos BioSystem y analizadas en un espectrofotómetro semiautomatizado (RA-50 de Bayer).
Análisis estadístico
Las datos fueron expresados como la media ± el error estándar de la media (ESM) para todos los experimentos.
El análisis estadístico se desarrolló, por medio de una ANOVA de una vía y un nivel de confianza de 95% y cuando fue necesario, se compararon las medias aplicando la prueba de Bonferroni.
Resultados y discusión
En el presente estudio se abordó el efecto hipoglucemiante y antihiperlipidemico de las nanomatrices de TiO2-SrB en un modelo animal de DM inducido con aloxano, el cual es un agente tóxico, que al ser administrado en roedores genera cambios metabólicos similares a la DM. De tal manera que el aloxano se emplea como un diabetogénico experimental para evaluar la efectividad de nuevos fármacos con propiedades hipoglucemiantes.19, 20
La evaluación de la glucemia y la lipidemia determina el grado de daño metabólico que existe en los animales de experimentación. Los resultados del presente trabajo, muestran que el tratamiento con TiO2-SrB ocasionó un efecto hipoglucemiante y antihiperlipidemico en las ratas diabéticas inducidas con aloxano, respecto al grupo administrado con aloxano + TiO2. Por otra parte, el grupo administrado con el vehículo + TiO2 mostró concentraciones de glucosa y lípidos dentro de los valores considerados fisiológicamente normales para los animales de experimentación.
En la figura 1A se muestra la concentración de glucosa de ratas diabéticas después de 0, 4, 8 y 12 horas de la administración del TiO2-SrB. Los resultados indican que no existe diferencia significativa entre el grupo tratado con aloxano + TiO2 y aloxano + TiO2-SrB.
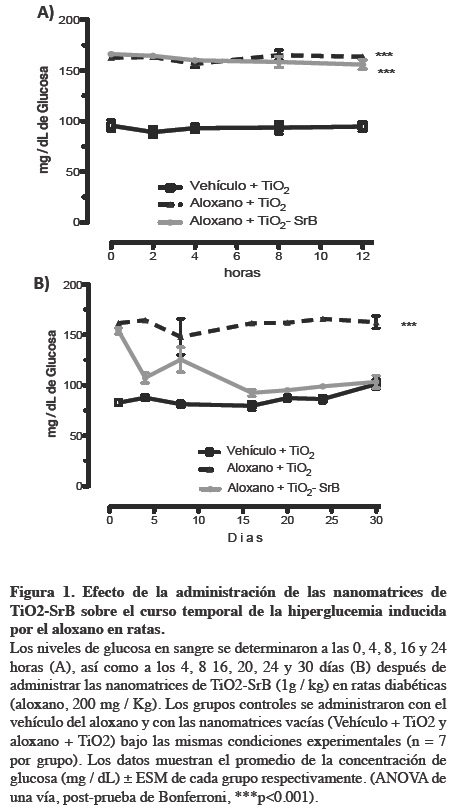
Por otra parte, al comparar la concentración de glucosa a los 1, 4, 8, 16, 20, 24 y 30 días en las ratas con aloxano después de la administración de TiO2-SrB, se observa una disminución del 7, 16, 78, 86, 93, 97 %, respectivamente, cuando se compara con el grupo de aloxano + TiO2 (Figura 1B). Una disminución que resulta significativa a partir de las 24 horas posteriores al inicio del tratamiento, observando el efecto hipoglucémico durante los 30 días posteriores a la administración de TiO2-SrB (ANOVA de una vía, post-prueba de Bonferroni, p<0.05).
Como se ha demostrado, el aloxano es una toxina especifica que destruye las células β-pancreáticas,20 provocando que la insulina secretada no sea suficiente para regular la glucosa en sangre, de ahí que los estudios de laboratorio desarrollados 31 días después de la administración de los tratamientos indican el aumento significativo en la concentración de glucosa (51%) del grupo con aloxano + TiO2 respecto al grupo control + TiO2 (Figura 2 A y B). En consecuencia la concentración de la hemoglobina glicosilada del grupo aloxano + TiO2 resultó mayor (38 %) respecto al grupo control + TiO2 (Figura 2 C) (ANOVA de una vía, post-prueba de Bonferroni, p<0.05).

Por otra parte, los animales del grupo de aloxano + TiO2-SrB presentaron una menor concentración de glucosa (57 %) y hemoglobina glicosilada (28 %) respecto al grupo con aloxano + TiO2 (Figura 2 A y C), asimismo el grupo con aloxano + TiO2-SrB registró una concentración mayor de insulina respecto al grupo con aloxano + TiO2 (Figura 2B). (ANOVA de una vía, post-prueba de Bonferroni, p<0.05). Esto demuestra por primera vez que las nanomatrices de TiO2-SrB revierten el efecto hiperglicemico que ocasiona el aloxano, debido a que los parámetros bioquímicos evaluados (glucosa, hemoglobina glicosilada e insulina) son estadísticamente similares al grupo control + TiO2.
Esta demostrado que el mecanismo de acción de la SrB es análogo a las sulfonilureas, debido a que bloquea los canales de K+ en las células β-pancreáticas, despolariza la membrana y promueve la apertura de los canales de Ca+2 dependientes de voltaje. En donde, el aumento de Ca+2 intracelular es crucial para inducir la secreción de insulina de las células β-pancreáticas y en consecuencia causar la disminución de la glicemia, hasta alcanzar valores biológicamente normales.21 En este sentido, es probable que el tratamiento que recibieron las ratas diabéticas con las nanomatrices de SrB estimuló de forma constante la secreción de insulina en las células β-pancreáticas remanentes. En consecuencia, la insulina resultante del tratamiento con SrB promovió la disminución en la concentración de la glucosa y la hemoglobina glicosilada en el plasma de los animales diabéticos.10
Por otra parte, los lípidos desempeñan un papel tóxico importante en la DM, generalmente la concentración de lípidos se incrementa en esta patología.1 En nuestros resultados se observa que el grupo administrado con aloxano + TiO2 mostró un incremento significativo en la concentración de colesterol (229 %) y triglicéridos (230 %), respecto al grupo control (Figura 3).
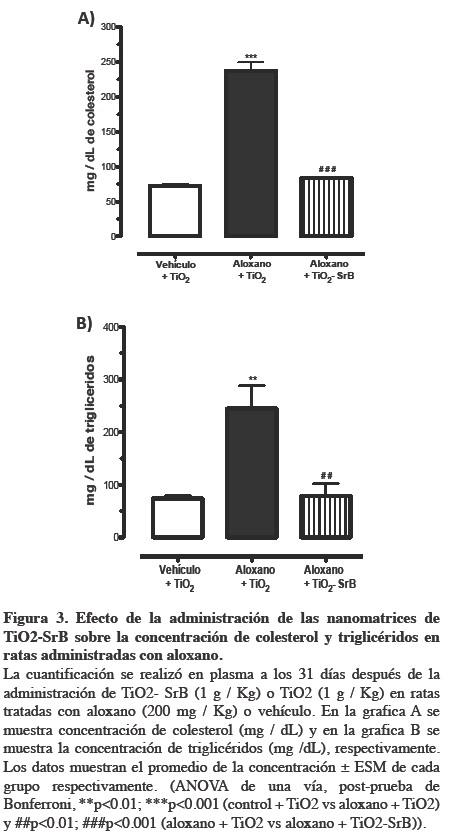
Por otra parte el tratamiento con las nanomatrices de TiO2-SrB, disminuyó la concentración de colesterol y triglicéridos en un 185 y 212 % respecto a los animales tratados con aloxano + TiO2. El análisis estadístico indicó una diferencia significativa (Figura 3). (ANOVA de una vía, post-prueba de Bonferroni, p<0.05).
Los resultados revelan que la administración de las nanomatrices de SrB normalizaron el perfil lipídico de las ratas diabéticas, lo que demuestra el efecto hipolipidémico de la SrB, sin embargo, el mecanismo molecular por el que ocurre dicho efecto se desconoce por el momento.22 Asimismo otros estudios indican que el SrB también ejerce efectos antioxidantes y antiapoptoticos.23, 24 Mecanismos que en conjunto contribuyen a potencializar el efecto terapéutico de la SrB.
Hasta el momento, el presente trabajó describe por primera vez los efecto de las nanomatrices de TiO2-SrB sobre la hiperglicemia e hiperlipidemia en ratas tratadas con aloxano. El empleo de un sistema de liberación controlada de SrB resulta eficaz para restaurar el metabolismo de los carbohidratos y lípidos en un modelo de DM. 25
Nuestros resultados abren una nueva oportunidad para el tratamiento de esta patología, sin embargo son necesarios más estudios para comprender mejor el uso potencial de las nanomatrices de TiO2-SrB en las enfermedades metabólicas.
Conclusiones
Los experimentos realizados indican que el tratamiento de las nanomatrices de TiO2-SrB podrían mejorar el metabolismo de los carbohidratos y lípidos a largo plazo en un modelo de DM en rata. Por lo que se sugiere, que estas nanomatrices poseen el potencial para ser empleados a futuro como un sistema de liberación de SrB en los pacientes con DM.
Agradecimientos
Al Dr. Carlos Escamilla Weinmann, director de bioterio Claude Bernard de la Benemérita Universidad Autónoma de Puebla, por haber proporcionado los animales de experimentación. Este trabajo fue apoyado parcialmente por la Dirección de la Facultad de Ciencias Químicas de la BUAP.
Referencias:
1. Skyler JS. Diabetes mellitus: Pathogenesis and treatment strategies. J Med Chem. 2004; 47:4113-4117. [ Links ]
2. World Health Organization. Genova: WHO. Diabetes. 2008; Fact sheet no. 312. [ Links ]
3. Mohan V, Sandeep R, Deepa R, Shah B, Varghese C. Epidemiology of type 2 diabetes: Indian scenario. Indian J Med Res. 2007; 125:217-230. [ Links ]
4. Laitiff AA, Teoh SL, Das S. Wound healing in diabetes mellitus: traditional treatment modalities. Clin Ter. 2010; 161(4):359-364. [ Links ]
5. Malviya N, Jain S, Malviya S. Antidiabetic potential of medicinal plants. Acta Pol Pharm. 2010; 67(2):113-118. [ Links ]
6. Suchy V, Zemlicka M, Svajdlenka E, Vanco J, Ceska Slov. Medicinal plants and diabetes mellitus. Farm. 2008; 57(2):78-84. [ Links ]
7. Soejarto DD, Kinghorn AD, Farnsworth NR. Potential sweetening agent of plant origin III: Organo leptic evaluation of Stevia leaf herbarium samples for sweetness. J Nat Prod. 1982; 45:590-599. [ Links ]
8. Starratt AN, Kirby CW, Pocs R, Brandle JE, Rebaudioside F. A diterpene glycoside from Stevia rebaudiana. Phytochemistry. 2002; 59:367-370. [ Links ]
9. Brandle J. Nature's Natural Low Calorie Sweetener. Canada: Agriculture and Agri-Food; 2004. FAQ- Stevia. [ Links ]
10. Oviedo CA, Fronciani G, Moreno R, Maas L. Hypoglycemic action of Stevia rebaudiana. Excerpta Med. 1970; 209:92-96. [ Links ]
11. Chan P, Xu DY, Liu JC, Chen YJ, Tomlinson B, Huang WP. The effect of stevioside on blood pressure and plasma catecholamines in spontaneously hypertensive rats. Life Sci. 1998; 63:1679-84. [ Links ]
12. Raskovic A, Gavrilovic M, Jakovljevic V, Sabo J. Glucose concentration in the blood of intact and alloxan-treated mice after pretreatment with comercial preparations of Stevia rebaudiana (Bertoni). Eur J Drug Metab Pharmacokinet. 2004; 29:87-90. [ Links ]
13. Chen TH, Chen SC, Chan P, Chu YL, Yang HY, Cheng JT. Mechanism of the hypoglycemic effect of stevioside, a glycoside of Stevia rebaudiana. Planta Med. 2005; 71:108-113. [ Links ]
14. Curry LL, Roberts A. Subchronic toxicity of rebaudioside A.Food Chem Toxicol. 2008; 46(7):11-20. [ Links ]
15. Barb C, Bartlett J, Kong L. Silica particles: A novel drug-delivery system. Adv Mater. 2004; 16:1959-1966. [ Links ]
16. Son SJ, Bai X, Lee SB. Inorganic hollow nanoparticles and nanotubes in nanomedicine Part 1. Drug/gene delivery applications. Drug Discov Today. 2007; 12:650-656. [ Links ]
17. López T, Bata-García JL, Esquivel D, Ortiz-Islas E, Gonzalez R, Ascencio J, Quintana P, Oskam G, Alvarez-Cervera FJ, Heredia-López FJ, Góngora-Alfaro JL. Treatment of Parkinson's disease: nanostructured sol-gel silica-dopamine reservoirs for controlled drug release in the central nervous system. Int J Nanomedicine. 2010; 6:19-31. [ Links ]
18. Lopez T, Ortiz E, Alvarez M, Navarrete J, Odriozola JA, Martinez-Ortega F, Páez Mozo EA, Escobar P, Espinoza KA, Rivero IA. Study of the stabilization of zinc phthalocyanine in sol-gel TiO2 for photodynamic therapy applications. Nanomedicine. 2010; 6(6):777-785. [ Links ]
19. Lenzen S, Panten U. Alloxan: History and mechanism of action. Diabetologia. 1988; 31:337-342. [ Links ]
20. Szkudelski T. The mechanism of alloxan and streptozotocin action in B-cells of the rat pancreas. Physiol Res. 2001; 50:537-46. [ Links ]
21. Jeppesen PB, Gregersen S, Poulsen CR, Hermansen K. Stevioside acts directly on pancreatic beta cells to secrete insulin: actions independent of cyclic adenosine monophosphate and adenosine triphosphate-sensitive K+-channel activity. Metabolism. 2000; 49(2):208-214. [ Links ]
22. Park JE, Cha YS. Stevia rebaudiana Bertoni extract supplementation improves lipid and carnitine profiles in C57BL/6J mice fed a high-fat diet.J Sci Food Agric. 2010; 90(7):1099-10105. [ Links ]
23. Xu D, Du W, Zhao L, Davey AK, Wang J. The neuroprotective effects of isosteviol against focal cerebral ischemia injury induced by middle cerebral artery occlusion in rats. Planta Med. 2008; 74(8):816-821. [ Links ]
24. Shivanna N, Naika M, Khanum F, Kaul VK. Antioxidant, anti-diabetic and renal protective properties of Stevia rebaudiana. J Diabetes Complications. 2013; 27(2):103-13. [ Links ]
25. Himanshu M, Manish S, Narendra S, Darshana M, Mehta B, and Jain DC.Antidiabetic activity of medium-polar extract from the leaves of Stevia rebaudiana Bert. (Bertoni) on alloxan-induced diabetic rats. J Pharm Bioallied Sci. 2011; 3(2):242-248. [ Links ]














