Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.4 Ciudad de México oct./dic. 2013
Revisión bibliográfica
Nanosuspensiones: Disminución del tamaño de partícula como herramienta para mejorar la biodisponibilidad de fármacos liposolubles
Nanosuspensions: Particle size reduction as tool to improve lipophilic drugs bioavailability
Walter Javier Starkloff,1 Santiago Daniel Palma,2 Noelia Luján Gonzalez-Vidal1,3
1 Cátedra Control de Calidad de Medicamentos, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur, Bahía Blanca, Argentina
2 UNITEFA-CONICET, Departamento de Farmacia, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba, Córdoba, Argentina
3 CONICET, Bahía Blanca, Argentina
Correspondencia:
Dr. Santiago D. Palma
UNITEFA-CONICET, Depto. de Farmacia
Facultad de Ciencias Químicas
Universidad Nacional de Córdoba
Ciudad Universitaria X5000HUA, Cordoba, Argentina
Tel. 54-351-4334163
e-mail: sdpalma@fcq.unc.edu.ar
Fecha de recepción: 27 de marzo de 2013.
Fecha de recepción de modificaciones: 20 de septiembre de 2013.
Fecha de aceptación: 09 de diciembre de 2013.
Resumen
En los últimos años, las nanosuspensiones han sido objeto de numerosos estudios con el fin de evaluar sus propiedades biofarmacéuticas, demostrando en muchos casos valiosas ventajas frente a las formulaciones utilizadas convencionalmente. El uso de esta novedosa tecnología ha permitido el desarrollo de formas farmacéuticas para ser administradas por diferentes vías y también su aplicación ha demostrado ventajas en el desarrollo de estudios toxicológicos.
En el presente trabajo se plantea una revisión de los aportes que brinda la obtención de partículas nanométricas de principios activos a la tecnología farmacéutica, los procesos de obtención de las mismas, así como su caracterización y principales aplicaciones en diferentes vías de administración de fármacos.
Palabras clave: Aumento de la biodisponibilidad; fármacos liposolubles; nanosuspensiones; vías de administración.
Abstract
In recent years, nanosuspensions have been subject of numerous studies in order to evaluate their biopharmaceutical properties, demonstrating in many cases valuable advantages over the conventional formulations. The application of this innovative technology has allowed the development of pharmaceutical dosage forms designed to be administrated by different routes, and its application has also demonstrated some advantages in the development of toxicological studies.
This paper presents a review of the contributions that nanometric particles provide to the pharmaceutical technology area, the design and formulation procedures, characterization studies and principal applications.
Key words: Administration routes; bioavailability enhancement; nanosuspensions; poorly water soluble drugs.
Introducción
La biodisponibilidad de fármacos es una de las principales propiedades que hacen a la calidad biofarmacéutica de los medicamentos. Este parámetro depende de la liberación del principio activo (PA) desde la forma farmacéutica, su disolución bajo condiciones fisiológicas y su permeación a través de las membranas. Si el proceso de disolución se encuentra bloqueado, es lento o incompleto, el efecto terapéutico buscado resultará ineficiente o nulo.1
En formas farmacéuticas como las soluciones no existe consideración alguna en cuanto al proceso de disolución de un PA, mientras que en las formulaciones sólidas existe un impacto considerable de la desintegración, eventualmente, y de la disolución, en lo inherente a su biodisponibilidad. Las suspensiones podrían considerarse análogas a la forma desintegrada de comprimidos y/o cápsulas, de manera que el proceso de disolución también constituye el paso limitante de la absorción y la biodisponibilidad.2,3
Es sabido que solo la fracción disuelta del PA estará disponible para ser absorbida, lo que constituye un problema debido a la gran cantidad de fármacos de escasa solubilidad en los fluidos biológicos en uso en la terapéutica actual, sin contar los numerosos fármacos en estudio que también pertenecen a esta clase.
Las dificultades que plantea la baja solubilidad acuosa son principalmente baja biodisponibilidad oral y absorción errática. La solubilidad puede ser mejorada usando métodos tradicionales como el uso de co-solventes, ciclodextrinas o micronización, sin embargo en muchos casos las técnicas mencionadas no resuelven este problema. Por ejemplo, la micronización no logra aumentar de manera considerable la superficie del fármaco disponible para el proceso de solubilización, lo que permitiría mejorar la velocidad del mismo. En este camino el siguiente paso nos lleva a reducir el tamaño de partícula a escala nanométrica.4-6
Las nanosuspensiones (NSs), como su nombre indica, son dispersiones de partículas nanométricas en un medio adecuado, por ejemplo agua. Este tipo de formulaciones mejoran la solubilidad de los PA y brindan mejores velocidades de disolución, pudiendo complementar, a su vez, otras tecnologías usadas para mejorar la biodisponibilidad de compuestos poco solubles (Clase II y IV del Sistema de Clasificación Biofarmacéutica, SCB).7 Las NSs pueden ser luego transferidas a un producto sólido a través de procesos de spray-drying, liofilización o usando la NS como agente humectante en un proceso de granulación húmeda, para la formulación de pellets o comprimidos.8,9
La presente revisión bibliográfica se centró en los avances de los últimos años sobre los métodos más utilizados para la obtención de NSs, así como también sobre los aspectos principales de la caracterización de estas formulaciones, su uso en el área de la farmacoterapia y sus aplicaciones en las principales vías de administración de fármacos.
Métodos de obtención de NSs
Las técnicas de obtención de NSs pueden agruparse en dos grandes grupos: las técnicas bottom-up (precipitación/cristalización controlada, el cristal se forma a partir de un núcleo de moléculas e incrementa su tamaño) y las técnicas top-down (las partículas se reducen en tamaño), siendo estas últimas las más usadas. Existe también la posibilidad de combinar de manera secuenciada este tipo de técnicas.10
Técnicas bottom-up
Nanoprecipitación
Este método implica la formación de partículas nanométricas, cristalinas o semi-cristalinas, por nucleación y crecimiento del cristal del PA. En un proceso convencional, el PA liposoluble se disuelve en un solvente orgánico apropiado, el cual se agrega posteriormente a un antisolvente (incluyendo estabilizantes adecuados) para la formación de los nanocristales. La elección de los solventes y estabilizantes, así como los parámetros del proceso de mezcla (temperatura, velocidad de agitación y velocidad de incorporación del PA solubilizado), son los factores que controlan el tamaño de partícula y la estabilidad del nuevo sistema.
También se ha aplicado el uso de solventes no orgánicos, y en este sentido se evaluó la factibilidad de un cambio de pH como, por ejemplo, mediante el empleo de una solución básica usada como precipitante para las moléculas solubles en un medio ácido. Este proceso es de interés cuando el PA tiene una solubilidad pH-dependiente.11 Mou et al. han desarrollado una NSs de Itraconazol a partir de esta metodología para su administración por vía oral, logrando incrementar en casi dos veces la biodisponibilidad de este PA.12 Por su parte, Xu et al. emplearon de manera exitosa la misma metodología en el desarrollo de NSs de aripiprazol.13
Preparación mediante el empleo de emulsiones/micro-emulsiones
Esta metodología es aplicable para PAs que sean solubles tanto en solventes orgánicos volátiles como en solventes parcialmente miscibles en agua. Existen dos métodos para formular NSs mediante esta técnica. En el primero, el solvente orgánico o una mezcla de solventes, con el PA incorporado, se dispersa en la fase acuosa que contiene los estabilizantes adecuados para formar una emulsión. La fase orgánica se evapora en condiciones de baja presión y, de esa manera, los cristales precipitan inmediatamente formando la NS. El segundo método hace uso de solventes parcialmente miscibles con el agua como fase dispersante, tales como butil lactato, alcohol bencílico y triacetina. La emulsión se forma de manera convencional y, posteriormente, mediante una adecuada dilución, se obtiene la NS. La dilución con agua de la emulsión induce la completa difusión de la fase interna hacia la externa, dando como resultado la formación de una NS.14
Las microemulsiones también pueden ser empleadas como medio para obtener nanopartículas. Estas son dispersiones termodinámicamente estables de dos líquidos inmiscibles, estabilizados por una película interfacial formada por un tensoactivo y un co-tensoactivo. En este caso, el PA puede ser cargado en la fase interna, o pueden saturarse con el mismo microemulsiones preformadas mediante mezclado absoluto. Con el mismo mecanismo mencionado anteriormente, una correcta dilución de la microemulsión da como resultado la obtención de una NS.15
Las ventajas que presentan estas técnicas son la facilidad para controlar las dimensiones de las micelas de la fase dispersa y un escalamiento relativamente sencillo. Sin embargo, el uso de solventes orgánicos puede tener consecuencias para el medio ambiente, así como probables efectos toxicológicos para el paciente si sus trazas no se eliminan de los productos medicinales, y suelen requerirse grandes cantidades de tensoactivos y/o estabilizantes.9
Técnicas top-down
Homogeneización de alta presión (HAP)
Los procesos básicos usados son el sistema Microfluidizer (IDD-P™), basado en el principio de corriente en chorro,16 y la homogeneización mediante un sistema de pistón-ranura, ya sea en medio acuoso (Dissocubes®, SkyePharma)17 o alternativamente en un medio de baja proporción acuosa o no acuoso (Nanopure®, previamente PharmaSol GmbH, actualmente Abbott).18 Las fuerzas de cavitación generadas a altas presiones y la colisión entre partículas dan como resultado la disminución del tamaño de partícula.
En general, los parámetros que tienen influencia sobre la calidad de los productos obtenidos por esta técnica son cuatro:
* Combinación de estabilizantes y su concentración.
* Número de ciclos de homogeneización.
* Porcentaje de contenido de sólidos.
* Presión de homogeneización.
Molienda
Estos son los de mayor trayectoria en la producción de nanocristales. Existen especialidades medicinales disponibles en el mercado para las que se emplean estos métodos de elaboración, como por ejemplo Rapamune® (Sirolumus, Lab. Wyeth), Invega® (Paliperidona, Lab. Janssen Cilag), Tricor® (Fenofibrato, Abbott Laboratories), Ritalin® LA (Metilfenidato HCl, Novartis) y Emend® (Aprepitant, Lab. Merck Sharp & Dohme).
Existe también la posibilidad de efectuar la molienda en condiciones secas, incluso se han utilizado antes que las técnicas por vía húmeda. Presentan la ventaja de prescindir de los solventes orgánicos, además de poder llevarse a cabo de manera fácil y económica.
Caracterización de las NSs
Tamaño de partícula e índice de polidispersidad
El diámetro medio de las nanopartículas y su distribución (índice de polidispersidad - IP), suelen medirse mediante espectroscopia de correlación de fotones (ECF). El intervalo de medición de la ECF se halla entre 3 nm y 3 µm. Para detectar partículas de tamaño micrométrico o agregados de nanopartículas suele emplearse también la difractometría láser (DL), ya que permite medir tamaños entre 1 µm a 1 mm.19 Las NSs destinadas a ser administradas por vía I.V., además, son analizadas mediante un contador Coulter.
Otras técnicas empleadas para la caracterización de este parámetro son la microscopía electrónica de barrido y la microscopía de fuerza atómica.20-22
Carga de la partícula (potencial zeta)
La carga de la partícula es un parámetro significativo para la estabilidad de las NSs acuosas. Se caracteriza mediante combinación de electroforesis y velocimetría láser Doppler, y se expresa comúnmente como movilidad electroforética [(µm/S)/(V/cm)] o convertida a potencial zeta (mV).
Para una NS estabilizada solo por repulsión electrostática, se requiere un valor de potencial zeta mínimo absoluto de 30 mV. Para el caso de una estabilización que combine repulsión electrostática y estabilización estérica, como regla general, se requiere contar con un valor absoluto mínimo de 20 mV.23
Estado cristalino
La estructura cristalina de las NSs puede ser evaluada mediante calorimetría diferencial de barrido (CDB) y difractometría de rayos X (DRX). Esto es sumamente importante cuando el PA estudiado presenta polimorfismo.
Los procesos de obtención del material sólido, como el secado por spray, son una estrategia habitual para mejorar la estabilidad física y química de las NSs. Durante este tipo de procesos, se requiere mucho menos energía para la formación de un estado amorfo que para uno cristalino. Obtener un estado parcial o completamente amorfo de los PA insolubles en los nanocristales, teóricamente, es un método que permite mejorar la velocidad de disolución. Sin embargo, las moléculas en estado amorfo son termodinámicamente inestables, comparando con los estados cristalinos, y por lo tanto es factible su transformación.24 Por lo tanto, la conversión entre estas formas puede inducir alteraciones en la solubilidad y, consecuentemente, en los efectos terapéuticos.25
Velocidad de disolución y solubilidad de saturación
La determinación de la velocidad de disolución es sumamente importante para asegurar los beneficios que presentan este tipo de formulaciones con respecto a las convencionales. Para ello se pueden emplear los métodos descritos en las diferentes Farmacopeas, para luego, mediante el tratamiento matemático apropiado, determinar la velocidad de disolución.
Para las NSs de partículas cuyas superficies hayan sido estratégicamente modificadas pueden investigarse algunos parámetros adicionales relacionados con su comportamiento in vivo, tales como (1) propiedades de adhesión (en caso de las partículas mucoadhesivas); (2) hidrofilicidad/hidrofobicidad de la superficie; e (3) interacción con las proteínas.26
Evaluación biofarmacéutica de NSs
NSs para estudios toxicológicos
Los estudios toxicológicos que requieren altas dosis suelen ser un desafío durante el desarrollo de compuestos poco hidrosolubles, ya que la absorción está limitada por la baja solubilidad a las dosis utilizadas en este tipo de ensayos. Cabe señalar que el marcado incremento en la exposición sistémica que se logra con las NSs, puede conducir a una significante reducción en la cantidad de principio activo que se requiere para los estudios toxicológicos, en los que las dosis pueden ir más allá de los 1000 mg/kg/día y los estudios pueden durar hasta dos años.
Jia et al. han demostrado que la reducción del tamaño de partícula de carbendazim (solubilidad acuosa de 8 µg/mL) a 280 nm les permitió disminuir la dosis a casi la mitad (516 vs. 1000 mg/kg) y, aun así, mantener similares exposiciones en ratas, comparado con una suspensión micronizada.27 Hecq et al. usaron NSs obtenidas por HAP para mejorar la biodisponibilidad de un PA débilmente básico (ucb-35440-3) a 100 mg/kg. En este caso la nanometrización incrementó cuatro veces la exposición en ratas Wistar frente al PA micronizado.28 Jia et al. utilizaron también la nanometrización para mejorar la biodisponibilidad oral del compuesto antiviral PG3010029, a dosis de 500 mg/kg en ratas Sprague-Dawley: la NS permitió una absorción significativamente más rápida con una disminución del Tmáx de aproximadamente 3 horas además de un incremento de cuatro veces en la exposición; de hecho, se ha logrado una absorción oral casi completa (99,1%).29
Este compuesto presenta baja permeabilidad y baja solubilidad (clase IV SCB), lo cual prueba que la nanometrización también brinda beneficios sobre compuestos con baja permeabilidad, siempre que el paso de solubilidad/disolución siga siendo el principal limitante para la absorción oral.
El aporte de las NSs en el desarrollo de estudios toxicológicos, permite disminuir de manera notable la relación fármaco administrado-fármaco absorbido. Al aumentar la biodisponibilidad del PA, los efectos tóxicos pueden ser estudiados disminuyendo las dosis requeridas.
NSs para aplicaciones clínicas y preclínicas
Estudios preclínicos
En uno de los primeros reportes de la utilización de nanopartículas, Liversidge y Conzentino elaboraron una NS de naproxeno (tamaño de partícula 270 nm), que demostró un incremento significativo en la velocidad de absorción del PA (mayor Cmáx y menor Tmáx) con respecto a una microsuspensión de partículas de 20 µm formulada con los mismos excipientes.30
Jinno et al. evaluaron los efectos positivos sobre la absorción de cilostazol (clase II en el SCB) con los alimentos. Compararon la velocidad de disolución para la NS (tamaño de partícula 220 nm) con dos microsuspensiones (tamaño de partícula 2,4 µm y 13,4 µm). Con la NS observaron un incremento de cinco veces en la exposición, una absorción casi completa (86%) y la eliminación del efecto positivo de la administración del PA con los alimentos, lo que se traduce en una disminución de la variabilidad de la respuesta al tratamiento.31 Kocbek et al., usando HAP, mejoraron la velocidad de disolución del ibuprofeno (clase II en el SCB)23 y Kaiser et al. demostraron la actividad antiparasitaria de una NS de anfotericina B por vía oral, mientras que el mismo principio activo micronizado carecía de actividad.32
Por su parte, Kesteleyn et al. evaluaron el desempeño para NSs de inhibidores de VIH-proteasas en formulaciones de acción prolongada. Determinados derivados sintéticos de estos PAs usados actualmente en el tratamiento del VIH/SIDA, mostraron ser adecuados para su formulación como NSs, en formulaciones de liberación prolongada, tras los estudios in vivo en animales.33
Usos clínicos
Merisko-Liversidge et al., reportaron un estudio acerca del efecto positivo de los alimentos sobre la absorción de danazol. Los autores observaron que tras la administración de una NS de este PA (dosis 200 mg) se eliminaba casi completamente el efecto positivo de los alimentos sobre la absorción que se veía tras la administración de un producto comercial.
La nanometrización también puede tener otros usos, como el que se observa en un estudio sobre el naproxeno nanocristalino. Este PA es un ácido débil (clase II en el SCB) cuya alta permeabilidad permite una absorción casi completa. Este compuesto muestra alta solubilidad al pH intestinal, por lo que se espera que las diferentes formas de liberación inmediata sean bioequivalentes en términos de área bajo la curva (ABC). Sin embargo, debido a que se espera un rápido inicio de acción para los analgésicos-antiinflamatorios, el tiempo para alcanzar la Cmáx puede ser importante para diferenciar las distintas formulaciones. Dado el incremento en la velocidad de disolución que exhibe la nanoformulación de naproxeno, el Tmáx tuvo lugar aproximadamente una hora y media antes comparada con los productos comerciales Naprosyn (suspensión) y Anaprox (comprimidos), a la vez que se observó un incremento de un poco más de dos veces en el ABC parcial cumplida una hora desde la administración.34
Aplicaciones de las NSs en las diferentes vías de administración
Vía oral
Para los compuestos de clase II del SCB la biodisponibilidad está limitada por la velocidad de disolución, y para los compuestos de clase IV (baja solubilidad, baja permeabilidad) se le adiciona algún mecanismo que reduce la absorción (por ejemplo la glicoproteína P). La rápida disolución de las nanopartículas ayuda a mejorar la absorción de ambas clases de compuestos, al permitir una mayor disponibilidad del PA en solución.
El incremento de la solubilidad que tiene lugar con la reducción del tamaño de partícula provoca mayores gradientes de concentración en las membranas, lo que lleva a una mayor penetración o permeación. Además, las partículas de tamaño nanométrico poseen una alta adhesividad a las membranas biológicas. Para aquellos compuestos cuya ventana de absorción es estrecha, el incremento en la velocidad de disolución y la alta adhesividad permiten una disponibilidad casi completa del PA disuelto en el sitio de absorción.
La administración como NS de atovaquona (un antibiótico empleado para tratar las infecciones oportunistas por Pneumocystis carinii) permitió un aumento de 2,5 veces en la biodisponibilidad oral comparado con el producto comercial Wellvone®, que contiene el PA micronizado.35 El danazol (un inhibidor de las gonadotrofinas) muestra una drástica mejora en la biodisponibilidad oral, del 82,3%, cuando es administrado como NS comparado con una macrosuspensión comercializada (Danocrine) que permite una biodisponibilidad del 5,2% de la dosis.36
El aumento de la biodisponibilidad oral puede atribuirse entonces al incremento de la superficie disponible para la disolución, la mayor adhesividad de las nanopartículas a las membranas biológicas y el incremento en la solubilidad de saturación. Además se logra una reducción en la variabilidad de la absorción del PA con respecto a la presencia o no de alimentos en el tracto digestivo, y disminución de la variabilidad inter-individual.
La adhesividad de las NSs no sólo puede ser usada para mejorar la biodisponibilidad, sino que también puede ser una herramienta importante para la vectorización del fármaco hacia su sitio de acción, como por ejemplo los parásitos persistentes del tracto gastrointestinal. Tal es el caso de Cryptosporidium parvum, un patógeno oportunista que causa serios cuadros diarreicos en pacientes inmunosuprimidos por VIH. Este patógeno se ubica en las membranas epiteliales de la pared intestinal. Las NSs de bupravaquona ofrecen algunas ventajas dadas las mencionadas propiedades que permiten el direccionamiento y la persistencia del PA en el lugar de acción.37
Para la vía oral, las NSs pueden ser precursoras de formas farmacéuticas tales como comprimidos o cápsulas. Así lo demuestran Zuo et al. al obtener comprimidos de fenofibrato, a partir de NS del PA, mediante secado por atomización, El tamaño medio de partícula de los mismos fue de 606 nm. Los perfiles de disolución obtenidos, muestran un incremento en la velocidad de disolución con la disminución del tamaño de partícula a escala nanométrica, respecto al mismo principio activo en forma micronizada.38
Administración parenteral
La administración parenteral de PAs insolubles puede requerir el empleo de NSs, al menos cuando las dosis a administrar no pueden disolverse en los volúmenes empleados para inyección (1 a 10 mL) o en infusión (100 mL por ejemplo). Las estrategias que se han empleado para mejorar la solubilidad están basadas en el uso de tensoactivos (por ejemplo Cremophor® El), mezclas de solventes o complejos de inclusión de ciclodextrinas. Muchos PA actualmente en estudio no pueden solubilizarse mediante el empleo de estas estrategias, o bien su uso se asocia con efectos secundarios indeseables, como es el caso de la reacción anafiláctica que puede tener lugar con el uso de productos que contengan Cremophor® El39 o la nefrotoxicidad provocada por la administración intravenosa (I.V.) de formulaciones que contienen ciclodextrinas.40 El empleo de las NSs de paclitaxel brindan un aumento de tres veces en la dosis máxima tolerada comparado con Taxol®.41 NSs I.V. de nimodipina fueron desarrolladas por Xiong et al., con el fin de obtener una formulación de mayor tolerancia que las soluciones etanólicas comercialmente disponibles. En ese sentido, los estudios de irritación en ratas mostraron menor irritación local y menor riesgo de flebitis.42
Un aspecto interesante es que las NSs inyectadas exhiben una farmacocinética diferente comparada con una solución administrada por la misma vía, cuando presentan un tamaño por debajo de los 100 nm. Las partículas nanométricas que no se disuelven suficientemente rápido son secuestradas por las células del sistema fagocítico mononuclear (SFM) mediante mecanismos endocíticos. Se acumulan principalmente en las células de Kupffer del hígado, al igual que todas las partículas coloidales. Como efecto positivo, esta acumulación en el hígado permite conseguir niveles plasmáticos prolongados del PA. Los macrófagos actúan como depósito y el PA se libera de manera sostenida en la circulación sistémica. Como posible efecto secundario, las altas concentraciones pueden causar efectos tóxicos localizados en el hígado.
Por ejemplo, Ganta et al. desarrollaron una NS de asulacrina I.V. para el tratamiento del cáncer de mama y ésta mostró una farmacocinética diferente para el mismo PA solubilizado, acumulándose en el hígado, riñón y pulmones.43
La influencia del tamaño de partícula sobre la distribución fue estudiada empleando NSs de oridonina (un diterpenoide natural purificado de Rabdosia rubescens, que ha demostrado efectividad en el tratamiento del mieloma múltiple por su actividad antiangiogénica) con dos diferentes tamaños de partícula: 103 nm vs. 897 nm. Los cristales más pequeños mostraron un comportamiento similar a la solución inyectada mientras que los más grandes se acumularon en los órganos del sistema retículoendotelial.44
Si el objetivo de la administración I.V. es el direccionamiento específico del PA hacia las células del SFM, la captación por parte de estas células mediante mecanismos endocíticos puede verse incrementada si se modifica la superficie de las mismas con tensoactivos o polímeros agregados adecuadamente durante el proceso de elaboración. Los sistemas coloidales portadores de PAs también han sido objeto de atención de las investigaciones en los últimos años debido a su habilidad de incorporar fármacos en sistemas como micropartículas, liposomas, partículas poliméricas y nanopartículas y así aprovechar este mecanismo de captación natural.
La afidicolina es un metabolito fúngico proveniente de Nigrospora sphaerica que posee actividad antiparasitaria. Su uso también está condicionado por su baja solubilidad acuosa. Pudo demostrarse microscópicamente la captación endocítica de las partículas de afidicolina por parte de macrófagos RAW26 (línea celular de macrófagos de ratones leucémicos). Un gran número de microorganismos patógenos humanos persisten en el interior de los macrófagos, entre ellos, Mycobacterium tuberculosis y Listeria monogyna. Aprovechar la habilidad de estas células del sistema inmunitario para acaparar todos los objetos particulados, sobre todo fragmentos celulares, proteínas macromoleculares o los microorganismos que invaden el cuerpo, puede traer resultados terapéuticamente eficaces.37
La terapéutica antitumoral mediante NSs también es objeto de avances recientes. Tang et al. desarrollaron una formulación de un PA antitumoral (Q39) con la cual lograron una mejora en la estabilidad respecto a la solución, además de observar incrementos de hasta 7 veces en la solubilidad y un direccionamiento hacia el tumor en estudios in vivo.45
La administración de nutrientes esenciales mediante NSs también ha sido estudiada. Du et al. desarrollaron una forma de liberación prolongada de riboflavina por vía intramuscular. La formulación resultó eficaz tras su administración en modelos animales con deficiencias inducidas mediante la administración de metotrexato.46
Vía dérmica y aplicación sobre mucosas
Como se dijo anteriormente, las NSs muestran aumentada permeación y bioadhesividad. Sin embargo durante mucho tiempo no se centró la atención en aprovechar estas propiedades para la aplicación sobre mucosas y por vía transdérmica. Esto cambió cuando se formularon NSs de los antioxidantes rutina, hesperidina y apigenina, con el fin de emplearlas en productos cosméticos anti-edad.47 Los nanocristales simplemente son mezclados en la fase acuosa de una crema o loción de tipo o/w. La formulación con nanocristales de rutina fue comparada in vivo con una crema que contenía un derivado hidrosoluble del mismo PA. La concentración del PA en la fase acuosa de la NS fue de 1/500, y mostró un mayor factor de protección solar.48
El mecanismo de acción subyacente consiste en que el aumento de la solubilidad del PA en la fase acuosa de la NS incrementa el gradiente de concentración entre la formulación y la piel. Además cuenta con la ventaja de estar formulada con la propia molécula de rutina que es más lipofílica. Al ser mayor la penetración de las moléculas del activo liposoluble, existe un rápido recambio del PA en la fase acuosa de la formulación que proviene de las nanopartículas, de esta forma actúan como un sistema depot situado en la fase dispersante.
El mismo principio se puede aplicar para los sistemas de administración transdermal (SAT). Una NS de diclofenaco sódico para administración como SAT mostró un incremento en el flujo de permeabilidad a través de la piel de casi 3,8 veces, comparado con el control.49
El efecto adhesivo de las partículas de tamaño nanométrico puede ser mejorado mediante el uso de polímeros cargados positivamente como estabilizadores. La carga opuesta aumenta la afinidad del sistema así estabilizado por la superficie celular, cargada negativamente. Este principio se empleó para la producción de sprays antisépticos que contienen cloruro de cetilpiridinio, como tensoactivo y antiséptico al mismo tiempo,50 y en la elaboración de un sistema de aplicación tópica de lidocaína de liberación prolongada.51
Vía pulmonar
Esta es una vía interesante de administración debido a su gran área superficial (entre 75 y 140 m2), al escaso espesor de la barrera aire-sangre de los alvéolos (menos de 1 µm), a su alta perfusión sanguínea y a la posibilidad de evitar el efecto de primer paso hepático. Dadas estas características, parece posible que la administración pulmonar de medicamentos pueda mejorar la absorción y la biodisponibilidad de PAs.
Ali et al. propusieron emplear esta vía para la administración de sulfato de atropina en el tratamiento de la intoxicación con organofosforados, en lugar de la vía intramuscular (I.M.) habitualmente usada para casos de emergencia. Argumentan que, dadas las características de los pulmones, se puede obtener un efecto más rápido que el que se observa tras la administración I.M. De esa manera, formularon un polvo seco de sulfato de atropina por una técnica de nanoprecipitación y observaron que se alcanzaban concentraciones plasmáticas terapéuticamente efectivas en la mitad del tiempo estimado para la vía I.M.52
Las NSs se pueden emplear como alternativa a los polvos secos para inhalación, simplemente mediante la nebulización de las mismas.
Los nebulizadores generan un aerosol con un tamaño de gota adecuado para la administración pulmonar que oscila entre 1 y 5 µm, suficiente para contener cantidades adecuadas de nanopartículas. Los polvos secos de tamaño nanométricos presentan dificultades para ser inhalados, dado que son altamente adhesivos (con tendencia a la aglomeración) y las partículas entre 0,5 y 1 µm pueden ser exhaladas.
Cuando las gotas de aerosol se depositan en los pulmones, las nanopartículas se extienden de forma uniforme en la superficie del tejido, especialmente cuando las formulaciones se estabilizan con tensoactivos que permiten lograr una buena extensibilidad. Hernández-Trejo et al. llevaron a cabo estudios al respecto mediante la comparación del empleo de diferentes nebulizadores con respecto a su capacidad para nebulizar NSs.53 La formulación de fluticasona (corticosteroide sintético empleado en el tratamiento del asma y la rinitis alérgica) en forma de NS, administrada en ratones, demostró una deposición dosis dependiente y los resultados fueron altamente reproducibles y robustos.54
Vía ocular
Los ojos se encuentran entre los órganos más accesibles en términos de ubicación anatómica, aunque la administración de fármacos por esta vía es particularmente problemática. El principal inconveniente es que las formas líquidas son removidas relativamente rápido de la superficie ocular por el flujo lagrimal y otros mecanismos de drenaje.
El aspecto aprovechable de las NSs es la alta bioadhesividad que exhiben las nanopartículas, pudiendo incluso constituir un sistema de liberación prolongada como se ha visto recientemente. NSs de flurbiprofeno e ibuprofeno mostraron un desempeño superior in vivo frente a las formulaciones disponibles en el mercado, e incluso permitieron una liberación sostenida del PA por 24 horas.55
Como se recomienda que el tamaño de partícula para fármacos de administración en la superficie ocular no supere los 10 ^m, las nanopartículas nuevamente se muestran como buenas candidatas para el desarrollo de medicamentos para esta vía. Las potenciales ventajas de los sistemas nanométricos de administración de medicamentos por vía ocular serían: (1) la posibilidad de la autoadministración del medicamento por el paciente; (2) no hay interferencia con la visión dado el tamaño de las partículas; (3) protección contra las enzimas metabólicas (como peptidasas y nucleasas); (4) posible captación del PA por las células corneales; (5) liberación prolongada del PA, lo que reduce la necesidad de repetidas instilaciones y/o inyecciones; y (6) direccionamiento hacia el tejido afectado, evitando los posibles efectos secundarios a las dosis empleadas.56
Kassem et al. evaluaron la influencia del tamaño de partícula en la biodisponibilidad ocular de tres glucocorticoides formulados como NSs usando HAP: hidrocortisona (de acción corta), prednisolona (de acción media) y dexametasona (de acción prolongada), observando una marcada diferencia entre los perfiles de porcentaje de incremento medio de la Presión Intra-Ocular (PIO) vs. tiempo, diferencia que se incrementa con la disminución del tamaño de partícula del PA. También demostraron que las NSs provocan un aumento en el porcentaje de incremento medio de la PIOmáx de entre 76% y 124%. El ABC de cada uno de los perfiles de disolución obtenidos se incrementa desde la solución hacia las suspensiones y dentro de estas últimas se observa una relación inversa entre ABC y tamaño de partícula. Los resultados indican un aumento pronunciado de la biodisponibilidad cuando los PA se preparan como NSs, como resultado de una mejorada penetración corneal.57
Ali et al., empleando dos metodologías distintas de preparación de NSs de hidrocortisona, lograron un efecto sostenido en el aumento de la PIO. Estos resultados se cotejaron contra una solución del mismo PA, sin observarse diferencias en cuanto al comienzo de la acción terapéutica, pero si en lo que respecta a su duración.58
A pesar de las ventajas presentadas anteriormente, las NSs no han sido suficientemente empleadas para esta vía. Sin embargo, la elevada adhesividad de las NSs pueden dar lugar a una liberación prolongada.59
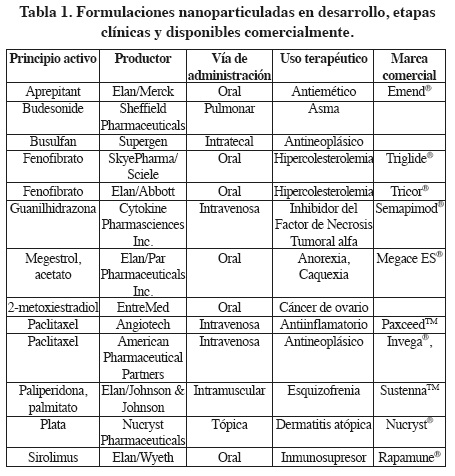
En la Tabla 1 se resumen algunas de las formulaciones disponibles, tanto comercialmente como en etapas de desarrollo, para aplicación en las diferentes vías de administración.
Conclusiones
Los beneficios de las NSs en las formulaciones farmacéuticas se traducen en un notable avance en el comportamiento de las mismas, en aspectos tales como velocidad de disolución mejorada, aumento de la solubilidad, incremento de permeación en las membranas, reproducibilidad de la absorción oral, mejor relación dosis-biodisponibilidad y un progreso hacia el óptimo cumplimiento terapéutico por parte del paciente, debido a la reducción del número de dosis requeridas por día. El tamaño óptimo de partícula de una NS dependerá de la naturaleza del PA, su aplicación farmacéutica y las propiedades biofarmacéuticas deseadas; no debiendo generalizarse que "a menor tamaño de partícula siempre es mejor". Estas novedosas formulaciones son una estrategia útil también en los aspectos farmacotécnicos para la obtención de derivados que pueden formar parte de las formulaciones convencionales, mejorando los aspectos biofarmacéuticos también en estos últimos casos. Como se ha visto, los beneficios de las NSs pueden ser aprovechados en la administración de medicamentos por las vías comúnmente empleadas y permiten la incorporación de nuevos PAs, o bien mejorar de manera notable el tratamiento con agentes terapéuticos de efectividad comprobada en uso actualmente.
Agradecimientos
Walter J. Starkloff cuenta una beca doctoral de la Secretaría General de Ciencia y Tecnología (SGCyT) de la Universidad Nacional del Sur (UNS).
Referencias
1. Cid Cárcamo E. Cinética de disolución de Medicamentos. 1a Ed. Washington DC: Secretaría General de la Organización de los Estados Americanos (OEA), Programa Regional de Desarrollo Científico y Tecnológico; 1981. [ Links ]
2. Higuchi WI, Swarbrick J, Ho NFH, Simonelli AP, Martin A. Fenómenos de las partículas y dispersiones groseras. En: Remington Farmacia. Gennaro AR, editor. 17a Edición. Tomo I. Buenos Aires: Editorial Médica Panamericana; 1992. p. 423-60. [ Links ]
3. Abdou HM, Hanna S, Muhammad N. Disolución. En: Remington Farmacia. Gennaro AR, editor. 20a Edición. Tomo I. Buenos Aires: Editorial Médica Panamericana; 2003. p. 764-78. [ Links ]
4. Gao L, Zhang D, Chen M. Drug nanocrystals for the formulation of poorly soluble drugs and its application as a potential drug delivery system. J Nanopart Res. 2008; 10:845-62. [ Links ]
5. Müller RH, Pardeike J, Hommoss A. Nanoparticles in therapeutics: drug nanocrystals and lipid nanoparticles. Potsdam, Alemania: NanoTrends; 2006. [ Links ]
6. Rabinow BE. Nanosuspensions in drug delivery. Nat Rev Drug Discov. 2004; 3:785-96. [ Links ]
7. Amidon GL, Lennernas H, Shah VP, Crison JR. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo biovailability. Pharm Res. 1995; 12(3):413-20. [ Links ]
8. Chen H, Khemtong C, Yang X, Chang X, Gao J. Nanonization strategies for poorly water-soluble drugs. Drug Discov Today. 2011; 16(7-8):354-60. [ Links ]
9. Chingunpituk J. Nanosuspension technology for drug delivery. Walailak J Sci & Tech. 2007; 4(2):139-53. [ Links ]
10. Keck CM, Müller RH. Drug nanocrystals of poorly soluble drugs produced by high pressure homogenization. Eur J Pharm Biopharm. 2006; 62:3-16. [ Links ]
11. Chen J-F, Zou M-Y, Shao L, Wang Y-Y, Yun J, Chew NYK, et al. Feasibility of preparing nanodrugs by high-gravity reactive precipitation. Int J Pharm. 2004; 269(1):267-74. [ Links ]
12. Mou D, Chen H, Wan J, Xu H, Yang X. Potent dried drug nanosuspensions for oral bioavailability enhancement of poorly soluble drugs with pH-dependent solubility. Int J Pharm. 2011; 413:237-44. [ Links ]
13. Xu Y, Liu X, Lian R, Zheng S, Yin Z, Lu Y, Wu W. Enhanced dissolution and oral bioavailability of aripiprazole nanosuspensions prepared by nanoprecipitation/homogenization based on acid-base neutralization. Int J Pharm. 2012; 438:287-95. [ Links ]
14. Trotta M, Gallarate M, Pattarino F, Morel S. Emulsions containing partially water-miscible solvents fot the preparation of drug nanosuspensions. J Con Rel. 2001; 76:119-28. [ Links ]
15. Trotta M, Gallarate M, Carlotti ME, Morel S. Preparation of griseofulvin nanoparticles from water-dilutable microemulsions. Int J Pharm. 2003; 254:235-42. [ Links ]
16. Haynes DH, inventor. Phospholipid-coated microcrystals: injectable formulations of water insoluble drugs. United States patent 5091187. 1992 Feb 25. [ Links ]
17. Müller RH, Becker R, Kruss K, Peters K, inventores; Medac Gesellschaft Fur Klinische Spezialpraparate, cesionario original. Pharmaceutical nanosuspensions for medicament administration as systems with increased saturation solubility and rate of solution. United States patent 5858410. 1999 Ene 12. [ Links ]
18. Müller RH, Krause K, Mäder K, inventores. Method for controlled production of ultrafine microparticles and nanoparticles. W0/2001/003670. 2001 Ene 18. [ Links ]
19. Staniforth J. Análisis del tamaño de las partículas. En: Aulton ME, editor. Farmacia: la ciencia del diseño de las formas farmacéuticas. 2a ed. Madrid: Elsevier España; 2004, p. 155-76. [ Links ]
20. Moribe K, Limwikrant W, Higashi K, Yamamoto K. Structural evaluation of probucol nanoparticles in water by atomic force microscopy. Int J Pharm. 2012; 427:365-71. [ Links ]
21. Wutikhun T, Ketchart O, Treetong A, Jaidee B, Warin C, Supaka N. Measurement and compare particle size determined by DLS, AFM and SEM. J Microsc Soc Thai. 2012; 5(1-2):38-41. [ Links ]
22. Kuntsche J, Horst JC, Bunjes H. Cryogenic transmission electron microscopy (cryo-TEM) for studying the morphology of colloidal drug delivery systems. Int J Pharm. 2011; 417:120-37. [ Links ]
23. Kocbek P, Baumgartner S, Kristl J. Preparation and evaluation of nanosuspensions for enhancing the dissolution of poorly soluble drugs. Int J Pharm. 2006; 312(1-2):179-186. [ Links ]
24. Nakamoto K, Urasaki T, Hondo S, Murahashi N, Yonemochi E, Terada K, Evaluation of the crystalline and amorphous states of drug products by nanothermal analysis and Raman imaging, J Pharmaceut Biomed. 2013; 75:105-11. [ Links ]
25. Puri V, Dantuluri AK, Kumar M, Karar N, Bansal AK, Wettability and surface chemistry of crystalline and amorphous forms of a poorly water soluble drug, Eur J Pharm Sci. 2010; 40:84-93. [ Links ]
26. Patravale VB, Date AA, Kulkarni RM. Nanosuspension: a promising drug delivery strategy. J Pharm Pharmacol. 2004; 56:827-40. [ Links ]
27. Jia L, Wong H, Wang Y, Garza M, Weitman SD. Carbendazim: disposition, cellular permeability, metabolite identification, and pharmacokinetic comparison with its nanoparticle. J Pharm Sci. 2003; 92(1):161-72. [ Links ]
28. Hecq J, Deleers M, Fanara D, Vranckx H, Boulanger P, Le Lamer S, et al. Preparation and in vitro/in vivo evaluation of nano-sized crystals for dissolution rate enhancement of ucb-35440-3, a highly dosed poorly water-soluble weak base. Eur J Pharm Biopharm. 2006; 64(3):360-8. [ Links ]
29. Jia L, Wong H, Cerna C, Weitman SD. Effect of nanonization on absorption of 301029: ex vivo and in vivo pharmacokinetic correlations determined by liquid chromatography/mass spectrometry. Pharm Res. 2002; 19(8):1091-6. [ Links ]
30. Liversidge GG, Conzentino P. Drug particle size reduction for decreasing gastric irritancy and enhancing absorption of naproxen in rats. Int J Pharm.1995; 125:309-13. [ Links ]
31. Jinno J, Kamada N, Miyake M, Yamada K, Mukai T, Odomi M, et al. Effect of particle size reduction on dissolution and oral absorption of a poorly water-soluble drug, cilostazol, in beagle dogs. J Control Release. 2006; 111(1-2):56-64. [ Links ]
32. Kayser O, Olbrich C, Yardley V, Kiderlen AF, Croft SL. Formulation of amphotericin B as nanosuspension for oral administration. Int J Pharm. 2003; 254(1):73-5. [ Links ]
33. Kesteleyn B, Amssoms K, Schepens W, Hache G, Verschueren W, Van De Vreken W, et al. Design and synthesis of HIV-1 protease inhibitors for a long-acting injectable drug application. Bioorg Med Chem Lett. 2013; 23(1):310-7. [ Links ]
34. Merisko-Liversidge E, Liversidge GG, Cooper ER. Nanosizing: a formulation approach for poorly-water-soluble compounds. Eur J Pharm Sci. 2003; 18(2):113-20. [ Links ]
35. Schöler N, Krause K, Kayser O, Müller RH, Borner K, Hahn H, et al. Atovaquone nanosuspensions show excellent therapeutic effect in a new murine model of reactivated toxoplasmosis. Antimicrob Agents Chemother. 2001; 45:1771-9. [ Links ]
36. Liversidge GG, Cundy KC. Particle size reduction for improvement of oral bioavailability of hydrophobic drugs: I. Absolute oral bioavailability of nanocrystalline danazol in beagle dogs. Int J Pharm. 1995; 125:91-7. [ Links ]
37. Müller RH, Jacobs C, Kayser O. Nanosuspensions as particulate drug formulations in theraphy rationale for development and what we can expect for the future. Adv Drug Deliv Rev. 2001; 47:3-19. [ Links ]
38. Zuo B, Sun Y, Li H, Liu X, Zhai Y, Sun J, et al. Preparation and in vitro/in vivo evaluation of fenofibrate nanocrystals. Int J Pharm. 2013; 455:267-75. [ Links ]
39. Irizarry LD, Luu TH, McKoy JM, Samaras AT, Fisher MJ, Carias EE, et al. Cremophor EL-containing paclitaxel induced anaphylaxis: a call to action. Community Oncol. 2009; 6:132-4. [ Links ]
40. Rabinow B, Kipp J, Papadopoulos P, Wong J, Glosson J, Gass J, et al. Itraconazole IV nanosuspension enhances efficacy through altered pharmacokinetics in the rat. Int J Pharm. 2007; 339:251-60. [ Links ]
41. Böhm BHL. Herstellung und Charakterisierung von Nanosuspensionen als neue Arzneiform für Arzneistoffe mit geringer Bioverfügbarkeit. Ph.D. Thesis. Freie Universität Berlin, Alemania. 1999. [ Links ]
42. Xiong R, Lu W, Yue P, Xu R, Li J, Chen T, et al. Distribution of an intravenous injectable nimodipine nanosuspension in mice. J Pharm Pharmacol. 2008; 60:1155-9. [ Links ]
43. Ganta S, Paxton JW, Baguley BC, Garg S. Formulation and Pharmacokinetic evaluation of an asulacrine nanocrystalline suspension for intravenous delivery. Int J Pharm. 2009; 367:179-186. [ Links ]
44. Gao L, Zhang D, Chen M, Duan C, Dai W, Jia L, et al. Studies on pharmacokinetics and tissue distribution of oridonin nanosuspensions. Int J Pharm. 2008; 355:321-7. [ Links ]
45. Tang XJ, Fu YH, Meng QH, Li LM, Ying XY, Han M, et al. Evaluation of pluronic nanosuspensions loading a novel insoluble anticancer drug both in vitro and in vivo. Int J Pharmaceut. 2013; 456 (1): 243-50. [ Links ]
46. Du L, Li G, Jin Y, Wang L, Xu Q, Dong J. Riboflavin laurate nanosuspensions as an intramuscular injection for long-term riboflavin supplementation. Int J Pharm. 2013; 450:338-44. [ Links ]
47. Al Shaal L, Shegokar R, Müller RH. Apigenin smartCrystals for novel UV skin protection formulations. Presentado en Eighth European Workshop on Particulate Systems. 2010. Abstract no. 22. [ Links ]
48. Petersen R, inventor. Nanocrystals for use in topical cosmetic formulations and method of production thereof. United States Patent 2010/0047297 A1. 2010 Feb 25. [ Links ]
49. Piao H, Kamiya N, Hirata A, Fujii T, Goto M. A novel solid-in-oil nanosuspensión for transdermal delivery of diclofenac sodium. Pharm Res. 2008; 25:896-901. [ Links ]
50. Müller RH, Shegokar R, Singh KK. Positively charged nanostructured lipid carriers (NLC) for drug delivery by adhesion. Presentado en Ninth International Symposium on 'Advances in Technology and Business Potential of New Drug Delivery Systems'; Controlled Release Society-Indian Local Chapter; 2009 Feb 25-26; Mumbai, India. [ Links ]
51. Shegokar R, Al Shaal L, Müller RH. Local anesthetic nanocrystal as prolonged release formulation. Presentado en First Combined Annual Meeting of the International Pharmaceutical Federation, PSWC and AAPS; 2010 Nov 14-18; New Orleans, Louisiana; Abstract no. 2203. [ Links ]
52. Ali R, Jain GK, Iqbal Z, Talegaonkar S, Pandit P, Sule S, et al. Development and clinical trial of nano-atropine sulfate dry powder inhaler as a novel organophosphorous poisoning antidote. Nanomed: Nanotechnol, Biol Med. 2009; 5:55-63. [ Links ]
53. Hemandez-Trejo N, Kayser O, Steckel H, Müller RH. Characterization of nebulized bupravaquone nanosuspensions-effect of nebulization technology. J Drug Target. 2005; 13:499-507. [ Links ]
54. Chiang PC, Hu Y, Thurston A, Sommers CD, Guzova JA, Kahn LE, et al. Pharmacokinetic and pharmacodynamic evaluation of the suitability of using fluticasone and an acute rat lung inflammation model to differentiate lung versus systemic efficacy. J Pharm Sci. 2009; 98:4354-64. [ Links ]
55. Bucolo C, Maltese A, Puglisi G, Pignatello R. Enhanced ocular antiinflammatory activity of ibuprofen carried by an Eudragit RS100 nanoparticle suspension. Ophthalmic Res. 2002; 34:319-23. [ Links ]
56. Araújo J, Gonzalez E, Egea MA, Garcia ML, Souto EB. Nanomedicines for ocular NSAIDs: safety on drug delivery. Nanomed: Nanotechnol, Biol Med. 2009; 5:394-401. [ Links ]
57. Kassem MA, Abdel Rahman AA, Ghorab MM, Ahmed MB, Khalil RM. Nanosuspension as an ophthalmic delivery system for certain glucocorticoid drugs. Int J Pharm. 2007; 340:126-33. [ Links ]
58. Ali HSM, York P, Ali AMA, Blagden N. Hydrocortisone nanosuspensions for ophthalmic delivery: A comparative study between microfluidic nanoprecipitation and wet milling. J Control Rel. 2011; 149:175-81. [ Links ]
59. Skegokar R, Müller RH. Nanocrystals: Industrially feasible multifunctional formulation technology for poorly soluble actives. Int J Pharm. 2010; 399(1-2):129-39. [ Links ]














