Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.3 Ciudad de México jul./sep. 2013
Trabajo científico
Respuestas vasculares y cambios tisulares en riñón de ratas con hipertensión inducida con L-NAME: participación del sistema renina angiotensina
Vascular responses and tissular changes in kidney from rats with L-NAME induced hypertension: the renin-angiotensin role
Areli Gutiérrez-Pérez,1 José Rafael Rodríguez-Bonaparte,2 Salvador Manzo-Avalos,1 Daniel Godínez-Hernández,1 Homero Reyes-De la Cruz1
1 Instituto de Investigaciones Químico-Biológicas
2 Facultad de Ciencias Médicas y Biológicas Dr. Ignacio Chávez, Universidad Michoacana de San Nicolás de Hidalgo
Correspondencia:
Dr. Homero Reyes de la Cruz
Instituto de Investigaciones Químico-Biológicas
Universidad Michoacana de San Nicolás de Hidalgo
Edificio B3, Ciudad Universitaria, CP. 58030. Morelia,
Mich., México
Tel/Fax: +52 443 326 5788
e-mail: delacruz@umich.mx
Fecha de recepción: 26 de noviembre de 2012.
Fecha de recepción de modificaciones: 20 de mayo de 2013.
Fecha de aceptación: 01 de julio de 2013.
Resumen
Existe controversia con respecto a si los tratamientos antihipertensivos que inciden sobre el sistema renina angiotensina (SRA) son capaces de prevenir el desarrollo de complicaciones durante la hipertensión que pueden desencadenar la insuficiencia renal. En el presente trabajo se analizó la respuesta a la angiotensina II y los cambios tisulares renales durante la hipertensión subcrónica inducida en ratas con L-NAME, con y sin tratamiento antihipertensivo. Se observó que el captopril logró mantener activo el SRA para responder a los cambios vasculares que requiere el riñón aún después de establecida la hipertensión. El tratamiento antihipertensivo con captopril, y no con la hidralazina, retardó la aparición de modificaciones histológicas renales que podrían desencadenar la insuficiencia renal y la falla orgánica como complicación de la hipertensión arterial.
Palabras clave: hipertensión, cambios tisulares, captopril.
Abstract
There is a controversy about whether treatments that target the renin angiotensin system (RAS) are able to prevent complication development during hypertension that could cause kidney failure. In the present work the kidney's physiological state and tissular changes were analyzed during L-NAME-induced subchronic hypertension in rats with or without antihypertensive treatment. It was observed that captopril preserves RAS activity to respond to vascular changes required by the renal function even after hypertension establishment. Antihypertensive treatment with captopril but not with hydralazine, delays the appearance of histological modifications that could cause kidney failure and organic failure as a complication of arterial hypertension.
Key words: hypertension, tissular changes, captopril.
Introducción
La hipertensión arterial es una condición patológica caracterizada por un incremento de la presión arterial (presión arterial sistólica (PAS) >140 mm de Hg, y/o presión arterial diastólica (PAD) >90 mm de Hg),1 como consecuencia de cambios hemodinámicos macro y microvasculares. Además, en esta patología existe un desequilibrio entre los factores vasoconstrictores y vasodilatadores del organismo. Estos cambios que anteceden en el tiempo a la elevación de la presión, producen lesiones orgánicas específicas. En este sentido, uno de los principales órganos blanco de la hipertensión es el riñón, desarrollando a largo plazo hipertrofia renal e insuficiencia renal crónica.1
En México, el 30.8 % de la población de más de 20 años padece hipertensión, lo que representa a 17 millones de adultos. Más del 50 % de los hombres y más del 60 % de las mujeres de más de 60 años de edad padecen hipertensión. Estudios epidemiológicos han mostrado que las enfermedades cardiovasculares son la principal causa de muerte en casi todos los países del mundo incluido México.2
Actualmente se emplean distintos blancos terapéuticos en el tratamiento de la hipertensión, entre los que destacan: los canales de calcio de tipo L, los receptores adrenérgicos, el péptido angiotensina II (Ang II), el receptor AT1, la enzima convertidora de angiotensina (ECA), entre otros.3,4 Muchos de los blancos descritos anteriormente están involucrados en la regulación del sistema renina-angiotensina (SRA), que a su vez se considera como uno de los más importantes en el desarrollo y establecimiento de la hipertensión.5 Se sabe que como efecto predominante, la Ang II produce vasoconstricción en las células de músculo liso vascular a través de su interacción con el receptor AT1 y como consecuencia de la activación de la vía de transducción de señales río abajo del receptor.6 También, se ha demostrado la influencia de la Ang II en los procesos de angiogénesis, como promotor de la hipertrofia cardiaca y como un factor determinante en el desarrollo de la disfunción endotelial, entre otros.7
Por otro lado, la mayoría de los modelos de hipertensión conocidos, incluida la hipertensión en el humano, reproducen características comunes, entre ellas una disminución en la respuesta vasodilatadora al óxido nítrico. En este sentido, existe un modelo de hipertensión crónica que se logra por la administración a largo plazo del inhibidor de las óxido nítrico sintasas, el NG-nitro-L-arginina metil éster (L-NAME).8,9 Los principales cambios celulares observados durante la hipertensión en este modelo, están relacionados con la disfunción endotelial y el aumento en la resistencia vascular, además de provocar una intensa vasoconstricción renal, con marcada reducción del flujo sanguíneo renal y una ligera reducción en el índice de filtración glomerular.8 A nivel tisular, este modelo de hipertensión induce modificaciones histológicas tales como lesiones escleróticas en los vasos sanguíneos y en el glomérulo,10 provoca una reducción en el número de células endoteliales glomerulares y en los capilares peritubulares, glomeruloesclerosis,11 daño tubular y fibrosis intersticial en la zona medular renal.12
Este modelo de hipertensión por deficiencia de óxido nítrico permite analizar claramente un fenómeno renal llamado "autorregulación", por el cual el riñón mantiene un estado de equilibrio entre la vasodilatación arterial causada por el óxido nítrico y la vasoconstricción promovida por la Ang II para que se lleven a cabo las funciones de filtración, excreción y reabsorción renal.13
La gran mayoría de los estudios sobre el efecto de la hipertensión en los diferentes órganos se han realizado en modelos de hipertensión crónica y existen escasos reportes de los efectos en etapas tempranas de esta patología. Además, los resultados obtenidos con modelos de hipertensión crónica son controversiales respecto a si los tratamientos que inciden sobre el SRA son capaces de prevenir el desarrollo de complicaciones durante la hipertensión tales como la insuficiencia renal.13-16 Por esta razón, en el presente trabajo se estudiaron las respuestas presoras a la Ang II como reflejo del estado fisiológico renal, utilizando el sistema de órgano aislado y perfundido tipo Langendorff17 y se analizó si existen modificaciones histológicas con y sin tratamientos con captopril (que incide directamente sobre el SRA inhibiendo a la ECA) y la hidralazina (un vasodilatador con blancos independientes del sistema), usando como modelo ratas con hipertensión subcrónica inducida por la administración de L-NAME por cuatro semanas previas al tratamiento antihipertensivo.
Material y métodos
Reactivos
El captopril, la hidralazina, el L-NAME y la angiotensina II se obtuvieron de Sigma Chemical Co. (USA).
Manejo de animales
Los animales de laboratorio utilizados fueron sacrificados de acuerdo a los procedimientos establecidos en las regulaciones federales para el uso y cuidado de animales de laboratorio (NOM-062-ZOO-1999) de la Secretaría de Agricultura, Ganadería y Desarrollo Rural en México; y con la aprobación del Comité de Investigación y Ética Institucional de la Universidad Michoacana de San Nicolás de Hidalgo.
Grupos experimentales
Se emplearon ratas Wistar macho de 4 semanas de edad, las cuales se dividieron en 6 grupos, que a continuación se detallan:
GRUPO CONTROL (CT): ratas exentas de tratamiento (control).
GRUPO CAPTOPRIL (CP): ratas control tratadas con captopril (30 mg/kg/día).
GRUPO HIDRALAZINA (HD): ratas control tratadas con hidralazina (50 mg/kg/día).
GRUPO L-NAME (LN): ratas tratadas con L-NAME (50 mg/kg/día).
GRUPO L-NAME + CAPTOPRIL (LC): ratas hipertensas inducidas con L-NAME y tratadas con captopril (30 mg/kg/día).
GRUPO L-NAME + HIDRALAZINA (LH): ratas hipertensas inducidas con L-NAME y tratadas con hidralazina (50 mg/kg/día).
La hipertensión se indujo por medio de la administración del inhibidor de la síntesis de óxido nítrico: NG-nitro-L-arginina metil éster (L-NAME) hasta el término de los tratamientos y sacrificio de los animales. Los tratamientos se administraron por un total de ocho semanas. Para los grupos de ratas normotensas (CT, CP y HD), las primeras cuatro semanas se les dio agua sin ningún tratamiento adicional, y las siguientes cuatro semanas se les administró captopril para el grupo CP e hidralazina al grupo HD a las dosis antes mencionadas; el grupo CT continuó sólo con agua. En el caso de los grupos de ratas hipertensas (LN, LC y LH), las primeras cuatro semanas se les administró el inhibidor L-NAME y en las últimas cuatro se les dio captopril (grupo LC) e hidralazina (grupo LH) además del inhibidor; el grupo LN continuó con el tratamiento del inhibidor solamente. Debido a que la administración de los fármacos fue por vía oral, se midió el peso y el consumo de agua cada tercer día para ajustar las dosis. Después de dichos tratamientos se sacrificaron las ratas para realizar los ensayos propuestos.
Medición de los niveles de presión arterial
Se hizo una medición semanal de los niveles de presión arterial de los animales de todos grupos experimentales, utilizando un método pletismográfico no invasivo en la cola del animal. El sistema usado fue el LE 5007 (Letica, PanLab, Barcelona, España).
Los animales fueron adiestrados previamente para reducir el estrés que pudiera interferir en las mediciones de presión arterial. Las ratas conscientes se pusieron en un cuarto con temperatura controlada (30°C), fueron introducidas en cilindros plásticos para inmovilizarlas, dejando fuera de éstos la cola del animal. Posteriormente se les colocó un manguito en la cola y se procedió a realizar la lectura de la presión. Cada medición se realizó por triplicado.
Preparación de riñón aislado y perfundido. Sistema de órgano aislado tipo Langendorff
La preparaciones para órgano aislado se realizaron de acuerdo al protocolo de Sosa y cols.17 Se hicieron curvas dosis-respuesta graduales a la Ang II, administrando dosis crecientes de Ang II con rangos de concentración de 1x10-9 M a 1x10-5 M, por inyección énbolo, a través de la cánula insertada en la arteria renal para obtener incrementos de la presión de perfusión renal, como a continuación se describe. La solución de Ang II se preparó en el momento de su utilización al 0.5% de Na2CO3. Bajo anestesia profunda, se extrajo el riñón derecho y se canuló la arteria renal, para después montar el riñón en un sistema de órgano aislado tipo Langendorff. El riñón se perfundió con solución de Krebs-Henseleit, a pH 7.4, burbujeada con una mezcla de 95% de O2-5% de CO2 y se mantuvo a 37 °C hasta la estabilización de la presión de perfusión. El flujo se ajustó a 10 ml/min para obtener una presión basal de perfusión. El incremento en la presión de perfusión se midió utilizando un transductor de presión (Grass, FT03) acoplado a un sistema de adquisición de datos (Biopac, MP100). Los cambios en la presión de perfusión se interpretaron como un índice de aumento en la resistencia arterial renal y, por lo tanto, como un efecto vasoconstrictor.
Medición del índice de hipertrofia renal
Para evaluar de manera indirecta la hipertrofia renal, se calculó el índice de hipertrofia para el cual, se obtiene el peso húmedo del órgano y se divide por el peso del animal completo.
Preparaciones histológicas del riñón
El riñón completo se perfundió con paraformaldehído al 4% hasta la eliminación total de la sangre. A continuación se llevó a cabo el fijado del tejido dejando el órgano 24-48 hr en paraformaldehído al 4%, seguido de tres pasos de deshidratación en soluciones de sacarosa al 10%, 20% y 30%, respectivamente. Posteriormente el riñón completo se incluyó en una matriz crioprotectora de OCT y se almacenó a -20° C. Después, se procedió a hacer los cortes histológicos de 10 μm de espesor en un criostato (Hyrax C25, Zeiss), para enseguida teñirlos empleando la técnica de hematoxilina-eosina (H-E). Finalmete, se analizaron las laminillas en un microscopio óptico en campo claro (Leica DM3000) y se capturaron las imágenes para evaluar cualquier modificación en las estructuras renales.
Resultados y discusión
Inducción de la hipertensión con L-NAME en ratas
Con la finalidad de validar el modelo de hipertensión inducida con la administración de L-NAME, se llevó a cabo la medición de los niveles de presión arterial de las ratas antes y durante los tratamientos (Figura 1). Dichos niveles se mantuvieron en valores normales en el grupo control durante las 8 semanas de medición. En los grupos L-NAME o ratas hipertensas (LN), se observó un incremento gradual de la presión arterial, alcanzando niveles de hipertensión por arriba de 140 mmHg en la semana 2 de tratamiento. Al inicio de los tratamientos antihipertensivos, esto es, a partir de la cuarta semana, observamos que en los grupos con tratamiento captopril (CP) e hidralazina (HD) en ratas normotensas, no hubo cambios significativos en los valores respecto del grupo control manteniendo niveles normales de presión arterial. En los grupos de ratas hipertensas tratadas con captopril (LC) e hidralazina (LH) a partir de la cuarta semana se observó una disminución paulatina de los niveles de presión arterial sistólica hasta llegar a niveles normales en la última semana del tratamiento.
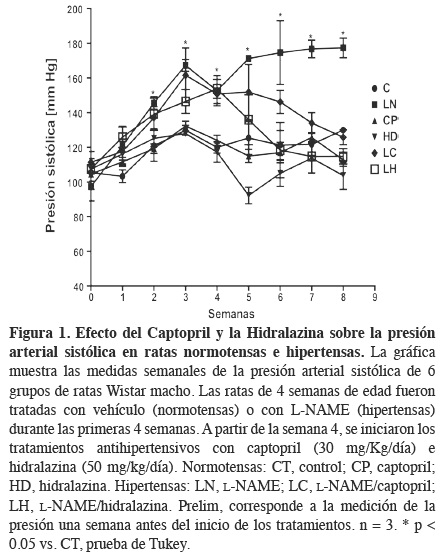
Estos datos demuestran que la administración de L-NAME, un inhibidor de las óxido nítrico sintasas, nos permite obtener un modelo adecuado de hipertensión subcrónica inducida por deficiencia del óxido nítrico en las ratas. Nuestros datos concuerdan con los hallazgos de Baylis y cols18 y Ribeiro y cols,19 donde establecen que la administración de L-NAME eleva los niveles de presión sistémica por arriba de los 140 mmHg, cifra limítrofe para el diagnóstico de hipertensión arterial. Además, las dosis de los tratamientos antihipertensivos administradas a los animales, son efectivas en la disminución de arterial. Además, las dosis de los tratamientos antihipertensivos administradas a los animales, son efectivas en la disminución de los niveles de presión en las ratas hipertensas y no causan modificación en la presión arterial sistémica de las ratas normotensas.
Evaluación de las respuestas vasculares renales promovidas por la administración de dosis crecientes de Angiotensina II
Para evaluar la respuesta renal a la Ang II, se midieron los cambios en la presión de perfusión en respuesta a dosis crecientes de Ang II en los riñones extraídos de los animales de todos los grupos experimentales mencionados anteriormente, utilizando el modelo de órgano aislado y perfundido tipo Langendorff. Este modelo nos permite evaluar respuestas vasculares manteniendo el órgano aislado, en las condiciones más cercanas al estado fisiológico.17 Fue de nuestro interés analizar el estado del sistema renina-angiotensina por su relevancia en el origen y establecimiento de la hipertensión y como uno de los principales mecanismos de regulación renal sobre la presión arterial sistémica.5
Después de montar los riñones, se dejó un periodo de estabilización de 15 minutos, posteriormente con el fin de analizar el estado fisiológico inicial de cada riñón montado, se midió la presión de perfusión basal (Figura 2), donde se observó una disminución significativa en los niveles de la presión de perfusión basal sólo en los riñones de ratas normotensas tratadas con el captopril (CP) en comparación con el grupo control (CT), sugiriendo una predominancia de los factores vasodilatadores en el órgano, causada por el tratamiento antihipertensivo que a nivel local actúa como un hipotensor. Ninguno de los otros tratamientos modificó los niveles de perfusión basal.

Posteriormente, se realizaron curvas dosis-respuesta a la Ang II utilizando un rango de concentraciones entre 1x10-9 M y 1x10-5 M en los riñones obtenidos de los animales de todos los tratamientos. Primero se compararon los efectos de las diferentes concentraciones de Ang II en los riñones del grupo control (CT) contra el grupo hipertenso (LN), en este análisis no se observaron diferencias significativas en el incremento de la presión de perfusión en ambos grupos (Figura 3). Se esperaba que en el grupo de las ratas hipertensas, existiera un estado de hiperreactividad a la Ang II, sin embargo, no ocurrió así, lo cual indica que en nuestro modelo de hipertensión subcrónica, aún no se perciben cambios en la repuesta renal a la Ang II, además de que es posible que exista una activación de la producción de sustancias vasodilatadoras como las prostaglandinas,20 como un efecto compensatorio por la inhibición de la síntesis de óxido nítrico a nivel renal.

Para evaluar las respuestas vasculares en respuesta a la Ang II promovidas por los tratamientos con captopril o hidralazina en ratas normotensas, se compararon las curvas obtenidas de estos grupos (Figura 4). En los grupos de ratas normotensas (CT) y con tratamientos con captopril o hidralazina (CP y HD, respectivamente), tampoco se observaron diferencias significativas en la respuesta a la Ang II. Sin embargo, la Figura 4 reveló que las curvas de los riñones provenientes de los grupos con tratamientos antihipertensivos, tienen un ligero desplazamiento hacia la izquierda, es decir, un ligero aumento en la sensibilidad de la respuesta presora a la Ang II, indicando que aunque las dosis de antihipertensivos utilizadas no provocaron cambios de presión arterial a nivel sistémico (Figura 1), sí se observaron ligeras modificaciones a nivel renal. Al emplear el tratamiento con captopril, se observó la inhibición del sistema renina-angiotensina, que en condiciones normales se compensa, ya sea por elevar el número de receptores AT1 o bien, por un mejor acoplamiento de la cascada de señalización intracelular como lo mencionan Zicha y Kuneš5 y Navar y cols.21 En el grupo donde se administró el tratamiento con hidralazina, este cambio de sensibilidad a la Ang II, puede explicarse a través de una regulación a la alta5,21 del sistema renina-angiotensina, en respuesta a la disminución en el tono vascular renal provocado por el efecto vasodilatador de la hidralazina, para mantener las condiciones de presión del órgano.

Al comparar la respuesta presora a la Ang II en riñones de ratas hipertensas (LN) contra los de las ratas hipertensas con tratamiento con captopril (LC) o hidralazina (LH) (Figura 5), se encontró un aumento en la respuesta a la Ang II, únicamente en los riñones obtenidos de las ratas hipertensas tratadas con captopril (LC), desde la concentración 1x10-75 M y hasta la concentración 1x10-6. Estos datos nos indican un aumento en la reactividad a la Ang II debido al tratamiento con captopril durante la hipertensión, puesto que por separado, ni el L-NAME (Figura 3) ni el captopril (Figura 4), inducen cambios en la respuesta renal a la Ang II, a pesar de que el L-NAME induce la hipertensión sistémica (Figura 1). El tratamiento con hidralazina promueve también un aumento en la respuesta presora a la Ang II, sin embargo, esta es de menor magnitud y no es estadísticamente significativo, lo que nos indica que no existe alguna interacción entre el mecanismo de acción de la hidralazina con el sistema renina-angiotensina, ya que su mecanismo farmacológico promueve una predominancia del estado vasodilatador a través de la inhibición de la translocación de calcio del retículo sarcoplásmico hacia el citoplasma, bloqueando así la vía clásica de contracción celular22 y probablemente afecta la función renal, debido a que no podría responder tan rápidamente a los cambios de presión requeridos para su función. Además, el detectar un aumento en la presión de perfusión con el tratamiento con captopril, puede interpretarse como la forma que tiene el riñón de responder a cambios en la presión arterial sistémica y a las demandas de su propia función. Sin embargo, la magnitud de la respuesta parece independiente del componente hemodinámico, es decir, de la sola disminución de los niveles de presión arterial sistémica y parece más relacionada con el mecanismo farmacológico de cada uno de los tratamientos. En el caso del tratamiento con captopril, cuyo mecanismo de acción incide directamente sobre el SRA, se observó una mayor reactividad a la Ang II respecto al tratamiento con hidralazina, sugiriendo que al actuar inhibiendo el SRA, probablemente se activan mecanismos para llevar a cabo una regulación a la alta del mismo, tales como un aumento en el número de receptores o un mejor acoplamiento de la vía transduccional,5 además de que el riñón cuenta con una fina regulación en cuanto a la localización, almacenamiento y diferencia de efectos del sistema renina-angiotensina local21 para llevar a cabo sus funciones de filtración, reabsorción y eliminación.
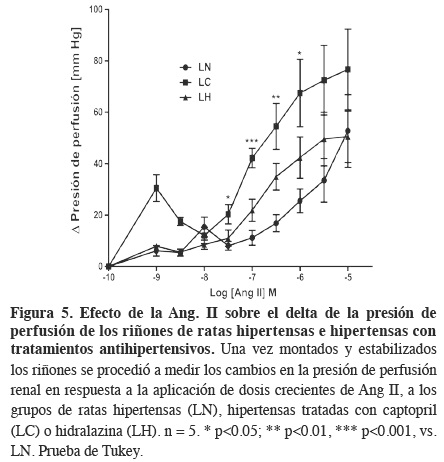
Todos los datos anteriores validan el modelo de hipertensión subcrónica utilizado, donde se tienen animales con la presión arterial sistólica por arriba de los 140 mmHg, indicativos de la hipertensión y con cambios ligeros en las respuestas vasculares expresadas en función de la presión de perfusión renal, obtenidas en nuestro modelo de órgano aislado y perfundido, de los grupos de ratas hipertensas tratadas con captopril. Sin embargo, no se pueden descartar hasta ahora, alteraciones a nivel celular en el tejido renal.
Medición del índice de hipertrofia en el riñón
Se ha descrito bastante acerca del desarrollo de hipertrofia como una consecuencia de la hipertensión arterial crónica en el corazón. Se sabe que el mantenimiento de niveles de presión arterial sistémica por arriba de los 140/90 mmHg provoca la hipertrofia del ventrículo izquierdo cardiaco con complicaciones fatales a largo plazo,23 sin embargo, en el caso del riñón, es complejo establecer la hipertrofia debido a que su aparición es multifactorial.
Fine en 198624 describió la dependencia de la edad, el estímulo, el factor hormonal, la disponibilidad de nutrientes, el tiempo de la patología, entre otros factores que van a definir si se activará la vía para producir hipertrofia; también mencionó que existen otras modificaciones estructurales en el riñón, que aunque previas al desarrollo de hipertrofia, son indicativos de daño renal.24 Para evaluar de manera indirecta la aparición de modificaciones en el riñón y en especial la presencia de hipertrofia en el órgano, se calculó el índice de hipertrofia que se obtiene del cociente del peso húmedo del órgano y el peso del animal completo (Figura 6).

En nuestras condiciones no se observaron diferencias significativas entre los tratamientos. En los grupos de ratas hipertensas inducidas con L-NAME, a pesar de observar un incremento sostenido en la presión arterial sistémica, no se detectó de manera macroscópica, la hipertrofia en el riñón. Sin embargo, como se mencionó anteriormente, el hecho de no encontrar cambios en el índice de hipertrofia renal, valida nuevamente nuestro modelo y tampoco descarta la aparición de cambios morfológicos adicionales en el riñón a nivel tisular, que se vean reflejados en una futura disminución de la función renal.
Evaluación de las modificaciones histológicas en el riñón
Para determinar la existencia de cambios tisulares en el riñón de las ratas hipertensas y el efecto de los tratamientos antihipertensivos en dicho órgano, se realizaron cortes transversales del riñón completo de cada uno de los grupos tratados, donde se analizó la morfología de las diferentes estructuras renales. Posteriormente, los cortes se tiñeron empleando la técnica de hematoxilina-eosina, que tiñe de color azul los núcleos celulares y de rojo el citoplasma y los componentes de naturaleza proteica.25 El análisis se realizó en las dos divisiones histológicas que componen al riñón, la corteza y la médula. En la primera se evaluó el tamaño y la celularidad de los glomérulos, y la relación ovillo glomerular-cápsula de Bowman. Los aspectos tubulares evaluados fueron el diámetro, el grosor de la pared y la presencia de material eosinófilo y hialino. En el espacio intersticial y la región medular, se analizó la composición del tejido conectivo, el número de vasos sanguíneos por campo y la cantidad de volumen sanguíneo contenido, además de la búsqueda de datos compatibles con edema.
En los cortes histológicos de riñones de ratas normotensas (grupo CT) (Figura 7 A-C), se observan glomérulos de tamaño normal, así como el número de las células mesangiales, la relación entre el ovillo glomerular y el espacio de Bowman está conservada. En la Figura 7B se aprecian túbulos sin alteraciones en el tamaño ni en la luz, espacio intersticial de contenido homogéneo, sin dato de fibrosis o infiltrado celular inflamatorio. Respecto a los vasos sanguíneos, no hay datos de vasocongestión o disminución del volumen sanguíneo que indiquen compromiso de la perfusión renal (Figura 7C).

En los cortes histológicos de riñones de ratas normotensas tratadas con captopril (CP) (Figura 7 D-F), se aprecian glomérulos de tamaño normal. En la Figura 7E se observa un glomérulo con un ligero aumento en la celularidad en el mesangio y el espacio de Bowman. La zona intersticial no presenta alteraciones, se detecta una leve disminución de la luz tubular a expensas de células y vasos sanguíneos en contrasentido por el corte, pero sin alteraciones.
Al corte histológico de riñones de ratas normotensas tratadas con hidralazina (HD) (Figura 7 G-I), se observa una ligera pérdida de la relación entre capilares glomerulares y espacio de Bowman. Se aprecia una mayor cantidad de material eosinófilo en comparación de un glomérulo normal, sugiriendo la presencia de un depósito de proteína en la matriz mesangial, también se observa un aumento en el número de células en el espacio intersticial (Figura 7 G-H). En la Figura 7I se observa que los capilares medulares contienen una menor cantidad de sangre al interior de su luz, debido a la redistribución sanguínea provocada por la vasodilatación producida por el fármaco.
En los cortes histológicos de ratas hipertensas (LN) (Figura 8 A-C), en la zona cortical (Figura 8A) se observa una marcada disminución en el número de glomérulos, este dato sugiere una permanencia de un estímulo lesivo que sobrepasó los límites adaptativos, teniéndose como consecuencia una lesión irreversible en el tejido renal, que se traduce en la pérdida de los glomérulos durante la hipertensión.26

Los glomérulos observados (Figura 8B), presentan hiperplasia de los capilares glomerulares y en consecuencia la pérdida total de la relación ovillo glomerular-espacio de Bowman, siendo el espacio urinario el que ocupa la mayor parte del glomérulo. Este fenómeno obedece a la hiperplasia e hipertrofia compensadora que aumenta la capacidad funcional de un tejido cuando se ve sometido al aumento de la presión intraglomerular por un estadio de sobrecarga hemodinámica continua, como es la hipertensión arterial.26
Se aprecia también una disminución de los componentes en el espacio intersticial que se explica por los cambios isquémicos producidos por las modificaciones en el tono vascular de las arteriolas aferente y eferente. En este punto, la Ang II provee un soporte adicional para mantener la filtración glomerular, a pesar de que la presión de perfusión disminuya.27 Se observa un aumento de la celularidad en el glomérulo y una marcada eosinofilia en la matriz mesangial, evidenciada por un aumento en su grosor.
Las células del mesangio son capaces de secretar factores que promueven el depósito de colágeno y posterior desarrollo de glomeruloesclerosis en la lesión crónica que repercuten directamente en el aspecto hemodinámico.26 Se encontró un aumento en el grosor de la pared de las arteriolas a expensas de mayor celularidad y tejido fibroso, este fenómeno se conoce como fibrosis arteriocapilar y habla de proliferación del músculo liso y sustitución del tejido por fibrosis.28
En la Figura 8C se observa que los capilares de la región medular presentan una marcada vasocongestión como resultado de un proceso de remodelación vascular que se manifiesta como una alteración en el diámetro de la luz con marcada reducción del flujo sanguíneo e incremento en la resistencia vascular.28 Todos los cambios morfológicos descritos anteriormente son consistentes con arterioesclerosis y modificaciones túbulointersticiales que hablan de una función renal disminuida.
En los cortes de ratas hipertensas con tratamiento captopril (LC) (Figura 8 D-F), se observa el número de glomérulos por campo dentro de los límites normales, sin alteración de la celularidad glomerular, una relación ovillo glomerular-espacio de Bowman conservada, y túbulos y vasos sanguíneos de calibre normal. Por lo tanto, existe una marcada reversión de los cambios estructurales adaptativos del riñón como resultado del tratamiento antihipertensivo administrado en etapas tempranas del establecimiento de la hipertensión subcrónica inducida con L-NAME. Se observa el fenómeno de angioesclerosis presente en los cortes de riñón de ratas hipertensas (LN) (Figura 8C), sin embargo con un grado mucho menor. En la Figura 8F se aprecian los capilares medulares sin alteraciones.
En los cortes de ratas hipertensas con tratamiento antihipertensivo hidralazina (LH) (Figura 8 G-I), se observa un número normal de glomérulos en la región cortical, aumento importante del espacio luminal de túbulos y vasos sanguíneos en comparación con la rata hipertensa sin tratamiento (LN) y la tratada con captopril (LC). En la Figura 8H no se aprecia disminución de la luz tubular por aumento en la celularidad; sin embargo, existe una gran cantidad de material hialino y eosinófilo homogéneo, depositado en la luz tubular. La Figura 8I muestra una disminución en la presencia de sangre intravascular por un fenómeno de redistribución sanguínea hacia los glomérulos para conservar la función renal.
Estos hallazgos sugieren que la hipertensión subcrónica causa modificaciones tisulares en el riñón que desencadenan a largo plazo un daño renal y por lo tanto la complicación de la patología. Nuestros datos concuerdan con los cambios histológicos reportados por Zatz y Baylis8, Boffa y cols10, y Bouriquet y cols29; en el modelo de hipertensión inducida con L-NAME.
Para los cortes de riñón de ratas hipertensas con tratamiento antihipertensivo con captopril observamos una restitución casi completa de la arquitectura renal normal, tanto en la zona cortical como en la medular (Figura 8 D-F).
En los cortes de riñón de ratas hipertensas con tratamiento antihipertensivo con hidralazina (LH) (Figura 8 G-I), encontramos cambios adaptativos primarios que en la hipertensión crónica se pueden convertir en una lesión irreversible del tejido renal con la consiguiente disminución de la función.
Conclusiones
El riñón desempeña una función muy importante en la regulación de los niveles de presión arterial sistémica; sin embargo, él mismo cuenta con mecanismos complejos en el manejo de las resistencias vasculares a su interior para llevar a cabo sus múltiples funciones de filtración, excreción y reabsorción. El equilibrio entre el sistema renina angiotensina local renal y la síntesis de óxido nítrico permiten la existencia de gradientes de presión arterial en el interior del órgano, compartamentalizados de acuerdo a la función que se realiza en cada zona renal. Durante la hipertensión arterial se presenta la disfunción endotelial, donde se provoca un desajuste entre los factores vasoconstrictores y vasodilatadores, lo que dificulta un correcto control de las resistencias vasculares renales y por lo tanto existen cambios que intentan suplir las funciones perdidas y que desencadenan invariablemente en insuficiencia renal. Nosotros encontramos que el tratamiento antihipertensivo con captopril logra mantener activo el SRA para responder a los cambios vasculares que requiere la función renal aún después de establecida la hipertensión.
El tratamiento antihipertensivo con captopril, y no con hidralazina, retarda la aparición de modificaciones histológicas renales que desencadenan la insuficiencia renal y la falla orgánica como complicación de la hipertensión arterial.
Por lo tanto, el bloqueo del SRA ayuda a prevenir el daño renal y mejora las respuestas vasculares renales aún después de establecida la hipertensión.
Agradecimientos
Este trabajo se desarrolló con el apoyo de los proyectos CONACyT No. 25540 y CIC-UMSNH No. 2.27 y 2.36 2010 y 2011. AGP es becaria de CONACYT con número 21552. Agradecemos a las D en C Alma Lilia Fuentes-Farías y Esperanza Meléndez-Herrera del Instituto de Investigaciones sobre Recursos Naturales de la UMSNH por el apoyo técnico en la parte histológica.
Referencias
1. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL, Jones DW, Materson BJ, Oparil S, Wright JT, Roccella EJ. Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension. 2003; 42(6):1206-52. [ Links ]
2. Instituto Nacional de Salud Pública, Secretaría de Salud. Encuesta Nacional de Salud y Nutrición 2006. 2007. http://www.insp.mx/ensanut/ensanut2006.pdf. Acceso 26 Nov 2012. [ Links ]
3. Swift PA, MacGregor GA. The frequent need for three or more drugs to treat essential hypertension. What evidence for optimal combinations? J Renin-Angio-Aldo S. 2002; 3(2):103-108. [ Links ]
4. Kalra S, Kalra B, Agrawal N. Combination therapy in hypertension: An update. Diabetol Metab Syndr. 2010; 2(1):44. [ Links ]
5. Zicha J, Kuneš J. Ontogenetic aspects of hypertension development: Analysis in the rat. Physiol Rev. 1999; 79(4):1227-82. [ Links ]
6. Mehta PK, Griendling KK. Angiotensin II cell signaling: physiological and pathological effects in the cardiovascular system. Am J Physiol-Cell Ph. 2007; 292(1):C82-C97. [ Links ]
7. Kim S, Iwao H. Molecular and cellular mechanisms of angiotensin II-mediated cardiovascular and renal diseases. Pharmacol Rev. 2000; 52(1):11-34. [ Links ]
8. Zatz R, Baylis C. Chronic nitric oxide inhibition model six years on. Hypertension. 1998; 32(6):958-964. [ Links ]
9. Zhao Q, Egashira K, Inoue S, Usui M, Kitamoto S, Ni W, Ishibashi M, Hiasa K, Ichiki T, Shibuya M, Takeshita A. Vascular endothelial growth factor is necessary in the development of arteriosclerosis by recruiting/activating monocytes in a rat model of long-term inhibition of nitric oxide synthesis. Circulation. 2002; 105(9):1110-15. [ Links ]
10. Boffa J-J, Ying L, Dussaule J-C, Chatziantoniou C. Improvements of renal lesions and function by angiotensin and endothelin receptor antagonism in nitric oxide-deficient rats. J Renin-Angio-Aldo S. 2001; 2(1 suppl):S211-S216. [ Links ]
11. Kang D-H, Nakagawa T, Feng L, Johnson RJ. Nitric oxide modulates vascular disease in the remnant kidney model. Am J Pathol. 2002; 161(1):239-248. [ Links ]
12. Polichnowski AJ, Lu L, Cowley AW. Renal injury in angiotensin II+l-NAME-induced hypertensive rats is independent of elevated blood pressure. Am J Physio-Renal Physiol. 2011; 300(4):F1008-F1016. [ Links ]
13. Staessen JA, Richart T, Wang Z, Thijs L. Implications of recently published trials of blood pressure-lowering drugs in hypertensive or high-risk patients. Hypertension. 2010; 55(4):819-831. [ Links ]
14. Matsumoto K, Morishita R, Moriguchi A, Tomita N, Yo Y, Nishii T, Matsumoto K, Nakamura T, Higaki J, Ogihara T. Prevention of renal damage by Angiotensin II blockade, accompanied by increased renal hepatocyte growth factor in experimental hypertensive rats. Hypertension. 1999; 34(2):279-284. [ Links ]
15. Kett MM, Alcorn D, Bertram JF, Anderson WP. Enalapril does not prevent renal arterial hypertrophy in spontaneously hypertensive rats. Hypertension. 1995; 25(3):335-342. [ Links ]
16. Kurtz TW, Pravenec M. Molecule-specific effects of Angiotensin II-receptor blockers independent of the renin-angiotensin system. Am J Hypertens. 2008; 21(8):852-859. [ Links ]
17. Sosa-Luna CA, Astudillo de la Vega H, Sánchez-González DJ, Martínez-Salas SG, Valdez-Espinosa R, Villalobos-Molina R, Ibarra-Barajas M. Óxido nítrico y prostaglandinas en la regulación endotelial del tono contráctil en la vasculatura renal de ratas hipertensas. Rev Sanid Milit Mex. 2005; 59(1):32-50. [ Links ]
18. Baylis C, Mitruka B, Deng A. Chronic blockade of nitric oxide synthesis in the rat produces systemic hypertension and glomerular damage. J Clin Invest. 1992; 90(1):278-281. [ Links ]
19. Ribeiro MO, Antunes E, de Nucci G, Lovisolo SM, Zatz R. Chronic inhibition of nitric oxide synthesis. A new model of arterial hypertension. Hypertension. 1992; 20(3):298-303. [ Links ]
20. Perinotto P, Biggi A, Carra N, Orrico A, Valmadre G, Dall'aglio P, Novarini A, Montanari A. Angiotensin II and prostaglandin interactions on systemic and renal effects of l-NAME in humans. J Am Soc Nephrol. 2001; 12(8):1706-12. [ Links ]
21. Navar LG, Harrison-Bernard LM, Nishiyama A, Kobori H. Regulation of intrarenal Angiotensin II in hypertension. Hypertension. 2002; 39(2):316-322. [ Links ]
22. Ellershaw DC, Gurney AM. Mechanisms of hydralazine induced vasodilation in rabbit aorta and pulmonary artery. Br J Pharmacol. 2001; 134(3):621-631. [ Links ]
23. Richey PA, DiSessa TG, Somes GW, Alpert BS, Jones DP. Left ventricular geometry in children and adolescents with primary hypertension. Am J Hypertens. 2009; 23(1):24-29. [ Links ]
24. Fine L. The biology of renal hypertrophy. Kidney Int. 1986; 29(3):619-634. [ Links ]
25. Genesser F. Histología. 3a Ed. Editorial Médica Panamericana; 2000, p.39-40, 555-575. [ Links ]
26. Kumar V, Abbas A, Fausto N, Aster J. Robbins y Cotran Patología estructural y funcional. 8a Ed. Barcelona; 2005. [ Links ]
27. Palmer BF. Renal dysfunction complicating the treatment of hypertension. N Engl J Med. 2002; 347(16):1256-61. [ Links ]
28. Johnson RJ, Herrera-Acosta J, Schreiner GF, Rodríguez-Iturbe B. Subtle acquired renal injury as a mechanism of salt-sensitive hypertension. N Engl J Med. 2002; 346(12):913-923. [ Links ]
29. Bouriquet N, Casellas D. Chronic L-NAME hypertension in rats and autoregulation of juxtamedullary preglomerular vessels. Am J Physiol-Renal Physiol. 1995; 269(2):F190-F197. [ Links ]














