Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.2 Ciudad de México abr./jun. 2013
Trabajo científico
La nitroglicerina no previene la osteopenia en ratas hembras Long Evans adultas jóvenes ovariectomizadas*
Nitroglycerin does not prevent bone loss in ovariectomized young adult female Long Evans rats
René Valdez-Mijares,1 Rebecca E. Franco-Bourland,1 Alejandra Quintana-Armenta,1 Lidia Ruiz-Rosano,1 Víctor M. Domínguez-Hernández,2 Víctor M. Araujo-Monsalvo,2 Cecilia Hernández-Flores1
1 Servicio de Bioquímica, Instituto Nacional de Rehabilitación
2 Laboratorio de Biomecánica, Instituto Nacional de Rehabilitación
Correspondencia:
Dra. en C.Q. Rebecca E. Franco y Bourland
Servicio de Bioquímica
Instituto Nacional de Rehabilitación
Calzada México-Xochimilco 289.
Colonia Arenal de Guadalupe, Delegación Tlalpan
14389 México, D.F., México.
Tel. (01-55) 59-99-10-00 Ext. 19504, 19508.
refrancobourland@gmail.com
Fecha de recepción: 19 de diciembre de 2012.
Fecha de recepción de modificaciones: 08 de mayo de 2013.
Fecha de aceptación: 21 de mayo de 2013.
Resumen
La integridad ósea depende de concentraciones bajas de óxido nítrico (NO·). Con el propósito de prevenir la pérdida de hueso en ratas Long Evans hembras adultas jóvenes ovariectomizadas bilateralmente (OVX), administramos nitroglicerina (NG), un donador de NO·. Sesenta ratas, de 250-330g de peso corporal (pc), fueron distribuidas de acuerdo a su peso en 9 grupos homogéneos: 3 OVX, 3 OVX-simulados (SIM) y 3 OVX-tratados (OVX-t). La NG se aplicó transdérmicamente a dosis de 25 y 50 μg/250g de pc/día durante 28 días; ratas OVX y SIM recibieron aceite mineral. Las pruebas bioquímicas (fosfatasa alcalina sérica, desoxipirridinolina urinaria) e histológicas de tibia (densidad y grosor del hueso trabecular), revelaron que la NG no previno la osteopenia en ratas OVX.
Palabras clave: Modelo experimental murino, osteoporosis, óxido nítrico.
Abstract
Bone integrity depends on low nitric oxide (NO·) concentrations. With the purpose of preventing the loss of bone in young adult female Long Evans rats bilaterally ovariectomized (OVX), we administered nitroglycerine (NG), a NO· donor. Sixty rats weighing 250-330 g body weight (bw) were distributed according to weight into 9 homogeneous groups: 3 OVX, 3 sham-OVX (SIM), and 3 treated-OVX (OVX-t). NG was given transdermally at a dose of 25 and 50 μg/250g bw/day for 28 days; OVX and SIM rats received mineral oil instead. Biochemical tests (serum alkaline phosphatase and urinary deoxypyrridinoline) and tibial histology (trabecular bone density and thickness) revealed that NG did not prevent osteopenia in OVX rats.
Key words: Murine experimental model, osteoporosis, nitric oxide.
Introducción
El óxido nítrico (NO·) es un radical libre gaseoso con potente acción reguladora sobre el metabolismo óseo.1-5 Es producto de la oxidación de la L-arginina en reacciones catalizadas por sintasas del NO· (NOS). La relevancia del NO· en hueso es evidente con la presencia en este tejido de las 3 isomorfas que se conocen de la enzima,6 la NOS endotelial (NOSe), la isomorfa predominante, 6,7,8 la NOS inducible (NOSi) 5,7,9 y la NOS neuronal (NOSn).10,11,12
Se ha especulado que en ratas con deficiencia de estrógeno, la osteopenia pudiera atribuirse, por lo menos en parte, a una disminución en la actividad de la NOSe12,13 y por ende una disminución en los niveles óseos de NO·. Wimalawansa et al.14,15,16 primero y luego Hukkanen et al.17 y Hao et al.,18 reportaron que la administración transdérmica de nitroglicerina (NG), un donador de NO·, aparentemente prevenía la pérdida de masa ósea en ratas ovariectomizadas (OVX), observaciones que pronto llegaron a la clínica19-24 apoyando moderadamente,19,23 apoyando con reservas20,21,22 o no apoyando24 el uso del fármaco en el manejo de la osteoporosis.
La perspectiva de un posible tratamiento económico para la población creciente de mexicanos con osteoporosis, de bajos recursos, fue la pauta para que nosotros incursionáramos en este terreno.
Dado que los resultados iniciales reportados en los modelos experimentales estaban apoyados en mediciones densitométricas a las 6 (Wimalawansa et al, 1996) y a las 4 semanas (Hukkanen et al, 2003) de iniciado el tratamiento con NG, vimos la necesidad de la reevaluación de estos reportes. La densitometría se considera un procedimiento confiable para el diagnóstico inicial de la osteoporosis/osteopenia, pero no para el seguimiento a corto plazo del efecto de algún tratamiento para controlar la pérdida de masa ósea. Para tal seguimiento se recomienda el uso de marcadores óseos en suero y orina. De hecho, sólo Hukkanen et al. 2003 acompañaron sus estudios densitométricos con mediciones de desoxipirridinolina (DPD), un marcador de resorción ósea urinario, que notablemente no disminuyó significativamente después de la administración de NG, a pesar de sus propios resultados densitométricos que sugerían la preservación de la masa ósea en las ratas OVX en respuesta al fármaco.
Basados en la hipótesis del efecto osteoprotector de la NG en animales deficientes en estrógenos, nos dimos a la tarea de reevaluar los efectos reportados para la NG transdérmica en ratas OVX midiendo DPD urinario y fosfatasa alcalina (FA) sérica, marcadores bioquímicos de resorción ósea y recambio óseo, respectivamente, así como pruebas biomecánicas y mediciones anatómicas de fémures y tibias y la respuesta metabólica global al fármaco a través de los cambios en su peso corporal.
Material y métodos
Ratas hembras vírgenes Long-Evans (n=60) de 15 -18 semanas de edad y 250-330g de peso corporal (pc), fueron mantenidas y manipuladas conforme a la norma oficial NOM-062-Z00-1999, habituadas dos semanas previas al estudio en jaulas metabólicas a 20-21° C, con ciclos de luz/obscuridad de 12h, alimentadas con una dieta comercial pulverizada y libre acceso a agua purificada cuyo consumo se registró diariamente durante los 28 días que duró el experimento.
Un grupo de 40 ratas fue OVX bilateralmente por aproximación dorsal bajo anestesia con una combinación de ketamina/xilazina (16.25 mg/2.5 mg por 250 g de pc). Los ovarios fueron extirpados y los oviductos cuidadosamente ligados con Mononylon 3-0 y regresados a su lugar en el abdomen. La incisión fue suturada en capas: para el músculo se usó Vicryl y para la piel Mononylon 3-0.
Un grupo de 20 ratas, las OVX-simulado (SIM), fueron sometidas al mismo procedimiento quirúrgico exponiendo brevemente al aire los ovarios y regresándolos a la cavidad abdominal. Para prevenir infecciones después de la cirugía se les administró a todas las ratas operadas (SIM y OVX) 0.5 mL de bencilpenicilina.
Previo al procedimiento quirúrgico los animales fueron distribuidos en 9 grupos homogéneos en cuanto a su pc: 3 grupos de ratas OVX, 3 SIM y 3 OVX-tratadas (OVX-t), en cada uno de estos casos 2 grupos con n=8 y 1 con n=4. Dos grupos de OVX-t recibieron NG-A (Anglix, usando aceite mineral como vehículo) por vía dérmica 25 ó 50 μg /250 g pc/día, y 1 grupo recibió NG-B (NITRO-BID en ungüento) 50 μg/250 g pc/día. Los grupos OVX y SIM recibieron el vehículo por la misma vía. La NG fue aplicada a nivel de las cervicales en un área de aproximadamente 1 cm2, el cual fue rasurado diariamente.
Al final de los 28 días de tratamiento se pesaron las ratas; luego bajo anestesia, se colectó toda la sangre posible por punción cardiaca. En seguida se disecaron úteros, timos, tibias y fémures. Las tibias fueron limpiadas y fijadas en formol al 10% para histología. Los fémures fueron limpiados y envueltos en una gasa humedecida con solución salina y almacenados a -20° C hasta realizárseles su prueba biomecánica de doblamiento a 3 puntos en una máquina universal de ensayos 4502 (Instron Inc., Canton, MA con celda de carga de 1kN) donde se midió: RI; rigidez, RE; resistencia, EM; energía máxima y ET; energía total. Los úteros y timos fueron fijados en formol al 10% y pesados en húmedo.
Para la medición en orina de DPD 28 días después de las cirugías y/o tratamientos, la orina fue colectada en frascos de vidrio que contenían una mezcla de antibióticos, penicilina V potásica [equivalente a 400 000 UI/mg], estreptomicina y amikacina en cantidades de 1mg de cada uno / mL de orina recolectada, con el fin de evitar la contaminación bacteriana durante las 16 h de su recolección. Durante este periodo las ratas se mantuvieron en ayuno, aunque tuvieron libre acceso a agua.
La DPD fue medida por ELISA usando el equipo Metra Quidel (San Diego CA) y normalizada por mmol de creatinina urinaria sin desproteinizar, medida por el método de punto final (Wiener Lab). Los nitratos y nitritos en orina (NOx, un índice de los niveles de NO·) fueron medidos por el método de Miranda et al.25 La fosfatasa alcalina (FA, marcador de recambio óseo) se determinó en el suero de la sangre colectada por punción cardiaca por un método colorimétrico cinético (Diagnostic Chemical Ltd de México, S A).
Los análisis estadísticos se realizaron con la prueba de ANOVA y la t de Student no pareada usando el programa GraphPad Prism.
Resultados y discusión
Existe evidencia que sugiere que el uso transdérmico de la NG en dosis bajas puede prevenir las pérdidas de hueso cortical y/o trabecular inducidas por la OVX en ratas14,15,16,17,18 así como prevenir las pérdidas de masa ósea en mujeres oforectomizas19 y mujeres posmenopáusicas.23 Con los resultados que presentamos aquí no confirmamos el efecto osteoprotector de la NG para prevenir la pérdida de hueso trabecular en ratas OVX en ninguno de los casos experimentales evaluados en coincidencia con las observaciones recientes en la clínica que tampoco apoyan este efecto osteoprotector de la NG en el manejo de la osteoporosis en mujeres posmenopáusicas.24
Consumo de agua, alimento y diferencia de peso corporal
La tabla 1 muestra el consumo de agua, alimento y la diferencia de la ganancia de peso corporal de ratas OVX durante 28 días de los tres grupos experimentales.
Se observa que el rango aproximado de consumo de agua de los grupos SIM fue de 25 a 30mL, de los OVX fue de 24 a 29 mL y de los OVX-t fue de 24 a 31 mL. En cuanto al consumo de alimento el rango aproximado para los grupos SIM fue de 17 a 19 g, para los OVX de 19 a 21g y el de los OVX-t de 19 a 22 g. En general, tanto el consumo de agua como de alimento fue similar en los tres grupos experimentales, a las 2 dosis de NG probadas.
La tabla 1 también muestra la diferencia de ganancia de pc entre los tres grupos experimentales, a las 2 dosis de NG evaluadas, donde los grupos OVX y OVX-t ganaron significativamente (p<0.05) más peso al final del estudio que los grupos de ratas SIM. Ninguna de las dosis de NG estudiadas tuvieron efecto sobre la ganancia del pc de los animales OVX-t, tal y como lo reportan Wimalawansa et al.,14 aunque contrario a las observaciones de Hukkanen et al.17
Comprobación de la ovariectomía
Veintiocho días después de las cirugías y/o tratamientos, las ratas SIM, OVX y OVX-t fueron sacrificadas y se disecaron y pesaron sus úteros y timos. Se observó que en las ratas OVX y OVX-t se atrofiaron los cuerpos uterinos (p<0.05) y se hipertrofiaron (p<0.05) los timos en comparación a los tejidos de las ratas con cirugía simulada. La NG no modificó ninguno de estos parámetros (Tabla 2).
Peso y longitud de tibia y fémur
La tabla 3 muestra las mediciones de peso y longitud de tibias y fémures húmedos de ratas SIM, OVX y OVX-t al final de los 28 días del experimento. No se encontraron cambios significativos en peso ni longitud de las tibias y fémures entre ninguno de los grupos experimentales. La OVX en las ratas Long Evans jóvenes adultas no produjo cambios sobre el peso ni la longitud de tibias y fémures. La aplicación una vez al día de NG por 28 días tampoco modificó estos parámetros.
En cuanto al peso de los huesos, nuestros resultados contrastan con el reporte de Wimalawansa et al.14 Ellos observaron que la aplicación en la piel de NG a ratas Sprague-Dawley jóvenes adultas OVX por 6 semanas, (de la misma edad que las nuestras) previno la pérdida del peso de fémures, es decir, previno la pérdida de hueso femoral. Tentativamente esta diferencia pudiera atribuirse a las distintas cepas empleadas. Por otra lado, Hukkanen et al.17 observaron que en ratas Wistar jóvenes adultas OVX por 4 semanas, la OVX no modificó la longitud de las tibias.
Prueba biomecánica de resistencia a la flexión de fémur
La tabla 4 presenta los valores para las propiedades de rigidez, resistencia y energía a carga máxima y total de los fémures de ratas OVX-t comparadas con las ratas OVX y SIM de los diferentes grupos experimentales, obtenidos en la prueba biomecánica de flexión (doblamiento) a 3 puntos, un índice de integridad de hueso cortical. No hubo diferencias significativas para ninguno de los parámetros evaluados entre los grupos de ratas, revelando la integridad del hueso cortical de los fémures de las ratas OVX y OVX-t jóvenes comparadas con las SIM.
Histología de tibias
La figura 1 muestra las micrografías de cortes histológicos representativos de las metáfisis proximales de tibia de ratas SIM (A), OVX (B) y OVX-t (C). Comparadas con las tibias de ratas SIM, las tibias de ratas OVX y OVX-t de los tres diseños experimentales mostraron una marcada pérdida de malla trabecular, menor grosor y no hubo continuidad de las espículas hacia la cavidad medular además de un mayor contenido de grasa en la médula ósea. La administración transdérmica de NG, a ninguna de las 2 dosis evaluadas, previno la pérdida de hueso trabecular ni el aumento en el contenido de grasa en la médula. No se observaron cambios en la placa de crecimiento entre los grupos de ratas OVX y OVX-t comparadas con las ratas SIM.
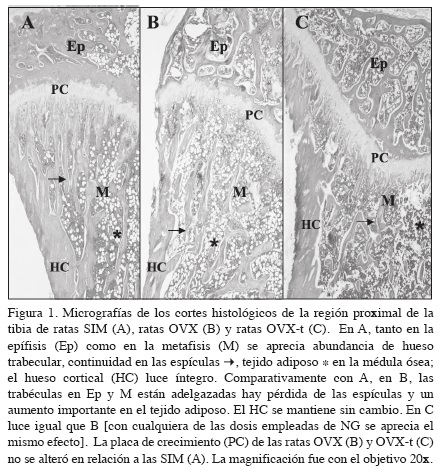
Nuestras observaciones se contraponen a las de Hao et al.18 Aunque poco definidas sus micrografías de las metáfisis proximales de tibia sugieren que a dosis baja y media la NG previno la pérdida de hueso trabecular pos OVX en ratas de la cepa Sprague Dawley. No es posible asegurar que las diferencias entre nuestros resultados sean atribuibles a las diferentes cepas de ratas empleadas.
Biomarcadores óseos
La tabla 5 muestra los valores de DPD y NOx urinarios y de FA sérica de todos los grupos de ratas de las tres series experimentales. La DPD y la FA de los grupos de ratas OVX y OVX-t fueron significativamente más elevados con respecto al grupo de ratas SIM, aunque no fueron diferentes entre sí. Por otra parte, los niveles de NOx urinario no fueron significativamente diferentes entre los grupos de ratas SIM, OVX y OVX-t para ninguno de los tratamientos experimentales.
La aplicación trandérmica diaria por 28 días de NG a nuestras ratas OVX no normalizó los niveles de DPD ni de FA y los niveles de NOx fueron iguales en todos los grupos de ratas de los 3 diseños experimentales. Estos resultados coinciden con los reportes de Hukkanen et al.17 y Hao et al.18 Ellos no observaron cambios significativos de estos parámetros después de la aplicación transdérmica de NG aunque le atribuyeron al fármaco la capacidad para prevenir la pérdida de hueso en ratas OVX, según sus mediciones densitométricas el primero y observaciones histológicas el segundo.
Conclusión
En el presente trabajo no logramos reproducir los efectos osteoprotectores de la administración transdérmica de NG por 28 días sobre la preservación de la masa ósea en ratas jóvenes adultas OVX, como se describe en la literatura. Notablemente nuestros resultados coinciden con observaciones recientes en el sentido que el fármaco no previene la osteoporosis en mujeres posmenopáusicas.
Referencias
1. Evans DM, Ralston SH. Nitric oxide and bone. J Bone Miner Res. 1996; 11(3):300-305. [ Links ]
2. Turner CH, Takano Y, Owan I, Murrel GAC. Nitric oxide inhibitor L-NAME suppresses mechanically induced bone formation in rats. Am J Physiol. 1996; 270 (4 Pt 1): E634-E639. [ Links ]
3. Turner CH, Owan I, Jacob DS, Mcclintock R, Peacock M. Effects of nitric oxide synthase inhibitors on bone formation in rats. Bone. 1997; 21(6): 487-490. [ Links ]
4. Chae HJ, Park RK, Chung HT, Kang JS, Kim JS, Choi DY, Bang BG, Kim HR. Nitric oxide is a regulator of bone remodeling. J Pharm Pharmacol. 1997; 49(9):897-902. [ Links ]
5. Van't Hof RJ, Ralston SH. Nitric oxide and bone. Immunology. 2001; 103(3): 255-261. [ Links ]
6. Helfrich MH, Evans DE, Grabowski PS, Pollock JS, Ohshima H, Ralston SH. Expression of nitric oxide synthase isoforms in bone and bone cell cultures. J Bone Miner Res. 1997; 12(7):1108-1115. [ Links ]
7. Fox SW, Chow JW. Nitric oxide synthase expression in bone cells. Bone. 1998; 23(1):1-6. [ Links ]
8. Armour KE, Armour KJ, Gallagher ME, Godecke A, Helfrich MH, Reid DM, Ralston SH. Defective bone formation and anabolic response to exogenous estrogen in mice with targeted disruption of endothelial nitric oxide synthase. Endocrinology. 2001; 142(2):760-766. [ Links ]
9. Cuzzocrea S, Mazzon E, Dugo L, Genovese T, Di Paola R, Ruggeri Z, Vegeto E, Caputi AP, Van De Loo FA, Puzzolo D, Maggi A. Inducible nitric oxide synthase mediates cone loss in ovariectomized mice. Endocrinology. 2003; 144(3):1098-1107. [ Links ]
10. Caballero-Arias AM, Loveridge N, Lyon A, Das-Gupta V, Pitsillides A, Reeve J. NOS isoforms in adult human osteocytes: multiple pathways of NO regulation? Calcif Tissue Int. 2004; 15(1):78-84. [ Links ]
11. Van't Hof RJ, Macphee J, Libouban H, Helfrich MH, Ralston SH. Regulation of bone mass and bone turnover by neuronal nitric oxide synthase. Endocrinology. 2004; 145 (11):5068-5074. [ Links ]
12. Armour KE, Ralston SH. Estrogen upregulates endothelial constitutive nitric oxide synthase expression in human osteoblast-like cells. Endocrinology. 1998; 139(2): 799-802. [ Links ]
13. Chambliss K L, Shaul P W. Estrogen modulation of endothelial nitric oxide synthase. Endocr Rev. 2002; 23(5): 665-686. [ Links ]
14. Wimalawansa SJ, De Marco G, Gangula P, Yallampalli C. Nitric oxide donor alleviates ovariectomy-induced bone loss. Bone. 1996; 18(4): 301-304. [ Links ]
15. Wimalawansa SJ. Restoration of ovariectomy-induced osteopenia by nitroglycerin. Calcif Tissue Int. 2000(a); 66(1):56-60. [ Links ]
16. Wimalawansa S, Chapa T, Fang L, Yallampalli C, Simmons D, Wimalawansa S. Frequency dependent effect of nitric oxide donor nitroglycerin on bone. J Bone Miner Res. 2000; 15(6):1119-1125. [ Links ]
17. Hukkanen M, Platts LA, Lawes T, Girgis SI, Konttinen YT, Goodship AE, MacIntyre I, Polak JM. Effect of nitric oxide donor nitroglycerin on bone mineral density in a rat model of estrogen deficiency-induced osteopenia. Bone. 2003; 32(2):142-149. [ Links ]
18. Hao YJ, Tang Y, Chen FB, Pei FX. Different doses of nitric oxide donor prevent osteoporosis in ovariectomized rats. Clin Orthop Relat Res Jun. 2005; 6 (435): 226-231. [ Links ]
19. Wimalawansa SJ. Nitroglycerin therapy is as efficacious as standard estrogen replacement therapy (Premarin) in prevention of oophorectomy-induced bone loss: a human pilot clinical study. J Bone Miner Res. 2000(b); 15(11): 2240-2244. [ Links ]
20. Wimalawansa SJ, Grimes JP, Wilson AC, Hoover DR. Transdermal nitroglycerin therapy may not prevent early postmenopausal bone loss. J Clin Endocrinol Metab. 2009; 94(9):3356-3364. [ Links ]
21. Pouwels S, Lalmohamed A, van Staa T, Cooper C, Souverein P, Leufkens HG, Rejnmark L, de Boer A, Vestergaard P, de Vries F. Use of organic nitrates and the risk of hip fracture: a population-based case-control study. J Clin Edocrinol Metab. 2010; 95(4):1924-1931. [ Links ]
22. Khosla S. Is nitroglycerin a novel and inexpensive treatment for osteoporosis? JAMA. 2011; 305(8):826-827. [ Links ]
23. Jamal SA, Hamilton CJ, Eastell R, Cummings SR. Effect of nitroglycerin ointment on bone density and strength in postmenopausal women. A randomized trial. JAMA. 2011; 305(8):800-807. [ Links ]
24. Beckett RD, Sheehan AH Nitroglycerin ointment for the prevention of postmenopausal osteoporosis. Ann Pharmacother. 2011; 45(12):1566-1570. [ Links ]
25. Miranda KM, Espey MG, Wink DA. A rapid, simple spectrophotometric method for simultaneous detection of nitrate and nitrite. Nitric Oxide. 2001; 5(1):62-71. [ Links ]
* El trabajo es el resultado de la tesis de doctorado en Ciencias Biológicas de RVM, UAMX.














