Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.2 Ciudad de México abr./jun. 2013
Revisión Bibliográfica
Biotransformación de triterpenos con diferentes microorganismos
Biotransformation of triterpene with different microorganisms
Arturo Cano-Flores
Laboratorio de Biotransformaciones y Química de Productos Naturales, L-314. Facultad de Estudios Superiores Zaragoza, Universidad Nacional Autónoma de México
Correspondencia:
M en C. Arturo E. Cano Flores
Laboratorio de Biotransformaciones y Química de
Productos Naturales, L-314.
Facultad de Estudios Superiores Zaragoza, Campo II,
UNAM.
Batalla 5 de mayo s/n. Col Ejército de Oriente, Iztapalapa
09230. México D. F.
Email: aecanomx@unam.mx
Fecha de recepción: 05 de marzo de 2013.
Fecha de recepción de modificaciones: 11 de junio de 2013.
Fecha de aceptación: 26 de junio de 2013.
Resumen
Actualmente la aplicación de las transformaciones microbiológicas en triterpenos, ha permitido la obtención de nuevos derivados con mejores propiedades químicas y biológicas mediante la funcionalización química de los átomos de carbonos poco reactivos, a través de reacciones de hidroxilación, glicosidación, oxidación, reducción, eliminación, apertura del anillo A mediante reacciones del tipo de Baeyer-Villiger y rearreglos en la estructura que involucran la transposiciones de un grupo metilo, entre otras; las cuales proceden con una alta regio, estereo y quimio-selectividad. Además, es una metodología química compatible con el medio ambiente, debido a las condiciones de reacción en las que se efectúan.
Palabras clave: biotransformaciones, bioconversiones, transformaciones microbiológicas, hongos filamentosos, triterpenos, productos naturales.
Abstract
Nowadays, the application of microbiological transformations in triterpenes have made possible the obtention of new derivates with improved chemical and biological properties through the chemical functionalization of unreactive carbon atoms by procedures such as hydroxylation, glycosylation, oxidation, reduction, elimination and A ring opening through reactions of the Baeyer-Villiger type and structure rearrangements involving the transposition of a methyl group, among others, which come along with a high regio, stereo and chemo-selectivity. Moreover, it is a methodology environmentally friendly due to the reaction conditions under which they take place.
Key words: biotransformation, bioconversions, microbial transformation, filamentous fungi, triterpene, natural products.
Introducción
Los triterpenos (30 átomos de carbono) son compuestos naturales que se construyen a partir de seis unidades de isopreno. Los cuales se encuentran ampliamente distribuidos en el reino vegetal y desempeñan un papel importante en la naturaleza. Desde una perspectiva biológica, se asume que los esqueletos del olaneano, ursano y lupano son las más importantes dentro de los triterpenos, ver figura 1. Dichas estructuras policíclicas pueden encontrarse, ya sea en su estado libre o en forma de glicósidos. Como consecuencia, presentan una gran diversidad estructural. Hasta ahora, se conocen alrededor de 100 diferentes tipos de esqueleto en la naturaleza1-3 y cientos de derivados han sido sintetizados.4-5 Los efectos biológicos correspondientes a este tipo de compuestos son muy diversos y pueden ser resumidos como: anti-tumorales,6-10 anti-inflamatorios,11 anti-VIH,12-13 anti-microbianos,9 hepa14-15 y cardioprotectores,16 analgésicos, anti-micóticos, anti-quimiopreventivos,17 entre otros.18-20

Por otro lado, las modificaciones estructurales en el esqueleto base han producido nuevos derivados con mejores propiedades farmacocinéticas,4 nuevos mecanismos de acción21 y menos efectos secundarios.22 Cabe mencionar dos derivados del ácido betulínico, como el bevirimat, el cual se encuentra en evaluación en pacientes (fase clínica II) con VIH13,23 y el NVX-207 con actividad antitumoral, considerado un buen candidato para su evaluación clínica.24 La mayoría de esos derivados químicos son obtenidos por aproximaciones sintéticas,25 aunque los procesos de biotransformación han sido empleados para favorecer ciertas posiciones, las cuales serian más difíciles de funcionalizar por métodos químicos.
Generalidades de las biotransformaciones
Las biotransformaciones26-28 son una herramienta útil e interesante para la obtención de una diversidad de compuestos químicos, los cuales tienen diferentes aplicaciones en la industria farmacéutica, de agroquímicos, alimenticia, biológica, química, entre otras.29-31 La utilidad actual de los microorganismos y en especial de los hongos como biocatalizadores ha despertado un interés particular, en parte por su habilidad para producir grandes cantidades de biomasa y una amplia variedad de enzimas en un corto tiempo. Además, muchos microorganismos pueden crecer bajo condiciones diversas y en una amplia variedad de sustratos. Esta flexibilidad metabólica permite que los microorganismos posean la capacidad de producir una diversidad de enzimas que puedan biotransformar una serie de compuestos químicos, mediante reacciones de hidrólisis, de óxido-reducción, formación de enlaces C-C, de adición-eliminación y glicosidación, entre otras; así como, en sustratos naturales y no naturales con estructuras químicas complejas.18
El interés en las biotransformaciones de triterpenos por parte de los químicos en productos naturales, se ha venido incrementando en los últimos años, debido a la obtención de nuevos y útiles compuestos farmacológicamente activos. Además, del desarrollo de nuevas cepas genéticamente modificadas, el incremento en la disponibilidad de enzimas inmovilizadas, y la manipulación de los medios de cultivo para favorecer la solubilidad de dichos sustancias por medio del uso de ciclodextrinas y algunos surfactantes.32-35 Sin embargo, muchos de los ejemplos de biotransformaciones de triterpenos que en el presente articulo se describen, son importantes por la novedad y utilidad de los productos, las cuales se ven muy limitadas por la solubilidad y rendimientos de la materia prima y productos. Por lo tanto, la presente revisión pretende dar a conocer un panorama muy general del desarrollo de las biotransformaciones de los triterpenos pentaciclos -olaneano, ursano y lupano- más comunes con diferentes microorganismos.
Triterpenos pentacíclicos
Esqueleto de oleanano
El ácido glicirrético (GA, 1) es la aglicona de la saponina aislada de Glycyrrhiza glabra y otras especies de Glycyrrhiza. El compuesto 1 y sus derivados han mostrado tener muy diversas actividades biológicas, tales como anti-inflamatoria, anti-tumoral y anti-ulcerosa. La biotransformación de 1 por Curvularia lunata (ATCC 13432)36 y Mucor spinosus (AS 3.3 4 50)32-33 produjo como metabolito principal al ácido 7β-hidroxiglicirrético (2). Por otro lado, de la bioconversión de 1 con Mucor polymorphosporus se obtuvieron 2 (26.8%) como producto mayoritario y cuatro productos de hidroxilación adicionales en C-15α (3, 18.2%), C-24 (4, 2.7%), C-6β (5, 2.7%) y el epímero en C-7 (6, 1.4%); además de los ácidos 3-oxo-7β-hidroxiglicirrético (7, 1.1%) y 3-oxo-15α- hidroxiglicirrético (8, 0.9%),37 ver figura 2.
La acción del hongo fitopatógeno Trichothecium roseum (ATCC 8685) sobre 1 fue la hidroxilación y esterificación, para producir los ésteres de los productos de monohidroxilación en C-7β (9) y C-15α (10), además del producto dihidroxilado C-7 β y C-15α (11),38 figura 2.
La formación de los ésteres metílicos a partir de 1 (figura 2), también fueron detectados en la incubación de 1 con Nocardia sp (NRRL 5646) para dar el glicirretato de metilo (12).39 La incubación de 1 con el micelio de Streptomyces sp. produjo tres productos de bioconversión, donde el derivado monohidroxilado en C-22α (13) es el producto mayoritario, y los compuestos dihidroxilados en C-22, C-23 y C-24 resultaron ser los compuestos minoritarios de dicha biotransformación (14 y 15), la hidroxilación en C-22 presenta una orientación α.40
De la transformación de 1 con Chainia antibiotica (IFO 12,246) se obtuvieron dos nuevos compuestos 16 y 17, los cuales tiene como estructura base al 3,4-seco-oleanano, mientras que a partir de 13 se obtuvo 18 con el mismo microrganismo, figura 2. La propuesta sobre la formación de los seco-derivados, involucra la oxidación de 1 y 13 para dar los 3-oxo-derivados, seguido de una reacción del tipo Baeyer-Villiger y una hidrólisis del anillo de la lactona de siete miembros.41
La transformación microbiológica de 1 por Sphingomonas paucimobilis en presencia de inhibidores de oxigenasas, se obtuvo un nuevo metabolito que fue identificado como el ácido 3β-hidroxi-11-oxoolean-12-eno-23,30-dioico (19).42 La misma biotransformación bajo condiciones normales generó el ácido 3,4-seco-4,23,24-trinor-11-oxoolean-12-eno-3,28,30-trioico (20),43 ver figura 2.
El ácido 18α-glicirrético (21), el ácido liquirítico (22) y el ácido 18α-liquirítico (23) son epímeros de 1 en los C-18, C-20, o en ambos carbonos. Los hongos Curvularia lunata (ATCC 13432), Trichothecium roseum (ATCC 8685), Cunninghamella (ATCC 3229), Mucor griseo-cyanus (ATCC 1207-a) y Helicostylum piriforme (ATCC 8992) biotransformaron a los ácidos 21 y 22 a sus correspondientes 7β-hidroxiderivados (24 y 25 respectivamente), 15α-hidroxiderivados (26 y 27) y a los compuestos 28 y 29 respectivamente, los cuales son productos de la dihidroxilación en C-7β y C-15α. Por otro lado, el ácido 23 fue convertido a su 7β-hidroxiderivado (30) por H. piriforme y Cunninghamella, mientras con T. roseum se obtuvo el 7β,15 α-dihidroxiderivado (31),44 ver figura 2.
El ácido oleanólico (32) es un triterpeno que se encuentra ampliamente distribuido en las plantas en forma libre o glicosilada. Se ha informado que 32 presenta una amplia actividad biológica, donde destaca: hipo-glicémica, hipo-lipidémica, hepaprotectora, anti-inflamatoria, anti-viral, anti-oxidante, anti-carcinogénica, entre otras. De la biotransformación del ácido oleanólico por Cunninghamella blakesleeana se aislaron los ácidos 3β-hidroxioleana-11, 13(18)-dien-28-oico (33), 3β, 7β-dihidroxiolean-12-en-28-oico (34), 3β-hidroxi-11-oxoolean-12-en-28-oico (35), 3β, 7β-dihidroxioleana-11, 13(18)-dien-28-oico (36), 3β, 7β, 13β-trihidroxiolean-11-eno-28, 13-lactona (37) y 1β, 3β-dihidroxiolean-12-en-28-oico (38),32-33 como se muestra en la figura 3.
De la transformación microbiológica de 32 con Fusarium lini se obtuvieron los compuestos 35 y 37, junto con el 15 α-hidroxiderivado (39) y una lactona (oleanderólida, 40). El ácido oleanólico también fue incubado con Penicillium chrysogenum para producir la mezcla de ácidos: 21-hidroxi (41), 21-oxo (42), 3-oxo-21-hidroxi (43) y 3,21-dioxo (44). Por otro lado, el compuesto 42 (21-oxoderivado de 32) fue biotransformado por Colletotrichum phomoides para producir 6-hidroxi (45) y 6,21-dihidroxi derivados (46). Asimismo, Aspergillus ochraceus (NG 1203) biotransformó a 32 para dar 11α-hidroxi-derivado (47, 10.1%).32-33
El ácido 3-oxolean-12-en-28-oico (48), derivado oxidado de 32 en C-3, fue biotransformado por Chaetomium longirostre (RF-1095) al ácido 4-hidroxi-3, 4-seco-olean-12-eno-3, 28 dioico (49) y al correspondiente 21β-hidroxiderivado (50),45 ver figura 4.

Además el compuesto 48 ha sido descrito como un agente anti-cancerígeno y anti-antigénico;46-47 sin embargo, por su baja solubilidad en agua se dificulta su evaluación biológica; por lo tanto, se procedió a su biotransformación con Absidia glauca Hagem, en presencia de ciclodextrina para mejorar su solubilidad e introducir otros grupos funcionales. De dicha biotransformación se obtuvieron tres nuevos triterpenoides, ver figura 4: 1β-hidroxi-3-oxo-olean-11-en-28, 13-lactona (51, 0.74%), ácido 1β, 11α-dihidroxi-3-oxo-olean-12-en-28.oico (52, 2.3%) y ácido 1β, 11α, 21β-trihidroxi-3-oxo-olean-12-en-28-oico (53, 0.23%), figura 4.48
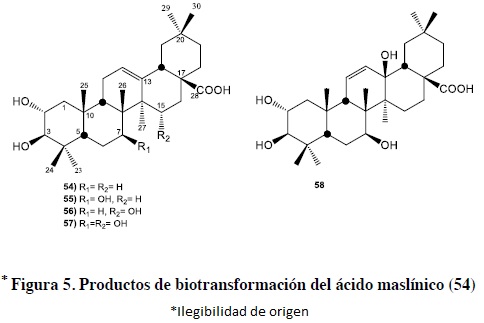
La biotransformación del ácido maslínico (54) por Cunninghamella blakesleeana (CGMCC 3.910) resultó en la formación de cuatro sustancias más polares, donde el ácido maslínico (54) se transformó al ácido 2α, 3β, 7β-trihidroxiolean-12-en-28-oic (55, 37.4%) y el ácido 2α, 3β, 15α-trihidroxioxolean-12-en-28-oico (56, 3.2%). Durante la incubación de 55 con dicho hongo, se pudo detectar la incubación de los compuestos 57 (ácido 2α, 3β, 7β, 15α-tetrahidroxiolean-12-en-28-oico, 1.7%) y 58 (ácido 2α, 3β, 7β, 13β-tetrahidroxiolean-11-en-28-oico, 3.4%).
Lo anterior, se puede explicar por la hidroxilación directa en 54 en los C-7 (55) y C-15 (56). El producto 54 fue metabolizado adicionalmente para dar 57 y 58, a través de la hidroxilación de C-15 con una orientación alfa (57) y la hidroxilación en el C-13 con migración de la doble ligadura. Los triterpenos, son generalmente convertidos a sus derivados hidroxilados en los C-7 con orientación β, C-15α y 7β,15α-dihidroxiderivado por especies del género Cunninghamella, figura 5.49
Esqueleto de ursano
El ácido ursólico (59) es un triterpenoide ampliamente distribuido en varias especies de plantas, y el cual posee un amplio rango de propiedades biológicas como, anti-viral, anti-VIH, entre otras actividades. La principal acción de Nocardia sp (NRRL 5646) en ácidos triterpénicos pentacíclicos consistió en la esterificación específica del C-2841; además de la isomerización del esqueleto del ursano a oleanano. La incubación de 59 con Nocardia sp produjo tres compuestos 32 (23%), 60 (13%) y 61 (9%).
La formación de 60 a partir de 59, se ha explicado en función de la transposición de un grupo metilo del C-19 a C-20 para dar 32, seguido de la metilación de C-28; o bien, mediante la esterificación del C-28 en 59 para dar 61, y paso seguido, la transposición del grupo metilo de C-19 a C-20, ver figura 6. Biogenéticamente el esqueleto de ursano y oleanano tiene un intermediario común, siendo el ursano, el producto de la biosíntesis del oleanano vía la transposición del grupo metilo de C-20 a C-19.50 Dicha observación confirma la habilidad de Nocardia para catalizar una conversión retro-biogenética39 del ursano al oleanano (se ha sugerido que la formación del éster metílico puede deberse a una metiltransferasa dependiente de la S-adenosilmetionina, la cual es una familia grande de enzimas con una amplia actividad biológica incluyendo la transmetilación39, 52). Cabe destacar, que es el segundo ejemplo informado en la literatura de una conversión retro-biogenética que cataliza dicho microorganismo.51
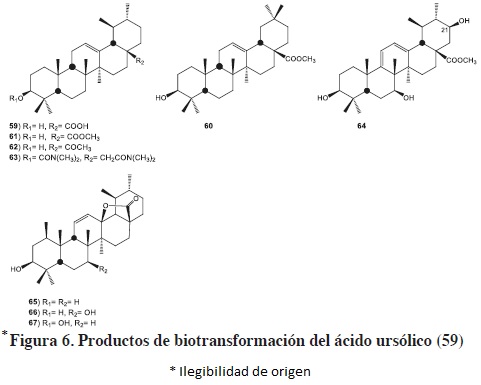
El ácido ursólico (59), el ursoato de metilo (61), 3β, 28-dihidroxi-urs-12-eno (uvaol, 62) y 3β, 28-bis(dimetilcarbamoxi)-urs-12-eno (63) fueron incubados con Mucor plumbeus (ATCC 4740). Los sustratos 62 y 63 se recuperaron del medio de transformación, mientras que de la incubación de 61 se obtuvo como único producto al 3β, 7β, 21β-trihidroxiursa-9(11), 12-dien-28 oato de metilo (64). La formación del doble enlace entre C-9 y C-11 en el compuesto 63, se puede explicar mediante la hidroxilación de un producto intermedio en C-11, seguido de la eliminación del agua para formar el alqueno conjugado,53 ver figura 6.
Recientemente se ha descrito la biotransformación del ácido ursólico (59) con Umbelopsis isabellina, hongo fitopatógeno aislado de Huperzia serrata, para producir tres productos 3β-hidroxi-urs-11-en-28, 13-lactona (65), 3β, 7β-dihidroxi-urs-11-en-28, 13-lactona (66) y 1β, 3β-dihidroxi-urs-11-en-28, 13-lactona (67), observándose que dicho hongo puede hidroxilar Δ12,13 en el C-13 del ácido ursólico y formar una lactona de cinco miembros con el grupo carboxilo del C-28, además de hidroxilar las posiciones en C-1 y C-7 del esqueleto de ursano.54
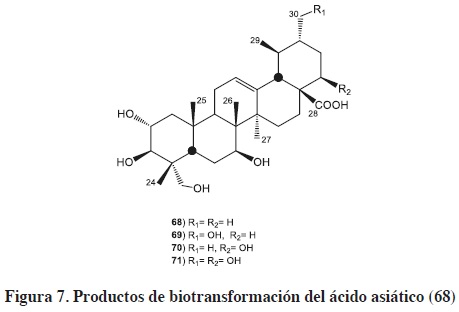
El ácido asiático (Centella asiatica) mostró poseer actividad anti-oxidante, anti-inflamatoria, hepaprotectora, anti-Alzheimer's, anti-depresivo; además, de su poder cardioprotector e inducir apoptosis en células tumorales de melanoma humano (SK.MEL-2]. La biotransformación del ácido asiático (68) con Alternaria longipes (AS 3.2875) produjo tres nuevos ácidos: 2α, 3β, 23, 30-tetrahidroxiurs-12-en-28-oico (69), 2α, 3β, 22β, 23-tetrahidroxiurs-12-en-28-oico (70) y 2α, 3β, 22β, 23, 30-pentahidroxiurs-12-en-28-oico (71), figura 7.55
El glucósido del ácido quinóvico (72) es el principal constituyente de la corteza del árbol Mitragyna inermis, importante especie vegetal empleada en la medicina tradicional de África del Este para el tratamiento de enfermedades del aparato digestivo, desordenes intestinales y enfermedades del hígado. El sustrato 72 fue desglucosilado por Nocardia sp (NLRR 5646) para dar la mezcla de ácidos quinóvico (73, 40%) y cinchólico (74, 20%);51 los cuales tiene una biosíntesis común. La formación de 74 puede explicarse vía la migración de un grupo metilo, similar a la observada en la conversión del ácido ursólico (59) a ácido oleanólico (32) por el mismo microorganismo.39 Por otro lado, la biotransformación de 72 con Streptomyces griseus (ATCC 13273) condujo a la formación de un nuevo producto de oxidación (75), como resultado de la hidroxilación del C-30, figura 8.56

Esqueleto de Lupano
El ácido betulínico (76) es un triterpeno con esqueleto de lupano, se encuentra ampliamente distribuido en el reino vegetal. Entre las actividades biológicas descritas para el ácido betulínico, destaca su actividad anti-melanómica, anti-neuroblas-tómica, anti-leucémica, anti-viral VIH, anti-malárica, entre otras. De la transformación biológica de dicho sustrato con Cunninghamella sp (NLRR 5695) se obtuvo el compuesto 77 (0.77%), el cual se encuentra glucosilado en el C-3.57 A partir de la biotransformación de 76 con Bacillus megaterium (ATCC 14581), se formaron dos nuevos compuestos hidroxilados: 78 (7β-hidroxi-) y 79 (6α, 7β-dihidroxi-), además del ácido betulónico (80). El ácido 7β-hidroxi-betulínico (78) también es producto de la biotransformación de 77 con Mucor mucedo (UI-4605), mientras que Cunninghamella elegans (ATCC 9244) produce el 1β,7β-dihidroxiderivado (81) a partir de 76, ver figura 9.58
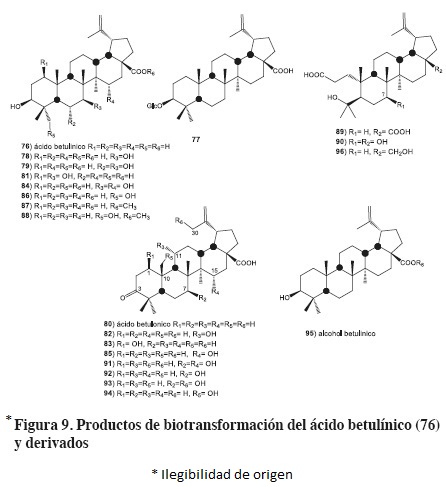
A partir de la biotransformación de 76 a escala preparativa con Bacillus megaterium (ATCC 13368), se aislaron los productos ácido betulónico (80) junto con los hidroxiderivados del ácido betulínico en C-11 (82) y C-1 (83), además del ácido 3,7,15-trihidroxilup-20(29)-en-28-oico (84), figura 9.59
El ácido betulónico (80) fue obtenido de la biotransformación de 76 con Chaetophoma (DPB125) y Dematium (DPB157), mientras que con Colletotrichum (DPB136) biotransformó a 76 al ácido 15α-hidroxi-betulónico (85).60 La incubación de 76 y 86 con Nocardia sp (NRRL 5646) produjo sus correspondientes ésteres metílicos (87 y 88), respectivamente, figura 9.41
El ácido betulónico (80) es un triterpeno natural aislado de muchas especies vegetales, el cual puede ser preparado por la oxidación química de 76. Se ha descrito que presenta propiedades anti-inflamatorias, anti-melanómicas y anti-virales. La biotransformación de 80 con el hongo Chaetomium longirostre (IFO 9873) produjo el ácido 4-hidroxi-3, 4-seco-lup-20(29)-en-3, 28-dioico (89, 6%), ácido 4, 7β, 17-trihidroxi.3, 4-seco-nor-lup-20(29)-en-3-oico (90, 12%) y el ácido 7β, 15α-dihidroxibetulónico (91, 4%). Con base en los productos obtenidos, se puede decir que dicho hongo es capaz de hidroxilar, descarboxilar y ocasionar la ruptura oxidativa del anillo del esqueleto de lupano en el compuesto 80, figura 9.61
A partir de la biotransformación del ácido betulónico (80) con Arthrobotrys (DPB134) se obtuvo una mezcla de ácidos 91, junto con el ácido 7β-hidroxibetulónico (92) y el ácido 7β, 30-dihidroxibetulónico (93). Por otro lado, la biotransformación de 80 con Colletotrichum (DPB136) produjo la mezcla de los ácidos 91 y 85 (15α-hidroxibetulónico), mientras que Chaetophoma (DPB125) generó a partir de 80 el ácido 25-hidroxibetulónico (94), figura 9.60
De la biotransformación del alcohol betulínico (95) con Chaetomium longirostre (IFO 9873) a escala preparativa, se obtuvo el ácido 4,28-dihidroxi-3,4-seco-lup-20(29)-en-3-oico (96, 3%).61 Asimismo, se encontró que el alcohol betulínico (95) y el betulinato de metilo (87) no son susceptibles de ser biotransformados por Rhizopus oryzae (ATCC 11145), figura 9.62
Conclusiones
Las biotransformaciones de triterpenos con microrganismos, es actualmente una herramienta indispensable en la funcionalización de carbonos poco reactivos "carbonos no activados" presentes en dichas sustancias, lo cual se logra mediante reacciones de hidroxilación, de óxido-reducción, formación de enlaces C-C, de adición-eliminación, glicosidación, entre otras; para obtener nuevos derivados químicos susceptibles de ser valorados biológicamente.
La principal acción de la mayoría de los hongos en los diferentes triterpenos pentacíclicos es la hidroxilación de diferentes átomos de carbono (C-1, C-6, C-21, C-22, C-23, C-24, C-25 y C-30); sin embargo, la hidroxilación en el C-7 y C-15 resultan ser las acciones más favorecidas por los diferentes microorganismos.
A partir de triterpenos pentacíclicos hidroxilados en C-3, diversos hongos fueron capaces de generar los 3-oxo-triterpenos; los cuales han sido transformados a los 3,4-seco derivados, sugiriendo su formación vía una reacción de Baeyer-Villiger seguido de una reacción de hidrólisis del anillo A de siete miembros. Además, dichos compuestos han presentado interesantes actividades biológicas.
De la biotransformación de triterpenos con esqueleto del tipo ursano por especies de Nocardia, se ha obtenido triterpenos con esqueleto de oleanano; lo cual tiene una trascendencia biosintética "retro-biosíntesis" importante, que puede ser explicada a través de la transposición de un grupo metilo de C-19 a C-20.
La biotransformación de triterpenos por hongos requiere de una mayor investigación y optimización, para establecer modelos que permitan predecir los sitios de acción de una determinada especie o género de hongo en este tipo de compuestos.
La biotransformación de triterpenos procede con rendimientos bajos en general, debido principalmente a la baja solubilidad de la materia prima, por tanto es importante desarrollar metodologías que incorporen el uso de surfactantes, líquidos iónicos, ciclodextrinas, liposomas, entre otros; como se viene desarrollando en el campo de las biotransformaciones de compuestos esteroidales.
Agradecimientos
A la Dirección General de Asuntos del Personal Académico, UNAM por el apoyo al proyecto IN216012. A la Carrera de Biología de la FES-Zaragoza, UNAM. A la Lic. Fabiola Cano y al M. en C. Joan Robert por sus sugerencias y comentarios al manuscrito final.
Referencias
1. Mahato S, Nandy A, Roy G. Triterpenoids. Phytochemistry. 1992; 31: 2199-2249. [ Links ]
2. Xu R, Fazio G, Matsuda S. On the origins of triterpenoid skeletal diversity. Phytochemistry. 2004; 65: 261-291. [ Links ]
3. Shibuya M, Xiang T, Katsube Y, Otsuka M, Zhang H. Ebizuka Y. Origin of structural diversity in natural triterpenes: direct synthesis of seco-triterpene skeletons by oxidosqualene cyclase. J Am Chem Soc. 2007; 129: 1450-1455. [ Links ]
4. Qian K, Yu D, Chen C, Huang L, Morris-Natschke S, Nitz TJ, Salzwedel K, Reddick M, Allaway GP, Lee K, Anti-AIDS agents 78. Design, synthesis, metabolic stability assessment, and antiviral evaluation of novel betulinic acid derivatives as potent anti-human immunodeficiency virus (HIV) agents. J Med Chem. 2009; 52: 3248-3258. [ Links ]
5. Reddy KP, Singh AB, Puri A, Srivastava AK, Narender T. Synthesis of novel triterpenoid (lupeol) derivatives and there in vivo antihyperglycemic and antidyslipidemic activity. Bioorg Med Chem Lett. 2009; 19: 4463-4466. [ Links ]
6. Setzer WN, Setzer MC, Plant-derived triterpenoids as potential antineoplatic agents. Mini Rev Med Chem. 2003; 3: 540-546. [ Links ]
7. Liby KT, Yore MM, Sporn MB, Triterpenoids and rexinoids as multifunctional agents for the prevention and treatment of cancer. Nat Rev Cancer. 2007; 7: 357-369. [ Links ]
8. Fulda S, Kroemer G. Targeting mitochondrial apoptosis by betulinic acid in human cancers. Drug Discov Today. 2009; 14: 885-890. [ Links ]
9. Cichewicz RH, Kouzi SA. Chemistry, biological activity, and chemotherapeutic potential of betulinic acid for the prevention and treatment of cancer and HIC-infection. Med Res Rev. 2004; 24: 90-114. [ Links ]
10. Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN, Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytother Res. 2006; 20: 279-287. [ Links ]
11. Nguemfo EL, Dimo T, Dongmo AB, Azebaze AGB, Alaoui K, Asongalem AE, Cherrah Y, Kamtchouingl P, Anti-oxidative and anti-inflammatory activities of some isolated constituents from the stem bark of Allamblackia monticola Staner L. C.(Guttiferae), Inflammopharmacology. 2009; 17: 37-41. [ Links ]
12. Kashiwada Y, Hashimoto, F, Cosentino LM, Chen CH, Garrett PE, Lee KH, betulinic acid and dihydrobetulinic acid derivates as potent anti-HIV agents. J Med Chem. 1996; 39: 1016-1017. [ Links ]
13. Smith PF, Ogundele A, Forrest A, Wilton J, Salzwedel K, Doto J, Allaway GP, Martin DE, Phase I and II study of the safety, virologic effect, and pharmaco-kinetics/pharma-codynamics of single-dose 3-O-(3', 3'-Dimethylsuccinyl) betulinic acid (Bevirimat) against human immunodeficiency virus infection. Antimicrob Agents Chemother. 2007; 51: 3574-3581. [ Links ]
14. Saravanan R, Viswanathan P, Pugalendi KV. Protective effect of ursolic acid on etahanol-medated experimental liver damage in rats. Life Sci. 2006; 78: 713-718. [ Links ]
15. Oh S, Choi J, Lim S. Protection of betulin against cadmium-induced apoptosis in hepatoma cells. Toxicology. 2006; 220: 1-12. [ Links ]
16. Senthil S, Sridevi M, Pugalendi KV. Cardioprotective effect of oleanolic acid on isoproterenol-induced myocardial ischemia in rats. Toxicol Pathol. 2007; 35: 418-423. [ Links ]
17. Nakagawa-Goto K, Yamada K, Taniguchi M, Tokuda H, Lee K. Cancer preventive agents 9. Betulinic acid derivatives as potent cancer chemopreventive agents. Bioorg Med Chem Lett. 2009; 19: 3378-3381. [ Links ]
18. Dzubak P, Hajduch M, Vydra D, Hustova A, Kvasnica M, Biedermann D. Pharmacological activities of natural triterpenoids and their therapeutic implication implications. Nat Prod Rep. 2006; 23: 394-411. [ Links ]
19. Conolly JD, Hill RA. Triterpenoids. Nat Prod Rep. 2010; 27: 79-132. [ Links ]
20. Conolly JD, Hill RA. Triterpenoids. Nat Prod Rep. 2007; 24: 465-486. [ Links ]
21. Huang L, Yub D, Hoa P, Leeb K, Chen C. Synthesis and anti-HIV activity of bi-functional triterpene derivatives. Lett Drug Des Discov. 2007; 4: 471-478. [ Links ]
22. Petronelli A, Pannitteri G, Testa U, Triterpenoids as new promising anticancer drugs. Anticancer Drugs. 2009; 20: 880-892. [ Links ]
23. Martin DE, Blum R, Wilton J, Doto J, Galbraith H, Burgess GL, Smith PC, Ballow C. Safety and pharmacokinetics of Bevirimat (PA-457), a novel inhibitor of human immune deficiency virus maturation, in healthy volunteers. Antimicrob Agents Chemother. 2007; 51: 3063-3066. [ Links ]
24. Willmann M, Wacheck V, Buckley J, Nagy K, Thalhammer J, Paschke R, Triche T, Jansen B, Selzer E. Characterization of NVX-207, a novel betulinic acid-derived anti-cancer compound. Eur J Clin Invest. 2009; 39: 384-394. [ Links ]
25. Reddy KP, Singh AB, Puri A, Srivastava AK, Narender T. Synthesis of novel triterpenoid (lupeol) derivatives and their in vivo antihyperglycemic and antidyslipidemic activity. Bioorg Med Chem Lett. 2009; 19: 4463-4466. [ Links ]
26. Pantaleone DP, Biotransformations: "Green" Processes for the Synthesis of Chiral Fine Chemicals. Ager D J Ed.; Handbook of Chiral Chemicals; CRC Press: Boca Raton, Fla. 2006; 359-403. [ Links ]
27. Lehman LR, Stewart JD. Filamentous fungi: potential useful catalyst for the hydroxilations of non-activated carbon centers. Curr Org Chem. 2001; 5: 439-470. [ Links ]
28. Urlarcher V, Schmid RD, Biotransformation using prokaryotic P450 monooxigenases. Curr Opin Biotechnol. 2002; 13: 557-564. [ Links ]
29. Panke S, Held M, Wubbolts M. Trends and innovations in industrial biocatalysis for the production of fine chemicals. Curr Opin Biotechnol. 2004; 15: 272-279. [ Links ]
30. Aleu J, Bustillo AJ, Hernández-Galan R, Collado IG, Biocatalysis applied to the synthesis of agrochemicals. Curr Org Chem. 2006; 10: 2037-2054. [ Links ]
31. Huisman GW, Gray D. Towards novel processes for the fine chemical and pharmaceutical industries. Curr Opin Biotechnol. 2002; 13: 352-358. [ Links ]
32. Parra A, Rivas F, García-Granados A, Martínez R. Microbial transformation of triterpenoids. Mini-Rev Org Chem. 2009; 6: 307-320. [ Links ]
33. Muffler K, Leipod D, Scheller MC, Haas C, Steingroewer J, Bley T, Neuhaus HE, Mirata MA, Schrader J, Ulber R. Biotransformation of triterpenes. Process Biochem. 2011; 46: 1-15. [ Links ]
34. De Carvalho CCCR, Da Fonseca MMR. Biotransformation of terpenes. Biotech Adv. 2006; 24: 134-142. [ Links ]
35. Simeó Y, Sinisterra J V. Biotransformation of terpenoids: A green alternative for producing molecules with Pharmacology activity. Mini-Rev Org Chem. 2009; 6: 128-134. [ Links ]
36. Canonica L, Jommi G, Pagnoni UM, Pelizzoni F, Ranzi BM, Scolastico C, Microbiological oxidation of triterpenoids. I. 7β-hydroxyglycyrrhetic acid. Gazzetta Chim Ital. 1966; 96: 820-831. [ Links ]
37. Xin X, Liu Y, Ye M, Guo H, Guo D. Microbial transformation of glycyrrhetinic acid by Mucor polymorphosporus. Planta Med. 2006; 72: 156-161. [ Links ]
38. Canonica L, Ferrari M, Jommi G, Pagnoni UM, Pelizzoni F, Ranzi BM, Maroni S, Nencini G, Salvatori T. Microological oxidation of triterpenoids. II. 15α-Hydroxyglycyrrhetic and 7β,15α-dihydroxyglycyrrhetic acids. Gazzetta Chim Ital. 1967; 97: 1032-1051. [ Links ]
39. Zhang J, Cheng Z, Yu B, Cordell G A, Qiu S X. Novel biotransformation of pentacyclic triterpenoid acids by Nocardia sp. NRRL5646. Tetrahedron Lett. 2005; 46: 2337-2340. [ Links ]
40. Sakano K, Ohshima M. Structures of conversion products formed from 18β-glycyrrhetinic acid by Streptomyces sp. G-20. Agric Biol Chem. 1986; 50: 763-766. [ Links ]
41. Sakano K, Ohshima M. Microbial conversion of glycyrrhetinic acids. Part II. Microbial conversion of 18β-glycyrrhetinic acid and 22α-hydroxy-18β- glycyrrhetinic acid by Chainia antibiotica. Agric Biol Chem. 1986; 50: 1239-1245. [ Links ]
42. Yoshida K, Furihata K, Habe H, Yamane H, Omori T. Microbial transformation of 18β-glycyrrhetinic acid by Sphingomonas paucimobilis strain G5. Biotechnol Lett. 2001; 23: 1619-1624. [ Links ]
43. Yoshida K, Furihata K, Yamane H, Omori T. Metabolism of 18β-glycyrrhetinic acid in Sphingomonas paucimobilis strain G5. Biotechnol Lett. 2001; 23: 253-258. [ Links ]
44. Ferrari M, Pagnoni UM, Pelizzoni F, Ranzi BM, Salvatori T. Microbiological oxidation of triterpenoids. III. Behavior of 18α-glycyrrhetic, liquiritic, and 18α-liquiritic acids. Gazzetta Chim Ital. 1969; 99: 848-862. [ Links ]
45. Shirane N, Hashimoto Y, Ueda K, Takenaka H, Katoh K. Ring-A cleavage of 3-oxoolean-12-en-28-oic acid by the fungus Chaetomium longirostre. Phytochemistry. 1996; 43: 99-104. [ Links ]
46. Huang D, Ding Y, Li Y, Zhang W, Fang W, Chen X. Anti-tumor activity of a 3-oxo derivative of oleanolic acid. Cancer Lett. 2006; 233: 289-296. [ Links ]
47. Sultana N, Ata A, Oleanolic acid and related derivatives as medicinally important compounds. J Enzym Inhib Med Chem.2008; 23: 739-756. [ Links ]
48. Na Guo, Ying Zhao, Wei-Shuo Fang. Biotransformation of 3-oxo-oleanolic acid by Absidia glauca. Planta Med. 2010; 76: 1904-1907. [ Links ]
49. Fenga X, Luan J, Guo F, Li D, Chu Z. Microbial transformation of maslinic acid by Cunninghamella blackesleeana. J Mol Catal B Enzym. 2012; 82: 127-130. [ Links ]
50. Wendt KU, Schultz GE, Corey EJ, Liu DR. Enzyme mechanism for polycyclic triterpene formation. Angew Chem Int Ed. 2000; 39: 2812-2833. [ Links ]
51. Chen ZH, Yu BY, Cordell GA, Qiu SX. Biotransformation of quinovic acid glycosides by microbes: Direct conversion of the ursane to the oleanane triterpene skeleton by Nocardia sp. NRRL. 5546. Org Lett. 2004; 6: 3163-3165. [ Links ]
52. Herdricks C L. An enzyme-coupled colorimetric assay for S-adenosylmethionine-dependent methyl transferases. Anal Biochem. 2004; 326: 100-105. [ Links ]
53. Collins DO, Ruddock PLD, Chiverton de Grasse J, Reynolds WF, Reese PB. Microbial transformation of cadina-4, 10(15)-dien-3-one, aromadendr-1(10)-en-9-one and methyl ursolate by Mucor plumbeus (ATCC 4740). Phytochemistry. 2002; 59: 479-488. [ Links ]
54. Shao-bin Fu, Jun-shan Yang, Jin-long Cul, Xu Feng, Di-an Sun., Biotransformation of Ursolic Acid by an Endophytic Fungus from Medicinal Plant Huperzia serrate. Chem Pharm Bull. 2011; 59: 1180-1182. [ Links ]
55. Wen-Ni H, Jun-Gui D, Min Y, Li-Jun W, De-An G. Microbial transformation of asiatic acid by Alternaria longipes. J Asian Nat Prod Res. 2010; 12: 760-764. [ Links ]
56. Cheng, Z, Yu B, Guo Y, Qiu S. Microbial hydroxylation of quinovic acid glycoside by Streptomyces griseus ACCT 13273. Chin J Chem. 2006; 24: 95-98. [ Links ]
57. Chatterjee P, Pezzuto JM, Kouzi SA. Glucosidation of betulinic acid by Cunninghamella species. J Nat Prod. 1999; 62: 761-763. [ Links ]
58. Kouzi SA, Chatterjee P, Pezzuto JM, Hamann MT. Microbial transformations of the antimelanoma agent betulinic acid. J Nat Prod. 2000; 63: 1653-1657. [ Links ]
59. Chatterjee P, Kouzi SA, Pezzuto JM, Hamann MT. Biotransformation of the antimelanoma agent betulinic acid by Bacillus megaterium (ATCC 13368). Appl Environ Microbiol. 2000; 66: 3850-3855. [ Links ]
60. Bastos DZL, Pimentel IC, De Jesus DA, De Oliveira BH. Biotransformation of betulinic and betulonic acids by fungi. Phytochemistry. 2007; 68: 834-839. [ Links ]
61. Akihisa T, Takamine Y, Yoshizumi K, Tokuda H, Kimura Y, Ukiya M, Nakahara T, Yokochi T, Ichiishi E, Nishino H. Microbial transformations of two lupane-type triterpenes and anti-tumor-promoting effects of the transformation products. J Nat Prod. 2002; 65: 278-282. [ Links ]
62. Martin GDA, Reynolds WF, Reese PB. Investigation of the importance of the C-2 oxygen function in the transformation of stemodin analogues by Rhizopus oryzae ATCC 11145. Phytochemistry. 2004; 65: 701-710. [ Links ]














