Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.1 Ciudad de México ene./mar. 2013
Revisión bibliográfica
Agentes quelantes bifuncionales utilizados en la síntesis de radiofármacos
Bifunctional chelating agents used in the synthesis of radiopharmaceuticals
Elisa Leyva Ramos,1 Socorro Leyva Ramos,1 Carlos Jesús Cortés García2
1 Centro de Investigación y Estudios de Posgrado, Facultad de Ciencias Químicas, Universidad Autónoma de San Luis Potosí.
2 Departamento de Química, Universidad de Guanajuato.
Correspondencia
Dra. Socorro Leyva Ramos
Centro de Investigación y Estudios de Posgrado
Facultad de Ciencias Químicas
Universidad Autónoma de San Luis Potosí
Av. Dr. Manuel Nava No. 6, Zona Universitaria, San Luis Potosí, S.L.P.
México, C.P. 78210 Tel. (444)-826-2440 al 46 ext. 526
Fax. (444)-826-2371 y (444)- 826-2372
e-mail: sleyva@uaslp.mx
Fecha de recepción: 23 de mayo de 2012.
Fecha de recepción de modificaciones: 20 de noviembre de 2012.
Fecha de aceptación: 15 de diciembre de 2012.
Resumen
Los radiofármacos son compuestos orgánicos que contienen átomos de elementos radiactivos. Se han diseñado para utilizarse en diagnóstico o terapia, para liberar pequeñas dosis de radiación ionizante a ciertos tejidos u órganos en el cuerpo. En contraste con la quimioterapia convencional, los radiofármacos actúan contra células malignas con alta especificidad. Generalmente, los radiofármacos consisten en un agente quelante bifuncional, una molécula marcadora, un conector y un radionúclido.
En esta revisión, se presentan los aspectos generales de radiofármacos de marcado específico así como los agentes quelantes bifuncionales más utilizados para la generación de estos medicamentos.
Palabras clave: Radiofármacos, agentes quelantes bifuncionales, radionúclido.
Abstract
Radiopharmaceuticals are organic compounds containing atoms of some radioactive elements. They are designed for diagnostic or therapeutic purposes, to deliver small doses of ionizing radiation to certain tissues or organs in the body. Unlike classical chemotherapeutics, radiopharmaceuticals act against malignant cells with high specificity. These compounds contain a bifunctional chelating agent, a targeting molecule, a linker and a radionuclide. In this review, the general aspects of target specific radiopharmaceuticals are presented, as well as, the bifunctional chelating agents most studied in the development of these drugs.
Key words: Radiopharmaceuticals, bifunctional chelating agents, radionuclide.
Introducción
Radiofármacos
El proceso de marcado de fármacos comenzó desde 1908 con el Dr. Paul Ehrlich, quien propuso que los agentes quimioterapéuticos podrían unirse covalentemente a sustrato ligantes como anticuerpos, los cuales tienen afinidad y especificidad para marcar tejidos que presentan tumores malignos.1 Por lo que varios investigadores han estado estudiando diferentes ligantes y agentes quimioterapéuticos para el desarrollo de bioconjugados (figura 1), dando inicio a la era de los radiofármacos con el uso de metales radiactivos (radionúclidos) y diferentes moléculas marcadoras como anticuerpos, péptidos, entre otros.

Los radiofármacos son importantes por sus aplicaciones médicas en diagnóstico o terapia.2,3 Un radiofármaco de diagnóstico es una molécula marcada con un isótopo de emisión que permite evaluar una enfermedad o eficacia de un tratamiento terapéutico específico.4-8 Por otro lado, un radiofármaco terapéutico es una molécula diseñada para liberar dosis de radiación ionizante a sitios específicos.
Hay tres formas para suministrar esta radiación: irradiación externa, semillas radiactivas implantables o administración sistémica. Un radiofármaco de marcado específico generalmente contiene una molécula marcadora o biomolécula (BM), un conector, un radionúclido y un agente quelante bifuncional. Este último se conoce como BFCA por su nombre en inglés (bifunctional chelating agent). La molécula marcadora es el acarreador que lleva el radionúclido al sitio receptor del tejido enfermo.
Los radiofármacos más populares en la actualidad son los que contienen radionúclidos de tecnecio (99mTc) y de renio (186,188Re), ya que presentan propiedades nucleares favorables para imagen y terapia en el tratamiento de diversas enfermedades, como cardiovasculares (99mTc, γ 140 Kev, t1/2= 6 h; 186Re, β 1.07 Mev, t1/2=90 h, 188Re, β 2.21 Mev, t1/2=17 h). Existen artículos donde se reporta el empleo de varios radionúclidos (131I, 67Ga, 67Cu, 212/213Bi)3,7,11-17 y la síntesis de quelatos bifuncionales1-7,9,10,18-20 que se utilizan para marcar diferentes receptores como anticuerpos, ácidos grasos,14 péptidos,3,7,9-13,16,21-26 esteroides,27-31 adenovirus,32,33 y fármacos como tamoxifeno.34
Marcado de biomoléculas utilizando agentes quelantes bifuncionales
Un gran número de técnicas de radiomarcado han sido desarrolladas y extensamente revisadas.13,35-39 En la técnica conocida como premarcado se emplea un agente quelante bifuncional que forma un complejo con el radionúclido y después se conjuga con la biomolécula marcadora.13 En 1985 se utilizó por primera vez esta técnica para unir 67Cu a un anticuerpo monoclonal.40 Posteriormente, en 1994 se aplicó esta metodología en el marcado de un anticuerpo con 90Y y 111In (Figura 2).41

La técnica del postmarcado se basa en la conjugación del BFCA con la molécula marcadora (figura 3), seguido por el radiomarcado del bioconjugado con el radionúclido.3,42 Este método es el más utilizado en el desarrollo de radiofármacos, ya que no hay pérdida en la actividad biológica de la biomolécula.

Un radiofármaco de diagnóstico requiere que la biomolécula radiomarcada presente una alta captación en el órgano a marcar con una relación señal-ruido diagnósticamente útil en un corto periodo de tiempo. Para lograr este objetivo, la biomolécula marcada debe poseer un tiempo corto de residencia en la sangre, para minimizar la exposición de tejidos sanos a radiactividad. El tiempo de retención en la sangre debe ser lo suficientemente prolongado para permitir que el bioconjugado se una al sitio receptor y logre una acumulación adecuada en el tejido a marcar, permitiendo conseguir imágenes diagnósticamente útiles.
Siendo necesario que el BFCA forme un complejo metálico con alta estabilidad termodinámica para evitar tener competencia con quelatos nativos como la transferrina.
La elección de las características del quelato metálico de un BFCA también depende de la farmacocinética del radiofármaco.43-45 Para anticuerpos marcados que frecuentemente tienen una vida media alta en el torrente sanguíneo y en el sitio del tumor, el quelato metálico tiene que presentar una alta estabilidad termodinámica y una cinética adecuada para soportar la competencia que existe con los iones metálicos y quelatos nativos en la circulación sanguínea, además de tolerar el metabolismo hepatobiliar. Sin embargo para pequeñas moléculas radiomarcadas, la vida media biológica en el torrente sanguíneo es normalmente más corta que para los anticuerpos marcados. El principal objetivo al elegir un BFCA es minimizar la disociación en vivo del radionúclido.35
Agentes quelantes bifuncionales (BFCAs)
Los agentes quelantes bifuncionales han sido desarrollados para marcar biomoléculas, para el diagnóstico y terapia en vivo.41 A estos se les considera, la parte más importante de un radiofármaco de marcado específico, ya que coordina al radionúclido y se encuentra unido covalentemente a la molécula marcadora directamente o a través de un conector. En la figura 4 se muestra una representación esquemática de un radiofármaco de marcado específico (Figura 4).35

Las moléculas marcadoras son los acarreadores de los radionúclidos al sitio receptor en vivo y pueden ser macromoléculas como anticuerpos y sus fragmentos, o pequeñas moléculas orgánicas como péptidos entre otros.10,35,46 La selección de un BFCA esta generalmente determinada por la naturaleza y estado de oxidación del ión metálico. El conector es frecuentemente usado para modificar las propiedades farmacocinéticas del radiofármaco y su biodistribución, alterando la carga neta, lipofilicidad e hidrofilicidad.47
En la Figura 535 se muestran los diferentes conectores que existen (catiónicos, aniónicos, neutros o de corte metabólico). El conector puede ser una simple cadena alifática para incrementar la lipofilicidad, una secuencia de polipéptidos (como poliglicina, poliserina, o ácido poliaspártico) para incrementar la hidrofilicidad y depuración renal, o un polietilenglicol para una lenta extracción de los hepatocitos y sales de amina que modifica la carga neta de estos medicamentos.
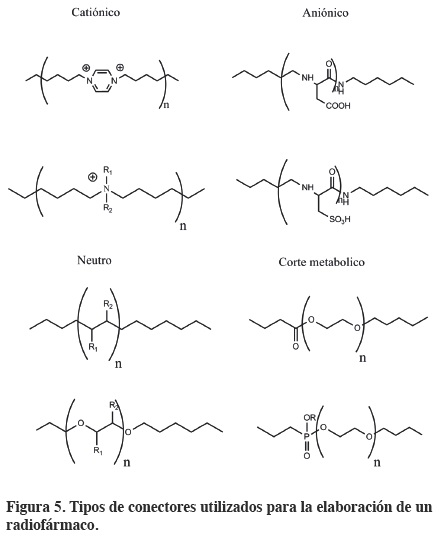
Los conectores metabolizables se han usado para los análogos de la somatostatina marcados con 111In.48 Un conector tetrapeptídico Gly-Gly-Gly-Leu-(ρ-NO2)-Ar-CONH2 que ha sido cortado entre los residuos de Gly y Ar se ha usado para modificar las propiedades farmacocinéticas de anticuerpos marcados con 90Y. Dependiendo del radionúclido y del BFCA, los grupos conectores son capaces de un rápido metabolismo; por ejemplo la presencia de un éster o disulfuro, pueden incrementar la eliminación de los radiofármacos en la sangre por medio del sistema renal.
El uso de radionúclidos ofrece muchas oportunidades para diseñar nuevos radiofármacos modificando el ambiente de coordinación alrededor del metal con una variedad de agentes quelantes. La química de coordinación del radionúclido metálico determinará la geometría y la estabilidad en solución del quelato metálico. Cada radionúclido presenta una química de coordinación diferente y requiere un BFCA con diferentes átomos donadores y fragmentos ligandos.
La naturaleza del quelato metálico puede impactar significativamente en la biodistribucion del radiofármaco y en su fijación al tumor, ya que modifica el tamaño global y el peso molecular del radiofármaco. Por lo tanto, el diseño y selección del BFCA es muy importante para el desarrollo de un agente terapéutico clínico útil
Requerimientos básicos de un agente quelante bifuncional (BFCA)
Hay varios requerimientos para considerar a un BFCA. La coordinación con el radionúclido debe ser fuerte y formar un complejo relativamente estable, que coincida con la naturaleza y estado de oxidación del radionúclido para evitar un cambio en su estado de oxidación.35 También debe presentar tolerancia hacia la radiólisis, ya que una dosis alta de radiación β, puede producir radicales libres muy reactivos, los cuales ocasionan una descomposición considerable del quelato metálico durante la distribución del radioconjugado ocasionando que este sea altamente tóxico.
Por lo tanto, el BFCA debe de formar un complejo con una alta estabilidad termodinámica, a pH neutro para mantener intacto el radionúclido bajo condiciones fisiológicas así como generar un quelato metálico con la menor cantidad de isómeros posibles.35,49,50 Además, el BFCA debe tener una alta hidrofilicidad que ayude a su eliminación en sangre y excreción renal.51
Grupos de conjugación de un radiofármaco
Los ésteres activos, isotiocianatos, maleimidas, hidrazidas, α-haloamidas y perfluoro aril azidas9 son grupos funcionales que pueden estar presentes en un BFCA ya que ayudan a la unión covalente de este con la biomolécula (Figura 6). Los ésteres activos se usan para formar un enlace amida entre un ácido carboxílico de un BFCA y un grupo amino de la biomolécula, dentro de los que se encuentran p-nitrofenil, pentafluorofenil, N- hidroxisuccinimida y sulfo- N- hidroxi-succinimida.

El éster de N-hidroxisuccinimida es muy reactivo con una alta selectividad por aminas alifáticas.3,52-54 La elección de un éster activo para ser usado en la formación del enlace BFCA-biomolécula es parcialmente debida a su reactividad total, pero también a la fácil remoción de los subproductos. Por ejemplo, para un conjugado BFCA-BM insoluble en agua, un éster succinimida es conveniente, ya que tanto la N-hidroxisuccinimida como la sulfo-N-hidroxisuccinimida son muy solubles en agua y fáciles de remover.53,54 Pero para un conjugado BFCA-BM soluble en agua, los ésteres de p-nitrofenil o pentafluorofenil, pueden ser inclusive una buena opción.9
Los isotiocianatos presentan una reactividad intermedia y forman enlaces tio-urea con aminas primarias de proteínas o péptidos. En general son más estables en agua que los ésteres de N-hidroxisuccinimida y reaccionan con aminas en solución acuosa a un pH óptimo entre 9-9.5. Por lo tanto, estos no son apropiados para la modificación de biomoléculas que son sensibles a condiciones alcalinas.
Las maleimidas reaccionan selectivamente con tioles y forman enlaces tio-éter sin ninguna competencia con la histidina u otros grupos reactivos. El pH óptimo para la reacción es cerca de 7, a pH más alto, pueden hidrolizarse formando ácidos maleimídicos no reactivos.45,55
Las hidrazidas son grupos de conjugación que reaccionan con el aldehído de la biomolécula para formar un conjugado de hidrazona-BM. Estas son apropiadas para biomoléculas que contienen en su estructura un grupo hidroxilo alifático (serina, treonina e hidroxilisina), el cual puede ser oxidado rápidamente con periodato a pH de 7 para generar un aldehído. Las hidrazonas formadas son estables en un pH entre 6 y 8 por 12 horas a 22°C.56 Las α-haloamidas son apropiadas para la conjugación con péptidos que contienen un grupo tiol libre. Los haluros (cloro, bromo) de acetilamida son los más usados.57,58
Las perfluoro aril azidas producen agentes quelantes bifuncionales fotolábiles útiles para el enlace covalente a moléculas marcadoras.36 Estos compuestos son los principales precursores utilizados en fotomarcado.59,60 Esta técnica es una alternativa atractiva para la unión de los BFCAs a proteínas y anticuerpos,61 en donde el grupo perfluoro aril azida59,62-66 produce, a través de radiación electromagnética en el rango del ultravioleta-visible, un intermediario altamente reactivo, que puede ser un nitreno singulete o triplete.67,68 En el caso del nitreno singulete es posible realizar una inserción eficiente con los enlaces C-H o N-H presentes en la biomolécula, mientras que el nitreno triplete promueve la abstracción de hidrógenos en la biomolécula para formar anilinas o se dimeriza con el mismo para generar azobencenos.69
Tipos de agentes quelantes bifuncionales
En la siguiente sección se presentan los agentes quelantes bifuncionales más utilizados en el desarrollo de diferentes radiofármacos, es muy importante seleccionar cuidadosamente el BFCA más adecuado, ya que la conjugación de este con una biomolécula dada requiere condiciones específicas de pH, temperatura y tiempos de reacción.
DTPA (ácido Nα-dietilentriaminopentaácetico). Este pertenece al grupo de los quelatos poliaminocarboxílicos y es un derivado del EDTA, que fue desarrollado por Sundberg y colaboradores70 en 1974 (Figura 7a).9 El DTPA es un grupo quelato fuerte para lantánidos y algunos iones metálicos de transición incluyendo Mn (II) e In (III), no es un buen ligando para Tecnecio y Renio. El DTPA se puede unir tanto a grandes proteínas como albúminas y anticuerpos45,55 y a pequeños péptidos como los análogos de la somatostatina.71 La conjugación del DTPA con macromoléculas se ha realizado con el uso del cloroformiato de isobutilo como agente de acoplamiento.72 Para la conjugación con péptidos se han aplicado los derivados del DTPA tales como el anhídrido bicíclico (cDTPA) y el derivado monoreactivo mDTPA (Figura 7 incisos b, c).9

El cDTPA fue sintetizado por Krejcarek y Tucker71 en 1977 y se ha usado por muchos investigadores en medicina nuclear, Hnatowich y colaboradores73 en 1983 desarrollaron un método simple para el acoplamiento covalente del cDTPA con péptidos. La eficiencia de este método es relativamente alta y ofrece algunas ventajas. La reacción se realiza en solución acuosa y se lleva a cabo en un solo paso, el producto secundario de la reacción, es un derivado DTPA doblemente sustituido y un material no reactivo que puede ser fácilmente separado por cromatografía de gel.
Este método es inapropiado para análogos de la somatostatina, debido a que el residuo de la lisina se encuentra situado dentro del sitio activo de la molécula, la conjugación puede resultar en la pérdida de la actividad del enlace al receptor. En 1991, Bakker y colaboradores74 propusieron proteger el residuo de la lisina dentro del sitio activo del péptido, antes de la reacción con cDTPA y desprotegerlo después de la conjugación, esto permite una reacción selectiva del grupo amino N-terminal con BFCA. Posteriormente en 1989, Boniface y colaboradores75 realizaron el marcado con 153Sm del cDTPA con un anticuerpo monoclonal (K-1-21) con células linfáticas, obteniendo un marcado muy eficiente y sin pérdida de la inmunoreactividad del radiofármaco.
Arano y colaboradores72 en 1991 sintetizaron el mDTPA con cuatro grupos carboxilos protegidos como ésteres de terbutilo (Figura 7c)9 y un grupo carboxílico libre, para permitir la formación de uniones intermoleculares libres con la biomolécula.
Un gran obstáculo en la eficiencia del radiomarcado con conjugados de DTPA es la presencia de metales traza en su preparación, ya que ellos compiten con los radionúclidos en el proceso de marcado. Para evitar esto, se debe de utilizar un exceso del péptido conjugado así como un radionúclido de alta pureza. Se ha visto que los derivados del DTPA pueden formar complejos estables con 111In (Figura 8),9 debido a que se coordina con ocho átomos donadores, de los cuales tres provienen del grupo amino, cuatro del grupo carboxílico, y el otro del oxígeno del carbonilo del grupo amida.76

Una ventaja de usar análogos del DTPA es su rápida cinética de marcado con anticuerpos o fragmentos de anticuerpos debido a que son resistentes a altas temperaturas. Muchos grupos de investigación se han dedicado a la síntesis de conjugados DTPA-biomolécula para mejorar la estabilidad termodinámica y cinética con 90Y o 111In.41 Por lo que se han preparado derivados del DTPA, para desarrollar conjugados de primera (Figura 9 incisos a, b)9 y segunda generación (Figura 9c).9,77,78

La primera generación fueron sintetizados por Brechbiel y colaboradores79 que reportaron la síntesis del quelato ácido 1-(p-isotiocianato de bencilo)-dietilentriaminopentaacético (Figura 9a)9 y su conjugación con un anticuerpo monoclonal (MoAb B72.3) empleado para el diagnóstico del carcinoma humano colon rectal con el radionúclido 111In. Posteriormente, Keana y Jeffry80 en 1990 reportaron la síntesis de un compuesto similar. Sin embargo, el uso de estos BFCAs ha sido limitado por las complejas separaciones involucradas en su preparación, y por la baja estabilidad in vivo que presentan. Por lo tanto, se preparó una segunda generación de derivados del DTPA (Figura 9c),9 en donde se reemplaza uno de los grupos etileno de la estructura del quelato por un grupo ciclohexilo. Tal modificación incrementó la rigidez en la estructura del DTPA y la estabilidad in vivo del radiofármaco.
Recientemente se ha publicado la síntesis de nuevos derivados del DTPA en donde se mejoran las propiedades termodinámicas y cinéticas del BFCA así como la estabilidad in vivo del radiofármaco.9 Safavy y colaboradores81 en el 2002 sintetizaron el ácido N4, Nα, Nα, Nε, Nε- (pentakis (carboximetil))- N4-(carboximetil)- 2,6-diamino-4-azahexanoico hidrazida (Figura 10), el cual fue conjugado con una proteína (Mab Δ CH2HuCC49) para después ser marcado con 90Y para el tratamiento de cáncer de colon rectal.

DOTA (ácido 1, 4, 7, 10- tetraazaciclododecano- N, N', N'', N''' - tetraacético) y sus derivados son ejemplos de quelatos macrocíclicos, que surgieron a partir de 1967, cuando Pederson82,83 dio a conocer la química de los éteres corona. Desde entonces se ha reportado en la literatura un gran número de ejemplos de este tipo de quelatos utilizando una gran variedad de átomos donadores con diferentes iones metálicos, ya que forman complejos metálicos con buena estabilidad termodinámica y cinética adecuada.
El agente quelante DOTA (Figura 11a)9junto con sus derivados (Figura 11a)9 son una buena alternativa que puede ser utilizada en lugar del DTPA, ya que los complejos metálicos de dicho compuesto han mostrado tener una liberación del radionúclido bajo condiciones fisiológicas.48 El DOTA forma complejos muy estables con una variedad de radionúclidos trivalentes, tales como 68Ga79, 90Y, 111In, 149Pm, 177Lu,84,85 y radionúclidos divalentes como 27Mg, 47Ca, 64Cu.86

Se han desarrollado dos metodologías de conjugación del DOTA con biomoléculas. En el primer método, uno de los cuatro grupos carboxílicos en la molécula de DOTA es activado para facilitar su reacción con aminas primarias en la biomolécula y formar un enlace amida estable. Mientras que en el segundo método, la biomolécula se une covalentemente a los derivados de DOTA con cadenas laterales (Figura 11 incisos b,c).5,9,84
En años recientes, Eisenwiener y colaboradores87 introdujeron nuevos derivados (Figura 11d)9 donde la conjugación se realizó a través del grupo amino de la biomolécula. Los conjugados DOTA son especialmente apropiados para radionúclidos de terapia, ya que pueden ser marcados con 67Ga, 90Y73 e 111In.88 De Jong y colaboradores89 han demostrado que los conjugados de 90Y-DOTA tienen muy buenas propiedades farmacocinéticas in vivo. Sin embargo, en estos conjugados el quelato está situado cerca del péptido, haciendo que el bioconjugado sea más rígido y menos flexible, lo cual provoca que el enlace con el receptor sea más difícil.
Reubi y colaboradores90 reportaron complejos de 67Ga-DOTA con mejores propiedades farmacológicas. Donde la geometría de coordinación del radionúclido, incrementó la flexibilidad del ligando y permitió una mejor afinidad al sitio de enlace del receptor. Para un tratamiento en radioterapia seguro y potente se requiere un ligando que forme un complejo estable con una cinética de complejación clínicamente aceptable. Por lo que Chong y colaboradores,91 sintetizaron la segunda generación del DOTA, el DEPA (ácido (7- [2- bis- (carboximetil- amino)-etil]- 4, 10- bis- carboximetil- 1, 4, 7, 10- tetraza- ciclododec- 1-il)- acético), donde evaluaron la estabilidad del quelato con 177Lu, 212/213Bi y 205/206Bi (Figura 12).91

Muy recientemente el mismo grupo llevó a cabo la síntesis de un nuevo agente quelante bifuncional el c-DEPA (Figura 13),15 el cual lograron conjugarlo al trastuzumab que es un anticuerpo para el marcado específico de tumores, evaluando la cinética de complejación con el 205/206Bi. El radiofármaco mostro una alta eficiencia de radiomarcado y buena estabilidad en suero humano durante 72 h, por lo que en base a estos resultados, los autores sugieren que el c-DEPA puede ser un buen agente quelante para radioinmunoterapia utilizando radionúclidos de 212/213Bi.15

En 2012, Susuki y colaboradores16 reportaron la síntesis de un nuevo análogo, el c-DOTA (Figura 14) como agente quelante para el 111In, utilizado en la radiodetección, donde el complejo mostró altos rendimientos radioquímicos y buena estabilidad termodinámica.

TETA (ácido 1, 4, 8, 11- tetraazaciclotetradecano- 1, 4, 8, 11-tetraacético) Figura 15,9 es uno de los agentes quelates más estudiados para cobre en el marcado de péptidos y anticuerpos en radioterapia. Se han sintetizado varios derivados de este, que se han utilizado en el desarrollo de conjugados de 67Cu con anticuerpos para el tratamiento de cáncer de colon.41,55,92,93 TETA también ha sido exitosamente utilizado como BFCA con análogos de la somatostatina.9

El grupo de Yoo94 en el 2012 reportaron la síntesis de un nuevo agente quelante tipo TETA. El PCB-TE2A puede acomplejarse con 64Cu (Figura 16) ,94 teniendo una muy alta estabilidad cinética y adecuada biodistribución, para ser utilizado como radiofármaco de marcado específico.

NOTA (ácido 1,4,7-triazaciclononano-1,4,7-triacético) Figura 17a junto con su derivado fosfonato NOTP (Figura 17b) y éster monoetil NOTPME (Figura 17c) fueron estudiados para su posible uso como radiofármacos.9 Se han reportado los complejos de estos agentes quelantes con 67/68Ga y 111in.85,93,95 Recientemente Jeong y colaboradores96 reportaron la conjugación de NOTA con el péptido cíclico Arg- Gly- Asp- D-Tyr- Lys [c (RGDyK)] y marcado con 68Ga para estudios de imagen de angiogénesis en el tejido isquémico, obteniendo un alto rendimiento de marcado y alta selectividad a los receptores del péptido cíclico.

Eisenwiener y colaboradores97 sintetizaron un derivado monoreactivo de NOTA, el NODAGA (Figura 17d).9 Este BFCA es útil para acoplar péptidos con el grupo N-amino terminal tanto en fase sólida como en solución. Los conjugados del NODAGA-biomolécula fueron marcados con 67Ga y 111In en altos rendimientos y presentaron buenas actividades específicas.
La segunda generación de NOTA fue preparada por Chong y colaboradores98 resultando NETA (ácido {4- [2- (bis-carboximetil- amino)- etil]- 7- carboximetil- [1.4.7]triazonan-1-il}-acético) y NE3TA (ácido {4-carboximetil-7- [2- (carboximetil- amino)- etil]- [1.4.7]triazonan-1-il}-acético) (Figura 18).91 Estos ligandos fueron evaluados como quelatos con varios metales (90Y, 205/206Bi, 203Pb, 177Lu y 64Cu) mostrando una buena afinidad por lo que se pueden utilizar en diagnóstico y terapia. En particular, los quelatos de NETA resultaron ser muy efectivos en radioinmunoterapia, donde se emplea un anticuerpo monoclonal para la entrega selectiva del radioisótopo citotóxico.

La tercera generación de estos compuestos fue recientemente propuesta por Gasser y colaboradores99 en el 2008, ellos sintetizaron un derivado del 1,4,7-triazaciclononano, (TACN) el ácido 2- (4, 7- bis- (2- piridilmetil)- 1, 4, 7- triazaciclononan- 1-il)-acético (Figura 19),99 que contiene tanto un grupo carboxílico para la unión covalente a la biomolécula como dos grupos secundarios piridil. Ellos realizaron el radiomarcado con 64Cu y su conjugación con un análogo de la bombesina en la radiodetección del cáncer pancreático. Gasser y colaboradores concluyeron que el bioconjugado presenta una alta estabilidad in vivo y rápida separación renal sin pérdida del radionúclido.

Abrams y colaboradores100 en 1990 fueron los primeros en reportar el uso de arilhidrazinas, incluyendo el ácido 4-hidrazinobenzoico (HYBA) y el ácido 6-hidrazinonicotínico (HYNIC) (Figura 20),9 como agentes quelantes bifuncionales para 99mTc y su conjugación con anticuerpos policlonales IgG.100,101 Desde entonces HYNIC se ha usado para el marcado de 99mTc con anticuerpos,102 péptidos,103 quimiotácticos,104 γ-globulinas,101,102 análogos de la somatostatina,104 receptores para ligandos folatos105 y polipéptidos.106-108

La ventaja de utilizar el HYNIC es su alta eficiencia de marcado. El arreglo estructural del HYNIC indica solo la presencia de dos sitios de coordinación del radionúclido. Por ello con un coligando como la tricina, ácido etilen-diamino-acético o glucoheptonato se coordina para completar la esfera de coordinación del radionúclido109,110 (Figura 21).9 La conjugación de los coligandos ayuda a modificar las propiedades farmacocinéticas del radiofármaco.

Se han encontrado que los derivados de HYNIC, junto con fosfinas110,111 y tricinas forman complejos ternarios. (99mTc (HYNIC-Tm) (tricina) (fosfina)) (Tm: molécula marcadora), los cuales son estables en solución, y su hidrofilicidad puede ser modificada cambiando los grupos funcionales unidos a la fosfina o por substitución de la tricina con otros derivados de la glicina.
Desde hace varios años, Liu y colaboradores112 han utilizado un sistema de ligandos ternarios (HYNIC, tricina y trifenilfosfina-3-3'-3''-trisulfonato trisódico) para el marcado de 99mTc con una gran variedad de pequeñas biomoléculas como: receptores antagonistas de LTB4,113 receptores antagonistas de vitronectina112 y receptores antagonistas de GPIIb/IIIa.114 Este sistema ternario forma complejos con el tecnecio con alto rendimiento y actividad específica mostrando frecuentemente dos formas isoméricas si la biomolécula contiene uno o más centros quirales.
Recientemente se ha propuesto la síntesis de nuevos coligandos, para generar una nueva de clase de quelatos HYNIC, que contienen dentro de su estructura fenilhidrazina, un éter corona con ditiocarbamato y una difosfina conocida como PNP (Figura 22).108 La combinación de esos tres ligandos con el 99mTc resulta en la formación de complejos catiónicos que se pueden utilizar en el desarrollo de radiofármacos para imagen en diagnóstico de enfermedades cardiovasculares.

Dentro de los quelatos tetradentados se encuentran triamidotioles N3S, diamidaditioles N2S2 (DADS),114,115 N2S2 monoamidamonoaminaditiol (MAMA),116,117 diaminotetratioles N2S4,13 N2S2 diaminaditiol (DADT)3 (Figura 23)9 y un gran número de sus derivados, que contienen átomos de azufre y nitrógeno, incorporados en la estructura de estos quelatos. Los quelatos N2S4 contienen dos átomos donadores de nitrógeno amino y cuatro átomos donadores de azufre, los cuales se han utilizado para el marcado de anticuerpos con 99mTc y 186/188Re,36,118 la presencia de los grupos ti oles permite el acoplamiento con anticuerpos vía unión disulfuro.3

Los quelatos N2S2 diamidaditiol (DADS) tienen dos átomos donadores de nitrógeno amida y dos átomos donadores de azufre para formar complejos estables aniónicos de oxotecnecio con el núcleo (Tc=O).3+ Los N2S2 diamidaditiol y triamidotioles N3S forman complejos de tecnecio muy estables y solubles en lípidos.119 Fritzberg y colaboradores120 fueron los primeros en reportar el uso del 4,5-bis(tioacetamida)pentanoato como BFCA en el marcado de anticuerpos y sus fragmentos con 99mTc utilizando la técnica del premarcado. Se encontró que el enlace de este BFCA y la incorporación del radionúclido (99mTc, 188/186Re) no afectan significativamente las propiedades biológicas de los anticuerpos y sus fragmentos, ya que el radiomarcado solo ocurre en una porción de estas macromoléculas.3 Otros agentes quelantes bifuncionales como N2S2 diamidaditiol y triamidaditiol N3S también se han utilizado para el marcado de biomoléculas, incluyendo proteínas,121-123 biotina,124 péptidos.9’ 116,125,126
N2S2 (DADT) forman complejos muy estables con 99mTc y 188/186Re. Los quelatos N2S2 contienen dos átomos donadores amino y dos átomos donadores tiol, y se han utilizado para el marcado de proteínas, péptidos y oligonucleótidos.
Estos forman complejos con renio y tecnecio altamente lipofílicos,127 por lo que se han aplicado en el marcado en sistemas hidrofóbicos.121 N3S y N2S2 son BFCAs que forman complejos con alta actividad específica. Por ello pueden ser utilizados en la técnica del premarcado. En el caso de pequeñas moléculas (esteroides, péptidos de bajo peso molecular) acomplejan al 188/186Re en el proceso de marcado de post-conjugación.128 Por lo que son utilizados en la síntesis de radiofármacos.129
Los quelatos N2S2 monoamidamonoamidatiol (MAMA) tienen en su estructura un nitrógeno de amina secundaria, un nitrógeno de amida y dos donadores de azufre, que forman complejos neutros con el tecnecio, evitando que quede sin carga. Estos quelatos se han utilizado para el marcado de tecnecio con biomoléculas tales como ligandos receptores de la progesterona,29 antagonistas receptores plaquetarios GPIIb/GPIIIa117 y transportadores de dopamina.130,131
Los BFCAs más frecuentemente utilizados son los del tipo MAG3 (mercaptoacetil-glicilglicilglicina) y MAG2-GABA (ácido-γ-butírico-mercaptoacetilglicilglicilglicina), los cuales contienen grupos glicina y GABA, respectivamente (Figura 24).9 Los grupos GABA son dos unidades de carbono mayor que la glicina; por lo que presentan mejores propiedades fisicoquímicas como alto rendimiento en el marcado de radionúclidos o mayor enlace al receptor debido a los cambios en la organización intramolecular.36,129

Recientemente Seifert y colaboradores132 han reportado la síntesis de quelatos tetradentados del tipo tetratiolato S4 (Figura 25). Los quelatos S4 sintetizados fueron acomplejados con el 188Re, presentando una alta estabilidad in vivo de los complejos así como una alta retención en tejidos marcados y rápida elimación en órganos no marcados. Por lo que Seifert y colaboradores concluyeron que los complejos 188Re-S4 cumplen con los requerimientos básicos de un marcado estable y específico a biomoléculas.

Conclusiones
La aplicación de radiofármacos con fines de diagnóstico o terapéuticos está ganando importancia rápidamente en medicina nuclear. Moléculas biológicamente activas que interaccionan selectivamente con sitios específicos, en tejidos u órganos humanos son vehículos adecuados para liberar pequeñas dosis de radioactividad. Existen dos métodos en la síntesis de radiofármacos. El premarcado que se basa en la conjugación del BFCA con el radionúclido seguido de su unión a la biomolécula y el postmarcado donde se une el BFCA y la biomolécula seguido del radiomarcado. Este último procedimiento es el más utilizado en la síntesis de radiofármacos. Para esto se han sintetizado varios BFCAs como DTPA, DOTA, NOTA e Hynic. Actualmente no existen muchos ejemplos de radiofármacos en la práctica clínica. La mayoría de ellos son análogos de somatostatina, por lo que es necesario desarrollar nuevos BFCAs bioconjugados que puedan ser preparados por metodologías sencillas y tengan las propiedades fisicoquímicas adecuadas para ser utilizados en diagnóstico o terapia. El desarrollo de nuevos radiofármacos es un trabajo multidisciplinario que requiere la colaboración de científicos en las áreas del campo orgánico, inorgánico, química analítica, bioquímica y medicina nuclear.
Agradecimientos
Se agradece al Consejo Nacional de Ciencia y Tecnología, CONACYT, por el financiamiento otorgado a través de la beca de maestría (registro No. 230777) y proyectos de investigación (CB-2010-155678, SEP-82585). A la Universidad Autónoma de San Luis Potosí, UASLP (PIFI 2011).
Referencias
1. Koppel GA Recent advances with monoclonal antibody drug targeting for the treatment of human cancer. Bioconjugate Chem. 1990; 1(1): 13-23. [ Links ]
2. Ziessman HA, O'Malley JP, Thrall JH. Nuclear Medicine. Elsevier. 2006. [ Links ]
3. Liu S, Edwards DS. 99mTc-labeled small peptides as diagnostic radiopharmaceuticals. Chem Rev. 1999; 99(9): 2235-2268. [ Links ]
4. Liu S. Bifunctional coupling agents for radiolabeling of biomolecules and target-specific delivery of metallic radionuclides. Adv Drug Delivery Rev. 2008; 60(12): 1347-1370. [ Links ]
5. Liu, S. Ether and crown ether-containing cationic 99mTc complexes useful as radiopharmaceuticals for heart imaging. Dalton Trans. 2007; 1183-1193. [ Links ]
6. Bartholomä MD, Louie AS, Valliant JF, Zubieta J. Technetium and gallium derived radiopharmaceuticals: comparing and contrasting the chemistry of two important radiometals for the molecular imaging era. Chem Rev. 2010; 110(5): 2903-2920. [ Links ]
7. Schubiger PA, Alberto R, Smith A. Vehicles, chelators, and radionuclides: choosing the "building blocks" of an effective therapeutic radioimmunoconjugate. Bioconjugate Chem. 1996; 7(2): 165-179. [ Links ]
8. Reubi JC. J. Neuropeptide receptors in health and disease: the molecular basis for in vivo imaging. J Nucl Med. 1995; 36(10): 1825-1835. [ Links ]
9. Fichna J, Janecka A. Synthesis of target-specific radiolabeled peptides for diagnostic imaging. Bioconjugate Chem. 2003; 14(1): 3-17. [ Links ]
10. Wilbur DS. Radiohalogenation of proteins: an overview of radionuclides, labeling methods and reagents for conjugate labeling. Bioconjugate Chem. 1992; 3(6): 433-470. [ Links ]
11. Jurisson SS, Lydon JD. Potential technetium small molecule radiopharmaceuticals. Chem Rev. 1999; 99(9): 2205- 2218. [ Links ]
12. Anderson CJ, Welch MJ. Radiometal-labeled agents (non-technetium) for diagnostic imaging. Chem Rev. 1999; 99(9): 2219-2234. [ Links ]
13. Liu S, Edwards DS, Barrett JA. 99mTc labeling of highly potent small peptides. Bioconjugate Chem. 1997; 8(5): 621-636. [ Links ]
14. Yamamura N, Magata Y, Arano Y, Kawaguchi T, Ogawa K, Konishi J, Saji H. Technetium-99m-labeled medium-chain fatty acid analogues metabolized by β-oxidation: radiopharmaceutical for assessing liver function. Bioconjugate Chem. 1999; 10(3): 489-495. [ Links ]
15. Dadwal M, Kang CS, Song, HA, Sun X, Dai A, Baidoo KE, Bhechbiel MW, Chong HS. Synthesis and evaluation of a bifunctional chelate for development of Bi(III)-labeled radioimmunoconjugates. Bioorg Med Chem Lett. 2011; 21(24): 7513-7515. [ Links ]
16. Susuki H, Kanai A, Uehara T, Guerra Gomez FL, Hanaoka H, Arano Y. Facile synthesis and evaluation of C-functionalized benzyl- 1- oxa- 4, 7, 10 triazacyclododecane-N,N',N''-triacetic acid as chelating agent for 111In-labeled polypeptides. Bioorg Med Chem. 2012; 20 (2): 978-984. [ Links ]
17 .Maruk AY, Bruskin AB, Kodina GE. Novel 99mTc radiopharmaceuticals with bifunctional chelating agents. Radiochemistry. 2011; 53(4): 341-353. [ Links ]
18. Swor CD, Tyler DR. Synthesis and coordination chemistry of macrocyclic phosphine ligands. Coord Chem Rev. 2011; 255: 2860-2881. [ Links ]
19. Lim SC, Paterson BM, Fodero-Tavoletti MT, O'Keefe GJ, Cappai R, Barnham KJ, Villemagne VL, Donnelly PS. A copper radiopharmaceutical for diagnostic imaging of Alzheimer's disease: a bis(thiosemicarbazonato)copper(II) complex that binds to amyloid-β plaques. Chem Commun. 2010; 46: 5437-5439. [ Links ]
20. Bechara G, Leygue N, Galaup C, Mestre B, Picard C. An efficient route to pyridine and 2,2'-bipyridine macrocycles incorporating a triethylenetetraminetetraacetic acid core as ligand for lanthanide ions. Tetrahedron Lett. 2009; 50(47): 6522-6525. [ Links ]
21. Maschauer S, Einsiedel J, Hocke H, Hübner H, Kuwert T, Gmeiner P, Prante O. Synthesis of a 68Ga-labeled peptoid-peptide hybrid for imaging of neurotensin receptor expression in vivo. Med Chem Lett. 2010; 1(5): 224-228. [ Links ]
22. Zelenka K, Borsig L, Alberto R. Metal complex mediated conjugation of peptides to nucleus targeting acridine orange: a modular concept for dual-modality imaging agents. Bioconjugate Chem. 2011; 22(5): 958-967. [ Links ]
23. Cai H, Li Z, Huang CW, Shahinian AH, Wang H, Park R, Conti PS. Evaluation of copper-64 labeled ambasar conjugated cyclic RGD peptide for improved microPET imaging of integrin αvβ3 expression. Bioconjugate Chem. 2010; 21(8): 1417-1424. [ Links ]
24. Huang CW, Li Z, Cai H, Shahinian T, Conti PS. Biological stability evaluation of the α2β1 receptor imaging agents: diamsar and DOTA conjugated DGEA peptide. Bioconjugate Chem. 2011; 22(2): 256-263. [ Links ]
25. Volkert WA, Hoffman TJ. Therapeutic radiopharmaceuticals. Chem. Rev. 1999; 99(9): 2269-2292. [ Links ]
26. Blok D, Feitsma RIJ, Vermeij P, Pauwels EJK. Peptide radiopharmaceuticals in nuclear medicine. Eur J Nucl Med. 1999; 26(11):1511-1519. [ Links ]
27. DiZio JP, Fiaschi R, Davison A, Jones AG, Katzenellenbogen JA. Progestin-rhenium complexes: metal-labeled steroids with high receptor binding affinity, potential receptor-directed agents for diagnostic imaging or therapy. Bioconjugate Chem. 1991; 2(5): 353-366. [ Links ]
28. DiZio JP, Anderson CJ, Davison A, Ehrhardt GJ, Carlson KE, Welch MJ, Katzenellenbogen JA. Technetium- and rhenium-labeled progestins: synthesis, receptor binding and in vivo distribution of an 11β-substituted progestin labeled with technetium-99 and rhenium-186. J Nucl Med. 1992; 33(4): 558-569. [ Links ]
29. O'Neil JP, Carlson KE, Anderson CJ, Welch MJ, Katzenellenbogen JA. Progestin radiopharmaceuticals labeled with Technetium and Rhenium: synthesis, binding affinity, and in vivo distribution of a new progestin N2S2-metal conjugate. Bioconjugate Chem. 1994; 5(3): 182-193. [ Links ]
30. Chi DY, O'Neil JP, Anderson CJ, Welch MJ, Katzenellenbogen JA. Homodimeric and heterodimeric bis(amino thiol) oxometal complexes with rhenium(V) and technetium(V). Control of heterodimeric complex formation and an approach to metal complexes that mimic steroid hormones J Med Chem 1994; 37(7): 928-937. [ Links ]
31. Skaddan MB, Katzenellenbogen, JA. Integrated "3+1" oxorhenium(V) complexes as estrogen mimics. Bioconjugate Chem. 1999; 10(1): 119-129. [ Links ]
32. Zinn KR, Douglas JT, Smyth CA, Liu HG, Wu Q, Krasnykh VN, Mountz JD, Curiel DT, Mountz JM. Imaging and tissue biodistribution of 99mTc-labeled adenovirus knob (serotype 5). Gene Ther. 1998; 5(6): 798-808. [ Links ]
33. Vasalatiy O, Gerard RD, Zhao P, Sun X, Sherry AD. Labeling of adenovirus particles with PARACEST agents. Bioconjugate Chem. 2008; 19(3): 598-606. [ Links ]
34. Hunter DH, Luyt LG. Single isomer technetium-99m tamoxifen conjugates. Bioconjugate Chem. 2000; 11(2): 175-181. [ Links ]
35. Liu S, Edward DS. Bifunctional chelators for therapeutic lanthanide radiopharmaceuticals. Bioconjugate Chem. 2001; 12(1): 7-34. [ Links ]
36. Griffiths GL, Goldenberg DM, Knapp FF, Callahan AP, Chang CH, Hansen HJ. Direct radiolabeling of monoclonal antibodies with generator-produced rhenium-188 for radioimmunotherapy: labeling and animal biodistribution studies. Cancer Res. 1991; 51(17): 4594-4602. [ Links ]
37. Rajagopalan R, Kuntz RR, Sharma U, Volkert WA, Pandurangi RS. Chemistry of bifunctional photoprobes. 6. Synthesis and characterization of high specific activity metalated photochemical probes: development of novel rhenium photoconjugates of human serum albumin and Fab fragments. J Org Chem. 2002; 67(19): 6748-6757. [ Links ]
38. Baidoo KE, Scheffel U, Stathis M. High-affinity no-carrier-added 99mTc-labeled chemotactic peptides for studies of inflammation in vivo. Bioconjugate Chem. 1998; 9(2): 208-217. [ Links ]
39. Fischman AJ, Babich JW, Strauss WJ. A ticket to ride: peptide radiopharmaceuticals. J Nucl Med. 1993 ; 34(12): 2253-2263. [ Links ]
40. Moi MK. Meares CF, McCall MJ, Cole WC, DeNardo, SJ. Copper chelates as probes of biological systems: stable copper complexes with a macrocyclic bifunctional chelating agent. Anal Biochem. 1985; 148(1): 249-253. [ Links ]
41. Li M, Meares FC, Zhong GR, Miers L, Xiong CY, DeNardo SJ. Labeling monoclonal antibodies with 90Yttrium- and 111Indium-DOTA chelates: a simple and efficient method. Bioconjugate Chem. 1994; 5(2): 101-104. [ Links ]
42. Weber RW, Boutin RH, Nedelman MA, Lister-James J, Dean RT. Enhanced kidney clearance with an ester-linked 99mTc-radiolabeled antibody Fab'-chelator conjugate. Bioconjugate Chem. 1990; 1(6): 431-437. [ Links ]
43. Liu S. The role of coordination chemistry in the development of target-specific radiopharmaceuticals. J Nucl Med. 2004; 45(10): 1776-1783. [ Links ]
44. Ando A, Ando I, Hirako T, Hisda K. Relation between the location of elements in the periodic table and various organ-uptake rates. Nucl Med Biol. 1989; 16(1): 57-80. [ Links ]
45. McMurry TJ, Pippin CG, Wu C, Deal KA, Brechbiel MW, Mirzadeh S, Gansow OA. Physical parameters and biological stability of yttrium (III) diethylene-triaminepentaacetic acid derivative conjugates J Med Chem. 1998; 41(18): 3546-3549. [ Links ]
46. Cheng Y, Ono M, Kimura H, Ueda M, Saji H. Technetium-99m labeled pyridyl benzofuran derivatives as single photon emission computed tomography imaging probes for β-smyloid plaques in Alzheimer's brains. J Med Chem. 2012; 55(5): 2279-2286. [ Links ]
47. De León-Rodríguez LM, Kovacs Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 2008; 19(2): 391-402. [ Links ]
48. Smith-Jones PM, Stolz B, Albert R, Knecht H, Bruns CJ. Synthesis, biodistribution and renal handling of various chelate-somatostatin conjugates with metabolizable linking groups. Nucl Med Biol. 1997; 24(8): 761-769. [ Links ]
49. Luyt GL, Jenkins HA, Hunter DH. An N2S2 bifunctional chelator for Technetium-99m and Rhenium: complexation, conjugation, and epimerization to a single isomer. Bioconjugate Chem. 1999; 10(3): 470-479. [ Links ]
50. Rao TN, Adhikesavalu D, Camerman A, Fritzberg AR. Technetium (V) and rhenium (V) complexes of 2,3-bis(mercaptoacetamido)propanoate. Chelate ring stereochemistry and influence on chemical and biological properties. J Am Chem Soc. 1990; 112(15): 5798-5804. [ Links ]
51. Tsai SW, Li L, Williams LE, Anderson AL, Raubitscheck AA, Shively JE. Metabolism and renal clearance of 111In-labeled DOTA-conjugated antibody fragments. Bioconjugate Chem. 2001; 12(2): 264-270. [ Links ]
52. Anderson GW, Zimmerman JE, Callahan FM. Reinvestigation of the mixed carbonic anhydride method of peptide synthesis. J Am Chem Soc. 1967; 89(19) : 5012-5017. [ Links ]
53. Anderson GW, Zimmerman JE, Callahan FM. The use of esters of N-hydroxysuccinimide in peptide synthesis. J Am Chem Soc. 1964; 86(9): 1839-1842. [ Links ]
54. Grumbach IM, Veh RW. Sulpho-N-hydroxysuccinimide activated long chain biotin: a new microtitre plate assay for the determination of its stability at different pH values and its reaction rate with protein bound amino groups. J Immunol Methods. 1991; 140(2): 205-210. [ Links ]
55. Meares, CJ. Chelating agents for the binding of metal ions to antibodies. Nucl Med Biol. 1986; 13(4): 311-318. [ Links ]
56. Geoghegan KF, Stroh JG. Site-directed conjugation of nonpeptide groups to peptides and proteins via periodate oxidation of a 2-amino alcohol. Application to modification at N-terminal serine. Bioconjugate Chem. 1992; 3(2): 138-146. [ Links ]
57. Pearson DA, Lister-James J, McBride WJ, Wilson DM, Martel LJ, Civitello ER, Dean RT. Thrombus imaging using technetium-99m-labeled high-potency GPIIb/IIIa receptor antagonists. Chemistry and initial biological studies. J Med Chem. 1996; 39(7): 1372-1382. [ Links ]
58. Pearson DA, Lister-James J, McBride WJ, Wilson DM, Martel LJ, Civitello ER, Taylor JE, Moyer BR, Dean RT. Somatostatin receptor-binding peptides labeled with technetium-99m: chemistry and initial biological studies. J Med Chem 1996; 39(7): 1361-1371. [ Links ]
59. Poe R, Grayzar J, Young MT, Leyva E, Schnap KA, Platz M. Remarkable catalysis of intersystem crossing of singlet (pentafluorophenyl)nitrene. J Am Chem Soc. 1991; 113(8): 3209-3211. [ Links ]
60. Schnapp KA, Poe R, Leyva E, Soundararajan N, Platz MS. Exploratory photochemistry of fluorinated aryl azides. Implications for the design of photoaffinity labeling reagents. Bioconjugate Chem. 1993; 4(2): 172-177. [ Links ]
61. Pandurangi RS, Karra SR, Kuntz RR, Volkert WA. High efficiency photolabeling of human serum albumin and human γ-globulin with [14C] methyl 4- azido- 2, 3, 5, 6-tetrafluorobenzoate. Bioconjugate Chem. 1995; 6 (5): 630-634. [ Links ]
62. Leyva E, Platz MS, Persy G, Wirz J. Photochemistry of phenyl azide: the role of singlet and triplet phenylnitrene as transient intermediates. J Am Chem Soc. 1986; 108(13): 3783-3790. [ Links ]
63. Leyva E, Jennifer M, Young T, Platz M. High yields of formal CH insertion products in the reactions of polyfluorinated aromatic nitrenes. J Am Chem Soc. 1986; 108(26): 8307-8309. [ Links ]
64. Leyva E, Munoz D, Platz M. Photochemistry of fluorinated aryl azides in toluene solution and in frozen polycrystals. J Org Chem. 1989; 54(25), 5938-5945. [ Links ]
65. Leyva E, Sagredo R. Photochemistry of fluorophenyl azides in diethylamine. Nitrene reaction versus ring expansion. Tetrahedron. 1998; 54(26): 7367-7370. [ Links ]
66. Leyva E, Sagredo R, Moctezuma E. Photochemistry of fluorophenyl azides in aniline: asymmetric fluoroazobenzenes by NH singlet nitrene insertion. J Fluorine Chem. 2004; 125 (5): 741-743. [ Links ]
67. Moss R, Platz M, Maitland J. Reactive Intermediate Chemistry. Wiley Interscience, 2004. [ Links ]
68. Leyva S, Leyva E. Thermochemical reaction of 7-azido-1-ethyl-6,8-difluoroquinolone-3-carboxylate with heterocyclic amines. An expeditious synthesis of novel fluoroquinolone derivatives. Tetrahedron. 2007; 63(9), 2093-2097. [ Links ]
69. Leyva E, de Loera D, Leyva S. Photochemistry of 7-azide-1-ethyl-3-carboxylate-6,8-difluoroquinolone: a novel reagent for photoaffinity labeling. Tetrahedron Lett. 2008; 49(48): 6759-6761. [ Links ]
70. Sundberg MW, Meares CF, Goodwin DA, Diamanti CI. Chelating agents for the binding of metal ions to macromolecules. Nature. 1974; 250: 587-589. [ Links ]
71. Krejcarek, G. E.; Tucker, K.L. Covalent attachment of chelating groups to macromolecules. Biochem Biophys Res Commun. 1977; 77(2): 581-585. [ Links ]
72. Arano Y, Matsushima H, Tagawa M, Koizumi M, Endo K, Konishi J, Yokoyama A. A novel bifunctional metabolizable linker for the conjugation of antibodies with radionuclides. Bioconjugate Chem. 1991; 2(2), 71-76. [ Links ]
73. Hnatowich DJ, Layne WW, Childs RL, Lanteigne D, Davis MA, Griffin TW, Doherty, PW. Radioactive labeling of antibody: a simple and efficient method. Science. 1983; 220: 613-615. [ Links ]
74. Bakker WH, Albert R, Bruns C, Breeman WAP, Hofland LJ, Marbach P, Pless J, Pralet D, Stolz B, Koper JW, Lamberts SWJ, Visser TJ, Krennig, EP. [111In-DTPA-D-Phe1]-octreotide, a potential radiopharmaceutical for imaging of somatostatin receptor-positive tumors: synthesis, radiolabeling and in vitro validation. Life Sci. 1991; 49(22): 1583-1591. [ Links ]
75. Boniface GR, Izard ME, Walker KZ, McKay DR, Sorby PJ, Turner JH, Morris, JG. Labeling of monoclonal antibodies with samarium-153 for combined radioimmunoscintigraphy and radioimmunotherapy. J Nucl Med. 1989; 30(5): 683-691. [ Links ]
76. Maecke HR, Riesen A, Ritter W. The molecular structure of indium-DTPA. J Nucl Med. 1989; 30(7): 1235-1239. [ Links ]
77. Brechbiel, MW, Gansow, OA. Backbone-substituted DTPA ligands for yttrium-90 radioimmunotherapy. Bioconjugate Chem. 1991; 2(3): 187-194. [ Links ]
78. Kobayashi H, Wu C, Yoo TM. Sun BF, Drumm D. Pastan I, Paik CH, Gansow OA, Carrasquillo JA, Brechbiel MW. Evaluation of the in vivo biodistribution of yttrium-labeled isomers of CHX-DTPA-conjugated monoclonal antibodies. J Nucl Med. 1998; 39(5): 829-836. [ Links ]
79. Brechbiel MW, Gansow OA, Atcher RW, Schlom J, Esteban J, Simpson D, Colcher D. Synthesis of 1-(p-isothiocyanatobenzyl) derivatives of DTPA and EDTA. Antibody labeling and tumor-imaging studies. Inorg Chem. 1986; 25(16): 2772-2781. [ Links ]
80. Keana JFW, Jeffry SM. Chelating ligands functionalized for facile attachment to biomolecules. A convenient route to 4-isothiocyanatobenzyl derivatives of diethylene-triaminepentaacetic acid and ethylenediaminetetraacetic acid. J Org Chem. 1990; 55(9): 2868-2871. [ Links ]
81. Safavy A, Smith DC. Jr., Bazooband A, Buchsbaum DJ. De novo synthesis of a new diethylenetriaminepentaacetic acid (DTPA) bifunctional chelating agent. Bioconjugate Chem. 2002; 13(2): 317-326. [ Links ]
82. Pederson CJ. Cyclic polyethers and their complexes with metal salts. J Am Chem Soc. 1967; 89(10): 2495-2496. [ Links ]
83. Pederson CJ. Cyclic polyethers and their complexes with metal salts. J Am Chem Soc. 1967; 9(26): 7017-7036. [ Links ]
84. McMurry TJ, Brechbiel M, Kumar K, Gansow OA. Convenient synthesis of bifunctional tetraaza macrocycles. Bioconjugate Chem. 1992; 3(2): 108-117. [ Links ]
85. DeNardo SJ, Kukis DL, Miers LA, Winthrop MD, Kroger LA, Salako Q, Shen S, Lamborn KR, Gumerlock PH, Meares CF, DeNardo GL. Yttrium-90-D0TA-peptide-chimeric L6 radioimmunoconjugate: efficacy and toxicity in mice bearing p53 mutant human breast cancer xenografts. J Nucl Med. 1998; 39(5): 842-849. [ Links ]
86. Keire DA, Jang YH, Li L, Dasgupta S, Goddard WA, Shively JE. Chelators for radioimmunotherapy: I. NMR and Ab initio calculation studies on 1, 4, 7, 10- tetra(carboxyethyl)- 1, 4, 7, 10- tetraazacyclododecane (DO4Pr) and 1, 4, 7- tris (carboxymethyl)- 10-(carboxyethyl)- 1, 4, 7, 10- tetraazacyclododecane (DO3A1Pr). Inorg Chem. 2001; 40(17): 4310-4318. [ Links ]
87. Eisenwiener KP, Powell P, Mäcke HR. A convenient synthesis of novel bifunctional prochelators for coupling to bioactive peptides for radiometal labelling. Bioorg Med Chem Lett. 2000; 10(18): 2133-2135. [ Links ]
88. Virgolini I, Szilvasi I, Kurtaran A, Angelberger P, Raderer M, Havlik E, Vorbeck F, Bischof C, Leimer M, Dorner G, Kletter K, Niederle B, Scheithauer W, Smith-Jones P. Indium-111-DOTA-lanreotide: biodistribution, safety and radiation absorbed dose in tumor patients. J Nucl Med. 1998; 39(11): 1928-1936. [ Links ]
89. De Jong M, Bakker WH, Krenning EP, Breeman WAP, Van der Pluijm ME, Bernard BF, Visser TJ, Jermann E, Béhé M, Powell P, Mäcke, HR. Yttrium-90 and indium-111 labelling, receptor binding and biodistribution of [DOTA0, D-Phe1, Tyr3]octreotide, a promising somatostatin analogue for radionuclide therapy. Eur J Nucl Med. 1997; 24(4): 368-371. [ Links ]
90. Reubi JC, Waser B, Laederach U, Erion J, Srinivasan A, Schmidt MA, Bugai, JE. Unsulfated DTPA- and DOTA-CCK analogs as specific high-affinity ligands for CCK-B receptor-expressing human and rat tissues in vitro and in vivo. Eur J Nucl Med. 1998; 25(5): 481-490. [ Links ]
91. Chong HS, Lim S, Baidoo KE, Milenic DE, Ma X, Jia F, Song HA, Brechbiel MW, Lewis MR. Synthesis and biological evaluation of a novel decadentate ligand DEPA. Bioorg Med Chem Lett. 2008; 18(21): 5792-5795. [ Links ]
92. Meares CF, Wensel TG. Metal chelates as probes of biological systems. Acc Chem Res. 1984; 17(6): 202-209. [ Links ]
93. Broan CJ, Cox JPL, Craig AS, Kataky R, Parker D, Harrison A, Randall AM, Ferguson G. Structure and solution stability of indium and gallium complexes of 1, 4, 7-triazacyclononanetriacetate and of yttrium complexes of 1,4,7,10-tetraazacyclododecanetetraacetate and related ligands: kinetically stable complexes for use in imaging and radioimmunotherapy. X-Ray molecular structure of the indium and gallium complexes of 1, 4, 7- triazacyclononane-1, 4, 7- triacetic acid. J Chem Soc Perkin Trans. 2. 1991; 1(1): 87-98. [ Links ]
94. Pandya DN, Dale AV, Kim JY, Lee H, Ha YS, An G II, Yoo J. New macrobicyclic chelator for the development of ultrastable 64Cu-radiolabeled Bioconjugate. Bioconjugate Chem. 2012; 23(3): 330-335. [ Links ]
95. Clarke ET, Martell AE. Stabilities of the Fe(III), Ga(III) and In(III) chelates of N,N',N''-triazacyclononanetriacetic acid. Inorg Chem Acta. 1991; 181(2): 273-280. [ Links ]
96. Jeong JM, Hong MK, Chang YS, Lee YS, Kim YJ, Cheon GJ, Lee DS, Chung JK, Lee MC. Preparation of a promising angiogenesis PET imaging agent: 68 Ga-labeled c (RGDyK)-isothiocyanatobenzyl-1,4,7-triazacyclononane-1, 4.7-triacetic acid and feasibility studies in mice. J Nucl Med. 2008; 49(5): 830-836. [ Links ]
97. Eisenwiener KP, Prata MI, Buschmann I, Zhang HW, Santos AC.; Wenger S, Reubi JC, Macke HR. NODAGATOC, a new chelator-coupled somatostatin analogue labeled with [67/68Ga] and [111In] for SPECT, PET, and targeted therapeutic applications of somatostatin receptor (hsst2) expressing tumors. Bioconjugate Chem. 2002; 13(3): 530-541. [ Links ]
98. Chong HS, Garmestani K, Ma D, Milenic DE, Overstreet T, Brechbiel MW. Synthesis and biological evaluation of novel macrocyclic ligands with pendent donor groups as potential yttrium chelators for radioimmunotherapy with improved complex formation kinetics. J Med Chem. 2002; 45(16): 3458-3464. [ Links ]
99. Gasser G, Tjioe L, Graham B, Belousoff MJ, Juran S, Walther M, Künstler JU, Bergmann R, Stephan H, Spiccia L. Synthesis, copper(II) complexation, 64Cu-labeling, and bioconjugation of a new bis(2-pyridylmethyl) derivative of 1,4,7-triazacyclononane. Bioconjugate Chem. 2008; 19(3): 719-730. [ Links ]
100. Abrams MJ, Juweid M, TenKate CI, Schwartz DA, Hauser MM, Gaul FE, Fuccello AJ, Rubin RH, Strauss HW, Fischman AJ. Technetium-99m-human polyclonal IgG radiolabeled via the hydrazino nicotinamide derivative for imaging focal sites of infection in rats. J Nucl Med 1990; 31(12): 2022-2028. [ Links ]
101. Schwartz DA, Abrams MJ, Hauser MM, Gaul FE, Larsen SK, Rauh D, Zubieta JA. Preparation of hydrazino-modified proteins and their use for the synthesis of technetium-99m-protein conjugates. Bioconjugate Chem. 1991; 2(5): 333-336. [ Links ]
102. Ultee ME, Bridger GJ, Abrams MJ, Longley CB, Burton CA, Larsen S. K, Henson GW, Padmanabhan S, Gaul FE, Schwartz DA. Tumor imaging with technetium-99m-labeled hydrazinonicotinamide-Fab' conjugates. J Nucl Med. 1997; 38(1): 133-138. [ Links ]
103. Babich JW, Solomon H, Pike MC, Kroon D, Graham W, Abrams MJ, Tompkins RG, Rubin RH, Fischman AJ. Technetium-99m-labeled hydrazino nicotinamide derivatized chemotactic peptide analogs for imaging focal sites of bacterial infection. J Nucl Med. 1993; 34(11): 1964-1974. [ Links ]
104. Decristoforo C, Melendez-Alafort L, Sosabowski JK, Mather SJ. 99mTc-HYNIC-[Tyr3]-octreotide for imaging somatostatin-receptor-positive tumors: preclinical evaluation and comparison with 111In-octreotide. J Nucl Med. 2000; 41(6): 1114-1119. [ Links ]
105. Guo W, Hinkle, GH. Lee, RJ. 99mTc-HYNIC-folate: a novel receptor-based targeted radiopharmaceutical for tumor imaging. J Nucl Med. 1999; 40(9): 1563-1569. [ Links ]
106. Ono M Arano Y, Mukai T, Uehara T, Fujioka Y, Ogawa K, Namba S, Nakayama M, Saga T, Konishi J, Horiuchi K, Yokoyama A, Saji H. Plasma protein binding of 99mTc-labeled hydrazino nicotinamide derivatized polypeptides and peptides. Nucl Med Biol. 2001; 28(2): 155-164. [ Links ]
107. Ono M, Arano Y, Mukai T, Fujioka Y, Ogawa K, Uehara T, Saga T, Konishi J, Saji H. 99mTc-HYNIC-derivatized ternary ligand complexes for 99mTc-labeled polypeptides with low in vivo protein binding. Nucl Med Biol. 2001; 28(3): 215-224. [ Links ]
108. Kim YS, He Z, Hsieh WY; Liu S. A novel ternary ligand system useful for preparation of cationic 99mTc-diazenido complexes and 99mTc-labeling of small biomolecules. Bioconjugate Chem. 2006; 17(2): 473-484. [ Links ]
109. Edwards DS, Liu S, Barrett JA, Harris AR, Looby RJ, Ziegler MC, Heminway SJ, Carroll TR. New and versatile ternary ligand system for technetium radiopharmaceuticals: water soluble phosphines and tricine as coligands in labeling a hydrazinonicotinamide-modified cyclic glycoprotein IIb/IIIa receptor antagonist with 99mTc. Bioconjugate Chem. 1997; 8(2): 146-154. [ Links ]
110. Liu S, Edwards DS, Harris AR. A novel ternary ligand system for 99mTc- labeling of hydrazino nicotinamide-modified biologically active molecules using imine-N-containing heterocycles as coligands. Bioconjugate Chem. 1998; 9(5): 583-595. [ Links ]
111. Barrett JA, Crocker AC, Damphousse DJ; Heminway SJ; Liu S; Edwards DS, Lazewatsky JL, Kagan M, Mazaika TJ, Carroll TL. Biological evaluation of thrombus imaging agents utilizing water soluble phosphines and tricine as coligands when used to label a hydrazinonicotinamide-modified cyclic glycoprotein IIb/IIIa receptor antagonist with 99mTc. Bioconjugate Chem. 1997; 8(2): 155-160. [ Links ]
112. Liu S, Harris AR, Williams NE, Edwards DS. 99mTc-labeling of a hydrazinonicotinamide-conjugated LTB4 receptor antagonist useful for imaging infection and inflammation. Bioconjugate Chem. 2002; 13(4): 881-886. [ Links ]
113. Brouwers AH, Laverman P, Boerman, OC, Oyen WJG, Barrett JA, Harris TD, Edwards DS, Corstens FHM. A 99mTc-labelled leukotriene B4 receptor antagonist for scintigraphic detection of infection in rabbits. Nucl Med Commun. 2000; 21(11): 1043-1050. [ Links ]
114. Liu S, Edwards DS, Ziegler MC, Harris AR, Hemingway SJ, Barrett JA. 99mTc-labeling of a hydrazinonicotinamide-conjugated vitronectin receptor antagonist useful for imaging tumors. Bioconjugate Chem. 2001; 12(4): 624-629. [ Links ]
115. Rao, T. N.; Adhikesavalu, D.; Camerman, A.; Fritzberg, A. R. Technetium (V) and rhenium (V) complexes of 2,3-bis(mercaptoacetamido) propanoate. Chelate ring stereochemistry and influence on chemical and biological properties. J Am Chem Soc. 1990; 112(15): 5798-5804. [ Links ]
116. Liu S, Edwards DS, Looby RJ, Poirier MJ, Rajopadhye M, Bourque JP, Carroll TR. Labeling cyclic glycoprotein IIb/IIIa receptor antagonists with 99mTc by the preformed chelate approach: effects of chelators on properties of [99mTc] chelator-peptide conjugates. Bioconjugate Chem. 1996; 7(2): 196-202. [ Links ]
117. Meegalla SK, Plössl K, Kung MP, Chumpradit S, Stevenson DA, Kushner SA, McElgin WT, Mozley PD, Kung HF. Synthesis and characterization of technetium-99m-labeled tropanes as dopamine transporter-imaging agents. J Med Chem. 1997; 40(1): 9-17. [ Links ]
118. Najafi A, Alauddin MM, Siegel ME, Epstein AL. Synthesis and preliminary evaluation of a new chelate N2S4 for use in labeling proteins with metallic radionuclides. Nucl Med Biol. 1991; 18(2): 179-185. [ Links ]
119. Vanbilloen HP, Bormans GM, De Roo MJ, Verbruggen AM. Complexes of technetium-99m with tetrapeptides, a new class of 99mTc-labelled agents. Nucl Med Biol. 1995; 22(3): 325-332. [ Links ]
120. Fritzberg AR, Abrams PG, Beaumier PL, Kasina S, Morgan AC, Rao TN, Reno JM, Sanderson JA, Srinivasan A, Wilbur DS. Specific and stable labeling of antibodies with technetium-99m with a diamide dithiolate chelating agent. Proc Natl Acad Sci U.S.A. 1988; 85(11): 4025-4029. [ Links ]
121. Kasina S, Rao TN, Srinivasan A, Sanderson JA, Fitzner JN, Reno JM, Beaumier PL, Fritzberg AR. Development and biologic evaluation of a kit for preformed chelate technetium-99m radiolabeling of an antibody Fab fragment using a diamide dimercaptide chelating agent. J Nucl Med. 1991; 32(7): 1445-1451. [ Links ]
122. Majocha RE, Reno JM, Friedland RP, VanHaight C, Lyle LR, Marotta CA. Development of a monoclonal antibody specific for β/A4 amyloid in Alzheimer's disease brain for application to in vivo imaging of amyloid angiopathy. J Nucl Med. 1992; 33(12): 2184-2189. [ Links ]
123. Kasina S, Sanderson JA, Fitzner JN, Srinivasan A, Rao TN, Hobson LJ, Reno JM, Axworthy DB, Beaumier PL, Fritzberg AR. Simplified preformed chelate protein radiolabeling with technetium-99m mercaptoacetamido-adipoylglycylglycine (N3S-adipate). Bioconjugate Chem. 1998; 9(1): 108-117. [ Links ]
124. Van Gog FB, Visser GWM, Gowrising RWA, Snow GB, Van Dogen GAMS. Synthesis and evaluation of 99mTc/99Tc-MAG3-biotin conjugates for antibody pretargeting strategies. Nucl Med Biol. 1998; 25(7): 611-619. [ Links ]
125. Rajopadhye M, Harris TD, Yu K, Glowacka D, Damphousse PR, Barrett JA, Hemingway SJ, Edwards DS, Carroll TR. Synthesis, evaluation and Tc-99m complexation of a hydrazinonicotinyl conjugate of a GP IIb/IIIa antagonist cyclic peptide for the detection of deep vein thrombosis. Bioorg Med Chem Lett. 1997; 7(8): 955-960. [ Links ]
126. Hnatowich DJ, Qu T, Chang F, Ley AC, Ladner RC, Rusckowski M. Labeling peptides with technetium-99m using a bifunctional chelator of a N-hydroxysuccinimide ester of mercaptoacetyltriglycine. J Nucl Med. 1998; 39(1): 56-64. [ Links ]
127. Baidoo K, Lever S, Scheffel U. Bifunctional chelator for facile preparation of neutral techetium complexes. Bioconjugate Chem. 1994; 5(2): 114-118. [ Links ]
128. Hom RK, Katzenellenbongen JA. Technetium99m-labeled receptor-specific small-molecule radiopharmaceuticals: recent developments and encouraging results. Nucl Med Biol. 1997; 24(6): 485-498. [ Links ]
129. Mathias CJ, Sun Y, Welch MJ, Green MA, Thomas JA, Wade KR, Martell AE. Targeting radiopharmaceuticals: comparative biodistribution studies of gallium and indium complexes of multidentate ligands. Int J Rad Appl Instrum Part B. 1988; 15(1): 69-81. [ Links ]
130. Bubeck B, Brandau W, Reinbold F, Dreikorn K, Steinbächer M, Eisenhunt M, Georgi P. Technetium-99m labeled renal function and imaging agents: I. Clinical evaluation of 99mTc CO2-DADS-A (99mTc N, N'- bis- (mercaptoacetyl)- 2, 3-diaminopropanoate). Int. J. Rad. Appl. Instrum. Part B. 1988; 15(1): 99-108. [ Links ]
131. Walovitch, RC Cheesman EH, Maheu LJ, Hall KM. Studies of the retention mechanism of the brain perfusion imaging agent 99mTc-bicisate (99mTc-ECD). J Cereb Blood Flow Metab. 1994; 14 (Suppl 1):S4-S11. [ Links ]
132. Seifert S, Heinrich T, Jentschel C, Smuda C, Bergmann R, Pietzsch HJ. Preparation and biological characterization of isomeric 188 Re (V) oxocomplexes with tetradentate S4 ligands derived from meso-dimercaptosuccinic acid for labeling of biomolecules. Bioconjugate Chem. 2006; 17(6): 1601-1606. [ Links ]














