Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.43 no.2 Ciudad de México abr./jun. 2012
Trabajo científico
Elementos que influyen la medición del efecto de electrolitos sobre la extensión de una gota de champú
Elements influencing the assessment of the electrolytes effect on the extension of a drop of shampoo
Carmen Cristina Díaz Ramírez, Leopoldo Villafuerte Robles
Laboratorio de Tecnología Farmacéutica II, Departamento de Farmacia, Escuela Nacional de Ciencias Biológicas, IPN.
Correspondencia:
Dr. Leopoldo Villafuerte Robles
Laboratorio de Tecnología Farmacéutica II
Departamento de Farmacia, ENCB, IPN
e-mail: lvillaro@encb.ipn.mx; lvillarolvillaro@hotmail.com
Fecha de recepción: 30 de agosto de 2011.
Fecha de recepción de modificaciones: 3 de enero de 2012.
Fecha de aceptación: 17 de enero de 2012.
Resumen
El método de extensión de la gota se aplicó para evaluar el efecto de la concentración de electrolitos (cloruro de sodio y cloruro de amonio) sobre la viscosidad de un champú acondicionador. El método mostró ser satisfactorio utilizando placas cuadradas de vidrio de 15 cm y 3 mm de grosor. La precisión del método aumenta conforme aumenta el tiempo de exposición y el peso de la muestra. La variabilidad del método permite alcanzar I.C.95%<1%. La extensión de la gota cambia en función del peso de la muestra en una relación cúbica que pasa por el origen aunque en el intervalo de experimentación estudiado una regresión lineal es satisfactoria. El aumento en las concentraciones de electrolito estudiadas aumenta la viscosidad hasta un límite, haciendo posible el manejo de la viscosidad del champú.
Palabras clave: champú, electrolitos, viscosidad, extensión de la gota.
Abstract
The method of extension of a drop was applied to evaluate the effect of electrolyte concentration (sodium chloride and ammonium chloride) on the viscosity of a conditioning shampoo. The method showed to be satisfactory employing squared glass plaques of 15 cm and 3 mm thickness. The precision of the method showed to be higher as the exposition time and the weight of the sample increased. The variability of the method allowed to attain C.I.95%<1%. The extension of the drop changes as a function of the sample weight in a cubic relationship passing through the origin although in the studied experimental interval a linear regression is sufficient. An increase in the studied electrolyte concentrations increases the viscosity up to a limit, making possible the manipulation of the shampoo's viscosity.
Key words: shampoo, electrolytes, viscosity, drop extension.
Introducción
Actualmente, el champú es un producto que representa el 50% de las unidades vendidas de productos para el cuidado del cabello y forma parte de los hábitos individuales y sociales de las personas.
Particularmente, un champú acondicionador es aquel que se diseña específicamente para hacer el pelo más suave y brillante, le adiciona humedad y evita o previene los daños causados por tratamientos químicos. En general, mejora la manejabilidad del pelo.1
El propósito del champú es el de una necesidad higiénica, sin embargo, también se le demandan características cosméticas como la restauración de la apariencia del cabello. El pelo debe estar limpio, brillante, suave, aéreo, libre pero sin porciones que vuelen fuera, fácil de peinar, con cuerpo y con volumen. Las demandas de los consumidores son varias, independientemente del tipo de pelo y de su condición. El formulador debe tomar en cuenta para su diseño todas las posibles variables asociadas al pelo como si es seco, grasoso, relajado, blanqueado, pintado, corto o largo, crispado, caucásico, negroide, oriental, etcétera, además de problemas específicos relativos a la fisiología y condición superficial del cuero cabelludo tales como la caspa y la seborrea. Además de la edad, estilo de vida y hábitos de cuidado del pelo (frecuencia de uso y aplicación de acondicionadores), se toman en cuenta las nuevas tendencias del estilo del pelo y la aplicación de diferentes productos así como los deseos de los consumidores.2
Además del estado del pelo, existen preferencias individuales que también entran en juego. Preferencias para una cierta textura, aroma, espuma y características de uso, de la misma manera que la facilidad para enjuagarlo, de peinarlo húmedo y la rapidez de secado, entre otros. Todas estas variables, algunas veces contradictorias y difíciles de conciliar, hacen que la formulación sea difícil y con la necesidad de una investigación continua. Para satisfacer las demandas de los consumidores hace falta una gran variedad de productos, los cuales el consumidor cambia en sus preferencias con el tiempo, en la búsqueda de nuevas experiencias y de un desempeño original.
El pelo humano se ensucia debido al contacto con el medio ambiente y el sebo secretado por la cabeza. Esta circunstancia genera una sensación de suciedad así como una apariencia no atractiva. El lavado del pelo con champú lo limpia, removiendo el exceso de sebo y el polvo.3
El propósito del champú es la limpieza del pelo, sin embargo, el champú no debe limpiar demasiado bien o limpiar todos los aceites protectores del pelo y no oler mal tal como lo hacen los tensoactivos que contiene. Las exigencias a un champú incluyen una buena apariencia y una sensación viscosa o cremosa en las manos. Debe producir una sensación agradable después de su uso. Debe oler bien y además no debe ser muy caro.4
Desde el punto de vista del desarrollo de un champú, el formulador debe considerar algunos aspectos generales antes de trabajar el diseño del producto propiamente dicho.5
• El costo.
• La calidad y cantidad de las burbujas.
• Irritación de los ojos y de la piel.
• Viscosidad y características de flujo.
En este último caso, se utilizan una gran variedad de sustancias que aumentan la viscosidad de las formulaciones de champuses. Estas incluyen las alcanolamidas, las betaínas, los óxidos de aminas, polímeros, esteres de polietilenglicol, la sal, etc. Los champuses deben tener facilidad para fluir fuera del material de empaque y una consistencia que no sea tenaz o inflexible. Otro requisito es que estas sustancias den curvas de temperatura y pH contra viscosidad relativamente planas. Esto es, que cambios razonables de temperatura y pH no cambien drásticamente la viscosidad.
La mayoría de los preparados como un champú para el pelo están hechos de un gran número de ingredientes que desempeñan diferentes funciones. Por ejemplo las de limpieza, aumento de la formación de espuma, acondicionamiento del pelo, etc. Sin embargo, otros ingredientes se agregan para dar o mejorar propiedades preexistentes en el producto. Entre ellas se encuentran la claridad, el aroma y la viscosidad.
Quien formula un champú debe atender problemas que tienen que ver con incompatibilidades que se dan entre ingredientes antagonistas, los cuales dificultan el lograr, de forma simultánea, el mejor desempeño en todas las propiedades del producto. Este antagonismo se puede manifestar como una precipitación o separación, lo que obligaría al formulador a adicionar otro ingrediente más para restaurar la compatibilidad. Un ejemplo de antagonismo sería el efecto negativo de un tensoactivo aniónico sobre la actividad germicida de un tensoactivo cuaternario de amonio.
Por otro lado, también hay interacciones cooperativas entre ingredientes. Un ejemplo sería cuando la actividad de un ingrediente se ve aumentada por la adición de otro que no posee por si mismo esa actividad. Un caso de este tipo es el aumento de actividad superficial de un tensoactivo por la adición de un electrolito.
La viscosidad del champú
Los productos para el hogar entre los cuales se encuentran los champuses son agentes de limpieza en forma de soluciones líquidas, espumas o geles. La viscosidad de ellos es de importancia tanto para los consumidores así como para los formuladores. El consumidor espera una impresión subjetiva de calidad y suntuosidad así como un desempeño de dosificación y de aplicación simple, así como un excelente desempeño de limpieza. El formulador se beneficia de la estabilidad de la fase, de la manipulación técnica y de los bajos costos. En ambos casos una viscosidad adecuada contribuye a estos fines. Los rasgos técnicos que se buscan con ello son un tiempo de contacto prolongado sobre superficies verticales, estabilización de los ingredientes sólidos, un recubrimiento óptimo de la superficie, facilidad para enjuagarlo y para diluirlo.
Existe una gran variedad de aditivos que se pueden utilizar para ajustar o modificar la reología de los champuses. En la formulación de champuses se utilizan todas las posibilidades para reducir los costos, por esta razón, sería conveniente evitar el uso de agentes espesantes caros para lograr el perfil de viscosidad deseado. Para este fin se podrían utilizar efectos sinérgicos entre los componentes del champú.
Los agentes espesantes son excipientes para los cosméticos y los productos farmacéuticos. Se utilizan para alcanzar una cierta viscosidad en los sistemas que contienen tensoactivos. Se usan en grandes cantidades también en otras industrias. El mercado de espesantes, sólo en Alemania en el 2007, alcanzó un volumen de mercado de 12.3 miles de millones de euros. Especialmente en el área de cosméticos para el pelo y champuses. Entre los más usados se encuentran los poliacrilatos y los derivados de polietilenglicol. Las desventajas de materiales como los anteriores incluyen una pobre biodegradabilidad así como características toxicológicas críticas. Otros productos como la hidroxietilcelulosa tienen la desventaja de una lenta pérdida de la viscosidad causada por ciertas enzimas. Los agentes espesantes no sólo influyen la viscosidad sino que también influyen el comportamiento de flujo, en función de fuerzas de corte externas.6
La viscosidad de un champú también es una propiedad que puede aumentarse con la adición de un electrolito como el cloruro de sodio, para dar la consistencia cremosa que siempre se desea en él. Sin embargo, es un requisito que este champú con mayor viscosidad permanezca claro y brillante. Esto no siempre sucede con la adición de cloruro de sodio, generándose en ocasiones una ligera turbidez. Esto se considera como una desventaja no deseable en un líquido que deba ser claro. Aunque esto no sería una objeción cuando se formula un champú opaco, nacarado o aperlado.7
Aunque el cloruro de sodio sea un irritante para los ojos, particularmente en concentraciones elevadas, no se considera un problema relevante. El cloruro de sodio se utiliza no sólo para aumentar la viscosidad sino que también se usa para ayudar a eliminar los restos de champú con los enjuagues. Sin embargo, hay una tendencia para eliminarlo de los champuses.8
Por otro lado, es de notar que la sal puede hacer que el champú pierda suavidad, además de irritar los ojos, por lo que podrían también utilizarse otros agentes viscosantes de mayor precio, con tal de mantener los niveles de sal bajos.4
Efecto de los electrolitos sobre la viscosidad
A pesar de las investigaciones sobre el efecto de los electrolitos sobre la viscosidad, el efecto de iones específicos, sus propiedades y sus interacciones con otras moléculas, aún no se conocen los detalles y es difícil predecir su comportamiento. Una dificultad para ello es que las acciones involucran no sólo al efecto de los cationes sino que también al de los aniones de los electrolitos. El autoensamble de moléculas de tensoactivos se considera dependiente del número de moléculas de agua alrededor de las cabezas polares. La adición de electrolitos a una solución de tensoactivos deshidrata las cabezas polares. Esto conlleva a una disminución en el área efectiva por molécula en la interface y consecuentemente a un aumento en el parámetro de empacamiento estructural.
El efecto de las sales sobre un sistema con cargas puede diferir en función de su carácter cosmotrópico o caotrópico. Se sabe que iones pequeños con una elevada densidad de carga (p.e. sulfato, carboxilato, sodio) están fuertemente hidratados (cosmotrópicos) mientras que iones monovalentes grandes con baja densidad de carga (p. e. ioduro y potasio) están poco hidratados (caotrópicos). Por esta razón cada sal tiene una influencia individual, dependiendo de que tienda a adsorberse en la interface entre la micela y el agua o si permanece fuertemente hidratada en el medio circundante.9
El efecto sinérgico de los electrolitos sobre la viscosidad se ha probado agregando diferentes cantidades de cloruro de sodio o de sulfato de sodio a una solución de una mezcla de 2 tensoactivos, el Sandopan TFL y el laurilsulfato de sodio. Estos tensoactivos por si mismos ya presentan un efecto de sinergismo para aumentar la viscosidad cuando se mezclan. Una mezcla de 50 % de cada uno de los tensoactivos muestra una viscosidad varias veces mayor que la de los tensoactivos individuales. El efecto del cloruro de sodio sobre la viscosidad de la mezcla de tensoactivos se observa en la Figura 1. El aumento en la concentración de cloruro de sodio aumenta la viscosidad hasta alcanzar un máximo a una concentración del 1%. Un aumento mayor en la concentración de la sal mostraría una disminución de la viscosidad antes lograda.
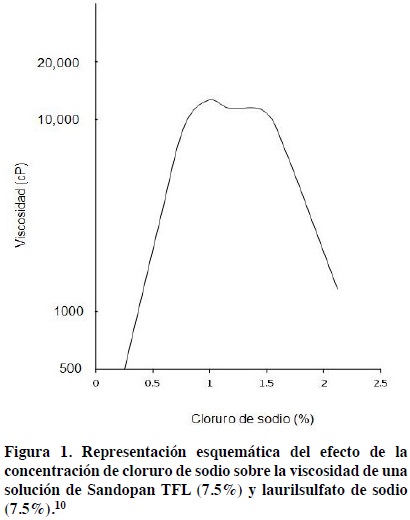
Lo mismo se ha observado para el sulfato de sodio. Sin embargo, en ese caso la concentración de sulfato de sodio que produce la máxima viscosidad fue de 2.8%.10
Un efecto de sinergismo, similar al antes mencionado, es el de mezclas formadas por tensoactivos zwitteriónicos o anfotéricos con tensoactivos aniónicos. Las mezclas muestran un aumento en la viscosidad el cual podría atribuirse a la incrustación del tensoactivo aniónico entre los monómeros que forman la micela del tensoactivo anfotérico. En esta circunstancia las repulsiones entre las cabezas de los tensoactivos disminuye permitiendo el ejercicio de interacciones de atracción. Otros factores que también contribuyen incluyen interacciones hidrofóbicas y de van de Waals.11
En el intervalo en el cual se perciben cambios de viscosidad en las soluciones de tensoactivos se ha observado que las estructuras de las micelas, que son dinámicas, se rompen y recombinan en función de ciertos parámetros. Una concentración muy elevada de electrolitos disminuye la vida media de las mi celas y con ello, la viscosidad del sistema.12
Se sabe que la adición de contraiones específicos a una solución micelar puede cambiar el tamaño de las micelas significativamente. El tamaño micelar aumenta lentamente con la adición de sal hasta llegar a una concentración crítica a partir de la cual el tamaño micelar aumenta de manera muy importante. Algunos iones liotrópicos como el salicilato y el tiocianato se sabe que promueven muy eficientemente el crecimiento del tamaño de las micelas catiónicas, además de disminuir la concentración micelar crítica. Contraiones como el salicilato aumentan fuertemente la viscosidad de las soluciones de tensoactivos catiónicos, mostrando un comportamiento viscoelástico. Este efecto indicaría la presencia de estructuras micelares grandes.13
Las micelas de tensoactivos iónicos pueden transformarse de esferas a bastones, a filamentos y a otras entidades de autoensamble, incluyendo vesículas y fases cristalinas líquidas, conforme aumenta su concentración, la temperatura o la concentración de aditivos. Particularmente, la adición de sales da un impulso a las transiciones microestructurales y al crecimiento micelar, aún a bajas concentraciones. La adición de co-iones a tensoactivos cargados puede afectar la repulsión electrostática, la hidratación y el tamaño de las cabezas polares, a través de varios mecanismos.
Tradicionalmente, la eficiencia de los iones inorgánicos para influir la micelización se ha atribuido a su influencia sobre la estructura del agua, a través de su localización en la serie liotrópica de Hofmeister OH < F < Cl < Br < NO3 < ClO4 -. Los iones del lado izquierdo son cosmótropos (iones pequeños con elevada densidad de carga se consideran como estructuras que "forman" agua, lo cual conlleva a una capa de hidratación gruesa), mientras que los del lado derecho de la serie liótropa, se denominan como caótropos (iones grandes con una densidad de carga pequeña y muy polarizables, se consideran como estructuras que "rompen" el agua, mostrando capas de hidratación delgadas). En general, se considera que el número liotrópico, el tamaño y la forma del anión, su polarizabilidad y la energía de hidratación participan todos ellos en la interacción con las micelas y que se necesita aún una mayor investigación experimental y teórica para poder predecir y controlar las propiedades de las soluciones micelares.14
Para examinar los efectos de la sal sobre los tensoactivos, se considera que las moléculas de tensoactivo se encuentran en solución como monómeros libres, como dímeros o en una forma enlazada, en una micela. Conforme la concentración del tensoactivo disminuye por debajo de su concentración micelar crítica su forma predominante es la de monómeros libres. Conforme la concentración del tensoactivo alcanza la concentración micelar crítica y la sobrepasa, la fracción de moléculas enlazadas en las micelas aumenta. La asociación de moléculas de tensoactivo, en su mínima expresión como dímeros, sería la asociación termodinámicamente más estable. En ella, la posición antiparalela (porciones hidrocarbonadas paralelas pero con las cabezas polares de lados contrarios) de las moléculas genera una reducción de la superficie expuesta de las porciones hidrocarbonadas con el agua, disminuyendo la energía libre del sistema, mientras que la repulsión electrostática de las cabezas polares, en ambos extremos del complejo, apoyaría este equilibrio. La agregación de las moléculas sería dependiente de la concentración de electrolito en el medio. De esta manera, al aumentar la concentración de cloruro de sodio en el medio, la asociación de las moléculas del tensoactivo y la formación de micelas ocurre a menores concentraciones de laurilsulfato de sodio. Concentraciones molares crecientes de cloruro de sodio de 0, 0.01 y 0.1, reducen la concentración micelar crítica molar de 8.05*10-3 a 4.75*10-3 y hasta 1.5*10-3.15
Una consecuencia importante de los temas antes mencionados es la posibilidad de manejar la viscosidad de las soluciones de las micelas, p. e. las de forma de gusano, a través de la inducción de asociaciones intermicelares y/o la promoción de cambios conformacionales por la adición de electrolitos.16 La formación de micelas tipo gusano se ha observado en algunos sistemas de tensoactivos iónicos después de la adición de sales. Este tipo de micelas también se ha observado en champuses con sistemas formados por tensoactivos aniónicos y co-tensoactivos no-iónicos.17
En estas circunstancias, el primer objetivo de este trabajo es el establecimiento de los factores que influyen en un método simple que permita inferir la viscosidad de un champú a través de la extensión de una gota. El segundo objetivo es determinar el efecto que tiene un electrolito (NaCl y NH4Cl) sobre la viscosidad de un champú acondicionador.
Material y método
Material
La composición y proporción de los componentes del champú acondicionador se describe en la Tabla 1.

Métodos
Procedimiento de fabricación del champú con acondicionador
En un vaso de precipitados se adiciona el agua correspondiente a la fase A, se agrega el Texapon con agitación moderada. Se adiciona el Comperlan, el Dehyton y, finalmente el Polyquart. En otro vaso de precipitados se agrega el agua correspondiente a la fase B, el Cetiol y el Nutrilan Keratina. Incorporar enseguida el Germaben II. Agregar la fase B a la fase A con agitación. Ajustar el pH a un valor de 6.5 con ácido cítrico. Finalmente ajustar la viscosidad agregando la cantidad escogida de cloruro de sodio.
Prueba de viscosidad
El método más común para medir viscosidad es el viscosímetro de rotación como el Haake VT 550 o el Brookfield RV-1.18,19 Este método se ha utilizado tanto para medicamentos así como para cosméticos.20,21,22 Sin embargo, entre los métodos más simples para medir la viscosidad se encuentran el viscosímetro de Ostwald,23 el de la caída de una esfera y el método de la extensión de la gota.
El método de la extensión de la gota es un método para medir la consistencia o fluidización de un semisólido a través de la determinación de su capacidad de dispersión o extensión. La determinación se lleva a cabo colocando una gota del fluido en el centro una superficie plana, de vidrio u otro material translúcido, cubriéndola con una placa similar con un peso determinado. El material de la placa así como el peso de la muestra puede variar, sin embargo, una vez seleccionados se define operativamente el método estableciendo el tipo de material, sus características y el peso de la muestra. Además de establecer si es que se usa una presión o un peso extra al de la placa misma. En este caso se probaron diferentes materiales, diferentes tamaños de las placas así como tamaños de la muestra del champú, sin aplicar mayor presión que el peso de la misma placa. Después de diferentes intervalos de tiempo se mide con una regla el diámetro mayor y el diámetro menor de la gota del champú entre las placas y se registra su promedio. Una vez establecida la cinética de la extensión de la gota, la lectura del diámetro de extensión se toma a un tiempo específico. Las pruebas se realizaron a temperatura ambiente. Las placas no recibieron ningún tratamiento especial, lavándose con agua y detergente.
La Figura 2 muestra, según Vennat y colaboradores, como los valores del diámetro de extensión de la gota son proporcionales a la viscosidad determinada con un viscosímetro de rotación (Brookfield).24

Resultados y discusión
Método de evaluación de la viscosidad
La viscosidad se define como la fricción interna de un fluido. La naturaleza microscópica de la fricción interna en un fluido es análoga al concepto macroscópico de fricción mecánica en un sistema donde un objeto se mueve sobre una superficie plana estacionaria. En este sistema se debe suministrar energía para superar el estado de inercia por la interconexión entre el objeto y la superficie plana, causado por las rugosidades de la superficie. En un fluido se debe suministrar energía para poder generar un flujo viscoso, a través de la ruptura de los enlaces entre las moléculas, y para provocar que unidades de flujo se muevan unas con respecto a otras. La resistencia de un fluido para la creación y movimiento de unidades de flujo, debida a la viscosidad del fluido, sólo se manifiesta cuando el fluido se encuentra en movimiento.25
En este caso la energía necesaria, para generar el flujo viscoso, es proporcionada por la fuerza de la gravedad ejercida sobre la placa de acrílico o vidrio que cubre la gota. La resistencia del champú para fluir, debida a la viscosidad del mismo, se manifiesta como el límite hasta el cual el peso de la placa de acrílico o vidrio puede extender la gota depositada. Para un tiempo de medición específico, una mayor extensión de la gota depositada corresponde con una menor resistencia del fluido para fluir, que es equivalente a una menor viscosidad y viceversa.
La cinética del crecimiento del diámetro de extensión de la gota de champú se describe gráficamente en la Figura 3. Como se puede observar, hay un crecimiento de la extensión de la gota en función del tiempo, el cual tiende a estabilizarse después de unos minutos. Esta relación se describe con un modelo potencial. El valor de la extensión de la gota se toma como representativo de la viscosidad del champú.
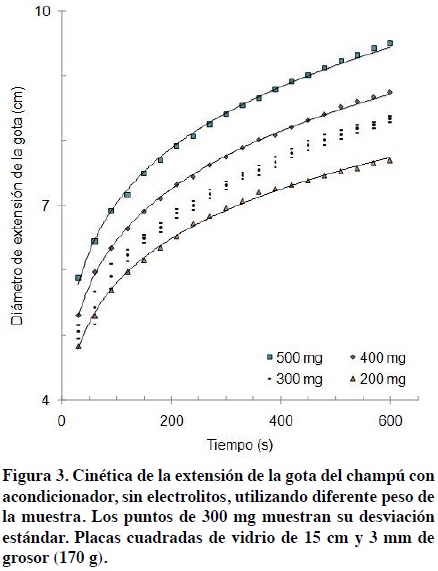
En la Figura 3 se muestran algunas curvas obtenidas para el champú acondicionador sin cloruro de sodio, con diferentes cantidades de peso en cada gota. El tiempo necesario para la estabilización parece ser relativo a la cantidad depositada del champú, aumentando dicho tiempo conforme se incrementa el tamaño o peso de la gota. Aunque el diámetro inicial de las gotas, bajo el peso de la placa, es diferente de cero y diferente para cada peso de la gota, este no se pudo medir físicamente, prefiriéndose dejar estabilizar el sistema y medir después de 30 s.
En la Figura 4 se observa la superficie de respuesta calculada para el efecto del tiempo y el peso o masa de champú sobre el diámetro de extensión alcanzado. Como se puede observar, el diámetro de extensión de la gota del champú aumenta conforme se aumenta el peso de la gota y el tiempo de exposición de la gota al peso de la placa.

La variabilidad de los resultados se describe con cualquier medida de dispersión, entre ellas, con la estimación de la desviación estándar. La desviación estándar es mayor al principio de las lecturas, disminuyendo progresivamente al paso del tiempo. Una descripción de la desviación estándar relativa al paso del estudio cinético se observa en la Figura 5, con mediciones con 6 repeticiones y usando placas cuadradas de vidrio de 3 mm de grueso y 15 cm de lado. La desviación estándar relativa promedio del proceso es calculada por regresión en 1.71%, iniciando con un valor calculado por regresión de 2.07% a los 30 segundos y alcanzando un valor de 1.35% a los 10 minutos. Seis mediciones permitirían promedios con un intervalo de confianza al 95% de 100±0.26%. Considerando un intervalo de confianza al 99%, las mediciones fluctuarían en un intervalo de 100±0.35%.

Cuando se desarrolla un método analítico es importante saber el intervalo de medición en que se trabaja y su relación con los resultados. Esto significa que debemos conocer cuál es el comportamiento de nuestro método cuando se desean estimar diferentes valores del diámetro de extensión de la gota para saber si hay una relación lineal entre el resultado y la cantidad del champú depositada, o si no la hay, o si la hay en un intervalo y en otro no, o si la relación es lineal pero no pasa por el origen.26
La linealidad de un método de análisis se define como la capacidad o habilidad que éste tiene para determinar que los resultados de las pruebas son directamente proporcionales a los cambios en las muestras, en un intervalo específico. La linealidad puede ser el resultado de una relación directa entre las variables o el resultado de las variables expresadas por medio de transformaciones matemáticas bien definidas.27
En la Figura 6 se pueden observar los primeros experimentos, realizados con placas de acrílico cuadradas de 3 mm de grueso y de 7.5 cm de lado. El modelo matemático que mejor se ajusta y que pasa por el origen es el de una relación entre la raíz cúbica de la masa o peso de champú depositado y el diámetro de extensión de la gota. Los resultados corresponden con una sola medición del diámetro de las gotas de champú a un tiempo de 5 minutos (300 s).

La representación gráfica de las líneas de regresión, calculadas de acuerdo al modelo propuesto para los datos obtenidos con placas de acrílico de 7.5 cm, se muestra en la Figura 7.

La línea de regresión calculada para el champú sin cloruro de sodio se realizó sólo con 7 puntos, los tres primeros puntos fueron considerados valores extremos y no fueron utilizados para calcular la regresión.
En las Figuras 6 y 7 se muestra una relación entre el diámetro de extensión de la gota del champú y la raíz cúbica del peso de la muestra del mismo, la cual pasa por el origen. Sin embargo, al igual que en cualquier otra relación descrita por una curva, cuando el espacio experimental es de tamaño suficientemente menor la relación se puede describir adecuadamente con una línea recta.
No obstante, la regresión con la línea recta sólo es válida en el área experimental calculada y sólo sirve a para la interpolación, no es extrapolable hasta el origen. Cuando se utilizaron placas de vidrio de mayor tamaño (15 cm de lado), con promedios de 6 mediciones y con mayores pesos de la gota, los datos del espacio experimental estudiado se pueden describir suficientemente con una relación lineal. La Figura 8 muestra esta relación lineal. En ella se describen los datos obtenidos a los 10 minutos de exposición.

Para comparar el diámetro de extensión de la gota, cuando se pesan diferentes cantidades de champú, se normalizan los resultados a un peso de la gota, p.e. de 100 mg. Para ello se calcula primero la desviación observada por un valor experimental con respecto a la línea de regresión. La desviación se determina como la diferencia entre el valor calculado con la ecuación de regresión para el peso utilizado de la gota de champú y el valor experimental obtenido. Posteriormente se calcula el valor correspondiente a 100 mg en la curva de regresión y se suma o resta la desviación observada. De esta manera se obtiene el valor correspondiente del diámetro de extensión de la gota a 100 mg de peso, conservando la desviación observada experimentalmente.
La curva de regresión que se utiliza como referencia para la normalización de los resultados antes mencionada es específica para cada disposición de las variables del experimento, por ejemplo, para un juego de variables de tamaño y tipo de material de las placas y para una formulación también específica.
Tal curva de referencia puede ser la de la relación cúbica que es más general o la relación lineal que es válida sólo para interpolar en el espacio estudiado. La Figura 8 es un ejemplo de una curva de referencia, en este caso, sólo para normalizar datos obtenidos con las placas de vidrio de 15 cm y para el champú acondicionador.
Este procedimiento se siguió para los datos obtenidos del champú acondicionador con placas de acrílico de 7.5 cm de lado. En la Tabla 2 se observan los resultados experimentales obtenidos para 10 determinaciones del diámetro de extensión de la gota de muestras con un peso de alrededor de 100 mg así como el valor normalizado para una muestra correspondiente a 100 mg. Este valor se denomina como D100mg en la Tabla 2.

Como se puede observar en la Tabla 2, si se consideran mediciones individuales, estas muestran desviaciones estándar relativas muy altas (12.3%). Sin embargo, cuando se considera la desviación estándar relativa del promedio de 2 mediciones, el valor disminuye hasta 9.6% y con el promedio de 3 mediciones baja hasta 8.3%. Considerando muestras de 100 mg, placas de acrílico de 7.5 cm de lado y tiempos de exposición de 5 minutos, la desviación estándar relativa es muy elevada.
En la Tabla 3 se muestran los resultados obtenidos para 10 mediciones de aproximadamente 200 mg del champú con 0.6% de cloruro de sodio y sus parámetros estadísticos. Las placas utilizadas fueron las de acrílico de 7.5 cm de lado. El aumento al doble del peso de las muestras (200 mg) permitió bajar los valores de la desviación estándar relativa de los valores individuales a 5.2%, para los promedios de 2 mediciones ésta llegó hasta 3.5% y para los promedios de 3 mediciones fue de 2.5%.

En la Tabla 4 se observan los resultados obtenidos para la desviación estándar relativa con el champú acondicionador, cuando se utilizaron placas de vidrio de 3 mm de grueso y de 15 cm de lado, cuando se pesaron diferentes cantidades entre 200 mg y 500 mg y haciendo 6 repeticiones. Considerando una desviación estándar relativa promedio del diámetro de la gota medido a los 10 minutos de 1.35%, haciendo 6 repeticiones, se calcula un intervalo de confianza al 95% de la medición del diámetro de extensión de la gota de 100±0.22% y un intervalo de confianza al 99% de 100±0.29%.
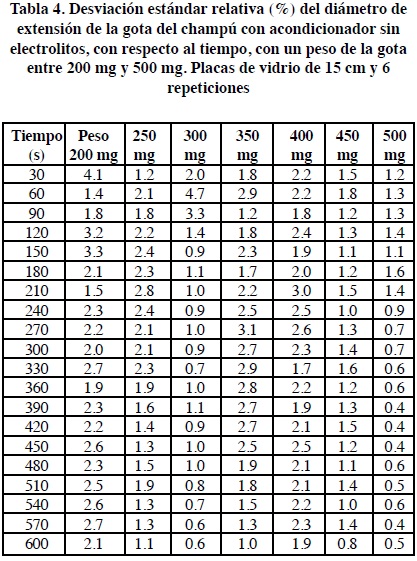
Como se ha mostrado antes en la Figura 5 la desviación estándar relativa de las mediciones del diámetro de extensión de la gota disminuye al aumentar el tiempo al cual se realizó la medición. En la Tabla 4 y en la Figura 9 se puede observar que al aumentar el peso de la gota también disminuye la variabilidad de la medición, aquí representada por la desviación estándar relativa.
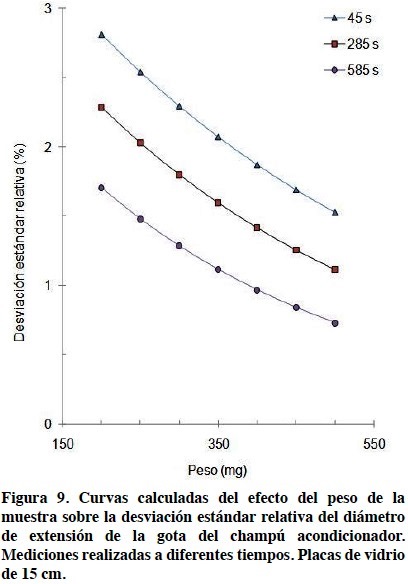
La Figura 9 muestra las líneas de regresión calculadas para los promedios de los tiempos de medición de 30 s y 60 s, representada por el tiempo de 45 s así como los promedios de 270 s y 300 s y 570 s y 600 s, representadas por los tiempos de 285 s y 585 s.
La precisión de los resultados de las determinaciones manifiesta la confianza que se puede tener en las predicciones acerca de las mediciones hechas en los productos.
La precisión de un método es la medida en que los resultados de pruebas individuales concuerdan con una serie de pruebas estandarizadas. La medición de la desviación estándar se puede subdividir en categorías como la repetibilidad y la reproducibilidad. La repetibilidad se obtiene al llevar a cabo el análisis en un laboratorio, por un operario utilizando el mismo equipo, en un intervalo de tiempo relativamente corto. Se recomiendan cuando menos 6 determinaciones para calcular la desviación estándar relativa.
El criterio de aceptación para la precisión depende mucho del tipo de análisis. Mientras que para un método de análisis de fármacos en control de calidad se alcanzan fácilmente desviaciones estándar relativas de cerca del 1%, para métodos como los que usan muestras biológicas sería de 10% a 15%. En general, este parámetro puede variar entre 2% y más de 20 %.27
Para saber que tan sensible es un método, hacemos uso de la estadística. Con la estadística del método, podemos medir su desviación estándar y su coeficiente de variación (CV) y con ellos, podemos calcular que variación de la medición puede ser detectada con significación estadística; cuando se realizan 1, 2, 3, o más repeticiones para esa determinación.
Por definición un valor reportable es el resultado final de un método de medición completo tal como se documenta. Este valor se compara con las especificaciones y es el valor oficial que se usa para el análisis estadístico.28 Esto significa que el resultado puede ser el promedio de 1, 2, 3, etc., número de repeticiones si el método así lo estipula.
En la Tabla 2 se establece una relación entre el intervalo de confianza al 95% y el número de ensayos (individuales y promedios de 2 y 3 repeticiones) que se realizan para reconocer una variación, con respecto a una medición, con una probabilidad del 95%. En este caso para el uso de placas de acrílico de 7.5 cm. Si un método tiene una desviación estándar de 4.8 mm, con un promedio de 39.1 mm y si realizamos 3 mediciones (D-3100mg) para sacar como resultado el promedio, tendremos, con una probabilidad del 95%, la posibilidad de reconocer una variación del diámetro de extensión de la gota > 1.0 mm. Si sólo hacemos 2 mediciones (D-2100mg) para sacar como resultado el promedio, tendremos, con una probabilidad del 95%, la posibilidad de reconocer una variación del diámetro de extensión de la gota ≥ 1.2 mm. Si sólo hacemos 1 medición (D100mg) para sacar el resultado tendremos, con una probabilidad del 95%, la posibilidad de reconocer una variación del diámetro de extensión de la gota ≥ 1.5 mm.
Sin embargo, cuando se usan placas de vidrio de 15 cm y muestras de un peso entre 200 mg y 500 mg se ha observado que la desviación estándar relativa no sólo depende del número de repeticiones. Ésta puede fluctuar en función del peso de la muestra y del tiempo al que se haga la medición, conforme mayor es el tiempo y el peso de la muestra la desviación estándar relativa será menor. Las placas de vidrio de 15 cm permiten obtener desviaciones estándar relativas entre 0.4 y 4.1% (Tabla 4), correspondientes con intervalos de confianza al 95% y al 99% menores del 1%, valores que se pueden considerar adecuados para una medición de la consistencia de un champú.
La frase "dentro del intervalo de variación del método" tiene aplicación para una circunstancia específica y no es de aplicación universal. Aunque los límites de los intervalos de confianza no se apliquen como criterio para establecer una especificación y aunque la superposición de los intervalos de confianza no son una prueba de significación.
Utilizando el método anterior (placas de vidrio de 15 cm) se evaluó el efecto de la proporción de electrolito sobre la viscosidad de un champú con acondicionador.
Efecto de los electrolitos sobre la viscosidad
En la Figura 10 se observa el efecto de la adición de cloruro de sodio sobre la cinética del diámetro de extensión de una gota de champú acondicionador, cuando se utilizaron placas de 15 cm para su determinación. Se observa el mismo patrón antes visto para el champú sin electrolito (Figura 3), esto es, un aumento rápido del diámetro seguido de una tendencia a estabilizarse al paso del tiempo. Al adicionar cloruro de sodio (0.2%) al champú éste muestra una disminución del diámetro de extensión de la gota, lo que es equivalente a un incremento de su viscosidad. Mayores incrementos de la concentración de electrolito, hasta 0.6%, no muestra cambios importantes en el diámetro de extensión de la gota y por consecuencia de la viscosidad del champú. Las líneas de tendencia mostradas en la Figura 10 corresponden con un modelo potencial y es el mismo antes aplicado en las líneas de tendencia en la Figura 3.
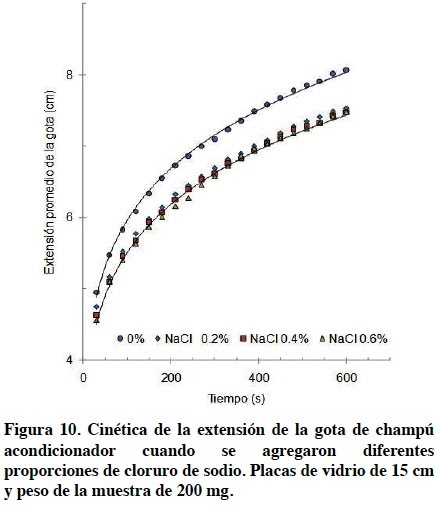
En el área de experimentación que comprende los datos de la Figura 10 no se llegó a observar una disminución de la viscosidad tal como se mostró en la Figura 1. Sin embargo, esto no quiere decir que no ocurra posteriormente. Si bien antes se ha mencionado que a mayor tamaño de la muestra es menor la variabilidad de los resultados, aquí se consideró que una muestra de 200 mg daría resultados suficientes.
La fuerza que impulsa la asociación de las moléculas de tensoactivo y la formación de las micelas es la interacción hidrofóbica de las cadenas hidrocarbonadas. Conforme mayor sea la interacción hidrofóbica menor será la concentración micelar crítica. La capacidad de los tensoactivos para disminuir la tensión superficial depende en gran medida del grado en que estos desplacen a las moléculas de agua de la interface agua-aire. Esto es, está determinada por la cantidad del tensoactivo que satura esta interface por adsorción. La adición de cloruro de sodio a las soluciones de dodecanosulfonatos disminuye su concentración micelar crítica. En los tensoactivos que tienen un ión común con el cloruro de sodio, la combinación de los iones opuestos (Na+) con las micelas debilita las fuerzas de repulsión electroestáticas entre las cabezas de los grupos aniónicos y con ello favorece la asociación de las moléculas y la formación de las micelas. La disminución de la concentración micelar crítica se atribuye en primera instancia a la reducción de la repulsión electrostática entre las cabezas de los grupos polares, y con ello, a una menor contribución de esos grupos a la energía libre que se opone a la micelización.29
En el caso de un tensoactivo iónico existe una doble capa difusa que influye sobre la termodinámica y la cinética de acercamiento de unas moléculas con otras y de su adsorción sobre la superficie del líquido. El proceso de autoensamble y adsorción se acompaña con un aumento progresivo de la densidad de la carga y del potencial eléctrico. La carga sobre el conjunto de moléculas de tensoactivo autoensambladas y sobre la superficie repele a las moléculas de tensoactivo que van llegando, lo que provoca una desaceleración del proceso de autoensamble y de adsorción. En la región interna de la capa de adsorción y sobre el conjunto de moléculas agrupadas o aisladas en la solución se desarrolla una doble capa eléctrica con una densidad de carga del medio diferente de cero (Figura 11). En la región externa, la carga media es cero, pero a pesar de ello la concentración de iones varía durante el proceso de autoensamble y de adsorción.29,30

En la Figura 12 se observa el efecto de la adición de electrolito, cloruro de sodio y cloruro de amonio sobre el diámetro de extensión de la gota alcanzado a los 10 minutos. El peso de la muestra fue de 200 mg. La adición de cloruro de amonio presenta un efecto similar al del cloruro de sodio, esto es, un aumento en la viscosidad el cual se refleja en una disminución de la extensión de la gota del champú colocado entre las placas, en este caso de vidrio de 15 cm con 6 repeticiones.

El efecto de los electrolito sobre la viscosidad de champuses depende de los componentes de la formulación así como del tipo de sal que se utilice. Sin embargo, una valoración exacta del máximo de viscosidad que se puede alcanzar requiere de la determinación de muchos más puntos experimentales. El objetivo aquí sería la aplicabilidad del método para examinar el efecto antes mencionado. Esta limitante nos permite observar sólo una parte del comportamiento del champú.
Los mismos principios de interacción entre las moléculas de tensoactivos y los electrolitos, antes mencionados, serían los responsables del aumento en la viscosidad de los sistemas conteniendo tensoactivos. Esto es, al agregar electrolitos se provocaría una disminución de las fuerzas repulsivas de las cabezas polares, lo que haría más evidente el ejercicio de las fuerzas de atracción entre las moléculas.
Cuando se gráfica el valor inverso del diámetro de extensión de la gota contra la concentración de electrolito (Figura 13) se obtiene una gráfica similar a la mostrada en la Figura 1, la cual muestra el efecto del cloruro de sodio sobre la viscosidad de una mezcla de tensoactivos. Los valores del inverso del diámetro de extensión de la gota del champú se consideran como unidades equivalentes a las de viscosidad.
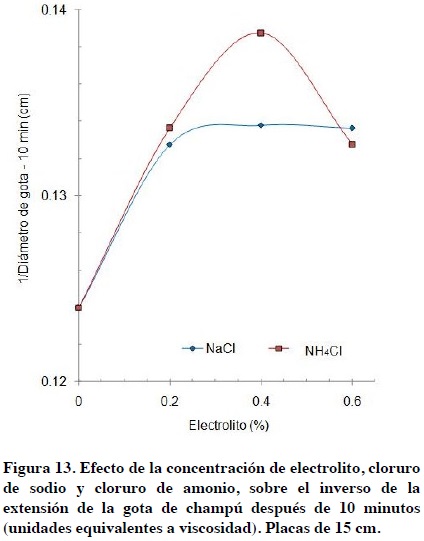
Conclusiones
Los resultados obtenidos nos permiten concluir que el método de la extensión de la gota se puede utilizar para determinar el efecto de los electrolitos sobre la viscosidad o consistencia en muestras de champú. La precisión del método es dependiente de la cantidad o peso de la muestra que forma la gota y del tiempo de exposición de la gota de champú al ejercicio del peso de la placa que tiene encima. Además de ser relativa al número de repeticiones que se hagan de la medición ya que el promedio de un número creciente de mediciones permite reducir progresivamente su variabilidad. Estas circunstancias determinan la precisión del método de extensión de la gota. La selección adecuada de estos parámetros permite obtener determinaciones del diámetro de extensión de la gota en un intervalo de confianza al 95% menor a ±1%.
En los intervalos de concentración de electrolito estudiados se observa una tendencia hacia mayores viscosidades del champú conforme aumenta la proporción del electrolito, hasta un límite. Este efecto parece ser atribuible a varios factores sin que se haya establecido hasta ahora el mecanismo exacto. Entre los parámetros que influyen la viscosidad de las soluciones de tensoactivo se incluye la deshidratación de las cabezas polares de los tensoactivos y la disminución de las fuerzas repulsivas de las cabezas polares que favorece la asociación de las moléculas de tensoactivo.
Además, los electrolitos influyen la formación de las micelas, dando impulso a las transiciones microestructurales y a cambios en la vida media de las micelas, lo que afecta la viscosidad del sistema.
Agradecimientos
Los autores agradecen la participación, en el desarrollo experimental, de los alumnos del grupo QF8-V1-2011 de la ENCB-IPN, en particular a: E. Álvarez campos, D. Castilla Parra, J. P. Montoya Ángel, C. J. Palma Rico y J. Vallejo Basilio.
Referencias
1. Aarhus, K. 2011. Conditioning shampoo. About.com Guide. Women's hairstyles [on line]. Consultado el 24 de agosto de 2011. Disponible en: http://womenshair.about.com/od/hairglossary/g/conditioningsha.htm. [ Links ]
2. Bouillon, C. 1996. Shampoos. Clinics in Dermatology; 14:113-121. [ Links ]
3. Grote, M. B., Russell, G. D. 1988. Patente de los estados Unidos No. 4,741,855 de mayo 3 de 1988, asignada a Procter & Gamble Company. [ Links ]
4. Shampoo [on line]. Disponible en: http://sci-toys.com/ingredients/shampoo.html. Consultado el 28 de abril de 2011. [ Links ]
5. Arif, S. Hair Shampoos The science & art of formulation. Technical bulletin of Pilot Chemical Co [on line]. Disponible en: www.pilotchemical.com. Consultado el 28 de abril de 2011. [ Links ]
6. Lehmann, A., Volkert, B., Fischer, S., Schrader, A., Nerenz, H. 2008. Starch based thickening agents for personal care and surfactant systems. Colloids and Surfaces A: Physicochem. Eng. Aspects. 331, 150-154. [ Links ]
7. Watanabe, H., Groves, W. L. 1968. Alcohol Ether Sulfates in Shampoos. Journal of the American Oil Chemists' Society. 45 (11), 738-741. [ Links ]
8. Why is there sodium chloride in my shampoo? [on line] Disponible en: http://www.treasuredlocksfaqs.com/activekb/questions/560/Why+is+there+sodium+chloride+in+my+shampoo%3F. Consultado el 28 de abril de 2011. [ Links ]
9. Vlachy, N., Drechsler, M., Verbavatz, J. M., Touraud, D., Kunz, W. 2008. Role of the surfactant headgroup on the counterion specificity in the micelle-to-vesicle transition through salt addition. Journal of Colloid and Interface Science, 319, 542-548. [ Links ]
10. Hay, P. M. 1972. Synergistic interactions of shampoo ingredients. Journal of the American Oil Chemists' Society, 49 (6), 343-345. [ Links ]
11. Mahajan, R. K., Sharma, R. 2011. Analysis of interfacial and micellar behavior of sodium dioctyl sulphosuccinate salt (AOT) with zwitterionic surfactants in aqueous media. Journal of Colloid and Interface Science, 363, 275-283. [ Links ]
12. Pflaumbaum, M., Müller, F., Peggau, J., Goertz, W., Grüning, B. 2001. Rheological properties of acid gel cleansers. Colloids and Surfaces. A: Physicochemical and Engineering Aspects. 183-185, 777-784. [ Links ]
13. Tuin, G., Candau, F., Zana, R. 1998. The influence of salicylate counterions on the aggregation behaviour of a polymerizable cationic surfactant. Colloids and Surfaces. A: Physicochemical and Engineering Aspects. 131, 303-313. [ Links ]
14. Abezgauz, L., Kuperkar, K., Hassan, P. A., Ramon, O., Bahadur, P., Danino, D. 2010. Effect of Hofmeister anions on micellization and micellar growth of the surfactant cetylpyridinium chloride. Journal of Colloid and Interface Science, 342, 83-92. [ Links ]
15. Zuev, Y. F., Kurbanov, R. K., Idiyatullin, B. Z., Us'yarov, O. G. 2007. Sodium Dodecyl Sulfate Self-Diffusion in Premicellar and Low-Concentrated Micellar Solutions in the Presence of a Background Electrolyte. Colloid Journal, 69 (4), 444-449. [ Links ]
16. Rojas, M. R., Müller, A. J., Sáez, A. E. 2010. Effect of ionic environment on the rheology of wormlike micelle solutions of mixtures of surfactants with opposite charge. Journal of Colloid and Interface Science. 342, 103-109. [ Links ]
17. Aramaki, K. Hoshida, S., Arima, S. 2010. Effect of carbon chain length of cosurfactant on the rheological properties of nonionic wormlike micellar solutions formed by a sugar surfactant and monohydroxy alcohols. Colloids and Surfaces A: Physicochem. Eng. Aspects. 366, 58-62. [ Links ]
18. Lehmann, A., Volkert, B., Fischer, S., Schrader, A., Nerenz, H. 2008. Starch based thickening agents for personal care and surfactant systems. Colloids and Surfaces A: Physicochem. Eng. Aspects. 331, 150-154. [ Links ]
19. Emil, A., Yaakob, Z., Kumar, M. N. S., Jahim, J. M., Salimon, J. 2010. Comparative Evaluation of Physicochemical Properties of Jatropha Seed Oil from Malaysia, Indonesia and Thailand. J Am Oil Chem Soc. 87, 689-695. DOI 10.1007/s11746-009-1537-6. [ Links ]
20. Pharmaceutical Ointment. Laboratory Viscometer Application Data Sheet. Brookfield Engineering. Disponible en: http://www.brookfieldengineering.com/education/applications/laboratory-pharmaceutical-ointment.asp. Consultado el 27/12/2011. [ Links ]
21. Hair Conditioner. Laboratory Viscometer Application Data Sheet. Brookfield Engineering. Disponible en: http://www.brookfieldengineering.com/education/applications/laboratory-hair-conditioner.asp. Consultado el 27/12/2011. [ Links ]
22. Sharma, R. M., Shah, K., Patel, J. 2011. Evaluation of prepared herbal shampoo formulations and to compare formulated shampoo with marketed shampoos. Int J Pharm Pharm Sci, 3 (4), 402-405. [ Links ]
23. Momin, S. A., Yeole, P. 2011. Comparative Study of Effect of Surfactant-Polymer Interactions on Properties of Alkyl Polyglucosides and Alpha Olefin Sulphonate. J Surfact Deterg. DOI 10.1007/s11743-011-1304-1. Publicado en línea el 05 de octubre de 2011. [ Links ]
24. Vennat, B. Gross, D. Pouget, M. P., Pourrat, A. y Pourrat, H. 1995. Comparison of the physical stability of astringent hydrogels based on cellulose derivatives. Drug Dev. Ind. Pharm. 21 (5), 559-570. [ Links ]
25. Leblanc, G. E., Secco, R. A., kostic, M. 1999. Capítulo 30. Viscosity measurement. En: Webster, J. G. (Editor). The measurement, instrumentation, and sensors handbook. CRC Press. Boca Ratón, FL. USA [on line]. Disponible en: http://books.google.com/books?id=b7UuZzf9ivIC&printsec=frontcover&dq=inauthor:%22John+G.+Webster%22&hl=es&ei=fHxdTojeFoSLsQLR1swE&sa=X&oi=book_result&ct=book-preview-link&resnum=1&ved=0CC0QuwUwAA#v=onepage&q&f=false . Consultado el 30 de agosto de 2011. [ Links ]
26. Villafuerte Robles, L. 2002. Estabilidad de medicamentos. Instituto Politécnico Nacional, D. F., México, pp. 339-345. [ Links ]
27. Huber, L. 2007. Validation and Qualification in Analytical Laboratories. LabCompliance. Tutorial. Validation of Analytical Methods and Procedures [on line]. Consultado el 11 de mayo de 2011. Disponible en: http://www.labcompliance.com/tutorial/methods/default.aspx#08_paramters. [ Links ]
28. Torbeck, L. D. L. 2011. Pitfalls in statistics. Pharmaceutical Technology, 35 (4), 40-42. [ Links ]
29. Azira, H., Tazerouti A. 2007. Micellar Behavior of Anionic Surfactants with Sulfonate Function in Aqueous Solutions. J. Surfact. Deterg. 10,185-190. [ Links ]
30. Danov, K. D., Kralchevsky, P. A., Ananthapadmanabhan, K. P., Lips, A. 2006. Influence of electrolytes on the dynamic surface tension of ionic surfactant solutions: Expanding and immobile interfaces. Journal of Colloid and Interface Science. 303, 56-68. [ Links ]














