Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.43 no.2 Ciudad de México abr./jun. 2012
Revisión bibliográfica
Tratamientos farmacológicos contra alternativos en el manejo de pacientes con artritis reumatoide
Pharmaceutical vs. alternative treatment in the rheumatoid arthritis patients
Liliana Domínguez Hernández, Ana Laura Hohlatcheff Ávila, José Luis Montiel Hernández
Universidad Autónoma del Estado de Morelos, Facultad de Farmacia. Laboratorio de Citocinas y Autoinmunidad.
Correspondencia:
Dr. José Luis Montiel Hernández.
Universidad Autónoma del Estado de Morelos
Facultad de Farmacia
Laboratorio de Citocinas y Autoinmunidad
Universidad 1001 Col. Chamilpa C.P. 62209,
Cuernavaca, Morelos
Tel. 01 7773297000 ext 3371
e-mail: jlmontiel@uaem.mx
Fecha de recepción: 23 de agosto de 2011.
Fecha de recepción de modificaciones: 1 de diciembre de 2011.
Fecha de aceptación: 17 de enero de 2012.
Resumen
La Artritis Reumatoide es una enfermedad autoinmune progresiva de etiología multifactorial caracterizada por inflamación, dolor y erosión articular. Los tratamientos terapéuticos más frecuentes es el empleo de medicamentos alopáticos (AINES, FARMES y biológicos), los cuales permiten un cierto nivel control de los síntomas y evolución de esta enfermedad en los pacientes. Sin embargo, un alto porcentaje de los pacientes emplean en algún momento, tratamientos no convencionales o alternativos (CAM), lo cual puede derivar en respuestas clínicas muy variadas y algunas veces indeseables. En este trabajo revisión se hace una comparación entre los tratamientos farmacológicos y de los tratamientos alternativos en base a las evidencias científicas en el manejo en pacientes con Artritis Reumatoide.
Palabras clave: artritis reumatoide, tratamiento, inflamación, fármaco, CAMs.
Abstract
Rheumatoid Arthritis is an autoimmune and progressive disease, of multifactorial etiology and characterized by inflammation, pain and bone erosion in the peripheral joints. The most common therapeutic treatments included the employ of allopathic drugs (AINES, DMARDs and biological), which allow a control of symptoms and development of the disease in patients. However, an elevated number of patients also employ non-conventional or alternative treatments (CAMs), deriving in very different and sometimes undesirable clinical responses. In this review we compare the pharmacologic treatments and alternative treatments according with the scientific evidences of its effect in the RA patients.
Key words: rheumatoid arthritis, treatment, inflammation, drug, CAMs.
Introducción
La Artritis Reumatoide (AR) es una enfermedad autoinmune crónica y progresiva, caracterizada por la inflamación, dolor y destrucción ósea en las articulaciones periféricas, situación que puede desembocar en discapacidad. Se estima que afecta aproximadamente entre el 0.5-1.0% de la población mexicana.1 Asimismo, es un padecimiento que afecta principalmente a mujeres adultas, por lo que se sugiere la participación de las hormonas sexuales.2 Se reconoce que la etiología de esta enfermedad es multifactorial, donde los factores más importantes son la predisposición genética, la desregulación de la respuesta inmune y los factores medioambientales, tales como infecciones bacterianas y virales, la exposición a sustancias químicos y físicas (tabaquismo), etc.3,4 Debido a la amplia gama de factores que pueden favorecer el desarrollo de esta enfermedad, se han diseñado diferentes alternativas farmacológicas para controlar síntomas de la enfermedad, así como su desarrollo (Tabla 1). A pesar de la presencia de varias opciones farmacológicas dentro de la medicina alopática, un porcentaje grande de los pacientes también hacen uso de métodos y reactivos de la Medicina complementaria y alternativa (CAM; por sus siglas en inglés Complementary and Alternative Medicine). Situación que ha significado un gran aumento en la comercialización y generación de nuevas opciones terapéuticas. Lamentablemente, pocos pacientes informan a los reumatólogos sobre el empleo de estos tratamientos, lo cual puede llevar en respuestas clínicas muy variadas y algunas veces indeseables.
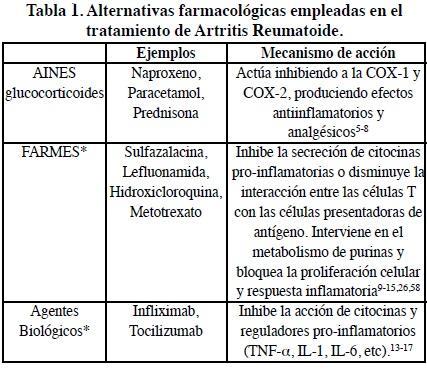
* ver Material suplementario
En esta tabla se muestran los mecanismos de acción de las diferentes alternativas farmacológicas comúnmente utilizados en el tratamiento de AR.
En esa situación, nos interesa en el presente trabajo comparar los dos tipos de medicina, en base a las evidencias científicas que explican su efecto biológico y beneficio en el uso clínico. Para eso realizamos una búsqueda bibliográfica en Pubmed (www.ncbi.nlm.nih.gov/pubmed) de trabajos en idioma inglés, del período 2000-2010, con las palabras clave: "antirheumatic drugs", "rheumatoid arthritis treatment", "alternative medicine". Es importante considerar que debido a la extensa de literatura especializada en la caracterización biológica y clínica de los tratamientos farmacológicos, en la sección de material suplementario se presenta una lista de enlaces a portales electrónicos de organizaciones nacionales y mundiales especializadas en el tratamiento de pacientes con AR, así como una relación adicional de revisiones bibliográficas recientes sobre este tema (2010-11). Asimismo, dado que los fines del presente trabajo fueron comparar la base científica de ambos tipos de tratamientos y, en ningún momento el constituirse en un compendio exhaustivo de los medicamentos antireumáticos, preferimos hacer hincapié en las evidencias científicas que pudimos localizar en la medicina complementaria y alternativa.
Tratamiento Farmacológico
Como su nombre lo dice, los anti-inflamatorios no esteroideos (AINES), disminuyen el dolor y la inflamación, mediante la inhibición de las ciclo-oxigenasas (COX-1 y 2) y el bloqueo de la secreción de mediadores pro-inflamatorios6. Sin embargo, se reconoce que su acción sólo bloquea los síntomas pero no induce un efecto significativo sobre el curso de la enfermedad.5,6
Por otra parte, los glucocorticoides son otra alternativa farmacológica muy empleada para controlar los síntomas de pacientes con AR, debido a su potente efecto anti-inflamatorio y analgésico.8 Sin embargo, debido a que se presentan diversos efectos adversos (favorece infecciones, riesgo cardiovascular, neoplasia, etc.), se recomienda su empleo a dosis bajas y por períodos cortos.7
La primera alternativa de tratamiento empleada por los reumatólogos son los fármacos modificadores de la enfermedad (FARMES), los cuales además de disminuir la inflamación y proteger de los daños estructurales, también pueden llevar a la remisión en el 50-80% de los pacientes, sobre todo en aquellos que iniciaron el tratamiento en una etapa temprana (<1 año del inicio de los síntomas).9-16 Varios estudios en sistemas in vitro, en modelos animales y en humanos han mostrado inducir efectos sobre la activación, proliferación y viabilidad de células inmunológicas.12 En particular se ha confirmado un efecto inhibidor de la respuesta inmunológica adaptativa para metrotexate y leflunomida, por bloqueo de cascadas de activación intracelular en linfocitos T, NK y B,10,1215 favoreciendo un descenso de los títulos de autoanticuerpos y proteínas de fase aguda.15 A pesar de sus ventajas, sus efectos se observan en tiempos largos, por lo que se prefiere esquemas de tratamiento combinado o con rápido escalamiento. Por otro lado, existe un porcentaje significativo de los pacientes que muestran resistencia a sus efectos, al tiempo que su uso prolongado conlleva a efectos gastrointestinales.
La alternativa farmacológica más reciente para el control de la AR es el empleo de los agentes biológicos17. Se trata de proteínas de origen biotecnológico diseñadas para bloquear de manera selectiva citocinas y proteínas asociadas en la regulación de la inflamación (por ejemplo, anticuerpos o receptores solubles para bloquear citocinas tales como TNF-α, IL-1β, IL-6, entre otras.13-15,17 Esta estrategia ha mostrado efectos muy buenos en los pacientes con AR, ya que influye tanto en la respuesta inflamatoria como en la desregulación autoinmune (ver material suplementario). En este sentido, el empleo combinado de biológicos con FARMES ha permitido un efecto positivo en cerca del 80-90% de los pacientes con AR y en casi el 100% de los pacientes con espondiloartripatías. Sin embargo, aun así se ha observado que un porcentaje minoritario de los pacientes son resistentes a estos medicamentos.16,17 Ajeno a su efecto terapéutico, el factor que limita su empleo de manera generalizada es su costo tan elevado, lo cual hace prohibitivo su empleo para gran parte de los pacientes en países en vías de desarrollo.
A pesar de la presencia de diferentes alternativas farmacológicas para el control de los síntomas en pacientes con AR, un porcentaje significativo de los pacientes presenta falta de apego al tratamiento, motivado ya sea porque no se alcanzaron las expectativas en corto tiempo, por el gasto económico o por una mezcla de estos factores.16,18 En esas condiciones, la presencia de alternativas no farmacológicas para el tratamiento de la AR parece llenar un vacío de la atención médica.19
Tratamiento no farmacológico
La medicina complementaria y alternativa es un grupo de sistemas de salud, prácticas, productos médicos y del cuidado de la salud que son ajenos a la medicina alopática o convencional. En años recientes, su uso se ha incrementado de manera importante tanto en países en vías de desarrollo como en países desarrollados. Estudios epidemiológicos en varios países han reportado que entre un 20-60% de los pacientes han empleado, en algún momento, los tratamientos de tipo CAM.20-23 Nuestro país no es la excepción, dado que cerca del 70% de los pacientes declararon haber empleado alguno de estos tratamientos y sólo el 26% lo informaron al especialista. Lo más notable de esta práctica es que fue un motivo para suspender su tratamiento farmacológico.24 Aunque en trabajos recientes se han enumerado las pocas evidencias científicas del efecto benéfico de estos tratamientos en pacientes con AR,19,25,26 resulta paradójico que su empleo no sólo no ha disminuido, sino que sigue creciendo. A continuación se ofrece una descripción de estas prácticas o productos médicos, así como las evidencias objetivas en que se basa su efecto benéfico en el control de los síntomas de la AR.
La acupuntura se basa en la estimulación de la piel para potenciar la liberación de neurotransmisores, los cuales, se sugiere, inhiben el dolor. Esta alternativa involucra el uso de técnicas de estimulación a través de agujas, estimulación eléctrica y calórica. Sin embargo, no se ha podido identificar evidencias significativas de su efecto benéfico en el desarrollo o control de la AR.28-31 Recientemente, en un estudio piloto, al azar, doble ciego y controlado, se observó que el tratamiento con acupuntura por 9 semanas permitió que un porcentaje significativo de los pacientes alcanzaran una mejoría del 20% (ACR20), al tiempo que su funcionalidad y evaluación analógica mejoraron. Sin embargo, ninguno de sus parámetros de laboratorio se modificó, sugiriendo que la mejoría observada pudo haber sido resultado de la percepción del dolor.32 Por otra parte, algunos estudios realizados en modelos animales sugieren que la electroacupuntura tiene efectos más importantes sobre el desarrollo de la inflamación, sin embargo, estos resultados no han sido validados en los pacientes.19
Una alternativa de la acupuntura, podría ser la aplicación articular del veneno de abeja, donde además de la estimulación cutánea, se implica la acción biológica de los componentes del veneno. Los estudios en modelos animales, sugieren que su efecto depende de la acción para controlar el dolor y formación de radicales de oxígeno.33 En un estudio clínico corto, se observó una disminución en los parámetros de inflamación articular,19 esto fue similar en otros estudios, aunque fueron evaluaciones con pocos pacientes y de diseño poco riguroso.34 Conviene considerar que su aplicación indiscriminada puede generar efectos adversos serios en pacientes sensibles (reacción anafiláctica).
Por su parte, la homeopatía es otra CAM ampliamente empleada en procesos crónicos, aunque sus resultados son material de un amplio debate. En estudios controlados y doble ciego, empleando pacientes con AR que continuaron recibiendo su tratamiento farmacológico, se observó que los medicamentos homeopáticos no modificaron los parámetros clínicos de los pacientes.35 En cambio, su asistencia a las consultas homeopáticas, ocasionó una mejora significativa en los índices clínicos, sugiriendo que la atención personalizada tiene mayor efecto que los medicamentos homeopáticos.36,37
Otro de los tratamientos alternativos es el empleo de suplementos alimenticios como las vitaminas con antioxidantes y los ácidos grasos poliinsaturados Omega-3. Es bien conocido que los ácidos grasos poliinsaturados Omega-3 tienen un efecto anti-inflamatorio, gracias a la expresión de las moléculas resolvinas y protectinas,38,39 las cuales inhiben la activación de NF-kB y la liberación de IL-1β y TNF-α.40-42 En un estudio clínico con un número limitado de pacientes, durante 24 semanas se observó que la mezcla de aceites de pescado y olivo indujo una disminución significativa en el dolor, rigidez matutina, aunque no altero los parámetros de laboratorio.43
Quizás la más importante de las alternativas terapéuticas no farmacológicas, es el empleo de preparados a partir de plantas (fitoterapia). Esta constituye una práctica muy común tanto en nuestro país como en muchos otros países, por lo que por sí sola se ha constituido como una de las áreas más florecientes. Recientemente, se hizo una revisión bibliográfica detallada de 260 productos CAM ofertados en Japón, encontrando que sólo 41 presentaban alguna evidencia experimental.27 A manera de conclusión, los autores señalan la posibilidad de incorporar algunos de estos suplementos al tratamiento farmacológico, sobre todo para el control del dolor; aunque se enfatiza que varias de las evidencias declaradas carecen de parámetros objetivos. Por otro lado, debido al pobre conocimiento de su empleo prolongado, el Colegio Americano de Reumatología recomienda hacer un empleo cuidadoso durante las primeras etapas del desarrollo de la AR, para limitar su efecto adverso a nivel de la erosión articular.16
En la Tabla 2 se presentan algunas de las alternativas herbolarias donde pudimos localizar evidencias objetivas de su efecto in vitro o modelos animales y en estudios con pacientes. Obsérvese que la mayor parte de estos extractos basan su efecto en la disminución de mediadores de inflamación,18,26,43 sin embargo pocos preparados se han evaluado en estudios clínicos controlados, con un número suficiente de pacientes y con parámetros clínicamente aceptados.26 Asimismo, una importante desventaja para la realización de estudios farmacológicos en este área, es la deficiente caracterización y purificación de los metabolitos potencialmente activos.

En diferentes estudios en modelos animales, la administración de extractos de Camellia sinensis (té verde) sugiere un efecto anti-inflamatorio, del cual se responsabiliza al alto contenido de polifenoles, principalmente epigalocatecina-3-galato. En modelos animales, estos metabolitos ocasionaron disminución de citocinas tales como IL-1β, IFN-γ, TNF-α, así como la disminución de óxido nítrico, prostaglandina E2 y de las metaloproteasas MMP-1 y MMP-3.18,44-46 Basados en un mecanismo biológico semejante, se ha propuesto que especies como Celastrus aculeatus y Uncaria tormentosa (Uña de gato) poseen también efectos antioxidantes y anti-inflamatorios.18 Interesantemente, en un estudio clínico controlado, empleando el extracto de Uncaria tormentosa se observó una disminución significativa de la inflamación articular y el dolor.47
Por su parte, el extracto de Lepidium meyenii, además de mostrar efectos anti-inflamatorios en modelos animales y en células en cultivo, parece promover la restauración de la articulación,18 por un mecanismo que sugiere la estimulación de IGF-1 por los condrocitos48. De manera diferente, se ha sugerido que Tripterygium wilfordii Hook F posee un componente activo (triptolido) que puede inducir efectos anti-inflamatorios al alterar la expresión de MMP-1, MMP-3, IL-1β, IL-17 y TNF-α en fibroblastos, macrófagos y condrocitos de ratón.49 De manera interesante, en un estudio clínico controlado, el extracto de esta especie mostró un efecto benéfico significativo a concentraciones elevadas (360 mg/día) tanto en el número de articulaciones dolorosas como en índice de recuperación (ACR50%).50
Por otro lado, estudios en modelos animales con extractos de Perna canaliculus han mostrado efectos anti-inflamatorios comparables a los AINES.51 Asimismo, empleando un modelo de artritis murina inducido por antígeno, este extracto inhibió la biosíntesis de prostaglandinas (PGE-2) y COX-2.52 Por otra parte, y mostrando mecanismos similares, se han evaluado extractos de Curcuma longa,53 Zingiber officinale54 y Semecarpus anacardium55 en modelos murinos.
De las evidencias de seguridad y eficacia
Varios otros trabajos de revisión bibliográfica, además del presente, han evidenciado la pocas evidencias objetivas y significativas de los productos CAM empleados en contra de la AR.26 Sin embargo se han reportado varios estudios rigurosos en ensayos con animales donde se ha mostrado un efecto positivo de los CAMs, lo cual sugiere que no es posible descartar indiscriminadamente estas prácticas y productos. Conviene considerar que cuando se han realizado evaluaciones en pacientes con AR, los beneficios son más bien modestos o se realizan diseños clínicos incompletos.25 Finalmente, la gran mayoría de los CAMs carece de una descripción fundamentada del mecanismo biológico por el que realizan su efecto (Tabla 2).
En esta tabla se muestran los efectos potenciales de las alternativas herbolarias más comunes en el tratamiento de AR. MMPs metaloproteasas, COX-2; Cicloxigenasa 2, LPS; Lipopolisacárido, IL; Interleucina, TNF-α; Factor de necrosis tumoral α, NF-κB; Factor nuclear κ Beta.
Por otro lado, el gran empleo de las terapias alternativas por parte de los pacientes con AR parece responder a diferentes factores: primeramente, constituye una alternativa muy accesible para el paciente. Segundo, toda vez que su promoción tiene un componente de carácter personal, su utilidad conlleva un importante elemento psicológico. Tercero, dado que una de las principales razones por la cual los pacientes con AR recurren al uso de CAM es la analgesia, su empleo no es regular y obedece a su percepción del dolor en un momento dado, por todo esto no es posible generar un esquema de tratamiento organizado. Finalmente, en general, los pacientes no informan al especialista del empleo de otras alternativas, contaminando su esquema de tratamiento y, por ende, su seguimiento.
Además de insuficiente evidencia científica para establecer esquemas de tratamiento con productos de tipo CAM para garantizar su seguridad y eficacia. En el caso particular del empleo de material botánico, es necesario establecer con seguridad el género y especie de las plantas empleadas, para intentar garantizar los efectos terapéuticos; por lo que es indispensable la identificación taxonómica. En términos oficiales, los medicamentos de cualquier clase, incluyendo los herbolarios y los vitamínicos, deben haber demostrado seguridad y eficacia, en ensayos controlados y certificados por organismos reguladores (COFEPRIS).58 Sin embargo, la gran mayoría de las CAMs sólo cuentan con el registro como suplementos alimenticios, vitaminas o cosméticos, lo cual no requiere este tipo de evaluación oficial.
Por otro lado, la población considera que los productos herbolarios, por ser naturales, son inocuos; sin embargo, esto no necesariamente es verdadero. Existen numerosos ejemplos en la literatura médica de los efectos adversos debido a la ingestión de productos que contienen extractos de plantas, así como reportes de los programas de farmacovigilancia que advierten de efectos graves debido a su empleo.57,58 Aunque no es obligatoria la presentación de estudios clínicos que avalen la eficacia de los remedios herbolarios, deben presentarse evidencias de la seguridad de las plantas o derivados contenidos en el remedio. Si se careciera de los datos que respalden la seguridad del producto, deberá generarse la investigación clínica que la demuestre.
Debido en gran manera a un diagnóstico tardío, insuficiente atención médica especializada y la respuesta variable a los tratamientos farmacológicos convencionales, la variedad de las alternativas terapéuticas disponibles en el mercado se ha incrementado de manera descontrolada. En ese sentido, tanto por su diversidad como su importante presencia en los medios de comunicación ha ocasionado que los tratamientos alternativos para los pacientes con AR, en lugar de servir como complemento en la atención al paciente, en algunos casos empiecen a sustituir al tratamiento farmacológico, con las consiguientes repercusiones económicas y de salud de los pacientes con AR.
Conclusiones
En estas circunstancias, podríamos concluir que los pacientes con AR se encuentran en una situación complicada: por un lado, es poco frecuente un diagnóstico temprano de los pacientes, lo cual limita la eficacia de los tratamientos farmacológicos; además que sus efectos pueden ser tardíos y sus costos elevados. Por el otro lado, el paciente es sujeto de un "bombardeo" publicitario para emplear tratamientos alternativos, que en términos generales son más económicos. Sin embargo, a pesar de presentar efectos benéficos moderados, los tratamientos alternativos basan su fortaleza más en aspectos subjetivos del paciente (percepción del dolor, etc.), que en evidencias científicas derivadas de estudios preclínicos y clínicos rigurosos.
Referencias
1. Ramos-Remus C, Sierra-Jimenez G, Skeith K, Aceves-Avila FJ, Russell AS, Offer R, et al. Latitude gradient influences the age of onset in rheumatoid arthritis patients. Clin Rheumatol. 2007 Oct;26(10):1725-8. [ Links ]
2. Cutolo M, Villaggio B, Craviotto C, Pizzorni C, Seriolo B, Sulli A. Sex hormones and rheumatoid arthritis. Autoimmun Rev. 2002 Oct;1(5):284-9. [ Links ]
3. Weyand CM. New insights into the pathogenesis of rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39 Suppl 1:3-8. [ Links ]
4. Glave-Testino C, Cardiel MH, Arce-Salinas A, Alarcon-Segovia D. Factors associated with disease severity in Mexican patients with rheumatoid arthritis. Clin Exp Rheumatol. 1994 Nov-Dec;12(6):589-94. [ Links ]
5. McCabe CJ, Akehurst RL, Kirsch J, Whitfield M, Backhouse M, Woolf AD, et al. Choice of NSAID and management strategy in rheumatoid arthritis and osteoarthritis. The impact on costs and outcomes in the UK. Pharmacoeconomics. 1998 Aug;14(2):191-9. [ Links ]
6. Chen YF, Jobanputra P, Barton P, Bryan S, Fry-Smith A, Harris G, et al. Cyclooxygenase-2 selective non-steroidal anti-inflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: a systematic review and economic evaluation. Health Technol Assess. 2008 Apr;12(11):1-278, iii. [ Links ]
7. Malysheva OA, Wahle M, Wagner U, Pierer M, Arnold S, Hantzschel H, et al. Low-dose prednisolone in rheumatoid arthritis: adverse effects of various disease modifying antirheumatic drugs. J Rheumatol. 2008 Jun;35(6):979-85. [ Links ]
8. Neeck G. Fifty years of experience with cortisone therapy in the study and treatment of rheumatoid arthritis. Ann N Y Acad Sci. 2002 Jun;966:28-38. [ Links ]
9. Kremer JM. Combination DMARD therapy for rheumatoid arthritis. Manag Care. 2001 Jul;10(7 Suppl):10-4. [ Links ]
10. Emery P. Leflunomide: a new DMARD for rheumatoid arthritis. Hosp Med. 2000 May;61(5):344-7. [ Links ]
11. Donahue KE, Gartlehner G, Jonas DE, Lux LJ, Thieda P, Jonas BL, et al. Systematic review: comparative effectiveness and harms of disease-modifying medications for rheumatoid arthritis. Ann Intern Med. 2008 Jan 15;148(2):124-34. [ Links ]
12. Tian H, Cronstein BN. Understanding the mechanisms of action of methotrexate: implications for the treatment of rheumatoid arthritis. Bull NYU Hosp Jt Dis. 2007;65(3):168-73. [ Links ]
13. Feely MG, O'Dell JR. Update on the use of conventional disease-modifying antirheumatic drugs in the management of rheumatoid arthritis. Curr Opin Rheumatol 2010 May; 22:316-20. [ Links ]
14. O'Mahony R, Richards A, Deighton C, Scott D. Withdrawal of disease-modifying antirheumatic drugs in patients with rheumatoid arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2010 Oct; 69:1823-6. [ Links ]
15. Schett G, Stach C, Zwerina J, Voll R, Manger B. How antirheumatic drugs protect joints from damage in rheumatoid arthritis. Arthritis Rheum 2008; 58:2936-48. [ Links ]
16. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2011; 69:964-75. [ Links ]
17. Fan PT, Leong KH. The use of biological agents in the treatment of rheumatoid arthritis. Ann Acad Med Singapore. 2007 Feb;36(2):128-34. [ Links ]
18. Sizova L. Approaches to the treatment of early rheumatoid arthritis with disease-modifying antirheumatic drugs. Br J Clin Pharmacol. 2008 Aug;66(2):173-8. [ Links ]
19. Efthimiou P, Kukar M. Complementary and alternative medicine use in rheumatoid arthritis: proposed mechanism of action and efficacy of commonly used modalities. Rheumatol Int. 2010 Mar; 30(5):571-86. [ Links ]
20. Herman CJ, Allen P, Hunt WC, Prasad A, Brady TJ. Use of complementary therapies among primary care clinic patients with arthritis. Prev Chronic Dis. 2004 Oct;1(4):A12. [ Links ]
21. Pirotta M. Arthritis disease - the use of complementary therapies. Aust Fam Physician. 2010 Sep;39(9):638-40. [ Links ]
22. Kajiyama H, Akama H, Yamanaka H, Shoji A, Matsuda Y, Tanaka E, et al. One third of Japanese patients with rheumatoid arthritis use complementary and alternative medicine. Mod Rheumatol. 2006;16(6):355-9. [ Links ]
23. Lee MS, Yang CY, Lee SI, Joo MC, Shin BC, Yoo WH, et al. Use of complementary and alternative medicine by rheumatoid arthritis patients in Korea. Clin Rheumatol. 2008 Jan;27(1):29-33. [ Links ]
24. Klingberg E, Wallerstedt SM, Torstenson T, Hawi G, Forsblad-d'Elia H. The use of complementary and alternative medicine in outpatients with inflammatory rheumatic diseases in Sweden. Scand J Rheumatol. 2009 Nov-Dec;38(6):472-80. [ Links ]
25. Alvarez-Nemegyei J, Bautista-Botello A, Davila-Velazquez J. Association of complementary or alternative medicine use with quality of life, functional status or cumulated damage in chronic rheumatic diseases. Clin Rheumatol. 2009 May;28(5):547-51. [ Links ]
26. Efthimiou P, Kukar M, Mackenzie CR. Complementary and Alternative Medicine in Rheumatoid Arthritis: No Longer the Last Resort! HSS J. 2009 Sep 26. [ Links ]
27. Kikuchi M, Matsuura K, Matsumoto Y, Inagaki T, Ueda R. Bibliographical investigation of complementary alternative medicines for osteoarthritis and rheumatoid arthritis. Geriatr Gerontol Int. 2009 Mar;9(1):29-40. [ Links ]
28. David J, Townsend S, Sathanathan R, Kriss S, Dore CJ. The effect of acupuncture on patients with rheumatoid arthritis: a randomized, placebo-controlled cross-over study. Rheumatology (Oxford). 1999 Sep;38(9):864-9. [ Links ]
29. Casimiro L, Barnsley L, Brosseau L, Milne S, Robinson VA, Tugwell P, et al. Acupuncture and electroacupuncture for the treatment of rheumatoid arthritis. Cochrane Database Syst Rev. 2005(4):CD003788. [ Links ]
30. Lee MS, Shin BC, Ernst E. Acupuncture for rheumatoid arthritis: a systematic review. Rheumatology (Oxford). 2008 Dec;47(12):1747-53. [ Links ]
31. Wang C, de Pablo P, Chen X, Schmid C, McAlindon T. Acupuncture for pain relief in patients with rheumatoid arthritis: a systematic review. Arthritis Rheum. 2008 Sep 15;59(9):1249-56. [ Links ]
32. Zanette Sde A, Born IG, Brenol JC, Xavier RM. A pilot study of acupuncture as adjunctive treatment of rheumatoid arthritis. Clin Rheumatol. 2008 May;27(5):627-35. [ Links ]
33. Suh SJ, Kim KS, Kim MJ, Chang YC, Lee SD, Kim MS, et al. Effects of bee venom on protease activities and free radical damages in synovial fluid from type II collagen-induced rheumatoid arthritis rats. Toxicol In Vitro. 2006 Dec;20(8):1465-71. [ Links ]
34. Lee JD, Park HJ, Chae Y, Lim S. An Overview of Bee Venom Acupuncture in the Treatment of Arthritis. Evid Based Complement Alternat Med. 2005 Mar;2(1):79-84. [ Links ]
35. Fisher P, Scott DL. A randomized controlled trial of homeopathy in rheumatoid arthritis. Rheumatology (Oxford). 2001 Sep;40(9):1052-5. [ Links ]
36. Brien S, Lachance L, Lewith GT. Are the therapeutic effects of homeopathy attributed to the consultation, the homeopathic remedy, or both? A protocol for a future exploratory feasibility trial in patients with rheumatoid arthritis. J Altern Complement Med. 2004 Jun;10(3):499-502. [ Links ]
37. Brien S, Lachance L, Prescott P, McDermott C, Lewith G. Homeopathy has clinical benefits in rheumatoid arthritis patients that are attributable to the consultation process but not the homeopathic remedy: a randomized controlled clinical trial. Rheumatology (Oxford). 2010 Jun;50(6):1070-82. [ Links ]
38. Arita M, Clish CB, Serhan CN. The contributions of aspirin and microbial oxygenase to the biosynthesis of anti-inflammatory resolvins: novel oxygenase products from omega-3 polyunsaturated fatty acids. Biochem Biophys Res Commun. 2005 Dec 9;338(1):149-57. [ Links ]
39. Hassan IR, Gronert K. Acute changes in dietary omega-3 and omega-6 polyunsaturated fatty acids have a pronounced impact on survival following ischemic renal injury and formation of renoprotective docosahexaenoic acid-derived protectin D1. J Immunol. 2009 Mar 1;182(5):3223-32. [ Links ]
40. Novak TE, Babcock TA, Jho DH, Helton WS, Espat NJ. NF-kappa B inhibition by omega -3 fatty acids modulates LPS-stimulated macrophage TNF-alpha transcription. Am J Physiol Lung Cell Mol Physiol. 2003 Jan;284(1):L84-9. [ Links ]
41. De Caterina R, Massaro M. Omega-3 fatty acids and the regulation of expression of endothelial pro-atherogenic and pro-inflammatory genes. J Membr Biol. 2005 Jul;206(2):103-16. [ Links ]
42. Calder PC. n-3 polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am J Clin Nutr. 2006 Jun;83(6 Suppl):1505S-19S. [ Links ]
43. Berbert AA, Kondo CR, Almendra CL, Matsuo T, Dichi I. Supplementation of fish oil and olive oil in patients with rheumatoid arthritis. Nutrition. 2005 Feb;21(2):131-6. [ Links ]
44. Ahmed S, Anuntiyo J, Malemud CJ, Haqqi TM. Biological basis for the use of botanicals in osteoarthritis and rheumatoid arthritis: a review. Evid Based Complement Alternat Med. 2005 Sep;2(3):301-8. [ Links ]
45. Ahmed S, Rahman A, Hasnain A, Lalonde M, Goldberg VM, Haqqi TM. Green tea polyphenol epigallocatechin-3-gallate inhibits the IL-1 beta-induced activity and expression of cyclooxygenase-2 and nitric oxide synthase-2 in human chondrocytes. Free Radic Biol Med. 2002 Oct 15;33(8):1097-105. [ Links ]
46. Ahmed S, Wang N, Lalonde M, Goldberg VM, Haqqi TM. Green tea polyphenol epigallocatechin-3-gallate (EGCG) differentially inhibits interleukin-1 beta-induced expression of matrix metalloproteinase-1 and -13 in human chondrocytes. J Pharmacol Exp Ther. 2004 Feb;308(2):767-73. [ Links ]
47. Singh R, Ahmed S, Islam N, Goldberg VM, Haqqi TM. Epigallocatechin-3-gallate inhibits interleukin-1beta-induced expression of nitric oxide synthase and production of nitric oxide in human chondrocytes: suppression of nuclear factor kappaB activation by degradation of the inhibitor of nuclear factor kappaB. Arthritis Rheum. 2002 Aug;46(8):2079-86. [ Links ]
48. Mur E, Hartig F, Eibl G, Schirmer M. Randomized double blind trial of an extract from the pentacyclic alkaloid-chemotype of uncaria tomentosa for the treatment of rheumatoid arthritis. J Rheumatol. 2002 Apr;29(4):678-81. [ Links ]
49. Miller MJ, Ahmed S, Bobrowski P, Haqqi TM. The chrondoprotective actions of a natural product are associated with the activation of IGF-1 production by human chondrocytes despite the presence of IL-1beta. BMC Complement Altern Med. 2006;6:13. [ Links ]
50. Cameron M, Gagnier JJ, Little CV, Parsons TJ, Blumle A, Chrubasik S. Evidence of effectiveness of herbal medicinal products in the treatment of arthritis. Part 2: Rheumatoid arthritis. Phytother Res. 2009 Dec;23(12):1647-62. [ Links ]
51. Tao X, Younger J, Fan FZ, Wang B, Lipsky PE. Benefit of an extract of Tripterygium Wilfordii Hook F in patients with rheumatoid arthritis: a double-blind, placebo-controlled study. Arthritis Rheum. 2002 Jul;46(7):1735-43. [ Links ]
52. Mani S, Lawson JW. In vitro modulation of inflammatory cytokine and IgG levels by extracts of Perna canaliculus. BMC Complement Altern Med. 2006;6:1. [ Links ]
53. Lawson BR, Belkowski SM, Whitesides JF, Davis P, Lawson JW. Immunomodulation of murine collagen-induced arthritis by N, N-dimethylglycine and a preparation of Perna canaliculus. BMC Complement Altern Med. 2007;7:20. [ Links ]
54. Funk JL, Oyarzo JN, Frye JB, Chen G, Lantz RC, Jolad SD, et al. Turmeric extracts containing curcuminoids prevent experimental rheumatoid arthritis. J Nat Prod. 2006 Mar;69(3):351-5. [ Links ]
55. Funk JL, Frye JB, Oyarzo JN, Timmermann BN. Comparative effects of two gingerol-containing Zingiber officinale extracts on experimental rheumatoid arthritis. J Nat Prod. 2009 Mar 27;72(3):403-7. [ Links ]
56. Singh D, Aggarwal A, Mathias A, Naik S. Immunomodulatory activity of Semecarpus anacardium extract in mononuclear cells of normal individuals and rheumatoid arthritis patients. J Ethnopharmacol. 2006 Dec 6;108(3):398-406. [ Links ]
57. Rieder SA, Chauhan A, Singh U, Nagarkatti M, Nagarkatti P. Cannabinoid-induced apoptosis in immune cells as a pathway to immunosuppression. Immunobiology. Aug;215(8):608-605. [ Links ]
58. Frati Munari A, Ocampo R, Martinez-Valdez E. Consideraciones acerca de la Regulación Sanitaria de Productos Herbolarios y Vitamíonicos. COFEPRIS Rev Sist Fed Sanit. 2005;1(3):3-11. [ Links ]














