Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.43 no.1 Ciudad de México ene./mar. 2012
Revisión bibliográfica
Técnicas de complejidad variable para evaluar la absorción de fármacos
Variable complexity techniques for assessing drug absorption
Dea Herrera Ruiz, Efrén Hernández Baltazar, Julio Cesar Espinosa Lara, Ixchel de la Luz Martínez, Adela Ayulia Beltrán Torres, Juan Manuel Martínez Alejo
Facultad de Farmacia, Universidad Autónoma del Estado de Morelos.
Correspondencia
Dra. Dea Herrera Ruiz y Dr. Efrén Hernández Baltazar
Facultad de Farmacia Universidad Autónoma del Estado de Morelos
Av. Universidad 1001, Col. Chamilpa, Cuernavaca, Mor., México, CP 62210
Tel.: 01(777)3297089, Ext. 7134 y 7135 Fax: 01(777)3297089
e-mail: dherrera@uaem.mx; efrenhbmx@yahoo.com.mx
Fecha de recepción: 22 de septiembre de 2011
Fecha de recepción de modificaciones: 10 de noviembre de 2011
Fecha de aceptación: 17 de noviembre de 2011
Resumen
El proceso de absorción de un fármaco administrado oralmente depende principalmente de la liberación del fármaco de la forma farmacéutica, descrito por la cinética de disolución de ésta, así como de la solubilidad y permeabilidad del fármaco en condiciones fisiológicas. Actualmente existe una necesidad práctica por mejorar la evaluación de la biodisponibilidad de fármacos administrados por vía oral, y se ha propuesto que la absorción intestinal de un fármaco sea estimada mediante la permeabilidad del compuesto a través de modelos que simulen el proceso de absorción. En este trabajo se describen las características del epitelio intestinal y los mecanismos de transporte de fármacos a través de éste, así como los diferentes modelos para estimar la absorción intestinal, sus características y aportaciones en la predicción del grado y mecanismo de absorción.
Palabras clave: absorción intestinal, permeabilidad, biodisponibilidad, PAMPA, Caco-2, MDCK.
Abstract
The drug absorption process after an oral administration mainly depends on the drug release from the dosage form, described by its dissolution kinetics, as well as the drug's solubility and permeability under physiological conditions. Nowadays, there is a practical need to improve the evaluation of oral drug bioavailability and it has been proposed that the drug intestinal absorption could be estimated through the compound's permeability determined in models which resemble the absorption process. Thus, the characteristics of the intestinal epithelium and the mechanism of drug transport are described. Different models to estimate intestinal absorption are discussed, their characteristics and predicting capabilities.
Key words: intestinal absorption, permeability, bioavailability, PAMPA, Caco-2, MDCK.
Introducción
La absorción de un principio activo por vía oral implica, generalmente, el paso de las moléculas de fármaco desde el intestino hacia la sangre a través de una barrera fisiológica, la membrana intestinal. Para que este fenómeno ocurra, el fármaco primero debe ser liberado de la forma farmacéutica y posteriormente disolverse en los fluidos fisiológicos.1,2 Con cerca del 80% de los medicamentos administrados por esta vía, la oral es por mucho la más utilizada.3
Por otro lado, se estima que el 40% de los compuestos que son candidatos a fármacos no logran llegar al mercado debido a propiedades biofarmacéuticas inadecuadas (solubilidad baja, permeabilidad y/o estabilidad metabólica), las cuales llevan a una baja biodisponibilidad que se traduce en bajos niveles plasmáticos y en un aumento en la variabilidad inter e intrasujeto.4 Esto ha llevado a que las compañías farmacéuticas evalúen dichas propiedades durante las etapas tempranas del desarrollo, caracterizando a los compuestos en paralelo con la investigación de su efecto farmacológico para de esta forma optimizar la selección de aquellos que presenten tanto propiedades biofarmacéuticas adecuadas como la mejor actividad biológica.5 Aunado a lo anterior, para lograr el diseño de una forma de dosificación apropiada es necesario conocer detalladamente las características del fármaco y su proceso de absorción.6 Algunos autores opinan que la absorción intestinal de un fármaco depende, principalmente, de factores tales como la solubilidad del mismo fármaco, de su proceso de disolución, de su permeabilidad a través de la mucosa intestinal y del tiempo de tránsito intestinal; aunque, cabe resaltar que cuando la disolución in vivo de una forma sólida de liberación inmediata es rápida en relación con el tránsito intestinal y el fármaco es de alta permeabilidad, tanto la velocidad y cantidad de fármaco absorbido raramente dependerá de la disolución del fármaco y/o del tiempo de tránsito gastrointestinal.7,8
Debido a esto, se ha propuesto que la evaluación de la absorción de un fármaco a través del tracto gastrointestinal se determine mediante el establecimiento de la permeabilidad de dicho compuesto a través de la pared gastrointestinal. Para este fin, no cabe duda que los estudios en animales y/o humanos son los más completos debido a que tienen la capacidad de evaluar la manera en que componentes fisiológicos, tales como los jugos gástricos y la bilis, pueden afectar las propiedades de disolución del fármaco, la precipitación del mismo en el sitio de absorción, la degradación química y/o bacteriana y su metabolismo en el lumen.9,10 Sin embargo, estos estudios conllevan también algunas desventajas importantes, como que por ejemplo, requieren de un conjunto grande de compuestos en etapa experimental, generalmente necesitan de una mayor infraestructura para su realización, lo que representa un mayor costo, además de que requieren el seguimiento de una serie de lineamientos y recomendaciones de tipo ético debido a que el objeto de estudio son organismos vivos.11
Por lo anterior, en los últimos años se han desarrollado una serie de técnicas que permiten modelar los procesos de absorción de fármacos de manera rápida y confiable. El objetivo del presente artículo es describir de forma general la morfología del epitelio intestinal, los mecanismos involucrados en el proceso de absorción de fármacos y de manera particular algunas técnicas que modelan los procesos de absorción de estos. Asimismo discutir algunas de las ventajas y desventajas de la aplicación de estos modelos.
El Epitelio Intestinal
El intestino delgado es la sección del sistema gastrointestinal que permite la absorción de nutrientes y que limita la absorción de xenobióticos, enzimas digestivas y bacterias. Está constituido por estructuras y células con características únicas que le confieren una morfología bastante compleja y especializada, sin embargo, toda esta estructura creada al interior del mismo tiene como objetivo ampliar el área disponible para que el proceso de absorción pueda llevarse a cabo de una manera sumamente eficaz.
La absorción de nutrientes y fármacos se lleva a cabo en la mucosa intestinal, la cual consta de tres capas: la mucosa muscularis, la lámina propia y la capa de células epiteliales.11 La mucosa muscularis se encuentra en la unión entre la mucosa y la submucosa. Es una lámina continua de músculo uniforme con un espesor de 3 a 10 células, compuesta de capas circulares internas y longitudinales externas. Por su parte, la lámina propia es el tejido conectivo dentro del villus que provee soporte estructural a la capa de células epiteliales, rodea a las criptas de Lieberkuhn y contiene numerosas células de defensa que interactúan con sustancias exteriores que llegan a esta capa desde el tracto gastrointestinal. A través de sus capilares, la lámina propia nutre a las células epiteliales y permite el transporte de las sustancias absorbidas hacia circulación sistémica. La capa de células epiteliales es una monocapa que contiene células madre que proliferan y migran a lo largo del eje cripta-villus, la cuales conforme migran reciben diferentes señales para diferenciarse generando así a diferentes tipos de células. Está constituida por células columnares, altamente polarizadas y con una membrana apical y una basolateral. La principal función de esta capa de células es la absorción. Su superficie apical se caracteriza por tener microvellosidades estrechamente empacadas de 0.5 a 1.0 μm de largo y 0.1 μm de ancho, con prolongaciones de las cadenas laterales de oligosacáridos de 0.5 a 2.0 μm, dependiendo de la especie (Figura 1).12 El espesor de la membrana apical es de 10 a 11 nm más largo que la mayoría de las membranas plasmáticas de eucariontes, tiene un alto coeficiente molar proteína-lípido y también una alta concentración de glicolípidos y colesterol. Por su parte, la membrana basolateral difiere de la apical tanto en su morfología, composición bioquímica y función, ya que mide unos 7 nm de ancho y contiene Na+-K+-ATPasa.7,13
Las células intestinales están unidas entre sí por complejos de unión intercelulares, miden de 0.1 a 0.6 μm y actúan como barrera de difusión. Se componen de uniones estrechas, intermedias y desmosomas, siendo las primeras los componentes más significativos de los complejos de unión al localizarse en el extremo apical de la membrana lateral de células adyacentes y eliminar el espacio intercelular. Entre las microvellosidades de las células absorbentes y el lumen existe una capa de agua sin agitación, que tiene un grosor que varía entre 30 y 100 μm. La capa de mucosa que se encuentra entre el lumen y la capa de células absorbentes contiene un gel de glicoproteína y un 90% de oligosacárido, siendo el pH de este microambiente de 5.2, el cual es independiente del pH luminal. Más cerca de las células se encuentra el glicocalix, en donde se encuentran glicoproteínas, enzimas digestivas y cadenas laterales de los oligosacáridos celulares.7,8,14
Mecanismos de Transporte de Fármacos a Nivel Intestinal
Una vez disueltas, las moléculas de fármaco que se encuentra en el lumen intestinal deben difundir hasta ponerse en contacto con la región apical de los enterocitos y posteriormente atravesar una serie de barreras para alcanzar la circulación sistémica.15 La primera de estas barreras es la membrana intestinal, siendo probablemente la más importante de ellas debido a que es una barrera permeable selectiva.
Cabe mencionar, que las fuerzas que dirigen a los diferentes compuestos desde la luz intestinal hasta ponerlos en contacto con la membrana intestinal son el gradiente de concentración, la diferencia de potencial eléctrico y los gradientes de presión hidrostática; aunque, cabe señalar que la resistencia y/o facilidad a la permeación a través de la mucosa intestinal se debe únicamente a barreras físicas y bioquímicas. La barrera física es el resultado de las uniones estrechas y del carácter lipídico de la membrana celular, siendo las uniones estrechas la principal barrera física que limita la absorción de los compuestos de interés farmacéutico debido a su pequeño tamaño de poro (de apenas 0.4-0.8 nm en humanos) y a que corresponde sólo al 0.01% del total del área superficial del intestino.13,16 Por su parte, el componente bioquímico de la barrera de mucosa consiste en enzimas metabolizadoras de fármacos y de transportadores, siendo la isoenzima CYP3A4 la que representa a cerca del 60% del total de las enzimas del citocromo encontradas en el intestino.7
Una vez que los fármacos llegan al lumen intestinal, pueden presentar varios de los siguientes procesos de transporte:3,7
Difusión pasiva.
Difusión transcelular (difusión simple).
Transporte paracelular (difusión vía uniones estrechas).
Transporte mediado por acarreadores (difusión facilitada).
Difusión activa.
Transporte activo mediado por acarreadores (con gasto de energía).
Transporte por vesículas (transocitosis que incluye a la pinocitosis).
Mecanismos de Eflujo (proteínas que expulsan a los fármacos).
La Figura 2 ilustra estos mecanismos de transporte y algunos subtipos de estos. En los casos donde se involucra la presencia de transportadores, las posibilidades de paso a través de la membrana pueden impactar la cantidad absorbida tanto de manera positiva (Figura 2C y 2D), como negativa (Figura 2H). A continuación se presenta una descripción más amplia de cada uno de estos mecanismos.
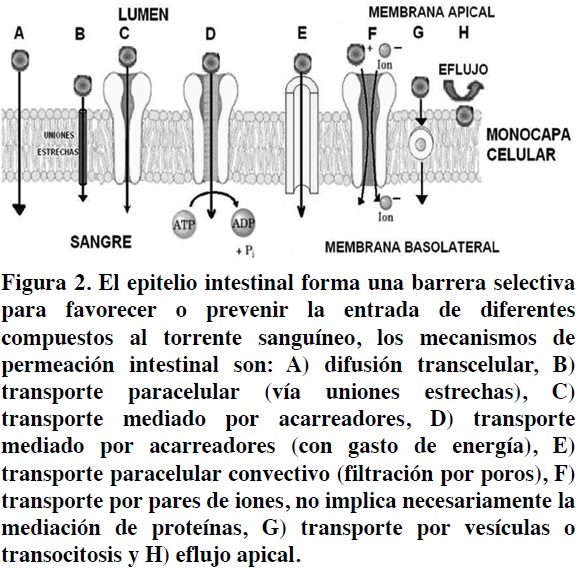
Difusión Pasiva
La difusión simple interviene en el paso de sustancias susceptibles de disolverse en los constituyentes de la membrana. El paso se realiza sin ningún gasto de energía y según un gradiente, que puede ser de mayor a menor concentración o electroquímico, hasta llegar a un estado de equilibrio entre los dos medios. El tiempo necesario para alcanzar el equilibrio entre una parte y otra de la membrana obedece a la ley de difusión de Fick:

siendo dm/Adt el flujo por unidad de área, Pm la constante de permeabilidad, y Ce y Ci, las concentraciones respectivas en los compartimentos exterior e interior. Es importante precisar que sólo la fracción libre del fármaco interviene en el gradiente de concentración.7
a) Difusión Transcelular
Representa la principal vía de transporte de los compuestos hidrofóbicos. Involucra el movimiento de las moléculas de soluto a través de la membrana apical, el citoplasma y la membrana basolateral.15 Normalmente, la difusión de moléculas pequeñas es un proceso rápido, por lo que la tasa de permeabilidad está determinada principalmente por la tasa de transporte a través de la membrana apical.17 Para que un fármaco sea transportado por esta vía se requiere que sea una molécula razonablemente lipofílica y de un tamaño moderado, sin embargo, numerosos estudios indican que la gran mayoría de los fármacos que presentan buena absorción utilizan predominantemente esta vía,18 considerándose actualmente que la tasa de transporte está determinada en gran medida por la capacidad del compuesto de formar puentes de hidrógeno, por su lipofilicidad, su tamaño y su carga.19
Cabe resaltar que la modalidad de transporte por pares de iones (Figura 2F) es un mecanismo propuesto para explicar el paso de ciertos compuestos muy fuertemente ionizados a través de la membrana, donde la formación de complejos neutros (pares de iones) con sustancias endógenas como la mucina, permiten la difusión del complejo neutro a través de la membrana.20
b) Transporte Paracelular
Constituye una vía de transporte extracelular a través del epitelio por medio de las uniones estrechas formadas entre las células. Los factores que intervienen en la difusión paracelular son el gradiente de potencial electroquímico (derivado de la diferencia en gradientes de concentración), el potencial eléctrico y la presión hidrostática.7 Se considera que la difusión paracelular es un proceso pasivo que se rige por la Ley de Fick,15 donde las moléculas hidrofílicas en su mayoría de bajo peso molecular (200 Da) pueden permear mediante este mecanismo, el cual cabe mencionar, tiene una tasa de transporte reducida; sin embargo, existe evidencia de que el diámetro de las uniones estrechas puede incrementarse mediante un proceso regulatorio celular. En este sentido, existen esfuerzos para incrementar la permeabilidad paracelular mediante la co-administración de agentes que modulen la apertura de las uniones estrechas.21,22,23
c) Transporte Mediado por Acarreadores (Difusión Facilitada)
La mucosa intestinal expresa un gran número de acarreadores o transportadores que son los responsables de la absorción de nutrientes y vitaminas. Estos tienen características de saturabilidad y especificidad comparables a las de un transportador activo, pero en este el transporte se realiza en sentido del gradiente de concentración y sin ningún gasto de energía. Quizás el ejemplo más conocido es el transportador de glucosa, el cual presenta un cambio de conformación después de que una molécula de glucosa se une a éste y se forma un poro por el cual entra la glucosa al citosol, para posteriormente recuperar su conformación original después de liberar a la glucosa en el interior de la célula.
Transporte Activo
El transporte activo necesita primordialmente energía, que puede ser cedida por medio de la hidrólisis de ATP u otra fuente de energía. A diferencia del proceso de difusión, en el transporte activo la velocidad de transporte no depende del gradiente de concentración.
a) Mediado por Acarreadores
Este mecanismo requiere de un transportador, que es una proteína de membrana capaz de formar un complejo con la molécula del fármaco, para así atravesar la membrana y posteriormente liberar al fármaco al otro lado de la membrana, a la vez que el transportador retoma su conformación original.24 Cabe mencionar que la función natural de estos transportadores es extraer del contenido luminal los nutrientes y otros compuestos esenciales para el organismo. Dentro de las características más notables de estas proteínas destacan su especificidad, capacidad de saturación y variabilidad de expresión regional.25 Algunos de los fármacos que son transportados por este mecanismo son los antibióticos β-lactámicos y los inhibidores de renina, los cuales se asemejan estructuralmente a los sustratos naturales de estas proteínas.26,27,28 Una de las proteínas trasportadoras más estudiadas es el transportador de oligopéptidos PepT1.29
b) Transporte por Vesículas (Transocitosis que incluye a la Pinocitosis)
Este tipo de transporte incluye a los procesos de endocitosis de fase fluida o pinocitosis (FPE), endocitosis mediada por receptores (RME) y transocitosis. En la FPE, las moléculas de soluto disueltas en el fluido luminal son incorporadas a las vesículas endocíticas originando invaginaciones que dan lugar a vesículas o pinosomas que migran a través de la célula hacia los endosomas, los cuales, subsecuentemente se fusionan con los lisosomas. Hoy se sabe que algunos péptidos y proteínas emplean esta vía de transporte.30 Por su parte, la RME involucra la unión de la macromolécula a un receptor de membrana y la unión subsecuente del complejo receptor-ligando dentro de sacos cubiertos de clatrina. Posteriormente, se presenta un proceso conocido como sorting en el cual los ligandos normalmente son destruidos por los lisosomas mientras que los receptores pueden ser destruidos o reciclados a la membrana celular.31 La transocitosis, por otro lado, ocurre cuando el ligando disuelto en la vesícula endocítica (posterior a la FPE o RME) atraviesa los lisosomas y es liberado a través de la membrana basolateral.32
c) Mecanismos de Eflujo
En contraste con los transportadores que promueven la absorción intestinal, existen otros transportadores conocidos como transportadores de eflujo que presentan el efecto contrario, es decir, se encargan de mediar la expulsión de compuestos del citoplasma celular hacia el lumen intestinal mediante un proceso llamado eflujo apical.7 Los mecanismos de eflujo intestinal se atribuyen regularmente a proteínas localizadas en la membrana apical pertenecientes a la familia ABC (ATP Binding Cassette), tales como la P-glicoproteína (Pgp) y a otras proteínas asociadas a la resistencia múltiple a fármacos conocidas como MRPs o MDRs (Multidrug Resistance Proteins y Multi Drug Resistance, respectivamente).15,25,33 La localización de los transportadores de eflujo en la membrana apical de enterocitos y colonocitos confiere al intestino la capacidad de limitar la absorción. Los transportadores de eflujo presentan baja selectividad y se consideran una limitante para la absorción de fármacos, por lo que el estudio de sus características y afinidades resulta de gran relevancia para la absorción de entidades terapéuticas.
Después de revisar los mecanismos involucrados en la absorción de fármacos, es claro entender que la absorción es un proceso muy complejo que involucra distintas alternativas para la absorción de los mismos. Así, los distintos modelos que simulan los diferentes mecanismos de transporte y las características de la barrera epitelial van desde propuestas sencillas hasta modelos de un alto grado de complejidad.
Modelos experimentales para estudiar la permeabilidad
La habilidad de un compuesto administrado oralmente para absorberse a través de la mucosa intestinal puede estar limitada por los componentes físicos y/o bioquímicos de la barrera epitelial, por lo que los modelos de permeabilidad in vitro no sólo deben predecir el potencial de absorción intestinal de un fármaco, sino también proporcionar información para comprender los mecanismos de absorción involucrados. Esto puede ser cumplido en la medida en que el modelo de permeabilidad incorpore la funcionalidad de los componentes físicos y bioquímicos de la barrera intestinal,7 ya que su grado de correlación con la absorción intestinal dependerá de la complejidad, costo y duración del ensayo.34
Los modelos de permeación pueden clasificarse en métodos in sílico, in vitro e in vivo, los cuales presentan diferente grado de correlación con la absorción intestinal. Cada modelo requiere diferentes herramientas y/o materiales para hacer su estimación de la absorción de fármacos, donde además del diferente grado de inversión, cada uno de estos tiene un grado de complejidad variable.15 La Tabla 1 hace un comparativo de las características de cada ensayo y su capacidad de modelar la absorción intestinal.
La absorción intestinal de un fármaco está controlada por la velocidad de disolución y solubilidad (determina qué tan rápido un fármaco alcanza una concentración máxima (C) en el fluido luminal), y el coeficiente de permeabilidad (el cual se relaciona con la velocidad a la cual el fármaco disuelto atravesará la pared intestinal (P) para alcanzar la circulación sanguínea portal).
Ambos factores, están incluidos en la primera ley de Fick aplicada a la absorción de fármacos.
Modelos Experimentales In Sílico
Las herramientas de caracterización farmacéutica in sílico tienen un impacto significativo en el descubrimiento de fármacos al ser utilizados como métodos complementarios para ensayos in vitro e in vivo,35 y son particularmente útiles para el diseño de bibliotecas combinatorias e investigaciones virtuales previas a la síntesis. Se han desarrollado numerosas herramientas in sílico para predecir propiedades como la solubilidad, permeabilidad, distribución en barrera hematoencefálica, eflujo, sistemas de transporte activo, metabolismo, toxicidad y propiedades farmacocinéticas.36 Los métodos computacionales buscan predecir la absorción intestinal basándose en la estructura química del fármaco involucrando desde aproximaciones de relaciones cuantitativas de estructura-actividad (QSAR, por sus siglas en inglés) relativamente simples, hasta el uso de modelos farmacocinéticos y/o farmacodinámicos fisiológicamente complejos.37,38 Para ser validados, estos métodos computacionales deben basarse en datos experimentales obtenidos para un amplio rango de compuestos estructuralmente diversos. Uno de los modelos más conocidos es el desarrollado por Lipinski y colaboradores,52 denominado ROF (Rule Of Five), que está basado en descriptores en 2 dimensiones. Modelos más sofisticados incluyen los de área de superficie polar y no polar (PSA y NPSA, de sus siglas en inglés) y paquetes de computo comerciales como QMPRplus, (Quantitative Molecular Permeability Relationships) Gastroplus e iDEA (In vitro Determination for the Estimation of ADME).39-42
Modelos Experimentales In Vitro
La aplicación exitosa de un modelo in vitro depende de en qué medida dicho modelo incorpore las características relevantes de la barrera biológica in vivo. A pesar de las dificultades obvias asociadas al tratar de reproducir in vitro todas las características de la mucosa intestinal, varios sistemas han sido desarrollados para imitar, a diferentes niveles, las propiedades de barrera relevantes de la mucosa intestinal.43 Estos sistemas incluyen:
1) Métodos fisicoquímicos.
2) Métodos con membranas artificiales.
3) Métodos empleando líneas celulares.
4) Tejidos extraídos.
5) Enterocitos aislados.
Estos modelos son de particular utilidad cuando la absorción limita la biodisponibilidad y cuando la permeabilidad limita la absorción del fármaco.44
1) Métodos Fisicoquímicos
La aproximación fisicoquímica mejor conocida para predecir la permeación a través de membranas es la determinación de la lipofilicidad determinando el logaritmo del coeficiente de partición entre octanol y agua (logPo/w). Si bien las relaciones entre los valores de logPo/w y la absorción intestinal de fármacos están bien establecidos, esta aproximación se ha vuelto controversial dadas las diferencias entre los coeficientes de partición octanol/agua y membrana/agua,45,46,47 de forma tal que se han desarrollado modelos fisicoquímicos más complejos para estudiar la absorción de fármacos, entre ellos, las membranas artificiales inmovilizadas y en paralelo.
2) Métodos con Membranas Artificiales
La principal ventaja de utilizar membranas artificiales es su reproducibilidad, mientras que entre sus principales desventajas están la ausencia de enzimas y de transportadores; además de que en su mayoría estos métodos no están conformados como bicapas lipídicas. A pesar de sus desventajas, las membranas artificiales resultan de gran utilidad en el estudio de las relaciones existentes entre la estructura química de los fármacos y su lipofilicidad, debido a su rapidez y bajo costo.48
Membranas Artificiales Inmovilizadas (MAI)
Las MAI están constituidas por columnas cromatográficas de fase reversa en las cuales la cubierta hidrocarbonada del soporte sólido es reemplazada por lípidos para imitar el ambiente lipídico de la membrana celular. El método se fundamenta en la premisa de que la permeación de solutos a través de la membrana celular es dependiente de su partición en las capas lipídicas.49 Una de las principales ventajas de esta técnica es que, a diferencia de los ensayos de permeabilidad con cultivos celulares, éste permite la realización de ensayos múltiples simultáneos y debido a que se elimina el uso de sistemas biológicos hace que los tiempos de ensayo sean más cortos,50 además de que ha mostrado una buena correlación con los valores observados con las monocapas de células Caco-2. La principal desventaja de esta técnica consiste en que no considera el papel del transporte paracelular, el mediado por acarreadores, el metabolismo y los transportadores de eflujo.7,51
Ensayo de Permeación con Membranas Artificiales en Paralelo (PAMPA)
Éste es uno de los modelos de membranas artificiales más utilizados debido a que ha reportado una buena correlación entre el porcentaje de transporte y la fracción absorbida en humanos para una serie de compuestos seleccionados.52,53
Desde su introducción en 1998 por Kansy et al, este sistema ha atraído considerablemente la atención en el área farmacéutica debido a que puede proveer rápidamente de información sobre la permeabilidad de fármacos cuya vía de absorción sea por transporte pasivo (Figura 3).54 Este sistema es completamente artificial, sin poros ni sistemas de transporte activo, y presenta la ventaja sobre las MAI al no requerir cuantificar a los fármacos por CLAR (Cromatografía Líquida de Alta Resolución). Sin embargo, éste al igual que las anteriores no contempla las condiciones del metabolismo y otros mecanismos de transporte tales como el eflujo y el transporte paracelular.55,56 Algunos de los factores a considerar al momento de implementar este modelo son que el análisis e interpretación de los resultados debe hacerse de manera cuidadosa, se debe plantear correctamente la estrategia para utilizar, implementar e integrar las condiciones de análisis más óptimas.57 A pesar de esto, su simplicidad, costo, y amplio rango de pH de trabajo, ha hecho a este modelo atractivo para su implementación rutinaria en el descubrimiento de fármacos,58 por lo que se ha buscado mejorar continuamente la correlación de éste con los valores obtenidos en modelos celulares e in vivo.59

3) Modelos empleando Líneas Celulares
Una de las principales ventajas de los cultivos celulares es que cuando se cultivan en forma de monocapas presentan un comportamiento polarizado que permite simular las condiciones del intestino. La mayoría de estos modelos intestinales se obtienen de líneas de células inmortalizadas que derivan de células normales y de tumores inducidos de cáncer de colon humano. Estas últimas son muy utilizadas porque se diferencian y rápidamente forman monocapas confluentes y polarizadas.60,61 Una desventaja que presentan estos modelos es la heterogeneidad de las líneas celulares utilizadas, así como también las diferentes metodologías utilizadas para realizar las determinaciones, lo cual ha llevado a que un mismo fármaco presente diferentes valores de permeabilidad.62
Líneas celulares MDCK (Madin Darby Canine Kidney)
Esta es una de las líneas más estudiadas en cuanto a su genética, composición lipídica, expresión de proteínas y otros parámetros; siendo utilizada en los últimos años en estudios de transporte de moléculas.63 Esta línea celular establecida en los años 50 presenta dos subclones: MDCK tipo I y tipo II.64 Para los estudios de transporte se utilizan las tipo II, que al cultivarse en condiciones adecuadas, alcanzan confluencia en dos días y llegan a una fase estacionaria de crecimiento después de siete días. Bajo condiciones estándar de cultivo forman monocapas polarizadas y desarrollan uniones estrechas similares a las intestinales.65 A su vez, presenta numerosas ventajas sobre los cultivos de células Caco-2, entre ellas, menores tiempos de cultivo, gran homogeneidad morfológica y resistencia eléctrica transepitelial (TEER) parecida a la del intestino delgado (≈ 200-300 Ω/cm2).66 Diversos estudios han demostrado una buena correlación entre los coeficientes de permeabilidad en células MDCK y Caco-2.67,68 Los coeficientes de permeabilidad de compuestos hidrofílicos son usualmente menores en las líneas celulares Caco-2 que en células MDCK, lo cual es consistente con el hecho de que la TEER de las Caco-2 es mayor que el de las MDCK. El origen canino de esta línea celular es considerado como una desventaja, además de que la expresión de sus transportadores intestinales no está totalmente caracterizada. Aun así, actualmente se siguen desarrollando métodos para mejorar la correlación de los resultados obtenidos con este modelo con los obtenidos in vivo.69
Líneas celulares Caco-2
Las células Caco-2 son una línea celular de adenocarcinoma de colon humano que ha sido utilizada ampliamente para predecir la absorción intestinal de potenciales candidatos a fármacos.70 Este modelo presenta características semejantes a las de intestino humano (uniones estrechas y microvillus), expresa enzimas intestinales (aminopeptidasas, estearasas, sulfatasas, y citocromo P450), y transportadores (de ácidos biliares, de aminoácidos, de biotina, de ácidos monocarboxílicos, PEPT1 y Pgp), simulando de manera muy completa los dos tipos de barreras para la absorción de fármacos: la bioquímica y la fisicoquímica (Figura 4).
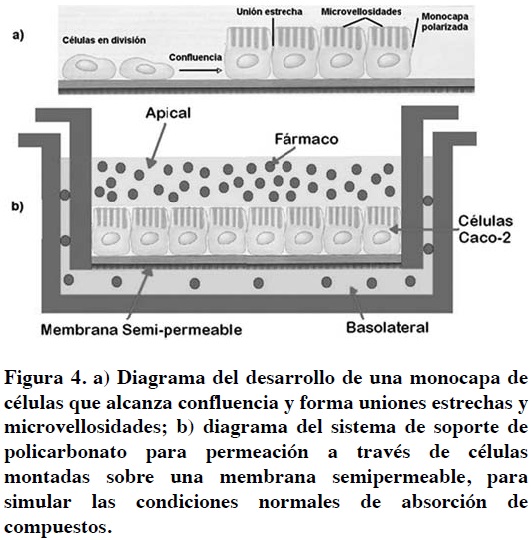
Esta línea celular tiene la ventaja de que puede cultivarse sobre un soporte poroso o un filtro en el que se forma la monocapa celular polarizada en sólo unos días y se diferencia en células intestinales de morfología típica, que incluye la expresión de enzimas y la formación de uniones estrechas. Esta línea ha reportado una alta correlación con la absorción de fármacos en humanos (biodisponibilidad, absorción, efecto farmacológico),71 por lo que su empleo se ha generalizado. Cabe mencionar que la heterogeneidad de las células Caco-2 y las diferentes condiciones de cultivo utilizadas en cada laboratorio ha dado lugar a la selección de diferentes poblaciones celulares que se conocen como tendencia fenotípica, lo cual puede ser la causa de la gran variabilidad de resultados obtenidos por diferentes laboratorios.
Normalmente, las células se cultivan sobre un soporte de policarbonato. Crecen hasta una fase estacionaria después de 10 días de cultivo y generalmente, los estudios de transporte se llevan a cabo después de 21 días, cuando la expresión de transportadores y enzimas alcanza su máximo.72
Hoy en día existen nuevos protocolos que permiten alcanzar la diferenciación de las células en un periodo de tiempo menor y en condiciones que facilitan su crecimiento. Asimismo se ha buscado optimizar la correlación con los resultados in vivo, al cultivarlos en combinación con otras líneas celulares.73,74
Resulta importante resaltar que los cultivos con líneas Caco-2 presentan algunas limitaciones que deben considerarse al momento de llevar a cabo los estudios. Dichas limitaciones se resumen en la Tabla 2.75 Se han realizado estudios para tratar de mostrar la correlación entre los estudios de permeación en células Caco-2 con estudios de absorción en ratas y de permeación en humanos,76,77 observándose una buena correlación para la mayoría de los fármacos, siendo menor la correlación para los fármacos transportados mayormente por vía activa. Esto se puede explicar por el nivel variable de transportadores existente en los diferentes modelos.
Otras líneas celulares
Hasta el momento, las líneas celulares más estudiadas, modificadas y utilizadas son las MDCK y las Caco-2, sin embargo, se han desarrollado y estudiado otras líneas celulares con el fin de contar con más opciones para la determinación de la permeabilidad. Una de ellas, recientemente estudiada, ha sido la línea NCI-N87, que también deriva de células carcinogénicas humanas, y que ha sido propuesto recientemente como modelo para determinar la permeabilidad debido a los buenos resultados obtenidos.78 A su vez, se han estudiado otras líneas celulares, como la 2/4/A1 (cuya permeabilidad paracelular es equiparable a la que muestra el epitelio intestinal in vivo mostrando una buena correlación con los datos de permeabilidad paracelular in vivo), las líneas HT29, T84 e IEC-18; sin embargo, el uso de éstas en la investigación no se encuentra muy generalizado.79
4) Tejidos extraídos
Los tejidos intestinales extraídos se han utilizado frecuentemente para estudiar la absorción intestinal de nutrientes y fármacos. En este sistema se aplica por un lado del tejido (mucosa o serosa) una solución que contiene al fármaco. La tasa de absorción de fármaco se determina ya sea midiendo la cantidad desaparecida de fármaco de la solución donadora o la aparición del mismo en el lado opuesto. Aunque varían en complejidad y versatilidad, estas preparaciones de tejido comparten dos ventajas importantes: la integridad del tejido y la habilidad para determinar la absorción a través de diferentes segmentos intestinales. Una desventaja en común es la viabilidad limitada de este tipo de preparaciones.7
Perfusión en segmentos de intestino
Esta metodología consiste en perfundir regiones específicas a lo largo del tracto intestinal, para lo cual se han desarrollado diferentes aproximaciones.80
En este sistema se calcula la permeabilidad al cuantificar la desaparición del compuesto del lumen intestinal donde, por lo general, se asume que el fármaco desaparecido es igual al fármaco absorbido.15 Esta consideración es válida cuando la captación apical del fármaco es el paso limitante en la absorción del mismo, pero si se tiene en consideración que la absorción del fármaco no es el único factor responsable de su desaparición esta consideración podría ser engañosa.
A diferencia de los animales completos, los intestinos perfundidos pueden usarse para estudiar diferencias segmentales en la absorción y metabolismo sin la interferencia de factores fisiológicos como el vaciamiento gástrico, el área superficial del segmento y/o el tiempo de tránsito intestinal. En general, esta técnica ofrece ventajas sobre los organismos completos mas no sobre sistemas in vitro. Algunas de sus desventajas son que requiere grandes cantidades del compuesto y que la determinación de la absorción basada en la desaparición luminar es, como se mencionó anteriormente, potencialmente engañosa, además de que el número de segmentos intestinales que pueden obtenerse de un animal es limitado, sin embargo, tiene un gran valor para la elucidación de mecanismos de transporte y para evaluar la absorción de fármacos cuya baja solubilidad requiere del uso de vehículos complejos que no podrían ser presentados en otros sistemas in vitro.7 Cabe resaltar que éste es el modelo que ofrece la forma más directa de medir la permeabilidad intestinal en humanos.80
Intestino invertido
Ésta fue una de las primeras técnicas in vitro utilizadas para estudiar la absorción intestinal de fármacos.81 Este modelo incluye a la mucosa y a las capas musculares subyacentes donde la presencia de la capa muscular puede inducir la acumulación de fármaco y, en dado caso, dar lugar a una recuperación pobre del mismo. Esta técnica fue muy popular hace algunas décadas, sin embargo, su uso en años recientes se ha reducido en gran medida debido a las complicaciones que presenta en cuanto a la viabilidad de los tejidos por tiempos prolongados y a la poca reproducibilidad que se puede presentar, aun así, todavía se puede observar su implementación en estudios para determinar la absorción de fármacos.7,9,82
5) Enterocitos aislados
Estas células se preparan cortando un segmento de intestino y tratando su superficie de mucosa con enzimas, agentes quelantes y/o mecánicos, con el fin de disociar las células de los tejidos subyacentes. Esta técnica no es usada comúnmente porque su utilidad es limitada, el proceso de aislamiento de las células destruye a muchas de éstas y disminuye en gran medida su viabilidad.83 Asimismo, al utilizarse en suspensión los enterocitos carecen de la polaridad que caracteriza a las células de la mucosa intestinal in vivo. Estas células pueden ser usadas para estudiar la captación del fármaco pero no el transporte transepitelial o la polarización del transporte.7
Estudios in vivo
En general, se cree que la absorción de fármacos en animales es un buen predictor de la absorción en humanos, debido a que integran todos los factores biológicos que pueden afectar su absorción. Mientras que en los sistemas in vitro se debe establecer una correlación con datos in vivo, este paso no es necesario cuando se usan animales. Una ventaja importante del empleo de animales es que las especies utilizadas en los estudios de absorción pueden utilizarse en las evaluaciones toxicológicas y farmacológicas, además de que pueden emplearse para evaluar formulaciones complejas que serían muy difíciles de evaluar in vitro. Algunas de las desventajas de estos estudios incluyen la necesidad de cantidades relativamente grandes de material, la complejidad de los métodos analíticos necesarios para el análisis de plasma, el consumo de tiempo, el intenso trabajo que se requiere para los experimentos y el hecho de que proveen poca información acerca de los mecanismos de absorción del fármaco.7
Los tiempos de vaciamiento gástrico son diferentes entre especies (en promedio en el humano, perro, conejo y rata son: 60, 40-50, 30 y 10 min, respectivamente). Si un fármaco es absorbido principalmente en el intestino, este llegará a la sangre más rápido en la rata que en el humano, como resultado del vaciamiento gástrico, lo que favorece su absorción. Asimismo, el pH del tracto gastrointestinal puede ser diferente entre especies. Las ratas y el humano son buenos secretores de ácido, sin embargo el perro y gato secretan menores cantidades. Si la solubilidad del fármaco es pH dependiente, las diferencias en la solubilidad y velocidad con la que ocurra el proceso entre especies, modificara su absorción.
El uso de ratas, debido a su amplio uso en los estudios farmacológicos y toxicológicos, ha llevado a que actualmente existan amplias bases de datos que pueden ser útiles para realizar predicciones. Los ratones modificados genéticamente para generar órganos humanizados resultan muy atractivos para los estudios tanto farmacológicos como farmacocinéticos.84
Estrategia de evaluación de fármacos
El reciente desarrollo de las membranas en paralelo ha proveído de un método simple, de bajo costo y de amplia selectividad para evaluar la permeabilidad. Este sistema en conjunto con los ensayos de permeabilidad en líneas celulares permite el diagnóstico a fondo de las causas de la baja absorción de un fármaco. Actualmente, existe una tendencia en la industria a usar membranas en paralelo como primera estrategia de investigación de permeabilidad y usar las líneas celulares como ensayos secundarios para estudios mecanísticos y con propósitos de diagnóstico.35
El empleo de los ensayos de permeabilidad en membranas artificiales y de líneas celulares puede llevarse a cabo durante todas las etapas de desarrollo de un nuevo medicamento, ya que ambas técnicas proporcionan información relevante sobre la permeación y juntas proporcionan información mecanística.
Además, la estrategia de emplear de manera conjunta los resultados de estudios de permeabilidad con PAMPA y con células Caco-2, permite una estimación temprana de los principales mecanismos de absorción predominantes para una molécula candidata a fármaco (Figura 5). Cabe señalar que PAMPA y Caco-2 no deben ser considerados como métodos de permeabilidad competitivos, ya que las características de las PAMPA: rapidez, bajo costo y estudios de permeabilidad sencillos (difusión pasiva), son de gran valor en el descubrimiento de fármacos; mientras que las características de las células Caco-2, con mayor detalle de los mecanismos de permeabilidad, funcionan mejor para estudios de mayor profundidad. Una buena correlación entre PAMPA y Caco-2 indica un predominio de la difusión pasiva durante la permeación, mientras que la falta de correlación indica efectos significativos en la absorción (transporte activo, paracelular, efectos de gradiente, etc.) o en la excreción (eflujo, efectos de gradiente, metabolismo).35

Perspectivas en el desarrollo de nuevos fármacos
Por varios años, la estrategia de la industria farmacéutica para el proceso de descubrimiento de un nuevo fármaco ha consistido en hacer, lo más pronto posible, predicciones acerca de las propiedades relacionadas con la ADME. Se ha propuesto que dichas propiedades puedan ser precedidas por un tamizado farmacológico,85 sin embargo, para alcanzar dicha meta, se requiere de un sistema que prediga dichas propiedades ADME con un alto nivel de confianza, ya sea por la utilización de métodos in sílico, estudios en PAMPA y/o en líneas celulares.
Las decisiones sobre el potencial de absorción de los nuevos candidatos a fármacos deberán estar basadas en varios sistemas en paralelo de alto desempeño que evalúen cada mecanismo de absorción o en un sistema sofisticado que incorpore a cada mecanismo de absorción. En este último caso, el mayor desafío es obtener una alta eficiencia y desempeño.
Los "modelos tradicionales" para la evaluación del potencial de absorción, tales como los estudios en animales y estudios in situ de perfusión intestinal continuarán siendo herramientas invaluables debido a que han demostrado resultados confiables en la predicción de la absorción intestinal en humanos. A su vez, la estandarización de los modelos de absorción es deseable para poder generar bases de datos de absorción, las cuales puedan ser compartidas entre grupos de investigación para continuar así con el desarrollo de modelos de absorción de alto desempeño.86
Conclusiones
Internacionalmente, se ha establecido la importancia de determinar el grado de solubilidad y permeación de fármacos como un elemento primordial para establecer su clasificación y con esto, evidenciar una técnica alternativa para valorar la intercambiabilidad de los medicamentos.87,88
A partir de los modelos de absorción presentados a lo largo de este trabajo, se puede determinar la permeabilidad de un fármaco considerando que dichos modelos presenten un alto grado de aproximación al fenómeno de absorción. La inclusión sistematizada de los estudios de permeabilidad como modelos de la absorción en el desarrollo de medicamentos representaría un aporte para la eficacia, seguridad y desempeño de los productos farmacéuticos que se comercializan o se quieran comercializar en el país. De la misma manera, la implementación de este tipo de pruebas podría repercutir en la sustitución de algunos estudios de bioequivalencia, tal como sucede en otros países como Estados Unidos y Europa, haciendo el registro legal de algunos productos más rápido y menos costoso.87,88,89
Agradecimientos
Juan M. Martínez Alejo agradece el apoyo CONACYT para realizar sus estudios de doctorado. Los investigadores agradecen el apoyo a través del proyecto CB-2007-83440.
Referencias
1. Wilson C, Washington N, Washington C. Cell membranes, epithelial barriers and drug absorption. En: Physiological Pharmaceutics. New York: CRC Press; 2001. pp. 1-18. [ Links ]
2. Dahan A, Miller J, Amidon G. Prediction of solubility and permeability class membership: provisional BCS classification of the world's top oral drugs. AAPS J. 2009; 11(4):740-746. [ Links ]
3. Lipper R. How can we optimize selection of drug development candidates from many compounds at the discovery stage? Mod Drug Disc. 1999; 2:55-60. [ Links ]
4. Venkatesh S, Lipper R. Role of the development scientist in compound lead selection and optimization. J Pharm Sci. 2000; 89:145-1544. [ Links ]
5. Kerns E. High throughput physicochemical profiling for drug discovery. J Pharm Sci. 2001; 90:1838-1858. [ Links ]
6. Aungst B. Intestinal permeation enhancers. J Pharm Sci. 2000; 89:429-442. [ Links ]
7. Hidalgo I. Assessing the absorption of new pharmaceuticals. Curr Top Med Chem. 2001; 1:385-401. [ Links ]
8. Dressman J, Lennernäs H, editores. Oral drug absorption: prediction and assesment. Serie: Drugs and pharmaceuticals sciences. In vitro methods for assesment permeability. New York: Marcel Dekker; 1997. [ Links ]
9. Yang Z, Manitpisitkul P, Sawchuk R. In situ studies of regional absorption of lobucavir and ganciclovir from rabbit intestine and predictions of dose-limited absorption and associated variability in humans. J Pharm Sci. 2006; 95(10):2276-2292. [ Links ]
10. Lennernäs H. Human instestinal permeability. J Pharm Sci. 1998; 87(4):403-410. [ Links ]
11. Joyce N, Haire M, Palade G. Morphological and biochemical evidence for a contractile cell network within the rat intestinal mucosa. Gastro. 1987; 92:68-81. [ Links ]
12. Avdeef A. Absorption and drug development: solubility, permeability, and charge State. 1a Ed. New Jersey: Wiley-Interscience; 2003, p. 17. [ Links ]
13. Madara J, Pappenheimer J. Structural basis for physiological regulation of paracellular pathways in intestinal epithelia. J Membr Biol. 1987; 100:149-164. [ Links ]
14. McCracken V, Lorenz R. The gastrointestinal ecosystem: a precarious alliance among epithelium, immunity and microbiota. Cell Microbiol. 2001; 3(1):1-11. [ Links ]
15. Stenberg P, Bergstrôm C, Luthman K, Artursson P. Theoretical predictions of drug absorption in drug discovery and development. Clin Pharmacokinet. 2002; 41(11):877-899. [ Links ]
16. Pappenheimer J, Reiss K. Contribution of solvent drag through intercellular junctions to absorption of nutrients by the small intestine of the rat. J Membr Biol. 1987; 100:123-136. [ Links ]
17. Murashini S. Absorption enhancers. Crit Rev Ther Drug Carrier Syst. 1990; 7:1-33. [ Links ]
18. Stenberg P, Luthman K, Artursson P. Virtual screening of intestinal drug permeability. J Contr Rel. 2000; 65:231-43. [ Links ]
19. Krâmer S. Absorption prediction from physicochemical parameters. Pharmaceut Sci Tech Today. 1999; 2:373-80. [ Links ]
20. Field M. Intestinal ion transport and the pathophysiology of diarrhea. J Clin Invest. 2003; 7:931-943. [ Links ]
21. Ward P, Tippin T, Thakker D. Enhancing paracellular permeability by modulating epithelial tight junctions. Pharm Sci Technol To. 2000; 3(10):346-358. [ Links ]
22. Ahrne S, Johansson M. Effect of lactobacilli on paracellular permeability in the gut. Nutrients. 2011; 3(1):104-117. [ Links ]
23. Hanson P, Moran A, Butler K. Paracellular permeability is increased by basal lipopolysaccharide in a primary culture of colonic epithelial cells; an effect prevented by an activator of Toll-like receptor-2. Innate Inmun. 2011; 17(3):269-282. [ Links ]
24. Cao X, Yu L, Sun D. Drug absorption principles. En: Krishna R, Yu L, editores, Biopharmaceutics applications in drug development. New York: Springer; 2008. pp. 75-100. [ Links ]
25. Carl S, Herrera-Ruiz D, Bhardwaj R, Gudmundsson O, Knipp G. Mammalian oligopeptide transporters. En: You G, Morris ME, editores. Drug transporters. 1st ed. New Jersey: John Wiley and Sons; 2007. pp.105-146. [ Links ]
26. Humphrey M, Ringrose P. Peptides and related drugs. A review of their absorption, metabolism, and excretion. Drug Metab Rev. 1986; 17:283-310. [ Links ]
27. Hu M, Amidon G. Passive and carrier-mediated intestinal absorption components of captopril. J Pharm Sci. 1998; 77:1007-1011. [ Links ]
28. Kramer W, Girbig F, Gutjahr U, Kleemann H, Leipe I, Urbach H, Wagner A. Interaction of rennin inhibitors with the intestinal uptake system for oligopeptides and beta-lactam antibiotics. Biochim Biophys Acta. 1990; 1027:25-30. [ Links ]
29. Herrera-Ruiz D, Knipp G. Current perspectives on established and putative mammalian oligopeptide transporters. J Pharm Sci. 2003; 92(4):691-714. [ Links ]
30. Clark S. The ingestion of proteins and colloidal materials by columnar absorptive cells of the small intestine in suckling rats and mice. J Biophys Biochem Cytol. 1959; 5:41-50. [ Links ]
31. Rodewald R, Kraehenbuhl J. Receptor-mediated endocytosis of IgG. J Cell Bio. 1984; 99:159S-164S. [ Links ]
32. Mostov K, Simister N. Transcytosis. Cell, 1985; 43:389-390. [ Links ]
33. Lauretta M, Simon L, Barry H. The ABCs of drug transport in intestine and liver: efflux proteins limiting drug absorption and bioavailability. Eur J Pharm Sci. 2004; 21:25-51. [ Links ]
34. Castella M, Reist M, Mayer J, turban J, Testa B, Boursier C, Walther B, Delbos J, Carrupt P. Development of an in vitro rat intestine segmental perfusion model to investigate permeability and predict oral fraction absorbed. Pharm Res. 2006; 23(7):1543-1553. [ Links ]
35. Di L, Kerns E. Profiling drug-like properties in discovery research. Curr Opin Chem Biol. 2003; 7:402-408. [ Links ]
36. Clark D. Computational methods for the prediction of ADME and toxicity. Adv Drug Deliv Rev. 2002; 54:253-254. [ Links ]
37. Mudra D, Jin J, Borchardt R. Absorption barriers in the rat intestinal mucosa: 2. Application of physiologically based mathematical models to quantify mechanisms of drug permeation and metabolism. J Pharm Sci. 2010; 99(2):999-1015. [ Links ]
38. Poulin P, Jones R, Jones H, Gibson C, Rowland M, Chien J, Ring B, Adkison K, Ku M, He H, Vuppugalla R, Marathe P, Fischer V, Dutta S, Sinha V, Björnsson T, Lavé T, Yates J. PHRMA CPCDC initiative on predictive models of human pharmacokinetics, part 5: prediction of plasma concentration-time profiles in human by using the physiologically-based pharmacokinetic modeling approach. J Pharm Sci. 2011. DOI 10.1002/jps.22550. [ Links ]
39. Bohets H, Annaert P, Mannens G, Van-Beijsterveldt L, Anciaux K, Verboven P, Meuldermans W, Lavrijsen K. Strategies for absorption screening in drug discovery and development. Curr Top Med Chem. 2001; 1:367-383. [ Links ]
40. Parrott N, Lave T. Applications of physiologically based absorption models in drug discovery and development. Mol Pharm. 2008; 5(5):760-775. [ Links ]
41. Heikkinen A, Korjamo T, Mönkkönen J. Modelling of drug disposition kinetics in in vitro intestinal absorption cell models. Basic Clin Pharmacol. 2009; 106:180-188. [ Links ]
42. Rowland M, Peck C, Tucker G. Physiologically-based pharmacokinetics in drug development and regulatory science. Annu Rev Pharmacol toxicol. 2011; 51:45-73. [ Links ]
43. Volpe D. Application of method suitability for drug permeability classification. AAPS J. 2010; 12(4):670-678. [ Links ]
44. Stewart B, Chan O, Lu H, Reyner E, Schmid H, Hamilton H, Steinbaugh B, Taylor M. Comparison of Intestinal Permeabilities Determined in Multiple in vitro and in situ Models: Relationship to Absorption in Humans. Pharm Res. 1995; 12(5):693-699. [ Links ]
45. Austin R, Barton P, Davis A, Fessey R, Wenlock M. Partitioning of ionizing molecules between aqueous buffers and phospholipids vesicle. J Pharm Sci. 1995; 84:1180-1183. [ Links ]
46. Herbette L, Rhodes D, Mason R. New approaches to drug design and delivery based on drug-membrane interactions. Drug Des Del. 1991; 7:75-118. [ Links ]
47. Mason R, Rhodes D, Herbette L. Reevaluating equilibrium and kinetic binding parameters from lipophilic drugs based on a structural model for drug interaction with biological membranes. J Med Chem. 1991; 34:869-877. [ Links ]
48. Luciani D, Nguyen L, Yazdanian M. Is PAMPA a useful tool for discovery? J Pharm Sci. 2007; 96(11):2886-2892. [ Links ]
49. Kansy M, Senner F, Gubernator K. Physicochemical high throughput screening: Parallel artificial membrane permeability assay in the description of passive absorption processes. J Med Chem. 1998; 41:1007-1010. [ Links ]
50. Avdeef A, Strafford M, Block E, Balogh M, Chambliss W, Khan I. Drug absorption in vitro model: filter-immobilized artificial membranes 2. Studies of the permeability properties of lactones in Piper methysticum forst. Eur J Pharm Sci. 2001; 14: 271-280. [ Links ]
51. Aungst B, Nguyen N, Bulgarelli J, Oates-Lenz K. The influence of donor and reservoir additives on Caco-2 permeability and secretory transport of HIV protease inhibitors and other lipophilic compounds. Pharm Res. 2000; 17:1175-1180. [ Links ]
52. Lipinski C, Lombardo F, Dominy B, Feeney P. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv Drug Deliv Rev. 2001; 46:3-26. [ Links ]
53. Hwang K, Martin N, Jiang L, Zhu C. Permeation prediction of M100240 using the parallel artificial membrane permeability assay. J Pharm Pharm Sci. 2003; 6(3):315-320. [ Links ]
54. Kansy M, Senner F, Gubernator K. Physicochemical high throughput screening: Parallel artificial membrane permeability assay in the description of passive absorption processes. J Med Chem. 1998; 41:1007-1010. [ Links ]
55. Thompson M, Krull U, Worsfold P. The structure and electrochemical properties of a polymer-supported lipid biosensor. Anal Chim Acta. 1980; 117:133-145. [ Links ]
56. Thompson M, Lennox R, McClelland R. Structure and electrochemical properties of microfiltration filter-lipid membrane systems. Anal Chem. 1982; 54:76-81. [ Links ]
57. Avdeef A, Bendels S, Di L, Faller B, Kansky M, Sugano K, Yamauchi Y. PAMPA-critical factors for better predictions of absorption. J Pharm Sci. 2007; 96(11):2893-2909. [ Links ]
58. Hwang K, Martin N, Jiang L, Zhu C. Permeation prediction of M100240 using the parallel artificial membrane permeability assay. J Pharm Pharm Sci. 2003; 6(3):315-320. [ Links ]
59. Chen X, Murawski A, Patel K, Crespi C, Balimane P. A novel design of artificial membrane for improving the PAMPA model. Pharm Res. 2008; 25(7):1511-1520. [ Links ]
60. Burton P, Toodwin T. Solubility and permeability measurement and applications in drug discovery. Comb Chem High T Scr. 2010; 13:101-111. [ Links ]
61. Avdeef A, Tam K. How well can the Caco-2/Madin-Darby Canine Kidney models predict effective human jejunal permeability? J Med Chem. 2010; 53:3566-3584. [ Links ]
62. Volpe D. Variability in Caco-2 and MDCK cell-based intestinal permeability assays. J Pharm Sci. 2008; 97(2):712-725. [ Links ]
63. Irvine J, Takahashi I, Lockhart K, Cheong J, Tolan J, Selick H, Grove J. MDCK cells: a tool for membrane permeability screening. J Pharm Sci. 1999; 88:28-33. [ Links ]
64. Braun A et. al. Cell cultures as tools in biopharmacy. Eur J Pharm Sci. 2000; 2:S51-S60. [ Links ]
65. Taub M, Kritensen L, Frokjaer S. Optimized conditions for MDCK permeability and turbidimetric solubility studies using compounds representative of BCS classes I-IV. Eur J Pharm Sci. 2002; 15:331-40. [ Links ]
66. Richardson J, Scalera V, Simmons N. Identification of two strains of MDCK cells which resemble separate nephron tubule segments. Biochim Biophys Acta, 1981; 673: 26-36. [ Links ]
67. Kim D, Burton P, Bochardt R. A correlation between the permeability characteristics of a series of peptides using an in vitro cell culture model (Caco-2) and those using an in situ perfused rat ileum model of the intestinal mucosa. Pharm Res. 1993; 10:1710-1714. [ Links ]
68. Hidalgo I, Grass G, Hillgreen K, Borchardt R. A new side-by-side diffusion cell for studying transport across epithelial cell monolayers. In Vitro Cell Dev B. 1992; 28A:578-580. [ Links ]
69. Di L, Whitney C, Umland J, Zhang H, zhan X, Gebhard D, Lai Y, Federico J, Davidson R, Smith R, Reyner E, Lee C, Feng B, Rotter C, Varma M, Kempshall S, Fenner K, El-Kattan a, Liston T, Troutman M. Development of a new permeability assay using low-efflux MDCKII cells. J Pharm Sci. 2011; doi:10.1002/jps.22674. [ Links ]
70. Hilgers A, Corandi A, Burton P, Caco-2 cell monolayers as a model for drug transport across intestinal mucosa. Pharm Res. 1990; 7:902-910. [ Links ]
71.Stewart B, Chan O, Lu R, Reyner E, Schmid H, Hamilton H, Steinbauch B, Taylor M. Comparison of intestinal permeabilities determined in multiple in vitro and in situ models: relationship to absorption in humans. Pharm Res. 1995; 12:693-699. [ Links ]
72. Anderle P, Niederer E, Rubas W, Hilgendorf C, Spahn-Langguth H, Wunderli-Allenspach H, Merkle H, Langguth P. P-Glycoprotein (P-gp) mediated efflux in Caco-2 cell monolayers: the influence of culturing conditions and drug exposure on P-gp expression levels. J Pharm Sci. 1998; 87:757-762. [ Links ]
73. Skolnik S, Lin X, Wang J, Chen X, He T, Zhang B. towards prediction of in vivo intestinal absorption using a 96-well Caco-2 assay. J Pharm Sci. 2010; 99(7):3246-3265. [ Links ]
74. Hilgendorf C, Spahn H, Regardh C, Lipka E, Amidon g, Langguth. Caco-2 versus Caco-2/HT29-MTX co-cultured cell lines: permeabilities via diffusion, inside- and outside-directed carrier-mediated transport. J Pharm Sci. 2000; 89:63-75. [ Links ]
75. Ingels F, Augustijns P. Biological, pharmaceutical, and analytical considerations with respect to the transport media used in the absorption screening system, Caco-2. J Pharm Sci. 2003; 92:1545-1558. [ Links ]
76. Bermejo M, Avdeef A, Ruiz A, Nalda R, Ruell J, Tsinman O, González I, Fernández C, Sánchez G, Garrigues T, Merino V. PAMPA - a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. Eur J Pharm Sci. 2004; 21:429—441. [ Links ]
77. Alsenz J. and Haenel E. Development of a 7-day, 96-well Caco-2 permeability assay with high-throughput direct UV compound analysis. Pharm Res. 2003; 20(12):1961-1969. [ Links ]
78. Lemieux M, bouchard F, Gosselin P, Paquin J, Mateescu M. The NCI-N87 cell line as a gastric epithelial barrier model for drug permeability assay. Biochem Bioph Res Co. 2011, doi:10.1016/j.bbrc.2011.07.106. [ Links ]
79. Ungell A, Artursson P. Drug transport and absorption. En: Van de Waterbeemd H, Testa B, editors. Drug bioavailability, estimation of solubility, permeability, absorption and bioavailability. 2nd ed. Winheim: Wiley-VCH; 2009:133-160. [ Links ]
80. Lennernäs H. Human intestinal permeability. J Pharm Sci. 1998; 87(4):403-409. [ Links ]
81. Leppert P, Fix J. Use of everted intestinal rings for in vitro examination of oral absorption potential. J Pharm Sci. 1994; 83:976-981. [ Links ]
82. www.biomodels-group.com/synCro_p_bp.jpg (consultada 01 de agosto de 2011).
83. Pinkus L. Separation and use of enterocytes. In Jakoby, W.B. ed., Methods in Enzymology. New York: Academic Press. 1975; 77:154-162. [ Links ]
84. Logan, C. Use of animals for the determination of absorption and bioavailability. En: Van de Waterbeemd H, Testa B, editores. Drug bioavailability, estimation of solubility, permeability, absorption and bioavailability. 2nd ed. Weinheim: Wiley-VCH; 2009. p. 161-184. [ Links ]
85. Lipinski C. Drug-like properties and the causes of poor solubility and poor permeability. J Pharmacol Toxicol Meth. 2000; 44:235-249. [ Links ]
86. Bohets H, Annaert P, Mannens G, Van Beijsterveldt L, Anciaux K, Verboven P, Meuldermans W, Lavrijsen K. Strategies for absorption screening in drug discovery and development. Curr Top Med Chem. 2001; 1:367-383. [ Links ]
87. World Health Organization. Proposal to waive in vivo bioequivalence requirements for WHO model list of essential medicines immediate-release, solid oral dosage forms. Technical Report 2010 (937), 40th Report, Annex 8 of WHO Expert committee on specifications for pharmaceutical preparations. [ Links ]
88. FDA-CDER. Guidance for industry: Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system. 2000. URL: http://www.fda.gov/cder/guidance/3618fnl.pdf (Consultada Junio 2011). [ Links ]
89. Rhodes C. Some observations on current and possible future developments in bioequivalency testing. Drug Dev Ind Pharm. 1999; 25(4):559-562. [ Links ]
90. Balimane PV, Pace E, Chong S, Zhu M, Jemal M, Van Pelt CK. A novel high-throughput automated chip-based nanoelectrospray tandem mass spectrometric method for PAMPA sample analysis. J Pharm Biomed Anal. 2005;39:8-16. [ Links ]














