Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.3 Ciudad de México jul./sep. 2011
Revisión bibliográfica
Conjugados Anticuerpo-Fármaco: El estado de arte
Antibody-Drug Conjugate: State of the Art
Hernández Baltazar E., González Christen J.
Facultad de Farmacia. Universidad Autónoma del Estado de Morelos.
Correspondencia
Dra. Judith González Christen
Facultad de Farmacia. UAEM
Av. Universidad 1001, Col Chamilpa.
Cuernavaca, Morelos, CP 62209
Tel: 777 3297 089
e-mail: judith.gonzalez@uaem.mx
Fecha de recepción: 19 de febrero de 2011.
Fecha de recepción de modificaciones: 25 de abril de 2011.
Fecha de aceptación: 14 de junio de 2011.
Resumen
El uso terapéutico de anticuerpos se ha expandido notablemente en los últimos años, particularmente en la oncología. Recientemente se ha impulsado el desarrollo de anticuerpos acoplados a fármacos citotóxicos (ADC antibody-drug conjugates). Los ADC son anticuerpos monoclonales que tienen gran afinidad por un antígeno presentado en las células transformadas, ligados a agentes citotóxicos a través de una molécula que puede ser escindida, lo que favorece una alta concentración del fármaco libre dentro del tumor, disminuyendo la exposición innecesaria en otros tejidos. En esta revisión presentaremos una breve descripción del desarrollo histórico de los ADC, las características de la molécula ideal, con ejemplos de moléculas que se encuentran en uso terapéutico o en diferentes fases de investigación, así como las perspectivas de estos sistemas.
Palabras clave: anticuerpos, terapéutica, conjugados anticuerpo fármaco.
Abstract
The therapeutic use of antibodies has increased considerably in recent years, particularly in oncology. Recently, the development of antibodies coupled to cytotoxic drugs (ADC antibody-drug conjugates), has been prompted. ADC are monoclonal antibodies that have high affinity for antigens on neoplasic cells, linked to cytotoxic agents by a linker that can be split, favoring a high concentration of free drug within the tumor, decreasing unnecessary exposure in other tissues. In this review we will present a brief description of the historical development of the ADC, the characteristics of the ideal molecule, with examples of molecules found in therapeutic use or in various stages of research, as well as the prospects for these systems.
Keywords: antibodies, therapeutic, antibody drug conjugate.
Introducción
La oncología es una de las principales áreas de investigación y desarrollo de las compañías farmacéuticas y biotecnológicas, con aproximadamente el 40% de los proyectos en fase I a III asociados a cáncer1. La diversificación y validación de nuevos blancos en oncología es un reto, pues el origen de las neoplasias es multifactorial, a veces redundantes y en general no están completamente entendidas.2Además, su tratamiento está limitado por varios factores, que incluyen el surgimiento de poblaciones tumorales resistentes a los fármacos y la radiación, la heterogeneidad del tumor, la presencia de metástasis y el daño a tejido sano por los fármacos.2,3
La quimioterapia tradicional es uno de los pilares para el tratamiento de las neoplasias. Los agentes citotóxicos, sin embargo, no son específicos de los tumores; su efectividad se asocia a la premisa de que las células transformadas presentan un crecimiento acelerado y por ello serían más susceptibles a estos fármacos.4 Además, se han reportado casos de tumores que presentan un fenotipo de multi-resistencia a fármacos, a veces asociados a la expresión de bombas transportadoras dependientes de ATP, por lo que se requiere de sistemas que permitan liberar el fármaco en el citosol, sin que sea afectado por estos transportadores.5 Desde hace varios años el desarrollo de Anticuerpos Monoclonales (mAb) es una propuesta para aumentar especificidad contra tumores, evitar proteínas de eflujo e incluso elevar la concentración que el fármaco alcanza en el citosol. El uso de los anticuerpos y sus derivados como agentes terapéuticos es un campo que está expandiéndose. Desde el establecimiento de la tecnología para el desarrollo de anticuerpos monoclonales, por Köhler y Milstein en 1975, se han generado diversos anticuerpos con uso terapéutico que han sido aprobados para su uso en humanos en varios países. Su utilización como agentes terapéuticos se vio frenada debido a la respuesta inmune del paciente, que rápidamente inactivaba a los anticuerpos murinos.4 Un aspecto clave del reciente impulso es la generación de anticuerpos quiméricos en donde la región que reconoce al antígeno proviene de una inmunoglobulina de ratón o rata, pero la región variable es de origen humano, presentando así un 66% de homología con los Ab humanos; o bien humanizados, esto es generados por medio de ingeniería genética, en los que la secuencia correspondiente a un ratón es menor al 5%, el 95% restante corresponde a secuencias humanas. Estas moléculas mantienen la especificidad por el ligando, pero presentan menor inmunogenicidad, lo que disminuye los efectos adversos y mejora el tiempo de vida útil del anticuerpo.6 Ver Figura 1.
En 1997 se aprobó el uso del primer anticuerpo quimérico en terapia antineoplásica, el rituximab (Rituxan/Mabthera), dirigido contra CD-20, para el tratamiento de linfomas no Hodgking, el cual continúa en uso hasta la fecha.7 La eficacia de este anticuerpo es la base de nuevas generaciones de mAb anti-CD20, algunos de los cuales ya han sido aprobados para su uso en humanos.7,8 El éxito de este anticuerpo ha permitido que se apruebe su uso en otras terapias como son artritis reumatoide y leucemia linfocítica crónica.9,10
El primer anticuerpo monoclonal aprobado, en el 2002, para su uso en clínica, fue el Adalimumab (Humira, Abbott), específico contra el TNF-a, utilizado para el tratamiento de enfermedades autoinmunes. Actualmente se han aprobado en Estados Unidos, Europa y en otros países, al menos 20 anticuerpos terapéuticos y de las 22 terapias aprobadas por la FDA para el tratamiento del cáncer, 9 son mAb.1,11 Ver Tabla 1. Además existen más de 24 productos de mAB que se encuentran en estudios de fase III o que están en trámite de ser aprobados por la FDA.6,9
El conocimiento detallado de la estructura de los anticuerpos y del mecanismo de su acción, han conducido al desarrollo biotecnológico de moléculas con fundamentos más racionales. Esto ha permitido generar moléculas más homogéneas y estables, con mejor actividad y mayor tiempo de vida.2,8 También se han logrado avances en la modificación de las propiedades de los anticuerpos, por ejemplo, tamaño molecular, afinidad de unión al antígeno y especificidad,12 así como la modificación de la glucosilación del anticuerpo para favorecer su unión a los receptores.
Entre otros logros, con lo anterior se ha conseguido tener una amplia variedad de anticuerpos con diferentes mecanismos de acción, la cual va desde la localización de células afectadas (por ejemplo, biomarcadores), hasta su exterminio (por ejemplo los acoplados a fármacos). Una estrategia ha sido el desarrollo de anticuerpos con capacidad de bloquear a diferentes receptores para factores de crecimiento, como por ejemplo bloquear al receptor para el factor de crecimiento vascular-endotelial (VEGF), mediante el anticuerpo Bevacizumab (Avastin, Roche), dos más para bloquear al factor de crecimiento epidérmico (EGFR), el cetuximab (Erbitux, Lilly) y el Panitumumab (Vectibix; Amgen), los tres utilizados en el tratamiento del cáncer colorectal, el último utilizado como monoterapia en ciertos pacientes.1,13
Otra estrategia para mejorar la efectividad de los mAb en la terapia antineoplásica ha sido la síntesis de conjugados Fármaco-Anticuerpo (ADC), en los cuales, por vía química, se liga una o varias moléculas de fármaco citotóxico a los anticuerpos, con ello se da un reconocimiento específico de antígenos en células neoplásicas y de esta manera se eliminan solo a las células de interés.
Características de los ADC
El acoplamiento de un fármaco citotóxico a un anticuerpo monoclonal representa un método para combinar la especificidad del anticuerpo por su blanco con la potencia del fármaco citotóxico, lo que puede incrementar significativamente ambas actividades.11
El desarrollo de nuevos ADC requiere que esta molécula presente varias características diferentes al monoclonal sin acoplar o del fármaco sistémico. Los principales aspectos que debe de cumplir son:
a) Circulación: El acoplamiento del fármaco al anticuerpo no debe de modificar negativamente la distribución de la molécula, comparado con el mAb libre. En todo caso, se debería de mejorar la biodistribución y/o incrementar la vida media14. Se debe de asegurar que el fármaco permanecerá unido al anticuerpo hasta la llegada al sitio de acción, para evitar el daño a otros tejidos.
b) Unión al antígeno. Existen dos estrategias para desarrollar un ADC, una de ellas es utilizar mAb que reconocen a un antígeno que se ha demostrado que está únicamente presente en células transformadas, y que además es eficaz como tratamiento, o bien incluir mAb que reconozcan nuevos blancos. Independientemente de la opción que se elija, el acoplamiento del fármaco no debe de interferir en la afinidad, avidez y especificidad del anticuerpo desnudo.14
c) Internalización. El ADC ideal deberá internalizarse en la célula blanco, para que sólo en el interior de esta célula se libere el fármaco; cumpliendo así la propuesta de especificidad y de incremento de la concentración.2 Los ADC deben de ser reconocidos por receptores de membrana asociados a procesos de endocitosis, ya sea que el mAb esté dirigido contra un receptor membranal, o bien que sea reconocido por receptores para inmunoglobulinas (presente en un limitado número de células). Este es uno de los principales retos del desarrollo de los ADC, pues generalmente el proceso de internalización es ineficiente.14
d) Liberación del Fármaco. Para alcanzar los niveles terapéuticos esperados en el interior de la célula, el procesamiento de la molécula debe de ser eficiente para liberar al fármaco sin modificar la estructura del mismo. En general esto requiere el desarrollo de moléculas de unión estables en circulación, pero que sean accesibles a enzimas o cambios fisicoquímicos en los diferentes compartimentos celulares.
e) Acción del fármaco. El fármaco debe de tener una gran potencia de eliminación de neoplasias, aún a concentraciones muy bajas. Inicialmente se acoplaron fármacos que ya habían sido aprobados para su uso como moléculas solas (por ejemplo: vinblastina y doxorubicina), pero que presentaban baja toxicidad o potencia. Actualmente se han introducido fármacos mucho más potentes, pero demasiado tóxicos para ser aplicados sistémicamente o por infusión, como son las auristatinas y los maytósidos. La especificidad y el hecho de que el fármaco sólo se libera dentro de la célula, debería de reducir los efectos adversos11. Estos agentes podrían ser entre 100 y 1000 veces más potentes que los agentes antineoplásicos tradicionales. Es importante recalcar que la reacción de ligación al anticuerpo se debe dirigir a la región constante del anticuerpo, particularmente los dominios 2 y 3. Si la molécula ligando se une a la región variable, o de reconocimiento, puede bloquear su acción al no reconocer su blanco.
De esto se deduce que los elementos claves de la arquitectura de un ADC son: el anticuerpo monoclonal, el fármaco citotóxico y la molécula ligando que conjuga al fármaco con el anticuerpo (ver Figura 2).

Anticuerpos: La importancia del anticuerpo radica en dos factores, el primero, que es más evidente, es la especificidad que tienen, lo que permite que el fármaco se asocie solamente a aquellas células que expresan un antígeno específico, convirtiéndose así en verdaderas "balas mágicas". La segunda ventaja es que, a través de receptores de membrana, el conjugado puede ser endocitado, favoreciendo la liberación del fármaco y su acción en el interior de la célula. Este aspecto es relevante considerando el eflujo de los fármacos vía las bombas de membrana, particularmente la familia de glicoproteínas P, ya que se ha observado que los fármacos introducidos a través de anticuerpos son menos susceptibles a ser transportados por estas proteínas, comparado con el fármaco aplicado sistémicamente.4,15
Los anticuerpos monoclonales se han utilizado exitosamente para el tratamiento de varios cánceres (ver Tabla 1), algunos ejemplos son el Rituxan® (rituximab), Herceptin® (trastuzumab) y Erbitux® (cetuximab)- que son usados para el tratamiento de linfomas de células B y en metástasis de cáncer de seno y colorectal.15
Fármacos citotóxicos: el segundo elemento clave es el fármaco antineoplásico o citotóxina. Actualmente existe una gran variedad de agentes antineoplásicos que se pueden utilizar en el tratamiento de tumores sólidos o de tipo hematológico. Sin embargo, la eficacia de estos medicamentos está limitada por la toxicidad sistémica o por sus efectos adversos.
Los fármacos antineoplásicos se pueden agrupar en seis clases principales que incluyen a: agentes alquilantes, antimetabólicos, antibióticos anti-tumorales, inhibidores de la topoisomerasa, corticoesteroides e inhibidores de la mitosis.
En el grupo de inhibidores de la mitosis es frecuente encontrar moléculas que interactúan con los microtúbulos, algunos de los cuales tienen décadas de utilización como agentes antineoplásicos, por ejemplo los taxoles y los derivados de la vinca. Desafortunadamente diferentes tipos de cánceres han desarrollado mecanismos de resistencia, que incluyen sistemas de eflujo (mediado por transportadores ABC), una baja interacción con el blanco e incapacidad de inducir apoptosis. Además, su uso se ha asociado a neuropatías periféricas.16 Los primeros ADC se acoplaron a estas pequeñas moléculas, que ya estaban aprobadas para su uso en humanos.11 Actualmente se están estudiando ADC acoplados a otros inhibidores de microtúbulos más potentes, pero a la vez más tóxicos, como son los maytósidos y las aurastatinas (ver Tabla 2).
La familia de los maytósidos se deriva del Maytósido, aislado y estudiado en la década de los 70's, por Kupchan, pero su empleo fue abandonado porque presentaban alta toxicidad y bajo índice terapéutico. Actualmente los maytósidos son los fármacos de elección de varios ADC, incluso que ya se encuentran en fase II/III de estudios clínicos. Se ha demostrado que ciertos fenotipos de tumores, particularmente aquellos que expresan el transportador MDR1, son resistentes a estos agentes citotóxicos, sin embargo, modificando el agente acoplador se ha logrado revertir este fenómeno.17 Por ejemplo el maytósido DM-1, acoplado a un mAb humanizado, se utiliza para el tratamiento de cáncer de mama, denominado Trastuzumab (Herceptin®, Genetech). El objetivo de hacer este acoplamiento es el de incrementar la efectividad del anticuerpo, en particular en pacientes con metástasis o que tienen una alta expresión de HER-2, los cuales no responden eficientemente al Trastuzumab. Actualmente se encuentra en estudios en fase I y II, los cuales han mostrado resultados prometedores.18 Otros ADC acoplados a DM-1 o DM-4 son el BIIBO15 y el Lorvotuzumab, para los cuales ya hay reportes de estudios clínicos de fase I (ver Tabla 2).
La familia de las auristatinas. Tanto la monometilauristatina E (MMAE) y la monometilauristatina F, pertenecen a la misma clase de moléculas que la dolastatina, un pentapéptido natural que se ha empleado en varios ensayos clínicos para el tratamiento de cáncer. Son también potentes inhibidores de la polimerización de tubulina y se sabe que son de 100 a 1000 veces más potentes que la doxorubicina.11 El Brentuximab vedotina (o SGN-35), es uno de los anticuerpos más prometedores para el tratamiento de linfomas de tipo Hodgkin, este es un conjugado de un mAB anti-CD30 y MMAE (ver Tabla 2).
La familia de los antibióticos-antitumorales está representada por la caliqueamicina y su derivados. Fueron descritas desde 1987, son antibióticos que están formados por grupos funcionales enediyne, originalmente aislados de Micromosporaechinopora spp calichemis, que al internalizarse en la célula se une al ADN e induce la ruptura de esta molécula, activando así programas apoptóticos que conducen a la muerte de la célula.19 Dentro de este grupo encontramos a la caliqueamicina G1 y a la esperamicina A, que son potentes agentes antineoplásicos, ya que la cadena glucosídidica de estas moléculas reconocen específicamente secuencias en el zurco menor del ADN, se genera un diradical que sustrae radicales de hidrógeno de los azúcares del ADN, provocando así el corte de esta molécula.20,21 Desde 1992 la caliqueamicina G1 se sintetiza químicamente, mediante el procedimiento desarrollado por Nicolau y colaboradores.
Ligandos
La molécula del ligando es un componente crítico de los ADC y se usa para unir covalentemente la citotoxina al anticuerpo monoclonal. Las estructuras de los ligandos que son comúnmente usados para desarrollar conjugados se esquematizan en la Figura 3.

Los ligandos son seleccionados de manera que sean estables al pH fisiológico de la sangre (pH 7.4). Sin embargo, una vez internalizado, el ligando debe ser cortado, incluso por el pH ácido encontrado en ciertos compartimientos intracelulares (pH 4.5-5.0) o por acción de las proteasas lisosomales, como la catepsina, la cual se ha observado se presenta en niveles elevados en células tumorales.14
Los ligandos se pueden dividir en químicamente lábiles y en sensibles a enzimas. Un ejemplo de ligando químicamente sensible es la hidrazona, la cual es relativamente estable mientras está en la circulación sanguínea pero se rompe en el medio ácido encontrado en los endosomas y en los lisosomas.22
Los ligandos sensibles a enzimas incluyen aquellos que contienen péptidos sensibles a proteasas en la conexión entre en anticuerpo monoclonal y la citotoxina. Esto aumenta significativamente la estabilidad del conjugado en plasma mientras que proporciona un mecanismo de liberación del fármaco dentro del lisosoma (por ejemplo el enlace valina-citrulina que contiene el ligando que usa la compañía Seattle Genetics en el producto SGN-35). Algunos ejemplos de ligandos y sus mecanismos de ruptura se muestran en la Figura 3.
Mecanismo de acción
Como se ilustra en la Figura 4 los ADC provocan la respuesta farmacológica vía la unión del anticuerpo monoclonal a un antígeno expresado en la superficie de la célula tumoral. Por ejemplo, el conjugado se une al receptor que está sobre expresado en la superficie de algunas células de cáncer. El complejo entonces es internalizado por medio de un receptor que regula la endocitosis. Posteriormente la fusión de la vesícula endosomal con el lisosoma lleva a la ruptura del conjugado. El ligando se rompe y permite la liberación de la citotoxina por la acción enzimática de las proteasas. La liberación del fármaco lleva a la célula a la fase de arresto y en consecuencia se induce la apoptosis o muerte celular.
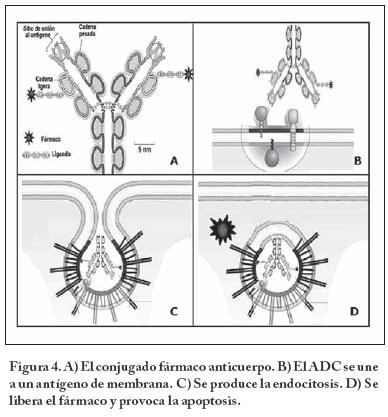
En la endocitosis las macromoléculas a internalizar se unen a receptores específicos situados en la superficie celular, lo cuales se acumulan selectivamente en las depresiones revestidas o recubiertas de Clatrina, estructuras invaginadas de 150 nm que ocupan aproximadamente el 2% de la superficie de membrana plasmática, y entran a la célula como complejos receptor-macromolécula en vesículas revestidas de clatrina de 50-60 nm de diámetro. La Clatrina es una proteína oligomérica que está formada por tres cadenas pesadas y tres ligeras que forma trisqueliones que se ensamblan una red poliédrica similar a una "canasta de baloncesto" en la cara citoplasmática de la membrana. En las depresiones se pinzan y se forman las vesículas revestidas de clatrina a través de un proceso molecular muy orquestado.23
Proceso de síntesis de ADC
La producción de un ADC puede llevarse a cabo en procesos de uno o dos pasos (Figura 5). La conjugación de un anticuerpo monoclonal a una citotóxina ocurre en la región donde estén presentes una cisteína o una lisina.

Los conjugados ligados por cisteína (por ejemplo SGN-35) se sintetizan usualmente en un solo paso en el cual, previamente se ha unido el fármaco al ligando, haciendo reaccionar directamente los grupos sulfhidrilo libres del anticuerpo, lo que resulta en una reducción parcial de los disulfuros intercadena. En la conjugación en dos pasos (por ejemplo T-DM1), el primer paso es la reacción de modificación, donde un N-hidroxi-succinimidilester reacciona con una lisina accesible en la superficie del anticuerpo. En el segundo paso de la conjugación, el anticuerpo-ligando se conjuga con el fármaco usando un segundo grupo reactivo (malemida) del ligando.
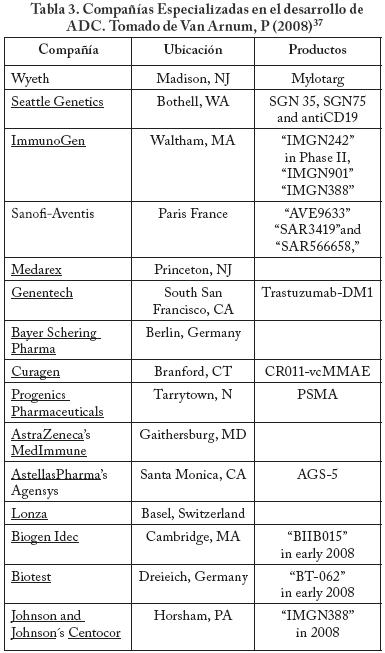
Compañías especialistas en ADC
Los ADC, al ser una combinación de la síntesis orgánica y la biotecnología, se vuelven productos de alta especialización y que solo algunas compañías en el mundo están desarrollando. Además de que hay que tener en cuenta que las características de seguridad de las instalaciones deben ser muy altas por los riesgos en el manejo de este tipo de productos, también hay que resaltar la necesidad de equipos analíticos de muy alta sensibilidad para cuantificar la cantidad de fármaco en el ADC y para determinar las trazas de producto que pudiesen permanecer en el equipo aún después de una limpieza exhaustiva. Ejemplos de compañías que están desarrollando estos productos se enlistan en la Tabla 3. Estas instalaciones se encuentran principalmente en Estados Unidos, Alemania y Suiza.
Desafíos actuales
El desarrollo de anticuerpos monoclonales que puedan ser usados en terapias antineoplásicas tiene una serie de dificultades, como son la necesidad de que las células transformadas presenten un antígeno específico, que no se exprese en células normales. Además está todo el proceso de producción de monoclonales, que de preferencia deben de ser de subtipo IgG2, y en, la medida de lo posible, no desencadenar una respuesta inmune en contra de ellos, como se detalló en la introducción. Sin embargo, desde una perspectiva clínica, los desafíos para el desarrollo de Anticuerpos Acoplados a Fármacos incluyen la farmacocinética y la biodistribución de los conjugados; su reactividad cruzada respecto a tejidos normales y sanos, y la estabilidad de los ligandos durante su circulación en suero. Una rápida eliminación del conjugado podría evitar su acumulación en los sitios objetivo a concentración suficiente para presentar actividad.
Así mismo, la estabilidad inadecuada del ligando durante circulación en el suero podría llevar a una liberación prematura del fármaco citotóxico, resultando en eventos adversos. Una complejidad adicional para el desarrollo del proceso es que la conjugación del fármaco al anticuerpo no debe interferir con los sitios de unión al antígeno del tumor.
La síntesis de ADC requiere el uso de fármacos citotóxicos con niveles de exposición entre 10-6 y 10-9 gramos/m3. Estas moléculas son muy potentes y se deben manejar con las protecciones adecuadas para limitar la exposición del trabajador y proteger el medio ambiente.
La síntesis de los conjugados en la mayoría de los casos requiere el uso de equipo e instalaciones dedicados específicamente para ello. Si estas instalaciones se utilizaran para síntesis de otras proteínas o conjugados, el riesgo de contaminación cruzada y de fármaco residual deberá reducirse muy por debajo de los límites permisibles. También se requieren métodos muy sensibles para detectar cantidades residuales a nivel de ng/mL. Las superficies de las instalaciones y equipo de proceso en contacto con el conjugado requieren la habilidad de ser esterilizadas con vapor en el sitio y de ser limpiadas en sitio.
Desde una perspectiva analítica, los ADC son una población heterogénea de moléculas con varios niveles de carga de fármaco. Esta heterogeneidad presenta un desafío para el desarrollo de ensayos analíticos que se utilizarán típicamente para verificar la estabilidad del anticuerpo, pero no necesariamente adecuado para asegurar la estabilidad del conjugado. Entonces, todas las aproximaciones que se hagan en el desarrollo de los ADC deberán tomar en cuenta la estabilidad del fármaco y del ligando, además de la especificidad del anticuerpo.
Perspectivas
Existen publicaciones que han mostrado resultados de estudios en fase I, II y II con diversos ADC, siendo menos abundantes los de fase II y III, como se observa en la Tabla 2. Entre los ADC que reportan estudios fase I/II destacan SGN-35 (un mAb anti- CD30, acoplado a monometilaurastina), ahora llamado Brentuximab Vedotin, y el Trastuzumab-DM-1 (mAb contra el receptor tipo 2 del factor de crecimiento epidérmico y el fármaco DM-1).
Los estudios de fase I y II llevados a cabo por Burris HA y colaboradores,18,24 realizados en pacientes que habían recibido al menos 4 tratamientos quimioterapéuticos contra cáncer de mama metastásico, muestran que los que recibieron tratamiento con Trastuzumab-DM-1 (T-DM-1), presentan una respuesta favorable, ya que se obtuvo una respuesta objetiva en el 26% de los casos, con un incremento en el tiempo libre de progresión del tumor de casi 5 meses. El fármaco fue bien tolerado, con efectos adversos de grado 1 y 2 y menos del 10% de grado 3.
Es importante notar que si bien el Trastuzumab, utilizado como anticuerpo sin acoplar a fármacos, es uno de los tratamientos más efectivos para los pacientes con cáncer de mama positivos a HER-2, un grupo significativo de pacientes no responden a este tratamiento. Se han propuesto 4 mecanismos por los cuales ocurre esta resistencia, tres de los cuales se pueden disminuir con el acoplamiento a un fármaco, ya que están relacionados con el mecanismo de acción del anticuerpo. Sin embrago, para aquellos pacientes que son resistentes al trastuzumab, debido a la expresión de HER-2, también podrían presentar resistencia al tratamiento con T-DM1.25
Entre los estudios de fase I el Brentuximab Vedotin, aplicado a pacientes con Linfoma de Hodgkin o con Linfoma Anaplásico de células grandes, se documentó una respuesta objetiva26 en el 38% de los pacientes tratados, incluyendo un 24% de remisión. En un 86% de los pacientes se observó la regresión del tumor, mientras que un 81% presentó una mejoría en los síntomas asociados al tumor.26
El primer y único ADC aceptado por la FDA para su uso clínico es el Mylotarg Gemtuzumab-ozogamicin (GO) de Pfizer, que fue aprobado en mayo 2000, bajo el esquema de aprobación acelerada para aquellas enfermedades que ponen en peligro la vida.27 Este fármaco fue específicamente aprobado para el tratamiento de leucemia mieloide aguda, positivos para CD33, en pacientes mayores de 60 años, para quienes los tratamientos anteriores no son recomendables.28 Este ADC consta de un anticuerpo humanizado que reconoce la molécula CD33, acoplado a un derivado semi-sintético de la caliqueamicina.19 En junio del 2010 Pfizer retiró voluntariamente este fármaco, después de que un estudio mostró que este tratamiento no representaba una mejor opción terapéutica sino que además la empeoraba, llegándose a asociar una mayor mortalidad en los pacientes bajo este esquema de tratamiento.27,29
Por otro lado, durante el 2010 se publicaron diversos estudios en los que se observó que el tratamiento con GO es seguro en ciertos pacientes, por ejemplo los mayores de 75 años, los que no toleran tratamientos de consolidación. En algunos casos los estudios proponen esquemas diferentes a los aprobados por la FDA.30
El resultado de un estudio multicéntrico de Fase III fue publicado en el 2010, en el que concluyen que no hay diferencia entre los que reciben el tratamiento con GO, después de haber presentado 2 ciclos de quimioterapia-remisión, comparado con aquellos que no recibieron este tratamiento, por lo que consideran que no hay ningún beneficio para el paciente. Sin embargo el mismo trabajo presenta algunas reservas en cuanto a su desarrollo, ya que se trató de un grupo pequeño y que presentan una situación de riesgo intermedia, pues los de alto riesgo no fueron seleccionados, aunque estos últimos son los que se consideran candidatos al tratamiento.31
El trabajo presentado por Ichikawa,32 en un grupo muy pequeño y no controlado (ya que todos los pacientes recibieron el tratamiento con GO), propone que este tipo de terapia es adecuada para aquellos pacientes que cumplan varios criterios, como son que no toleran tratamientos de consolidación y otras características favorables, como son la edad o el fenotipo del tumor.
Dos trabajos muestran que el uso de bajas dosis y en esquemas diferentes a los aprobados por la FDA, son buena opción, particularmente en pacientes de edad mayor (mayores de 75 años) y los que presentan co-morbilidades, los cuales no son considerados aptos para las quiomioterapias estándares. El estudio de Poloni,33 si bien es piloto, con un grupo pequeño, muestra que se puede utilizar GO como terapia de mantenimiento y para eliminar fases residuales; mientras que el trabajo de Amadori28 propone, a partir de un estudio de fase II, que el GO se puede utilizar en mono-terapia, bajo un esquema de aplicación en día 1 y 8 (diferente al aprobado por la FDA, que es más largo y espaciado), es esperanzador para los pacientes mayores de 75 años.
El trabajo de McHayle y colaboradores34 indica que el tratamiento con GO es una buena alternativa para aquellos pacientes que cumplan ciertos criterios, como son los que presentan diagnóstico reciente de AML y que presentan un cariotipo de riesgo intermedio, ya que los de cariotipo de riesgo alto no respondieron adecuadamente; por lo que proponen que no se retire el tratamiento, sino que se realicen las pruebas necesarias para que lo reciban solamente aquellos que cumplen con este perfil.
También se han analizado otros esquemas de uso, por ejemplo hay un estudio de fase II, en la que se propone una terapia combinada con trióxido de arsénico y GO, para otro tipo de leucemia, la leucemia de Síndrome Mielodisplásico. Ellos notaron los mismos efectos adversos que se presentan con otros tratamientos, pero los pacientes bajo este tratamiento tuvieron una ligera mejoría (19%).35
Estos datos, junto con los resultados que se han obtenido en estudios de fase II o III, que se han realizado con diversos ADC, hacen suponer que el desarrollo de estos fármacos no se va a detener, sino que se establecerán criterios más estrictos para su aprobación para uso en humanos.36
Si bien el hecho de que el único ADC que ha sido aprobado para su uso en humanos fue retirado del mercado 10 años después, consideramos que este nuevo grupo de fármacos aún tiene un gran futuro en la clínica. Para ello se requieren de ensayos fase II y III precisos, que permitan evaluar correctamente su potencial, así como establecer las causas de las fallas y proponer mejoras. Por ejemplo, uno de los problemas, con los ADC, que se presentan frecuentemente en ensayos pre-clínicos es la hepatotoxicidad y la nefrotoxicidad. Se ha propuesto que es por la liberación del fármaco en estos órganos durante su eliminación. Por lo que se tienen que buscar enlaces más estables, que permitan que el fármaco sólo se libere dentro de la célula blanco.
Conclusiones
Los ADC son un tipo de fármacos con amplia expectativa, debido al éxito que han tenido algunos anticuerpos monoclonales, particularmente en la oncología. Sin embargo, aún representan un desafío, pues se requiere aumentar su especificidad, potencia y eficacia, mientras que se logre limitar sus efectos indeseables y disminuir su toxicidad. Una comprensión completa de las propiedades de los anticuerpos y los agentes citotóxicos es necesaria en todas las etapas, empezando por la selección de las moléculas y continuando durante todo el desarrollo de la síntesis de ADC. Conforme la tecnología de ADC se haga más frecuente, esta tendrá el potencial para expandirse y mejorar significativamente las opciones de tratamiento para el cáncer.
Referencias
1. Aggarwal S, Targeted cancer therapies. Nat Rev Drug Discov. 2010; 9(6):427-8. [ Links ]
2. Beck A, et al. Strategies and challenges for the next generation of therapeutic antibodies. Nat Rev Immunol. 2010; 10(5):345-52. [ Links ]
3. Trail PA, Bianchi AB. Monoclonal antibody drug conjugates in the treatment of cancer. Curr Opin Immunol 1999; 11(5):584-8. [ Links ]
4. Schrama D, Reisfeld RA, Becker JC. Antibody targeted drugs as cancer therapeutics. Nat Rev Drug Discov. 2006; 5(2): 147-59. [ Links ]
5. Kovtun YV, Audette CA, Mayo MF et al. Antibody- maytansinoid conjugates designed to bypass multidrug resistance. Cancer Res. 2010; 70(6):2528-37. [ Links ]
6. Li J, Zhu Z. Research and development of next generation of antibody-based therapeutics. Acta Pharmacol Sin. 2010; 31(9):1198-207. [ Links ]
7. Oflazoglu E, Audoly LP. Evolution of anti-CD20 monoclonal antibody therapeutics in oncology. MAbs. 2010; 2(1):14-9. [ Links ]
8. Chames P, Baty D. Bispecific antibodies for cancer therapy: the light at the end of the tunnel? MAbs. 2009; 1(6):539-47. [ Links ]
9. Nelson AL, Dhimolea E., Reichert JM. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov. 2010; 9(10):767-74. [ Links ]
10. Chames P, Baty D. Bispecific antibodies for cancer therapy. Curr Opin Drug Discov Devel. 2009; 12(2):276-83. [ Links ]
11. Alley SC, Okeley NM, Senter PD. Antibody-drug conjugates: targeted drug delivery for cancer. Curr Opin Chem Biol. 2010; 14(4):529-37. [ Links ]
12. Carter P. Improving the efficacy of antibody-based cancer therapies. Nat Rev Cancer. 2001; 1(2):118-29. [ Links ]
13. Berardi R, Onofri A, Pistelli M, Maccaroni E, et al. Panitumumab: the evidence for its use in the treatment of metastatic colorectal cancer. Core Evid. 2010; 5:61-76. [ Links ]
14. Ducry L, Stump B. Antibody-drug conjugates: linking cytotoxic payloads to monoclonal antibodies. Bioconjug Chem. 2010; 21(1):5-13. [ Links ]
15. Wakankar AA et al. Physicochemical stability of the antibody-drug conjugate trastuzumab-DM1: changes due to modification and conjugation processes. Bioconjug Chem. 2010; 21(9):1588-95. [ Links ]
16. Dumontet C, Jordan MA. Microtubule-binding agents: a dynamic field of cancer therapeutics. Nat Rev Drug Discov. 2010; 9(10):790-803. [ Links ]
17. Kovtun YV, Audette CA, Mayo MF et al. Antibody-maytansinoid conjugates designed to bypass multidrug resistance. Cancer Res, 2010; 70(6):2528-37. [ Links ]
18. Krop IE, Beeram M, Modi S, Jones SF, Holden SN et al. Phase I study of trastuzumab-DM1, an HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2-positive metastatic breast cancer. J Clin Oncol. 2010; 28(16):2698-704. [ Links ]
19. Bross PF, Beitz J, Chen G, Chen XH, Duffy E et al. Approval summary: gemtuzumab ozogamicin in relapsed acute myeloid leukemia. Clin Cancer Res, 2001; 7(6):1490-6. [ Links ]
20. Walker S, et al. Cleavage behavior of calicheamicin gamma 1 and calicheamicin T. Proc Natl Acad Sci U S A, 1992; 89(10):4608-12. [ Links ]
21. Nicolaou KC, Chen JS, Dalby SM. From nature to the laboratory and into the clinic. Bioorg Med Chem, 2009; 17(6):2290-303. [ Links ]
22. Carter PJ, Senter PD. Antibody-drug conjugates for cancer therapy. Cancer J, 2008; 14(3):154-69. [ Links ]
23. Alberts BJ, A. Lewis J. Molecular Biology of the cell, G Science, Editor. 2002. [ Links ]
24. Burris HA, 3rd, Rugo HS, Vukelia SJ, Voegl CL et al. Phase II study of the antibody drug conjugate trastuzumab-DM1 for the treatment of human epidermal growth factor receptor 2 (HER2)-positive breast cancer after prior HER2-directed therapy. J Clin Oncol. 2011; 29(4): 398-405. [ Links ]
25. Pohlmann PR, Mayer IA, Mernaugh R. Resistance to Trastuzumab in Breast Cancer. Clin Cancer Res. 2009; 15(24):7479-7491. [ Links ]
26. Younes A, Barlett NL, Leonard JP, Kennedy DA et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 2011; 363(19):1812-21. [ Links ]
27. FDA(2010) http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm216458.htm.
28. Amadori S, Suciu S, Selleslay D, Stasi R et al. Randomized trial of two schedules of low-dose gemtuzumab ozogamicin as induction monotherapy for newly diagnosed acute myeloid leukaemia in older patients not considered candidates for intensive chemotherapy. A phase II study of the EORTC and GIMEMA leukaemia groups (AML-19). Br J Haematol. 2010; 149(3): 376-82. [ Links ]
29. Goozner M. FDA increases focus on postmarketing studies. J Natl Cancer Inst. 2010; 102(17):1302-4. [ Links ]
30. Clarke WT, Marks PW. Gemtuzumab ozogamicin: is there room for salvage? Blood. 2010; 116(14):2618-9. [ Links ]
31. Lowenberg B, Beck J, Graux C, van Putten W et al. Gemtuzumab ozogamicin as postremission treatment in AML at 60 years of age or more: results of a multicenter phase 3 study. Blood. 2010; 115(13):2586-91. [ Links ]
32. Ichikawa M, Hagaishi A, Nannya Y, Kurokawa M. Postremission gemtuzumab ozogamicin for elderly patients with acute myelogenous leukemia with favorable characteristics and comorbid conditions. Int J Hematol. 2010; 92(4):673-4. [ Links ]
33. Poloni A, Capelli D, Trapolini S et al. Low-dose Gemtuzumab-Ozogamicin as post-consolidation therapy in elderly patients with acute myeloid leukaemia: a pilot study. Br J Haematol. 2010; 150(1):119-21. [ Links ]
34. McHayleh W et al. Gemtuzumab ozogamicin as first-line treatment in patients aged 70 years or older with acute myeloid leukemia. Cancer, 2010; 116(12):3001-5. [ Links ]
35. Sekeres MA, Maciejewski JP, Erba HP, Afable M et al., A Phase 2 study of combination therapy with arsenic trioxide and gemtuzumab ozogamicin in patients with myelodysplastic syndromes or secondary acute myeloid leukemia. Cancer, 2010; 117(6):1253-1261. [ Links ]
36. Hughes B. Antibody-drug conjugates for cancer: poised to deliver? Nat Rev Drug Discov. 2010; 9(9):665-7. [ Links ]
37. Van Arnum P. Antibody Drug Conjugates: A Marriage of Biologics and Small Molecules. Pharmaceutical Tech. 2008; http://pharmtech.findpharma.com/pharmtech/Ingredients+Insider/Antibody-Drug-Conjugates-A-Marriage-of-Biologicsa/ArticleStandard/Article/detail/522139?ref=25. [ Links ]














