Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.1 Ciudad de México ene./mar. 2011
Trabajos científicos
Estudios preliminares sobre el efecto analgésico del extracto de hojas de Ageratina glabrata en dos modelos térmicos de dolor agudo
Preliminary studies on the analgesic effect of leaf extract from Ageratina glabrata in two thermal models of acute pain
Guadalupe García P.1, Rosa Elva del Río T.3, Ramón Guzmán M.3, María Isabel Martínez G.1, Thomas R. F. Scior2
1 Laboratorio de Neuroquímica, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla.
2 Departamento de Farmacia, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla.
3 Instituto de Investigaciones Químico Biológicas, Universidad Michoacana de San Nicolás de Hidalgo.
Correspondencia
D.C. Thomas R. F. Scior
Facultad de Ciencias Químicas, Benemérita Universidad
Autónoma de Puebla, Ciudad Universitaria
Edificio (Ex-139) 04-Cub-105C1, 14 Sur con Avenida San
Claudio, Colonia San Manuel, C.P. 72570, Puebla, Pue., México
Tel. 01 222 229 5500 Ext. 7362
Fax. 01 222 229 5584
e-mail: tscior@siu.buap.mx
Fecha de recepción: 18 de octubre de 2010.
Fecha de recepción de modificaciones: 25 de noviembre de 2010.
Fecha de aceptación: 24 de enero de 2011.
Resumen
Ageratina glabrata está ampliamente distribuida en México y es conocida popularmente por sus efectos analgésicos. Aunque esta especie ha sido estudiada químicamente, no hay estudios acerca de su efecto analgésico. En este trabajo fitofarmacéutico se evaluó el efecto analgésico del extracto de A.glabrata en dos modelos térmicos de dolor agudo en rata: la prueba del plato caliente y en la prueba de retirada de la cola. Se probaron dosis de extracto de 100mg/Kg y 150 mg/Kg para la prueba de plato caliente, y 100mg/Kg para la prueba de retirada de la cola. Los resultados preliminares obtenidos muestran que el extracto de hoja de A. glabrata posee efecto analgésico 5 horas posteriores a la administración en la prueba de plato caliente.
Palabras clave: Ageratina glabrata, extracto, ratas, analgesia.
Abstract
Ageratina glabrata is widely distributed in Mexico and it is popularly known for its analgesic activity. Though this specie has been chemically studied, there are no reports about any analgesic effects. In this phytopharmaceutical study, the analgesic effect of A. glabrata was evaluated in two thermal models of acute pain in rat, namely: hot plate and tail flick tests. Doses of 100mg/Kg and 150 mg/Kg of extract were used for the hot plate test, and 100mg/kg for the tail flick test. Preliminary results showed an analgesic effect 5 hours after the administration of the leaf extract of A. glabrata, in the hot plate test.
Key words: Ageratina glabrata, extract, rats, analgesia.
Introducción
La capacidad de percibir una sensación dolorosa es esencial para la sobrevivencia y bienestar de un organismo.1 El dolor, se define como una experiencia subjetiva que resulta de la percepción de un estímulo nocivo e incluye un componente emocional que requiere que el individuo esté consciente para que suceda. En 1986, la International Association for the Study of Pain (IASP) definió el dolor como una experiencia sensorial y emocional desagradable con daño tisular real o potencial o descrito en términos de dicho daño.2 La terapéutica del dolor se basa en el bloqueo de las vías nerviosas que llevan la información de la lesión provocada hasta el cerebro y así, evitar la percepción del dolor. Es por ello que los analgésicos, ya sean tipo AINES (antiinflamatorios no esteroidales), o analgésicos narcóticos como los opioides exógenos, bloquean alguna estructura de la vía nociceptiva.3,4
Los modelos de dolor agudo por aplicación de estímulos intensos de corta duración inducen cambios motores reflejos cuantificables y no requieren de la realización de una lesión previa en el animal. De acuerdo al tipo de estímulo, se clasifican en modelos térmicos, mecánicos y eléctricos. Los modelos más empleados basados en el uso de estímulos térmicos son la prueba del plato caliente y la prueba de retirada de la cola5,6, ya que permiten discriminar respuestas reflejas predominantemente de tipo espinal (sacudida de cola) de aquellas que son predominantemente de tipo supraespinal (plato caliente).7
Varios analgésicos de origen natural se han aislado a partir de plantas como la morfina que es un alcaloide proveniente del opio, el cual se obtiene de la Papaver somniferum o el ácido acetilsalicílico, que es la forma acetilada del acido salicílico, cuya fuente vegetal es la salicilina, la cual fue aislada de Salix alba.8,9 Estos ejemplos son parte importante de la medicina tradicional la cual se basa en el uso que, por la amplia variedad de especies, ha sido el punto de partida para el aislamiento de nuevos compuestos con posible actividad terapéutica, esto por un lado.
Por otro lado, el género Eupatorium pertenece a la tribu Eupatorieae de la familia Asteraceae (antes llamada Compositae) y comprende cerca de 1200 especies distribuidas en regiones templadas y subtropicales de Europa, África, Asia y principalmente de América.10 Varias especies de este género han sido estudiadas por su actividad bactericida, antifúngica, antiinflamatoria y antipirética, para el tratamiento de la malaria, úlceras gástricas y fiebre.11-14 A este género se le han realizados estudios fitoquímicos, encontrándose más de 146 metabolitos secundarios en diferentes especies de Eupatorium, entre ellos: terpenoides, lactonas terpénicas y diterpenoides (aceite "esencial"), flavonoides, alcaloides pirrolizidínicos (cancerígenos). La enorme diferencia en la composición química de los extractos de cada una de las especies de Eupatorium se debe a las condiciones de los sitios de recolección de las plantas, aunque muchas especies comparten compuestos similares dentro del mismo género e incluso de la misma familia Asteraceae.15,16
Ageratina glabrata H.B.K. (sin. Eupatorium glabratum (Kunth)17 crece en forma de arbusto silvestre con una altura de 1.5 metros, pudiendo alcanzar los 2 metros de altura en buenas condiciones de humedad. Es un arbusto erecto, ramoso, de tallos estriados, hojosos hasta la inflorescencia y hojas romboideo-oblongadas con distribución opuesta, de flores blanquecinas-rosadas en capítulos numerosos. Es conocida popularmente con el nombre de chamizo blanco, hierba del golpe e hilo y se emplea por su presunta actividad analgésica.18-20 Algunas especies del género Eupatorium han mostrado efecto antinociceptivo; Eupatorium buniifolium21, Eupatorium odoratum22,23, Eupatorium arnottianum.11 Tomando en cuenta estos antecedentes, el presente trabajo tiene como objetivo general evaluar el extracto de hojas de A. glabrata en dos modelos térmicos de dolor agudo y como objetivo particular realizar un análisis por espectroscopía de resonancia magnética nuclear para conocer la abundancia y naturaleza de los compuestos en el extracto, ya que la composición química de A. glabrata varía de acuerdo al sitio de recolección.24,25
Material y método
Recolección de la planta
La planta fue colectada en el periodo de floración, el 4 de enero del 2006, a la altura del km 191 de la carretera Federal número 15, México-Morelia, vía Mil Cumbres con las siguientes coordenadas: N 19°40'859'', W 100°50'423'' y altitud de 2,234 msnm. La identificación taxonómica fue realizada por el Dr. J. Rzedowski en el Instituto de Ecología de Pátzcuaro A.C., con el número de registro 188319.
Obtención el extracto
La planta fue separada por órganos (hojas, tallo, flor y raíz) y secada a la sombra a temperatura ambiente durante 10 días. Se utilizaron 200g de hojas molidas las cuales fueron maceradas por 24 horas, 3 veces consecutivas en 1.5 litros de diclorometano; el disolvente de maceración, fue evaporado en un rotavapor (Büchi Modelo R114, Waterbath B-480), obteniéndose 20g del extracto total.
Análisis del extracto por RMN
El análisis de los compuestos presentes en el extracto de hoja de A. glabrata en diclorometano se realizó por espectroscopía de resonancia magnética nuclear de hidrógeno, en un equipo Varian Mercury Plus a 400MHz en CDCl3, los espectros fueron procesados con el Programa Mnova Suite, adquirido en Mestrelab Research S.L.
Animales
Se utilizaron 60 ratas hembras de la cepa Sprague Dowley de 180-240g de peso provenientes del bioterio Claude Bernard de la Universidad Autónoma de Puebla. Los animales fueron alojados en cajas de acrílico individuales con agua y alimento ad libitum, ciclo luz/oscuridad de 12/12 horas, temperatura de 24±2°C y 50% de humedad. Durante 4 semanas las ratas recibieron diariamente un handling (manejo de los animales para habituarlos al experimentador y reducir el estrés) de 3 minutos hasta el día de la prueba. Todos los experimentos cumplieron los lineamientos del Reglamento del Comité de Ética para el Cuidado y Uso de Animales de Laboratorio de la Universidad Autónoma de Puebla (2007) el cual establece el cumplimiento de la Norma Oficial Mexicana "Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio" (NOM-062-ZOO-1999). Se prevé que en experimentos posteriores se usen ratas macho de la misma cepa con la finalidad de determinar si las diferencias hormonales influyen sobre el efecto del extracto, ya que existen reportes sobre dichas diferencias.26
Prueba del plato caliente
Se empleó una parrilla eléctrica Corning Stirrer y un recipiente de cerámica calentado a 40°C para la realización de la prueba. En el presente estudio, la intensidad del estímulo doloroso empleada (40°C) fue con la cual se obtuvieron latencias de 5.29±1.43 segundos27 en un grupo piloto de 5 ratas sin tratamiento. Se realizaron 5 mediciones en intervalos de 10 minutos.
Para reducir el estrés de los animales ante un ambiente nuevo, fueron habituados por 30 min en la habitación de experimentación y posteriormente se realizaron 3 mediciones basales, con intervalos de 10 minutos entre cada medición. Los animales fueron colocados sobre la placa caliente y se midió el tiempo de latencia con un cronómetro manual Oster®. Cuando una rata es sometida a la prueba de plato caliente, las conductas evocadas por el estímulo doloroso (calor) son sacudir o lamer las patas traseras o saltar.28 Una vez terminada la medición, los animales son regresados a su caja de alojamiento.
Al término de las mediciones basales, se procedió a la administración del extracto de A. glabrata disuelto en aceite de sésamo (28mg/mL). Se probaron dos dosis de extracto, 100mg/ Kg (n=9) y 150mg/Kg (n=10) por vía intraperitoneal (I.P). Como control se administró un valor relativo semejante del volumen administrado en los grupos con extracto, es decir, 0.7mL de aceite de sésamo (n=8). Además, como control positivo se empleó el analgésico tipo AINE meloxicam a dosis de 4mg/Kg (n=8)29, ambos por vía I.P. El tiempo total de observación fue de 12 horas; la evaluación de los tiempos de latencia se realizó cada 10 minutos los primeros 90 y posteriormente cada hora.
Prueba de retirada de la cola
Se empleó el equipo PANLAB LE 7106 que consta de una unidad de estimulación que posee una lámpara térmica y una unidad de control electrónica. Los animales fueron inmovilizados con ayuda de una caja de restricción fija y colocada en la unidad de estimulación del equipo. Cuando el animal mueve la cola, una celda fotoeléctrica situada en la parte inferior suspende la emisión de la radiación, se detiene el contador del tiempo y se registra el tiempo de latencia.
La lámpara térmica fue ajustada a 50°C y la radiación fue aplicada a 3 cm de inicio de la cola. La temperatura empleada en esta prueba fue determinada en un grupo piloto (n=5), realizando 5 mediciones con intervalos de 10 minutos entre ellas, el promedio de latencia obtenido fue de 6.25±1.29, aceptada para este modelo.27
Los animales fueron habituados a la caja de restricción por 30 minutos 3 días previos a la prueba. El día de la prueba, nuevamente fueron habituados y se obtuvieron 3 mediciones basales antes de la administración del extracto a dosis de 100mg/ kg (n=9), 0.7mL de aceite de sésamo (n=8) y meloxicam a dosis de 4mg/Kg (n=8).29 La mediciones se realizaron durante 12 horas; cada 10 minutos (10 mediciones) en la primera hora y media, cada hora en el tiempo restante (11 mediciones).
Análisis estadístico
Los datos obtenidos de las pruebas de analgesia de los grupos controles (vehículo y meloxicam) y experimentales (extracto) fueron analizados empleando un análisis de varianza (ANDEVA) seguida de una prueba de Tukey con el programa STATISTICA 8, Tulsa, OK, USA, se obtuvieron los promedios y la desviación estándar. Los valores fueron considerados estadísticamente significativos a p<0.05.
Resultados y discusión
Análisis espectroscópico de RMN
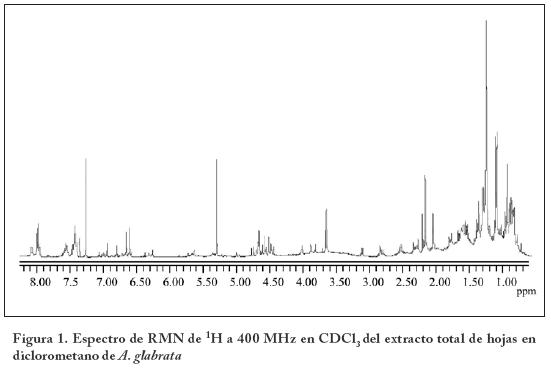
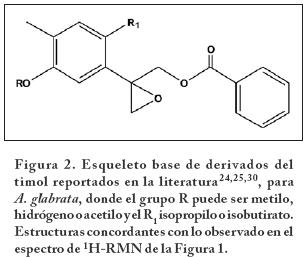
El uso de A. glabrata como analgésico en la medicina folklórica está reportado18, sin embargo, no existen estudios que validen el uso tradicional de esta planta. Es por ello que en el presente trabajo se evalúa un extracto de hojas de A. glabrata en la prueba del plato caliente y la prueba de retirada de la cola. En el espectro de 1H-RMN a 400 MHz (Figura 1) se observan señales múltiples en la región de 8.1-7.4 ppm características de un grupo benzoato; mientras que en 7.0-6.6 ppm se observan señales simples correspondientes a hidrógenos aromáticos; en la región de 4.8 a 4.4 ppm se observan señales múltiples características de hidrógenos bases de ésteres. En 3.1 y 2.5 ppm se observan señales características de hidrógenos bases de epóxidos, en 2.2 y 2.0 ppm se observan señales correspondientes a metilos aromáticos o metilos de acetilos y finalmente en la zona de 1.1 ppm se encuentran señales de metilos alifáticos. Estas señales sugieren que los compuestos mayoritarios presentes en el extracto total de hojas, poseen una estructura de derivados del timol30 como los que se muestran en la Figura 2. Existen reportes31 que avalan estos resultados, cuyos autores reportan también de E. glechonophyllum ciertos derivados del timol con grupos hidróxilos, epóxidos y acetilos. En otro trabajo32 se aislaron 16 nuevos compuestos derivados del timol de E. fortunei.
En los estudios conductuales, el extracto de hojas en diclorometano de A. glabrata mostró actividad analgésica a dosis de 100mg/Kg cinco horas después de la administración y la duración del efecto fue igualmente, de 5 horas. El análisis de varianza mostró diferencia significativa (p<0.05) cuando se compararon los grupos: vehículo (5.76±1.53), A. glabrata 100mg/ Kg (7.50±2.99), A. glabrata 150mg/Kg (6.14±2.88) y meloxicam (7.45±2.97) en la prueba del plato caliente. Este análisis no revela entre que pares de grupos existen diferencias, por lo cual se aplicó una prueba de Tukey post hoc la cual mostró que existen diferencias significativas al comparar el grupo administrado con A. glabrata 100mg/Kg contra el grupo administrado con aceite de sésamo, pero no se observa diferencia significativa al compararlo contra el grupo administrado con meloxicam (Figura 3). Este resultado pudiera deberse al nivel de integración del estímulo nociceptivo en este modelo, el cual se realizar a nivel supraespinal7,33,34 y la acción del meloxicam es más potente a nivel espinal35 lo que estaría provocando la obtención de latencias semejantes. No hubo diferencias cuando se compararon los grupos meloxicam contra A. glabrata 150mg/Kg y meloxicam contra el grupo vehículo. No es posible realizar comparaciones de los resultados obtenidos con los reportados, ya que otros autores26,36 emplearon temperaturas de 50°C como estímulo nociceptivo. El criterio en este trabajo fue obtener latencias de alrededor de 5 segundos27, las cuales fueron obtenidas con 40°C.
El extracto fue evaluado en la prueba de retirada de la cola solo a 100mg/Kg, ya que esta dosis mostró efecto antinociceptivo en la prueba del plato caliente. El grupo control positivo administrado con meloxicam (11.58±3.79 segundos) mostró diferencias significativas cuando fue comparado contra el grupo vehículo (7.86±2.80 segundos), lo que muestra su acción analgésica en este modelo experimental.37 Cuando se comparan las latencias de A. glabrata 100mg/Kg (7.96±1.95 segundos) contra el grupo administrado con vehículo no se observa diferencia estadísticamente significativa. Pero al comparar las latencias de A. glabrata 100mg/Kg contra el grupo meloxicam se observa diferencia estadísticamente significativa (Figura 4). Estos resultados no necesariamente indicarían que A. glabrata a 100mg/Kg no presenta efecto analgésico, sino que los elevados valores de latencia presentadas por el grupo meloxicam se pudieran deber a su acción espinal al igual que el estímulo aplicado en la cola. Esta controversia se solucionaría aumentando la dosis de meloxicam como lo indican los postulados de potencia farmacológica.35
Conclusiones
Los resultados obtenidos sugieren que el extracto en diclorometano de hojas de A glabrata presenta efecto antinociceptivo cuando es utilizado a una dosis de 100mg/Kg en la prueba de plato caliente. Los resultados obtenidos en la prueba de retirada de la cola no mostraron dicho efecto.
Perspectivas
Estos resultados alientan a continuar con el aislamiento de los compuestos mayoritarios presentes en el extracto y relacionarlos con las respuestas biológicas (structure—activity—relationships, SAR). Conocer la estructura química de los compuestos aislados permitiría conocer las posibles dianas biomoleculares y su mecanismo de acción para mitigar el dolor.
Agradecimientos
Al Dr. J. Rzedowski del Instituto de Ecología de Pátzcuaro A.C., por la identificación de la A glabrata. Al M.V.Z. Carlos Escamilla Weinmann, director del bioterio Claude Bernard de la Benemérita Universidad Autónoma de Puebla, por haber proporcionado los animales de experimentación. Este trabajo fue apoyado parcialmente por la Beca-Tesis No. 20090028484 otorgada a Guadalupe García Pérez por la Secretaría de Educación Pública. Proyecto de CONACYT (118287) y a la CIC-UMSNH.
Referencias
1. Basbaum A.I., Bautista D.M., Scherrer G., Julius D. 2009 Cellular and molecular mechanisms of pain. Cell, 139:267-284. [ Links ]
2. Merskey H., Bogduk N. 1994. Pain terms, a current list with definitions and notes on usage. En: Merskey H., Bogduk N. (eds.), Part III. Classification of Chronic Pain, 2a. ed. IASP Press. Seattle. p. 209-214. [ Links ]
3. Blivis D., Mentis G.Z., O'Donovan M.J., Lev-Tov A. 2007. Differential effects of opioids on sacrocaudal afferent pathways and central pattern generators in the neonatal rat spinal cord. Journal of Neurophysiology, 97:2875-2886. [ Links ]
4. Sawynok J. 2003. Topical and peripherally acting analgesics. Pharmacological Reviews, 55:1-20. [ Links ]
5. Thabrew M.I., Dharmasiri M.G., Senaratne L. 2003. Anti-inflammatory and analgesic activity in the polyherbal formulation Maharasnadhi Quathar. Journal of Ethnopharmacology, 85(2-3) :261-267. [ Links ]
6. González-Darder J.M. 2000. Modelos animales de dolor y aspectos éticos de la experimentación animal. Revista de la Sociedad Española del Dolor, 7:313-318. [ Links ]
7. Le Bars D., Gozariu M., Cadden S.W. 2001. Animal models of nociception. Pharmacological Reviews, 53:597-652. [ Links ]
8. García del Pozo J., Velasco M.A. 2003. Fármacos hipnoalgésicos u opiáceos. En: Velasco M.A., San Ramón L., Serrano J., Martínez-Sierra R., Cadavid I. (eds.) Farmacología fundamental, McGraw Hill Interamericana. Madrid. p. 355-374. [ Links ]
9. Wiart C. 2006. Ethnopharmacology of medicinal plants: Asia and the Pacific, 1a. Ed. Humana Press, New Jersey. p. 1-4. [ Links ]
10. Herz W. 2001. Chemistry of the Eupatoriinae. Biochemical Systematics and Ecology, 29:1115-1137. [ Links ]
11. Clavin M., Gorzalczany S., Macho A., Muñoz E., Ferraro G. , Acevedo C., Martino V. 2007. Antiinflammatory activity of flavonoids from Eupatorium arnottianum. Journal of Ethnopharmacology, 112:585—589. [ Links ]
12. Sasikumar J.M., Doss A.P.A., Doss A. 2005. Antibacterial activity of Eupatorium glandulosum leaves. Fitoterapia, 76:240—243. [ Links ]
13. Blair S., Mesa J., Correa A., Carmona-Fonseca J., Granados H., Sáez J. 2002. Antimalarial activity of neurolenin B and derivates of Eupatorium inulaefolium (Asteraceae). Die Pharmazie, 57:1-3. [ Links ]
14. Gupta M., Mazumder U.K., Chaudhuri I., Chaudhuri R.K., Bose P., Bhattacharya S., Manikandan L., Patra S. 2002. Antimicrobial activity of Eupatorium Ayapana. Fitoterapia, 73:168-170. [ Links ]
15. Maia J.G.S., Zoghbi M.G.B., Andrade E.H.A., Da Silva M.H.L., Luz A.I.R., Da Silva J.D. 2002. Essential oils composition of Eupatorium species growing wild in the Amazon. Biochemical Systematics and Ecology, 30:1071—1077. [ Links ]
16. Zhang M.L., Wu M., Zhang J.J., Irwin D., Gu Y.C., Shi Q.W. 2008. Chemical constituents of plants from the genus Eupatorium. Chemistry & Biodiversity, 5:40-46. [ Links ]
17. King RM, Robinson H 1970. Studies in the Eupatorieae (Compositae) new combinations in Ageratina. Phytologia, 19 (4):214. [ Links ]
18. Sánchez-González A., Granados-Sánchez D., Simón-Nabor R. 2008. Uso medicinal de las plantas por los otomíes del municipio de Nicolás Flores, Hidalgo, México. Revista Chapingo Serie Horticultura, 14(3): 271-279. [ Links ]
19. Granados-Sánchez D., Germán-H. R., López-Ríos G.F. 2000. Estudio ecológico florístico del municipio de Cuatepec de Hinojosa, Hidalgo. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 6(2):103-112. [ Links ]
20. García R.A. 1998. Geoecología del paisaje vegetal en el occidente de la ciudad de México. Anales de Geografía de la Universidad Complutense, 18:115-137. [ Links ]
21. Miño J., Muschietti L., Ferraro G., Martino V., Acevedo C. 2005. Antinociceptive activity of Eupatorium buniifolium aqueous extract. Fitoterapia, 76:100-103. [ Links ]
22. Owoyele B.V., Oguntoye S.O., Dare K., Ogunbiyi B.A., Aruboula E.A., Soladoye A.O. 2008. Analgesic, antiinflammatory and antipyretic activities from flavonoid fractions of Chromolaena odorata. Journal of Medicinal Plants Research, 2(9):219-225. [ Links ]
23. Umukoro S., Ashorobi R.B. 2006. Evaluation of the anti-inflammatory and membrane-stabilizing effects of Eupatorium odoratum. International Journal of Pharmacology, 2(5):509-512. [ Links ]
24. Romo de Vivar A., Cuevas L.A., Guerrero C. 1971. Eupaglabrin a terpene from Eupatorium glabratum. Revista Latinoamericana de Química 2:32-34. [ Links ]
25. Guerrero C., Silva M., Maldonado E., Martínez M. 1978. Eupaglabric acid a new compound isolated from Eupatorium glabratum H.B.K. Revista Latinoamericana de Química, 9:71-75. [ Links ]
26. Stoffel E.C., Ulibarri C.M., Folk J.E., Rice K.C., Craft R.M. 2005. Gonadal hormone modulation of mu, kappa and delta opioid antinociception in male and female rats. Journal of Pain, 6(4):261—274. [ Links ]
27. Stamford J.A. 1995. Descending control of pain. British Journal of Anaesthesia, 75:217-227. [ Links ]
28. Espejo E.F., Mir D. 1993. Structure of the rat's behaviour in the hot plate test. Behavioural Brain Research, 56:171-176. [ Links ]
29. Laird J.M.A., Herrero J.F., García de la Rubia P. y Cervero F. 1997. Analgesic activity of the novel COX-2 preferring NSAID. Meloxicam in mono-arthritic rats: central and peripheral components. Inflammation Research, 46:203-210. [ Links ]
30. Bohlmann F., Jakupovic J., Lonitz M. 1977. Über Inhaltsstoffe der Eupatorium Gruppe. Chemische Berichte, 110:301-314. [ Links ]
31. Delle Monanche G., Delle Monache F., Becerra J., Silva M., Menichini F. 1984. Thymol derivatives from Eupatorium glechonophyllum. Phytochemistry, 23(9):1947-1950. [ Links ]
32. Tori M., Ohara Y., Nakashima K., Sono M. 2001. Thymol derivatives from Eupatorium fortunei. Journal of Natural Products, 64(8):1048-1051. [ Links ]
33. Danneman P.J., Kiritsy J.A, Morrow T.J, Casey K.L. 1994. Central delay of the laser activated rat tail-flick reflex. Pain, 58:39-44. [ Links ]
34. Jasmin L., Cartens E., Basbaum A.I. 1997. Interneurons presynaptic to rat tail-flick motoneurons as mapped by transneuronal transport of pseudorabies virus: few have long ascending collaterals. Neuroscience, 76(3):859-876. [ Links ]
35. Dogrul A., Gülmez S.E., Deveci M.S., Gul H., Ossipov M.H., Porreca F., Tulunay F.C. 2007. The local antinociceptive actions of nonsteroidal antiinflammatory drugs in the mouse radiant heat tail-flick test. Pain Mechanisms, 104(4): 927-935. [ Links ]
36. Hassan H.S., Ahmadu A. A., Hassan A. S. 2008. Analgesic and antiinflammatory activities of Asparagus africanus root extract. African Journal of Traditional, Complementary and Alternative Medicines, 5(1):27-31. [ Links ]
37. Tsiklauri N., Viatchenko-Karpinski V., Voitenko N., Tsagareli M.G. 2010. Non-opioid tolerance in juvenile and adult rats. European Journal of Pharmacology, 629:68-72. [ Links ]














