Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ingeniería mecánica, tecnología y desarrollo
versão impressa ISSN 1665-7381
Ingenier. mecáni. tecnolog. desarroll vol.4 no.6 México Mar. 2014
Artículos
Estudio Experimental de la Reducción de Fricción en la Conducción de Fluidos usando Surfactantes
1Ponce Morales Rogelio, 2Sánchez Silva Florencio, 2Carvajal Mariscal Ignacio, 2Toledo Velázquez Miguel, 3Cruz Maya Juan Antonio
1 SEPI-ESIME Unidad Culhuacán
2 Laboratorio de Ingeniería Térmica e Hidráulica Aplicada, IPN-SEPI-ESIME Zacatenco
3 UPIITA-IPN
Fecha de recepción: 24-08-2013
Fecha de aceptación: 19-10-2013
Resumen
Se realizó una investigación experimental con disoluciones agua-surfactante, con el fin de analizar la influencia del uso de estos aditivos en la reducción de fricción durante la conducción de líquidos en tuberías. Se probaron tres tipos de surfactantes: aniónico, catiónico y no-iónico. Se diseñó y construyó una instalación experimental con una zona de pruebas de tubería de acrílico con un diámetro interno de 19 mm y una longitud de 5,700 mm. Las concentraciones de los surfactantes en las disoluciones fueron de 150, 250, 500, 750 y 1,000 ppm, preparados de acuerdo con un programa experimental que tomó en cuenta la cantidad y tipo de aditivo agregado en diferentes flujos másicos de líquido. Las pérdidas de presión se compararon contra las que se obtienen cuando fluyen los mismos flujos de agua por la instalación. Los resultados experimentales que se obtuvieron muestran una reducción en la fricción hasta del 44.3 % a un Re=6,851 (que corresponde a un Re=11,243 sin adición de surfactantes) y a una concentración de 250 ppm de cloruro de cetil trimetil de amonio, al que se le agregaron100 ppm de salicilato de sodio (NaSal) como estabilizador para la micro estructura del surfactante, que se aplica solo a surfactantes de tipo catiónico. Los resultados son prometedores pero quedan por estudiar algunos aspectos como la mejor forma de inyectar y recuperar los surfactantes, el mezclado más eficiente, los mecanismos que producen la reducción de fricción y el efecto de la temperatura entre otros.
Palabras clave: surfactantes, flujo en tuberías, reducción de fricción, estudio experimental, pérdida de presión.
Abstract
The experimental results of the water-surfactants dissolution in the drag reduction during the liquid conduction in pipes are presented. An experimental research with water-surfactant mixtures flows was undertaken, three types of surfactants were tested: anionic, cationic and non ionic. An experimental set up was designed and built; the test section was a cylindrical plexiglass 19 mm internal diameter pipe whose length was 300 D. The surfactant concentrations in the mixtures were 150, 250, 500, 750 and 1,000 ppm, added according to an experimental program which considered the quantity and type of additive supplied in different liquid mass flow rates. The experimental pressure drop was compared against the ones obtained with the same water flow rates used in the experimentation. A drag reduction around 44.3 % was attained for a Re = 6,851 (Re = 11,243 without surfactant addition), corresponding to a water solution with 250 ppm of cetyl trimethyl ammonium chloride with 100 ppm of Sodium Salicylate as a stabilizer. Experimental results are promising but there are still some questions waiting for a response like: the way to inject and recover surfactants, mechanisms which produce the drag reduction, and the temperature effect, among others.
Keywords: surfactants, pipe flow, drag reduction, experimental study, pressure drop.

Introducción
La demanda de energía del mundo aumenta día con día, esta situación requiere la implementación de medidas conducentes a su uso racional ya su optimización en los procesos industriales, con el fin de suavizar la implementación de nuevas energías y contribuir a la reducción del impacto ambiental. Entre estas medidas, la reducción de la fricción en la conducción de fluidos (petróleo, gas, agua, cemento, lodos de perforación, sistemas de acondicionamiento de aire, etc.) por medio de ductos, puede producir un ahorro importante de la energía que se utiliza en los sistemas de bombeo y de compresión, así lo demuestran numerosos estudios; Chara et al. (1993), Gasljevich et al. (2001), Hellsten (2002), Fichman y Hetsroni (2004), Drappier et al. (2006).
Como se sabe, la fricción de arrastre se produce debido a la interacción del flujo de un fluido con la superficie sólida del conducto por donde fluye. El fluido viscoso en contacto con la superficie sólida produce una zona denominada capa límite dinámica donde se generan importantes gradientes radiales de velocidad debido a la viscosidad del fluido y es precisamente en esta zona donde ocurre el fenómeno de fricción de arrastre que está asociado con el esfuerzo cortante sobre la superficie y con la viscosidad del fluido. Para flujo laminar el esfuerzo cortante se expresa de la siguiente manera.

Para el caso de flujo turbulento, el esfuerzo cortante se ve afectado por el tensor de esfuerzos de Reynolds,

Por otro lado, el coeficiente de fricción se define en función del esfuerzo cortante y la energía cinética del fluido,

por lo tanto, para reducir la fricción, se debe reducir el esfuerzo cortante. En la ecuación (1) se observa que el esfuerzo cortante, sobre la superficie, provocado por la interacción con el fluido, depende básicamente de dos factores: uno es la viscosidad del fluido, la cual a su vez depende de la cohesión y el intercambio de momentum entre las moléculas del fluido, y el segundo es el gradiente radial de velocidad sobre la pared del ducto, el cual depende también de la viscosidad del fluido y del número de Reynolds. Esto indica, en principio, que cualquier método que reduzca tanto la viscosidad como la estructura de la capa límite que afecta directamente al gradiente de velocidad, estará contribuyendo a la reducción de la fricción. Por otra parte en la ecuación (2), aparece un tercer factor denominado tensor de esfuerzos de Reynolds, que está relacionado directamente con la intensidad de la turbulencia, se puede observar que su efecto es negativo en el esfuerzo cortante, por lo que de acuerdo con esto, se debería promover cierto tipo de turbulencia en la capa límite para reducir la fricción.
La presencia de agentes que modifican la estructura de la capa límite, también varían la intensidad de la turbulencia, la cual puede en alguna medida disminuir la fricción de arrastre y alejar la zona de separación de la capa límite sobre las superficies no aerodinámicas.
La inyección de surfactantes en la capa límite es un medio para modificar su estructura vorticosa y la intensidad de turbulencia, por lo tanto también es una técnica de reducción de la fricción de arrastre. Las pequeñas concentraciones de macromoléculas de surfactantes y polímeros pueden ser agentes reductores de la fricción en la capa límite, debido a que forman micro vórtices que aumentan localmente la turbulencia, Metzner (2004).
Los surfactantes tienen una estructura similar a la de un resorte, por lo que Lumley (1969) propuso la teoría que al alargarse las moléculas de los surfactantes, que sin movimiento están en forma de espiral, aumenta la viscosidad efectiva. Como consecuencia, los grandes vórtices se dividen en pequeños lo que permite el engrosamiento de la subcapa viscosa y por lo tanto promueve la reducción de la fricción. Sin embargo De Gennes (1990) y Astarita (1965) sugieren que la reducción de la fricción se debe principalmente a las propiedades elásticas de los fluidos en lugar de las viscosas.
Aunque el efecto de las soluciones de surfactantes en la reducción de fricción fue publicado por primera vez por Mysels (1949, 1972), las investigaciones no fueron exhaustivas, ya que se prestó mayor atención a las soluciones con polímeros. Las disoluciones de surfactantes son atractivas debido a su estabilidad química y mecánica, que es un requisito importante para los usos prácticos. Por otro lado, Truong (2001) determinó experimentalmente que las concentraciones que se requieren para reducir fricción por adición de surfactantes y polímeros son muy similares.
En las últimas décadas el interés por la reducción de fricción por medio de la adición de surfactantes se ha incrementado como lo muestra la revisión de la literatura reciente Kim et al. (2011), Rozanski (2011), Hadri y Guillou (2010), Tamano et al. (2010), Li et al. (2008), Sher y Hetsroni (2008), Kawaguchi et al. (2007).
Surfactantes
Los surfactantes tienen una gran variedad de aplicaciones en la industria como detergentes, inhibidores de corrosión, transporte de petróleo, transporte de agua y cosméticos entre muchos otros, López Trosell A. (2005).
La clasificación de los surfactantes se fundamenta básicamente en sus propiedades fisicoquímicas y en el poder de disociación del tenso activo en presencia de un electrolito: por lo tanto, los surfactantes pueden ser iónicos o no-iónicos, y dentro de los iónicos, según la carga que posea la parte que presenta la actividad de superficie, serán aniónicos, catiónicos y anfóteros, Salager J. L. (2002).
Los surfactantes aniónicos son aquellos que luego de la disociación en solución acuosa, presentan carga negativa en el extremo del grupo hidrófobo o lipofílico, es decir que los constituyentes aniónicos (sulfonatos, sulfatos, fosfatos, etc.) permanecen unidos a la fracción orgánica compuesta por una cadena alquílica lineal o ramificada. Savins (1967, 1968) realizó trabajos extensos sobre los surfactantes aniónicos como agentes reductores de la fricción en soluciones acuosas. Este autor observó que la adición de un electrolito ayudaba a aumentar la reducción de fricción; expuso que el electrolito promueve la asociación de las moléculas de jabón.
Los surfactantes catiónicos, son aquellos que en solución forman iones, resultando cargado positivamente el grupo hidrófobo de la molécula. Hasta la fecha resultan más costosos que otros tipos de surfactantes, además, se degradan químicamente en soluciones acuosas en cuestión de algunos días lo que podría ser una desventaja en algunas aplicaciones. Por otra parte, según lo reportado por Truong (2001), aunque son mecánicamente estables, térmicamente no lo son y esta es la razón principal por lo que su uso es limitado.
Los surfactantes anfóteros presentan en su molécula a grupos aniónicos y catiónicos. Como su nombre lo indica, actúan dependiendo del medio en que se encuentren, en medio básico son aniónicos y en medio ácido son catiónicos.
Por otro lado, los surfactantes no-iónicos son aquellos que se disocian en solución en partículas no cargadas eléctricamente ya que su parte hidrofílica está formada por grupos polares no ionizados tales como el alcohol, el tiol, el éster o éter; esta característica los hace compatibles con otros tipos de surfactantes y permite su incorporación a formulaciones complejas debido a que no interactúan con otros compuestos químicos y/o elementos en solución y en suspensión. Tienen la ventaja de ser mecánica y químicamente más estables que los surfactantes aniónicos y catiónicos, Truong (2001).
Concentración micelar crítica
Cuando a una solución (acuosa por ejemplo) se le añade gradualmente una cantidad mayor de surfactante, este comienza por absorberse a las interfaces disponibles, luego su concentración mono molecular, aumenta hasta que se forman las primeras micelas o agrupaciones de moléculas que generan "clusters" hasta alcanzar un valor crítico. Sin embargo, la asociación de las moléculas a las micelas es reversible, es decir, cuando la concentración está por debajo del valor crítico, las micelas se disocian nuevamente en moléculas individuales. Las micelas están siempre en equilibrio termodinámico con las moléculas, y su tamaño se encuentra en el intervalo de 20 a 1,000 moléculas del surfactante, Truong (2001). Dependiendo de la estructura molecular, concentración y tipo del solvente, se pueden distinguir tres tipos geométricos de micelas: esferas, barras, y discos. Además, agregando algunas sales (electrólitos), las fuerzas de repulsión electrolítica de los grupos principales se logran disminuir y las moléculas se pueden empacar con mayor facilidad, dando lugar a la formación de micelas de disco o de barra. La capacidad de reducir fricción en una solución de surfactante depende en gran medida de la forma de estas micelas como se muestra en la figura 1.
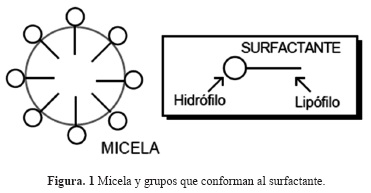
La concentración micelar crítica (CMC) de acuerdo con Salager (1992), es afectada por varios factores como: el grupo hidrofílico, el grupo hidrófobo, la adición de sales, la temperatura y los solventes orgánicos. El efecto de la temperatura en la concentración micelar crítica de un surfactante en un medio acuoso es complejo, Rosen (2004) precisa que la CMC disminuye con la temperatura hasta un valor mínimo y posteriormente aumenta con la misma.
Instalación Experimental
Se diseñó el montaje experimental que se muestra en la figura 2; está formado por un tanque de mezclado con un volumen de 400 litros, una bomba de1/4 de HP, tubería de acrílico de 19 mm de diámetro interior, un rotámetro con rango de 0-20 l/min, y un transductor de presión diferencial con un rango de 0-100 Pa, para medir la caída de presión en el sistema. Tanto el transductor de presión diferencial, como el rotámetro fueron calibrados utilizando los métodos convencionales.
Todos los instrumentos se conectaron a una tarjeta de adquisición de datos, la cual enviaba la información a una computadora para su almacenamiento y su posterior análisis.
El transductor de presión diferencial marca GE Druck, estaba conectado a dos tomas de presión separadas 0.4 m entre sí, las cuales se colocaron en la zona donde se tiene flujo completamente desarrollado. Por otra parte, también se verificó con un nivel de gota que la tubería estuviera perfectamente horizontal, para evitar el efecto de cualquier desnivel.
En los experimentos que se realizaron en este trabajo se utilizaron tres surfactantes de calidad industrial:
• Surfactante catiónico. Cloruro de cetil trimetil de amonio, al cual se le adicionó un estabilizador: Salicilato de Sodio NaSal.
• Surfactante Aniónico. Laurileter sulfato de sódio.
• Surfactante No-iónico. C8-16 alquil poliglucósido.
Investigación Experimental
Para analizar los efectos de los surfactantes sobre la viscosidad y en el gradiente de presión al variar la concentración de las disoluciones, se planeó el trabajo experimental de la siguiente manera:
a.) Determinar las propiedades de la disolución agua-surfactante, viscosidad y densidad, a las diferentes concentraciones que se utilizarían en las pruebas, ya que aparecen en la ecuación para evaluar la pérdida de presión (ecuación 5).
b.) Determinar la pérdida de presión empleando los mismos flujos de agua que se utilizarían en los experimentos, para que sirva como referencia en la comparación de los resultados.
c.) Determinar la pérdida de presión en un flujo de agua agregando surfactantes, con reemplazo del agua en cada cambio de la concentración del surfactante, para evitar el posible efecto de la degradación del aditivo.
d.) Determinar la pérdida de presión en un flujo de agua agregando surfactantes, pero sin reemplazo del agua cuando se cambia la concentración del surfactante, empezando de la concentración más baja a la más alta. Esto último se realizó para observar el efecto de la posible degradación de los surfactantes.
Se emplearon cuatro concentraciones diferentes para obtener la pérdida de presión con cada uno de los 3 surfactantes.
(a) Determinación de las propiedades de la disolución (agua-surfactante)
La caracterización de las disoluciones agua-surfactante se realizó por medio de tres repeticiones de los experimentos en estático, lo cual proporcionó la viscosidad de las disoluciones agua-surfactante, para ocho concentraciones y tres tipos de surfactantes (catiónico, aniónico y no-iónico). Para ello, se utilizó un viscosímetro de balín Marca Gilmont, con rango de 0.2 a 2 cP, y una balanza diferencial Ohaus, modelo: Triple beam, serie: 700/800 con capacidad máxima de 610 g y una sensibilidad de ±0.01 gramos para determinar la densidad de las disoluciones.
La primera serie de mediciones consistió en determinar la viscosidad del agua que se utilizó en los experimentos, la cual dio 1 cP. En la segunda, se determinó la viscosidad de las disoluciones agua-surfactante para concentraciones de 150, 250, 500, 750 y 1,000 ppm, en cada uno de los tres surfactantes (catiónico, aniónico y no-iónico). En cada ocasión que se realizaba una medición, es decir, para cada nueva concentración, se remplazaba el agua del experimento, se agregaba el aditivo y se mezclaba uniformemente. La tercera serie de mediciones fue similar a la segunda, con la diferencia de que se aumentaba gradualmente la concentración del surfactante de 250 en 250 ppm, hasta llegar a 1,000 ppm y no se hacía ningún reemplazo de agua. El reemplazo de agua se realizaba únicamente cuando se cambiaba el tipo de surfactante.
Los resultados experimentales que se obtuvieron indican que la concentración del surfactante tiene una influencia notable en la magnitud de la viscosidad de las disoluciones agua-surfactante. Así se encuentra que para concentraciones mayores de 150 ppm, el surfactante catiónico mostró una viscosidad superior a la del agua, desde un 31.7 hasta un 115 % a una concentración de 1,000 ppm, siendo solo el surfactante no-iónico el que mostró una reducción de viscosidad de la disolución, hasta del 10 % por debajo de la viscosidad del agua, en concentraciones de 250 ppm. Sin embargo, el surfactante aniónico, siempre mostró un aumento de viscosidad de la disolución, al incrementarse la concentración pero en menor medida que la del surfactante catiónico como se muestra en la figura 3, donde se han unido los puntos experimentales con una línea continua con el fin de facilitar la interpretación del lector.
En las mediciones de la viscosidad sin reemplazo de agua, se observó una tendencia similar y no hay un efecto apreciable del reemplazo del agua. Cabe mencionar que en promedio, la duración de cada medición fue de 60 minutos aproximadamente.
En lo que respecta a la densidad de la disolución, en cada medición, es decir, para cada nueva concentración, no se remplazaba el agua del experimento, solo se agregaba el aditivo y se mezclaba uniformemente, todas las mediciones se realizaron a la temperatura del medio ambiente que en general oscilaba entre 21 ± 1ºC, empleando el método del volumen conocido. Cabe mencionar que no hubo una gran variación del valor de la densidad al cambiar las concentraciones, puesto que se trata de un balance de masa. La densidad de la disolución varió menos del 1.0% con respecto a la del agua para el surfactante catiónico a una concentración de 150 ppm, a mayores concentraciones la densidad fue prácticamente la misma que la del agua como se puede apreciar en la figura 4, donde se grafica la densidad relativa de la disolución con el surfactante catiónico a diferentes concentraciones. Para los otros surfactantes el comportamiento fue similar. De estas mediciones se puede inferir que la variación de la densidad de la disolución agregando surfactantes para un mismo fluido de base, es un factor que afecta muy poco a la reducción de la fricción. Además, el adicionar surfactantes al agua no afecta a la medición del gasto másico, el cual se efectuó por medio de un rotámetro.

(b) Pérdida de presión en un flujo de agua sin añadir surfactantes
Con el fin de tener una referencia para saber si existe o no reducción de fricción, se realizó una serie de experimentos utilizando solo agua, para los mismos flujos másicos que se probaron con los surfactantes.
Para esta serie de experimentos, se diseñó un experimento donde se tomaron 120 lecturas de pérdida de presión de cada uno de los flujos que se manejaron en los experimentos con los tres diferentes surfactantes, posteriormente de estas lecturas se obtuvo un promedio. Se realizaron tres repeticiones para verificar que los promedios no tuvieran desviaciones mayores al 5%. La figura 5, muestra la pérdida de presión de los flujos de agua que se utilizaron en las pruebas y la figura 6 el factor de fricción en función del número de Reynolds para las mismas condiciones.
El coeficiente de fricción se determinó utilizando la ecuación desarrollada por P. K. Swarmee y A. K. Jain (1976), que proporciona ± 1.0 % de los valores que arroja la ecuación de Colebrook, dentro del intervalo de rugosidad relativa de D/e, comprendido entre 1,000 y 106, y para números de Reynolds que van de 5,000 hasta 1x108. Lo cual es la zona de turbulencia completa en el diagrama de Moody. En este estudio con el diámetro de 0.019 m y una rugosidad del acrílico de 0.0000015 m se tiene D/e = 12,670, por lo que es aplicable la ecuación.

En lo que respecta a la pérdida de presión, ésta se evaluó por medio de la relación,

(c) Pérdida de presión en un flujo de mezcla agua-surfactante, con reemplazo.
La tercera serie de experimentos consistió en determinar la caída de presión para cuatro concentraciones de cada uno de los tres tipos de surfactante empleados. En esta serie de experimentos, cada vez que se realizaba una corrida se reemplazaba el agua del experimento, para evitar cualquier posible efecto de la degradación del surfactante.
Los surfactantes catiónicos se pueden preparar en agua, solamente si se estabilizan agregándoles una substancia, ya que su falta de afinidad por el agua provoca que se separen rápidamente de ella. La estabilización de estos surfactantes se realiza por medio de la adición de iones, los cuales al absorberse pueden interactuar con el agua y de esta manera estabilizan el surfactante. La mutua repulsión entre las partículas del surfactante con los iones adsorbidos de la misma carga evita que las partículas choquen y aumenten su tamaño, como lo indica Moore (2000). Para estabilizar el surfactante catiónico se agregó salicilato de sodio. Las tablas 1 y 2 muestran las concentraciones que se utilizaron en las disoluciones con los surfactantes catiónico, aniónico y no-iónico. De igual forma que en todos los experimentos realizados en este trabajo, se efectuaron tres repeticiones por cada corrida con el fin de verificar que no hubiese desviaciones mayores al 5%.


(d) Pérdida de presión en un flujo de mezcla agua-surfactante, sin reemplazo.
En vista de que se pretendía conocer la influencia que provoca la degradación de los surfactantes en la caída de presión, se realizó la cuarta serie de experimentos con los mismos flujos y concentraciones de los tres surfactantes, pero en esta ocasión sin reemplazar el agua en cada incremento de concentración de los surfactantes. Con esto, los surfactantes ya recirculados se dejaban en la disolución y solo se agregaba la cantidad complementaria del aditivo.
El procedimiento que se siguió en el experimento (d) fue muy similar al mostrado en el experimento (c), salvo que no hubo reemplazo del agua.
La estimación del error relativo, tomando en cuenta el error provocado por las mediciones directas, del flujo másico de la mezcla agua-surfactante, de la concentración del surfactante, de la cantidad de electrolito agregado, así como la medición de la caída de presión, mostraron que no excedió el ±5.0 %. El error asociado en la determinación de las nuevas condiciones no excedía el ±4.5 %.
Resultados Experimentales
En lo que respecta a las pruebas de referencia, como ya se indicó, la figura 5 muestra los resultados obtenidos para el flujo de agua sin adición de surfactantes, usando los mismos gastos másicos de agua que se utilizaron en las pruebas con los aditivos. Se puede observar que hay una diferencia, entre lo que arroja la teoría usando las ecuaciones (4 y 5) y las mediciones experimentales, sobre todo a bajas velocidades que corresponden a Reynolds menores de 10,000, las diferencias pueden deberse a que la ecuación para calcular el factor de fricción produce errores más grandes en esta zona y sobre todo a que la tubería de acrílico no tiene una sección perfectamente circular, por lo que para realizar la comparación se decidió utilizar las mediciones experimentales. Por otro lado, la figura 6 muestra el factor de fricción calculado utilizando la ecuación (4) y el determinado experimentalmente usando los resultados de las pérdidas de presión. En virtud de que no se conoce con exactitud el estado de la superficie de la tubería que se utilizó en las pruebas, se decidió utilizar los datos que se obtuvieron experimentalmente para comparar los resultados de la pérdida de presión con adición de surfactantes, aunque la rugosidad del acrílico se puede tomar como D/e = 12,670.
Por otro lado, la reducción porcentual de fricción para fines del presente trabajo se definió como se indica en la ecuación (6).

Donde fss es el factor de fricción del flujo de agua sin surfactantes, que en este caso corresponde al que se obtuvo de manera experimental en el experimento (b) y fcs, es el factor de fricción del flujo de agua con surfactantes, que también se obtuvo experimentalmente en los experimentos (c) y (d). La figura 7 muestra la relación que hay entre el factor de fricción experimental usando surfactantes contra el experimental sin surfactantes, para el caso del surfactante catiónico, para diferentes números de Reynolds, calculado y corregido con la viscosidad modificada por la presencia del surfactante y tomando como parámetro la concentración. Se puede observar en la gráfica que cuando se aumenta el número de Reynolds, disminuye la relación entre los factores de fricción, es decir hay mayor reducción de fricción, y esto es más notable con la concentración de 250 ppm. El valor fcs/fss= 1 corresponde al caso donde se tiene un flujo de agua sin surfactante.
Si estos mismos resultados se grafican pero ahora la reducción de fricción está en función del número de Reynolds corregido, se observa claramente que la mayor reducción de fricción se obtiene con la concentración de 250 ppm del surfactante catiónico. Además, esta reducción de fricción tiene una tendencia a aumentar cuando se incrementa el Reynolds, como se puede ver en la figura 8 (el valor %DR= 0 corresponde al caso donde se tiene sólo agua sin surfactante). Por otro lado, en la figura 9 se grafica la relación de coeficientes de fricción en función de la concentración, tomando como parámetro el número de Reynolds del flujo de agua sin surfactantes. Se observa que efectivamente existe una concentración en la cual se obtiene la mayor reducción de fricción y corresponde a la concentración de 250 ppm y esto se mantiene para cualquier Reynolds, adicionalmente se puede observar que la reducción de fricción aumenta con el número de Reynolds.
Los mismos experimentos, con las concentraciones del surfactante catiónico y flujos de agua que se reemplazaban, cada vez que se incrementaba la concentración del surfactante, se realizaron para los surfactantes aniónico y el no-iónico.
Los resultados de los experimentos de pérdida de presión para los surfactantes aniónico y no-iónico se muestran en la figuras 10 y 11, donde se puede observar que la reducción de fricción es pequeña comparada con los resultados que se obtuvieron con el surfactante catiónico. Para el surfactante aniónico la reducción de fricción mayor fue apenas del 5.5 % y se logró con una concentración de 1,000 ppm, mostrando un comportamiento distinto al del surfactante catiónico, ya que la mayor reducción de fricción se obtuvo con las mayores concentraciones de surfactante. Para el surfactante no-ionico la reducción máxima que se logró fue del 10 % y se obtuvo con una concentración de 1,000 ppm para Reynolds bajos, esto también muestra un comportamiento opuesto a la de los otros dos surfactantes donde la reducción de fricción aumenta cuando crece el Reynolds.
El experimento para el surfactante no-iónico fue uno de los más complicados ya que se realizaron un gran número de pruebas experimentales sin encontrar resultados congruentes, por ello se tomó la decisión de elevar la temperatura del fluido de trabajo a T= 35ºC, ya que este surfactante se ve afectado por la temperatura como lo señaló Sabahi Nadia (2004) y a 35 ºC se mantenía estable.
Por otro lado, con el fin de evaluar la posible degradación de los surfactantes, se realizó la serie de experimentos (d), sin reemplazar el agua al ir incrementando la concentración, es decir, como ya se mencionó, solo se agregaba gradualmente la cantidad de surfactantes para incrementar la concentración. En la figura 12 se muestran los resultados obtenidos, solo con el surfactante catiónico, ya que fue el que dio mejores resultados en la reducción de fricción.
Al igual que en el caso de los experimentos con reemplazo del agua, la mayor reducción de fricción se logró con una concentración de 250 ppm, pero la diferencia de reducción de fricción fue de apenas un 6%, respecto al caso con remplazo de agua. Lo anterior puede deberse a la degradación de los surfactantes ya que el tiempo que tomaba cada prueba era de alrededor de 8 horas. Aun así, la disminución del efecto de reducción de fricción se esperaba aún mayor, sin embargo, con el tiempo de experimentación no fue posible determinar su efecto.
Discusión de los Resultados
De acuerdo a la ecuación (3), el esfuerzo cortante en las diferentes capas del flujo tiene que ver directamente con la fricción, pero en mayor medida en la capa límite. En vista de que la densidad prácticamente no varía con la concentración de surfactantes, para un flujo determinado de un fluido, la energía cinética no varía por lo que la fricción y la reducción de fricción solo son atribuibles al esfuerzo cortante, que tiene que ver con la viscosidad, el gradiente de velocidad y el tensor de esfuerzos de Reynolds.
Por otro lado, las propiedades del fluido que afectan a la pérdida de presión, durante la conducción del mismo, son básicamente la densidad y la viscosidad. La primera tuvo una variación menor al 1% al formar una disolución con 150 ppm del surfactante catiónico, a mayores concentraciones, se tiene prácticamente la densidad del agua (figura 4). Por esta razón se puede inferir que la variación de la densidad al agregar surfactantes no es un factor importante para la reducción de la fricción en esta serie de experimentos.
En lo que respecta a la viscosidad, para el surfactante catiónico, la medición de la viscosidad en estático con reemplazo de agua indican que la viscosidad de la disolución aumenta desde 31.7 % para concentraciones de 150 ppm, hasta 115 % respecto a la del agua a una concentración de 1,000 ppm. Para el surfactante aniónico el incremento máximo de viscosidad fue de 18.08 % a una concentración de 1,000 ppm, pero siempre se tuvo una viscosidad mayor a la del agua al incrementarse la concentración del surfactante. Respecto al surfactante no-iónico al aumentar su concentración reduce la viscosidad de la mezcla hasta en un 12.14 % con respecto al del agua sin adicionar algún químico.
De acuerdo con las ecuaciones (1) y (2), un incremento de la viscosidad aumenta al esfuerzo cortante, y el número de Reynolds disminuye.
En la medición de la viscosidad en estático sin reemplazo de agua, la viscosidad para la mezcla agua-surfactante catiónico fue mayor a las otras dos disoluciones agua-surfactante aniónico y agua-surfactante no-iónico, para todas las concentraciones medidas; sin embargo, la viscosidad disminuyó en un promedio de 4.5%, esto se puede atribuir al hecho de que hay un reacomodo del aditivo cuando se agrega a la mezcla ya existente. Para el surfactante aniónico la viscosidad siempre fue mayor que la del agua y aumentaba gradualmente conforme se aumentaba la concentración, hasta llegar a un valor máximo de 12.72 % a 1,000 ppm. Respecto al surfactante no-iónico, al agregar surfactantes la viscosidad disminuía hasta en un 12.13 % respecto a la del agua a 250 ppm y aumentaba gradualmente hasta 12 % a 1,000 ppm. En vista de que los resultados fueron prácticamente los mismos, se puede concluir que el reemplazo del agua no afecta a la viscosidad de las soluciones que se utilizaron en los experimentos.
En los experimentos para determinar la pérdida de presión en las soluciones agua-surfactante, se obtuvo una reducción de fricción hasta de 43.9 % usando concentraciones de 250 ppm del surfactante catiónico al que se le agregó100 ppm de un estabilizador denominado salicilato de sodio NaSal. Con el surfactante aniónico, se obtuvo una reducción máxima del 5.7 % la cual se alcanzó con una concentración de 1000 ppm. Finalmente con el surfactante no-iónico se obtuvo una reducción máxima de 10.3 % con una concentración de 1,000 ppm.
La misma serie de experimentos se repitieron sin reemplazar el agua, las resultados mostraron una pequeña disminución de la reducción de fricción del orden del 6%, de la máxima que se obtuvo con el surfactante catiónico (43.9 %). Lo anterior posiblemente se deba a la degradación del surfactante ya que cada experimento duraba alrededor de 8 horas.
Por lo tanto, se concluye que efectivamente se puede lograr una reducción de la fricción empleando surfactantes, sobre todo con el surfactante catiónico donde se reduce la fricción hasta en casi un 44 % respecto a la fricción que se obtiene con la conducción del mismo gasto másico de agua pero sin el químico.
Respecto a la reducción de la fricción se puede decir que existen dos efectos: uno es la reducción de la fricción debido a la disminución de la viscosidad de la disolución agua-surfactante (con lo cual se reduce el esfuerzo de corte), que en este estudio solo ocurre con el surfactante no-iónico donde la viscosidad disminuye 10 % a una concentración de 250 ppm; el otro es la disminución de la fricción por el efecto del surfactante mismo en la estructura de la capa límite, sobre todo cuando se tiene una concentración de 250 ppm de surfactante catiónico ya que con esta concentración la viscosidad aumenta 45% con respecto al del agua, es decir el único agente reductor de fricción es la presencia del surfactante en la capa límite, donde sus cadenas de moléculas forman una entramado axial que promueve una turbulencia local y disminuye el esfuerzo cortante en esta zona. Con esta misma concentración, la reducción de fricción aumenta cuando el número de Reynolds aumenta, con lo cual en cierta forma se comprueba que al incrementarse los esfuerzos de Reynolds, el esfuerzo de corte disminuye y por lo tanto también la fricción (figura 8).
Sin embargo, posteriormente a esta concentración, la magnitud de la reducción de fricción disminuye debido entre otros factores a que la viscosidad aumenta hasta en un 115 % respecto al del agua a 1,000 ppm y además posiblemente se deba a que se pierda el efecto hidrodinámico en la capa límite (figura 9) lo que coincide con las conclusiones del trabajo experimental de Li et al. (2008).
Conclusiones
Se realizaron mediciones de la densidad de la disolución agua-surfactante y se encontró una variación menor al 1 % al agregarle 150 ppm del surfactante catiónico, a mayores concentraciones es prácticamente similar a la densidad del agua. Por lo que se considera que la variación de la densidad al agregar surfactantes no es un factor que afecte a la reducción de la fricción.
En lo que respecta a la viscosidad, se realizaron mediciones en estático con reemplazo de agua y sin reemplazo de agua. El surfactante catiónico mostró un aumento de la viscosidad en la mezcla hasta en 115 % respecto a la del agua a una concentración de 1,000 ppm y siempre se mantuvo mayor que la del agua, por ejemplo a 150 ppm fue de 31.7%. En las pruebas con reemplazo de agua los resultados fueron prácticamente los mismos, por lo que se concluye que el reemplazo del agua afecta muy poco a la viscosidad de las soluciones de los experimentos.
En los experimentos para determinar la pérdida de presión en las soluciones agua-surfactante, a las condiciones en que se realizaron los experimentos, se obtuvo una reducción de fricción hasta de un 43.9 % usando concentraciones de 250 ppm del surfactante catiónico al que se le agregó un estabilizador denominado salicilato de sodio NaSal. Con el surfactante aniónico, se obtuvo una reducción máxima del 5.7 % la cual se alcanza con una concentración de 1,000 ppm. Finalmente con el surfactante no-iónico se alcanzó una reducción máxima de 10.3 % con una concentración de 1,000 ppm.
En lo que se refiere a los experimentos sin reemplazar el agua, los resultados muestran una pequeña disminución de la reducción de fricción del orden del 8%, alcanzada usando el surfactante catiónico con reemplazo de agua, debido a una posible degradación del surfactante ya que cada experimento duraba alrededor de 8 horas. Sin embargo este efecto no se puede evaluar objetivamente debido a que faltan más datos.
A pesar de los resultados alentadores, aún resta por investigar la degradación de los surfactantes y su efecto, entender el mecanismo de reducción de fricción por adición de surfactantes, la razón por la cual aumenta la viscosidad al agregar surfactantes, hacer un modelo matemático de la viscosidad y el esfuerzo cortante que contemple la degradación de los surfactantes y su distribución dentro del conducto y sobre todo en la capa límite.
En conclusión, el surfactante catiónico es el que ofrece mayor reducción de fricción, pero aún quedan varias cosas por estudiar, que permitan desarrollar tecnologías que sean técnica, económica y ambientalmente aceptables.
Referencias
Astarita G., "Possible Interpretation of Mechanism of Drag Reduction in Viscoelastic Liquids", Ind. Eng. Chem. Fundamen., 4 (3), (1965), pp 354–356. [ Links ]
Chara Z., Zakin J. L., Severa M., Myska J. (1993), "Turbulence measurements of drag reducing surfactant systems", Vol. 16. [ Links ]
De Gennes, P.G., "Introduction to Polymer Dynamics". Cambridge University Press, New York, (1990). pp: 1-16. [ Links ]
Dodge D. W. and Metzner A. B. "Turbulent flow of non-Newtonian systems", AIChE Journal., 5, (1959), pp189–203. [ Links ]
Drappier J., T. Divoux, Y. Amarouchene, F. Bertrand , S. Rodts, O. Cadot, J. Meunier and Daniel Bonn (2006), "Turbulent drag reduction by surfactants". Europhys. Lett., 74 (2). [ Links ]
Fichman M., Hetsroni G. (2004), "Electrokinetic aspects of turbulent drag reduction in surfactant solutions", Physics of Fluids, Vol. 16 (12). [ Links ]
Gasljevic K, Aguilar G., Matthys E.F. (2001), "On two distinct types of drag-reducing, diameter scaling, and turbulent profiles", J. Non-Newtonian Fluid Mech., Vol. 96. [ Links ]
Hadri F., Guillou S. (2010), "Drag reduction by surfactant in closed turbulent flow", International Journal of Engineering Science and Technology, Vol. 2(12). [ Links ]
Hellsten M. (2002), "Drag-reducing surfactants", Journal of Surfactants and Detergents, Vol. 4(1). [ Links ]
Kawaguchi Y, Li F. C., Yu B., Wei J.J. (2007), "Turbulent drag reduction with surfactant additives – Basic research and application to an air conditioning system", New Trends in Fluid Mechanics Research, Shanghai China. [ Links ]
Kim Jung Tae, Kim Chul Am, Zhang Ke, Jang Chun Hag, Choi Hyoung Jin 2011, "Effect of polymer–surfactant interaction on its turbulent drag reduction", Colloids and Surfaces A: Physico chemical and Engineering Aspects, Vol. 391, Issues 1–3. [ Links ]
Li Feng-Chen, Kawaguchi Yasuo, Yu Bo, Wei Jin-Jia, Hishida Koichi (2008), "Experimental study of drag-reduction mechanism for a dilute surfactant solution flow", International Journal of Heat and Mass Transfer,Vol. 51, issues 3-4. [ Links ]
López Trosell A. I., (2005) "Effects of nonionic surfactants on the interactions of different nanoparticle materials on glass surfaces", Technischen Universitat Berlin zurerlangung des akademischen grades, march 2005. [ Links ]
Lumley, J.L., (1969). "Drag reduction by additives". Ann. Rev. Fluid Mech., 1: 367-384. [ Links ]
Metzner, A. B. (2004) "Turbulent drag reduction". Presentation in a Symposium in Honor of Jan Mewis, Leuven, University, Leuven, Belgium, September 22, 2004. [ Links ]
Milton J. Rosen, (2004), "Surfactants and interfacial phenomena", Third edition (2004), Wiley Interscience. [ Links ]
Mysels K. J., (1949), U.S. Patent 2, 492, 173, (1949). [ Links ]
Mysels K. J., (1972), "Early experiences with viscous drag reduction", Drag Reduction:Chemical Engineering Progress Symposium Series, Vol. 67, Number 11. [ Links ]
Moore J., Kotz J. and Satanitski C. L., (2000) "El mundo de la química, conceptos y aplicaciones". Editorial Pearson Educación, 2000. [ Links ]
Rózanski J. (2011), "Flow of drag-reducing surfactant solutions in rough pipes", Journal of Non-Newtonian Fluid Mechanics, Vol. 166, Issues 5–6. [ Links ]
Sabahi Nadia (2004), "Caracterización de tenso-activos: poder espumante y tensiones superficiales", Tesis de doctorado, Facultad de Ciencias, Universidad de Granada, año, 2004. [ Links ]
Salager Jean-Louis, (1992), "El mundo de los surfactantes". Reporte Laboratorio de formulación, interfaces, reología y procesos, Venezuela febrero 1992. [ Links ]
Savins J. G. (1967), Rheol. Acta. 6, 323. [ Links ]
Savins J. G. (1968), US Patent 3 361 213. [ Links ]
Shaver R. G. and Merril E. W., (1959), "Turbulent Flow of Pseudo plastic Polymer Solutions in Straight Cylindrical Tubes". AIChE Journal. 5, 181. [ Links ]
Sher I., Hetsroni G. (2008), "A mechanistic model of turbulent drag reduction by additives", Chemical Engineering Science, Vol. 63, Issue 7. [ Links ]
Swamee, P. K. y A. K. Jain (1976), "Explicits equations for pipe flow problems", Journal of the Hydraulics Division. 102 (HY5): 657-664. New York: American Society of Civil Engineers. [ Links ]
Tamano S., Itoh M., Kato K., Yokota K. (2010), "Turbulent drag reduction in nonionic surfactant solutions", Physics of Fluids, Vol. 22. [ Links ]
Truong V. T. (2001), Drag Reduction Technologies, Aeronautical and Maritime Research Laboratory, ReportJune 2001. [ Links ]














