Introducción
El fenol es un compuesto ampliamente utilizado en la industria, es un contaminante para las aguas residuales y es resistente a la biodegradación, tiene efectos tóxicos en la salud y en el medio ambiente. Una forma de degradarlo es la oxidación catalítica vía húmeda (OCVH), la cual es un proceso de tratamiento de contaminantes orgánicos e inorgánicos presentes en forma disuelta o en suspensión en el efluente líquido con la utilización de catalizadores, lo cual permite reducir las condiciones de oxidación y aumentar la selectividad a CO2 capaz de reducir las condiciones de presión entre 5-20 bar y temperatura entre 100-200°C dependiendo del contaminante a tratar, lo cual hace que este proceso sea menos costoso para su aplicación industrial [1,2]. La OCVH es una técnica utilizada para oxidar totalmente a los contaminantes en fase acuosa que son difíciles de destruir por otros métodos de tratamiento o que son resistentes a la biodegradación. Además, tiene la ventaja de lograr mayores grados de mineralización de compuestos fenólicos en comparación con otras tecnologías de oxidación como el proceso de Fenton y el ozono [1,3]. En la OCVH de fenol, existen un gran número de investigaciones donde se han probado catalizadores soportados y no soportados o en combinación con óxidos de Co, Mo, Mn, Ni, Fe, Cr, Zn, Cu, Ti, etc. [4-14] bajo diversas condiciones de reacción como las reportadas por Yang et al. [15], Monteros et al. [16] Baloyi et al. [17] quienes obtuvieron una conversión de 100% de fenol y alrededor de 88% de carbono orgánico total (COT). Aunque hay un gran interés en el proceso de OCVH, no muchos estudios consideran condiciones operativas leves para el abatimiento del fenol. Por lo anterior en este estudio se plantea el uso de catalizadores a base de óxido de paladio (PdO) soportado en un material mesoporoso tipo SBA-15 en condiciones suaves de reacción. El uso de soportes de catalizadores proporciona grandes áreas superficiales con poca cantidad de material activo y es económicamente viable considerando el costo de los metales (plata, oro, níquel, rodio, platino, paladio, etc.) utilizados en las reacciones industriales. En este trabajo se preparó el material mesoporoso ordenado tipo SBA-15 como soporte de especies de paladio introducidas por el método impregnación a volumen de poro [18]. Se realizó la caracterización textural y estructural por diferentes técnicas analíticas, para conocer su potencialidad como catalizadores en la oxidación OCVH del fenol. Se discuten aquí los resultados de fisisorción de nitrógeno, difracción de rayos-X (DRX), microscopía electrónica de barrido (MEB-EDS) y microscopia electrónica de trasmisión de alta resolución (HR-TEM).
Desarrollo experimental
La síntesis de material mesoporoso tipo SBA-15 se realizó por el método reportado por Flodström [19] con una ligera variación que consistió en usar HNO3 0.5 M en lugar de HCl 4 M. La composición típica de la mezcla de partida es: 2.5% peso de Pluronic 123 (1.92 g), 45 mL de agua, 30 mL de HCl 4 M y 4 g de Tetraetilortosilicato (TEOS) como fuente de silicio.
Se usó como surfactante el Pluronic-P123, disuelto con un volumen de H2O y de HNO3 en agitación continua. Se utilizó tetraetilortosilicato (TEOS) como fuente de silicio, después de adicionar el TEOS, el material se deja en agitación continua (600 rpm) por 24 h. Posteriormente la muestra es colocada en una estufa para su tratamiento hidrotérmico a 80 °C por 72 h. El gel obtenido se filtra y lava hasta obtener un pH neutro para después secar a temperatura ambiente. El soporte SBA-15 se secó a 80 °C durante 24 h para la eliminación de humedad, y se calcinó a 500 °C por 6 h utilizando una rampa de calentamiento de 2.0 °C/min. La impregnación de Pd (0.5, 1.5 y 3% peso) en la SBA-15 se realizó usando la técnica post-síntesis y como precursor nitrato de paladio Pd(NO3)2. Posteriormente los catalizadores se secaron a temperatura ambiente y se calcinaron a 500 °C durante 6 horas con una rampa de calentamiento de 2 °C/min. La nomenclatura de los materiales es: Pdx/SBA-15, donde Pd = paladio,x = % de Pd.
Las propiedades del soporte y catalizadores sintetizados, se determinaron con las siguientes técnicas: fisisorción de nitrógeno con un equipo Micromeritics Tristar II 3020 (- 196 °C). Difracción de rayos-X (DRX), equipo Bruker D8-Advance con radiación Cu-Kα, condiciones 35 kV, 25 mA y 0.020° de incremento de paso. Microscopio electrónico de barrido (MEB-EDS) JEOL JSM-6010LA a 20 kV de voltaje de aceleración en condiciones de alto vacío a 5000X. Se utilizó un detector de energía dispersiva (EDS) acoplado al MEB para realizar el análisis semicuantitativo y de distribución de elementos en la superficie de las muestras. Las imágenes se procesaron en el Software In Touch Scope TM. Microscopia electrónica de trasmisión (HR-TEM) equipo JEOL JEM2100 STEM. Las muestras sólidas se dispersaron en una solución con agua y n-propanol, las gotas del líquido sobrenadante se colocaron en rejillas perforadas de cobre con carbono (malla 300). El tamaño de partícula promedio (
Donde
La evaluación catalítica se llevó a cabo en un reactor tipo Bach (Parr Instruments Co Ltd, IL), con flujo de oxígeno, utilizando 200 mg de catalizador, 200 mL de fenol de una solución de 500 ppm a una temperatura de 160 °C y presión de 10 bar. Cuando la temperatura seleccionada fue alcanzada, se comenzó la agitación a una velocidad máxima de 800 rpm. Este tiempo fue tomado como el tiempo cero de reacción y se tomaron muestras a intervalos de 15 minutos hasta llegar a los 180 minutos. Para cuantificar los productos obtenidos, las muestras de la reacción se analizaron en un cromatógrafo de gases marca Perkin Elmer Clarus* 580, equipado con un detector de ionización de flama. Se analizó el contenido de fenol, el contenido de intermediario y el
Donde: C oes la concentración de fenol a t=0 (ppm), C 180 ces la concentración de fenol a t=3 h de reacción (ppm), COT 0 es el COT al inicio de la reacción t=0 (ppm), C 180 es el COT a t=3 h de reacción (ppm).
Resultados y discusión
Propiedades texturales
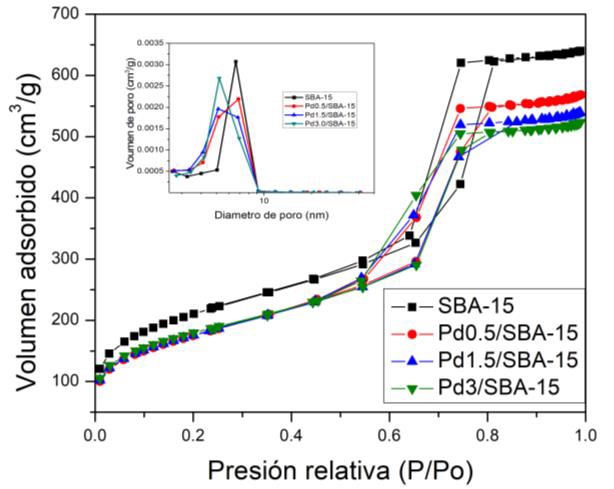
Los resultados obtenidos de las propiedades texturales (área específica, diámetro de poro y volumen de poro) de los materiales, se presentan en la Tabla 1. El área específica (SBET) de estos sólidos, se determinó a partir de la isoterma de adsorción-desorción de N2 empleando el método propuesto por Brunauer- Emmett-Teller (SBET). En tanto, la distribución del tamaño de poro se calculó por el método propuesto por Barrett-Joyner y Halenda (BJH). Los valores son los típicos de los materiales mesoporosos (SBET 450-970 m2/g, Dp ~ 5.0-10.4 nm y Vp ~ 0.6-1.07 cm3/g) [20,21].
Tabla 1 Propiedades texturales de SBA-15 y Pdx/SBA-15.
| Materiales | Área específica | Diámetro de poro | a0 | Espesor de la pared | |
| SBA-15 | 755 | 0.95 | 6.5 | 11.84 | 5.24 |
| Pd0.5/SBA-15 | 642 | 0.91 | 5.5 | 12.94 | 7.44 |
| Pd0.5/SBA-15 | 631 | 0.79 | 5.2 | 12.94 | 7.74 |
| Pd3//SBA-15 | 630 | 0.75 | 5.0 | 12.94 | 7.94 |
a0: Parámetro de red a0=2𝑑(100)/√3
Al incorporar el Pd en la SBA-15, observamos que la superficie específica y el diámetro de poro disminuyen± 15% y 24%, respectivamente; esta disminución está relacionada con la incorporación del Pd en la estructura de la SBA-15. Por otro lado, el volumen de poro parece también sufrir una disminución (de 0.95 a 0.75 cm³/g) relacionado con un mayor contenido metálico de paladio. Todas las isotermas son tipo IV propias de materiales mesoporosos con lazo de histéresis tipo H1 correspondientes a poros cilíndricos bien ordenados (Figura 1). En la Tabla 1 se muestra también el valor de espesor de pared (
Propiedades estructurales
En la Figura 2a se presentan los difractogramas de Rayos X (DRXs) a bajo ángulo de Pdx/SBA-15. con mayor intensidad a 0.81°, junto con dos picos menos intensos a 1.5 y 1.77° que corresponden a las reflexiones (100), (110) y (200), respectivamente. La SBA-15 muestra un pico de difracción en el ángulo 2θ de 0.89° con un espaciamiento
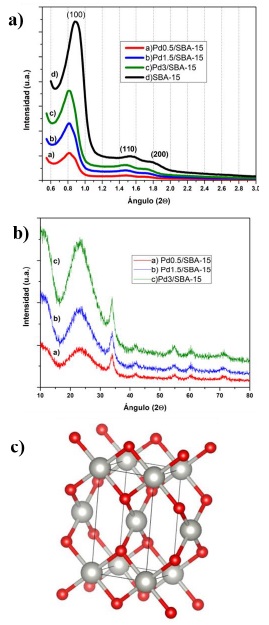
Figura 2 a) DRX a bajo ángulo de SBA-15 y Pdx/SBA-15, b) DRX a alto ángulo de Pdx/SBA-15 y c) Celda unitaria del PdO.
Los picos simulados coinciden con el acta cristalográfica, y se pudieron identificar los picos característicos del PdO que coincidieron con sus planos
Morfología
La morfología de los materiales se estudió mediante microscopía electrónica de barrido acoplado con un sistema espectro métrico de energía dispersiva (MEB-EDS) y microscopía electrónica de transmisión de alta resolución (HR-TEM). En la Figura 3a observamos la morfología de la SBA-15, podemos ver diferentes tamaños de las partículas que tienen una longitud aproximada de 2 nm con formas de barras cortas y bastones principalmente, lo que coincide con lo reportado por otros autores [18,22,33-36]. En las Figuras 3b, 3c y 3d, observamos las micrografías correspondientes a los materiales soportados con 0.5, 1.5 y 3 % de Pd respectivamente. La morfología de los catalizadores tiende a seguir a la del soporte (SBA-15); no se observan cambios sustanciales macroscópicos al adicionar el paladio [36]. Por MEB- EDS (figura no mostrada) vimos que la morfología de los materiales puede considerarse una distribución homogénea tal como lo reportaron Han et al. [29]. Adicionalmente, se realizó un análisis cuantitativo del contenido metálico de Pd por Espectroscopia de Emisión Óptica de Plasma Acoplado Inductivamente (ICP-OES), los resultados se muestran en la Tabla 2, los valores son muy cercanos al valor teórico con lo cual podemos concluir que la impregnación por volumen de poro fue exitosa. En las Figuras 4a - 4d, observamos por HR-TEM imágenes y la distribución de tamaño de partícula de Pd0.5/SBA-15 y Pd1.5/SBA-15; el tamaño promedio de partículas fue de 11.7 nm y 19.03 nm respectivamente. La Figura 4e y Figura 4f que corresponde al catalizador Pd0.5/SBA-15 muestra los canales paralelos con apilamiento regular alargados y pueden observarse que algunas partículas de Pd están dentro de los canales mesoporosos ordenados y otras fuera de los mismos. La naturaleza cristalina de las partículas de PdO se observa en la imagen (Figura 4f), con un espaciamiento d = 0.210 nm que corresponde al plano cristalográfico (111) [21,24,34, 37-41]
Tabla 2 Contenido metálico de Pdx/SBA-15 obtenido por el análisis ICP-OES
| Materiales | Contenido de Pd (% en peso) |
| Pd0.5/SBA-15 | 0.51 |
| Pd1.5/SBA-15 | 1.52 |
| Pd3//SBA-15 | 3.10 |
Propiedades catalíticas
La actividad catalítica del soporte y catalizadores (Pdx/SBA-15) en la degradación de fenol se muestra en la Figura 5. Las conversiones obtenidas para los materiales sintetizados están en función del tiempo de reacción que se llevó a cabo durante 180 minutos. En Figura 5, se observa que la conversión de fenol por parte del soporte (SBA-difiere significativamente de los catalizadores (Pdx/SBA-15), ya que sólo alcanzó el 20% de degradación. El orden de las curvas de conversión coincide con la capacidad de degradación; el material más activo fue Pd0.5/SBA-15.

Figura 5 a) Conversión (%) de fenol en función del tiempo y b) Conversión (%) de COT en función del tiempo de: a) SBA-15, b) Pd3/SBA-15, c) Pd1.5/SBA-15 y d) Pd0.5/SBA-15.
Diversos trabajos tales como los de Yang et al. [15] que estudiaron el tratamiento del fenol mediante el proceso OCVH a 155°C y una presión de 25 bar, utilizando óxido de grafeno (GO) y óxidos de grafeno químicamente reducidos (rGO) obtuvieron una conversión de fenol del 100% y la mineralización del 84% y el 80% se observó con GO y rGO, respectivamente. Monteros et al. [16] estudiaron catalizadores de Ru y Pt soportados en TiO-CeO en un reactor tipo batch a 160 °C y 20 bar de presión de oxígeno puro, 2098 mg/L de fenol durante 180 min de reacción obteniendo 100% de remoción de fenol y 88% de carbono orgánico total (COT). Baloyi et al. [17] con catalizadores Al/Zr-PILCs emplearon las siguientes condiciones de reacción en una autoclave, 100°C, 10 bar, 1000 mg/L de fenol, 120 minutos y obtuvieron una conversión de 100% de fenol y 88% de COT. En este estudio las condiciones de los catalizadores de Pd soportados en SBA-15 fueron: temperatura 160°C, 10 bar de presión, 500 mg/L de fenol y 180 minutos de reacción, lo cual son en general ligeramente inferiores a las reportadas en la OCVH de fenol dando resultados prometedores a partir del PdO dado que para la activación de los catalizadores solo se calcino con aire y no se redujo con hidrogeno y así abatir costos de operación al usar un metal noble. Los resultados del carbono orgánico total (COT), normalizado en función del tiempo se muestran en la Figura 5b.
El catalizador con menor carga metálica (Pd0.5/SBA-15) registró los valores más altos (64 %) de COT, esto indica que algunos subproductos intermediarios se formaron durante la reacción. Los subproductos intermediarios (catecol, hidroquinona, benzoquinona, ácido fórmico, ácido maleico), fueron identificados por cromatografía de gases. El mecanismo de reacción de la oxidación del fenol es un proceso complejo que resulta en la formación de aromáticos, ácidos carboxílicos y compuestos inorgánicos (CO2 y H2O). El mecanismo de reacción requiere una comprensión de las reacciones que tienen lugar en la superficie del catalizador junto con productos intermediarios y de oxidación final [42]. Existen 3 rutas principales de la oxidación catalítica de fenol presentada en la literatura: 1) Reacciones de complejación que se dan por reacciones en cadena que producen la combinación de radical fenil con hidroquinona y p-benzoquinona, 2) Orto-oxidación que es la ruta del catecol y, 3) Para-oxidación que es la ruta de la hidroquinona [43-45]. En la mayoría de los casos, la oxidación del fenol sigue la siguiente ruta; oxidación, descarboxilación, deshidratación o combinación de todos estos pasos [46]. De acuerdo a lo anterior, consideramos como un probable mecanismo de reacción de estos catalizadores (Pdx/SBA- 15) en la oxidación catalítica vía húmeda, que fenol se degrada a compuestos aromáticos (como catecol, hidroquinona y benzoquinona), lo que se observó en el cambio de color de la solución. Los últimos intermediarios, como el ácido maleico, el ácido oxálico y el ácido fórmico, se formaron después de la apertura del anillo aromático, lo que hizo que la solución se volviera incolora. Estos productos intermediarios se mineralizaron a CO2 y H2O. El color de la solución al final de la reacción era incoloro; lo que indica que los intermedios aromáticos ya no estaban presentes en la solución. La presencia de hidroquinona y catecol nos indica la ocurrencia de rutas de reacción paralelas cómo ha sido reportado por otros autores [43-50].
Conclusiones
Los catalizadores presentan propiedades texturales y estructurales características de los materiales mesoporosos. Se obtuvieron materiales con elevada área específica, distribución estrecha de poros y morfología típica. Los DRX a bajo ángulo indicaron que se logró sintetizar con éxito el material mesoporoso SBA-15 ordenado con estructura hexagonal en dos dimensiones (p6mm) y, al soportar el Pd (0.5, 1.5 y 3% en peso) la estructura se preservó y, a alto ángulo se observó PdO con estructura tetragonal. La morfología de los catalizadores fue barras cortas y bastones principalmente. El tamaño promedio de partículas fue de 11.7 nm y 19.03 nm para el catalizador con 0.5 y 1.5 de carga de Pd respectivamente. El catalizador con menor contenido metálico (Pd0.5/SBA-15) degradó 64% de fenol, siendo el más activode los catalizadores en la oxidación húmeda del fenol generando productos intermediarios que finalmente se mineralizaron a CO2 y agua como productos finales de la reacción.











 nueva página del texto (beta)
nueva página del texto (beta)