Introducción
Desde hace tiempo ha sido reconocido por diversos autores que las emisiones de CO2 pueden ser mitigadas disminuyendo las fuentes de emisión o incrementando la existencia de sumideros como los suelos agrícolas [1]. También ha sido reconocido que los suelos agrícolas están entre los mayores depósitos de carbono del planeta, teniendo un gran potencial para expandir el secuestro de CO2 y de esta manera mitigar las concentraciones atmosféricas de CO2 [2]. El secuestro de dióxido de carbono en los suelos puede depender de la estructura porosa de sus constituyentes y de la composición química de los componentes que constituyan a este suelo. El suelo puede ser considerado como un sistema poroso constituido de dos entidades fundamentales: una parte sólida y una parte porosa [3], Figura 1.
A las entidades huecas se les ha denominado en forma artificial como: poros, huecos, antros, cavidades, u oquedades [4]. La clasificación de los poros en función de su tamaño, forma, naturaleza de sitios o enlaces ayuda a anticipar el resultado de algunos fenómenos capilares o de otro tipo que ocurren dentro de las estructuras porosas. Normalmente los poros están siempre ocupados por uno o más fluidos como agua, aire, aceite o una mezcla de ellos, etc [5]. Los medios o sólidos porosos pueden ser de origen natural, como las rocas de la corteza terrestre o las substancias provenientes de diversos organismos vegetales o animales, o el mismo suelo. Esta clase de substratos también pueden ser creados por el hombre y posteriormente modificados mediante tratamientos térmicos (calcinación, sinterización) o mediante tratamientos químicos [6]. Es muy complicado catalogar los sólidos porosos dentro de tipos específicos de substratos debido a las diferentes y complicadas geometrías que éstos pueden presentar. Sin embargo, los sólidos porosos han sido clasificados morfológicamente como corpusculares y esponjosos [7]. Los sólidos corpusculares están formados por corpúsculos sólidos que al empaquetarse de acuerdo a arreglos regulares o al azar originan huecos entre ellos. Los sólidos esponjosos consisten de huecos diseminados dentro de una matriz sólida; además no se pueden identificar partículas sólidas individuales dentro de ellos. De acuerdo a la amplitud W de los huecos o poros en cuestión, ellos pueden ser clasificados como: micropores (W < 2 nm), mesoporos (2 nm < W < 50 nm) y macroporos (W > 50 nm) [8].
Los microporos, a su vez, presentan dos subgrupos llamados ultramicroporos (W < 0.7 nm) y supermicroporos (0.7 < W < 2 nm). Esta clasificación está basada en análisis de tamaño de poros procedentes de estudios de adsorción de N2 a su temperatura normal de ebullición y en el grosor estadístico t, de las capas de moléculas de N2 adsorbidas en las paredes de los distintos poros [9].Siendo las arcillas y las zeolitas una parte importante como constituyente de los suelos es imprescindible conocer los distintos fenómenos que están ocurriendo en este tipo de entidades porosas.
Las zeolitas son sólidos altamente cristalinos que están constituidos de microporos como integrantes primarios y de mesoporos como constituyentes secundarios. La mesoporosidad que pueden presentar estos substratos se debe a la presencia de impurezas como arcillas y cuarzo en las rocas zeolíticas de origen natural y de fases amorfas que no alcanzan a cristalizar durante el periodo de síntesis en el caso de las zeolitas sintéticas [10]. Tanto las zeolitas naturales como las arcillas existen en forma de yacimientos a cielo abierto en diferentes zonas de México. Los objetivos del presente trabajo son comparar los resultados experimentales de adsorción de CO2 obtenidos por el método dinámico en zeolitas clinoptilolita, erionita, mordenita, epistilbita y la arcilla caolinita como partes constituyentes del suelo para establecer el orden de selectividad con respecto a este gas y proponerlos como sumideros para la captación de CO2.
Desarrollo experimental
En este trabajo se utilizan muestras de especímenes de zeolitas naturales sin ningún tratamiento adicional, originarios de yacimientos localizados en distintos puntos de la República Mexicana: erionita (ERIN) de Agua Prieta, Sonora, mordenita (MORN) de Cruillas, Tamaulipas, clinoptilolita (CLIN) de Tehuacàn, Puebla, epistilbita (EPIN) de Zapopan, Jalisco y la arcilla caolinita (CAON) de San Juan Amecac, Puebla. Las muestras están etiquetadas conforme a los códigos de tres letras de la Asociación Internacional de Zeolitas [11], seguidas con la letra "N" subrayando su origen natural. Los gases usados (He, N2 y CO2) son de ultra-alta pureza (99.99 %) y fueron suministrados por LINDE. Las características estructurales de las zeolitas y arcillas empleadas en este trabajo están reportadas en la Tabla 1[12,13].
Patrones de difracción de rayos X se obtuvieron en un difractómetro Siemens D-500 que emplea una radiación CuKα con longitud de onda λ de 1.54 Å. Las fases cristalinas presentes en las muestras se identificaron con ayuda de tarjetas del Comité Conjunto de Estándares de Difracción (JCPDS por sus siglas en inglés: Joint Committee of Powder Diffraction Standards).
Las imágenes SEM se obtuvieron mediante un microscopio electrónico de barrido Jeol, modelo JSM-5300, equipado con un espectrómetro de energía dispersiva (EDS por sus siglas en inglés), el cual permitió una determinación de la composición local sobre la superficie de las muestras.
Las isotermas de adsorción de N2 fueron medidas a la temperatura 76.4 K de ebullición de nitrógeno líquido a las condiciones de altitud 2160 metros sobre nivel del mar de la Ciudad de Puebla, México en un instrumento volumétrico automático de sorción Quantachrome AutoSorb-AS1. Las isotermas se determinaron en el intervalo de presiones relativas p/p 0 = [10-5, 0.995]; la presión de saturación p 0 fue registrada continuamente durante el curso de las medidas de adsorción. Antes de la adsorción, las partículas de zeolita o arcilla de malla 60-80 fueron desgasificadas a 623 K durante 20 h a una presión inferior a 10-6 Torr.
Los experimentos de adsorción de CO2 a diversas temperaturas (463-583 K) sobre los substratos fueron realizados en un cromatógrafo Gow-Mac 350 equipado con un detector de conductividad térmica. Las columnas cromatográficas de acero inoxidable (diámetro interno = 5 mm y longitud = 50 cm) fueron empacadas con gránulos de muestra equivalentes a tamaños de malla 60 - 80. Antes de la adsorción cada muestra es pretratada in situ bajo un flujo de He a 573 K durante 8 horas. Posteriormente, distintos volúmenes de CO2 fueron dosificados en la columna empacada con las muestras con el fin de medir el tiempo de retención asociado. Las evaluaciones de la cantidad adsorbida en función de la presión se realizaron aplicando el método de picos cromatográficos máximos [14] (GC peak máxima method), empleando helio (30 cm3 min-1) como gas acarreador.
Los datos de adsorción del CO2 a bajas presiones fueron evaluados a través de la ecuación de Freundlich en su forma lineal con el fin de determinar los parámetros de adsorción pertinentes. La ecuación [15] puede ser escrita como:
Donde a son los moles de adsorbato en el sólido a la presión p, K F es la constante de adsorción de Freundlich, y n es un factor exponencial.
En esta zona se evaluaron las constantes de Henry (K H ) [16], a diferentes temperaturas para los adsorbentes en estudio de acuerdo a la siguiente expresión.
Donde a representa la cantidad adsorbida a la presión p y a m es la capacidad en la monocapa evaluada a partir de la ecuación de Langmuir [17]:
Donde
Los valores de las energías de adsorción estándar (-ΔU0) fueron evaluados a partir de la dependencia de la temperatura de las constantes de Henry, una relación que supone ser consistente con una forma tradicional de la ecuación de Van՝t Hoff:
donde ΔU 0 = ΔH 0 + RT; ΔΗ 0 es la entalpía de adsorción estándar, R es la constante universal de los gases, y K 0 es el factor pre-exponencial de la ecuación Van't Hoff. Por su parte, el calor isostérico de adsorción (q st , Kj mol-1) a diferentes cantidades de sustancia adsorbida puede ser evaluado a partir de los datos experimentales de las isotermas de adsorción a través de la ecuación de Clausius-Clapeyron [18]:
Donde p y T son la presión de equilibrio y T es la temperatura a una cantidad de sustancia adsorbida (a).
Resultados y discusión
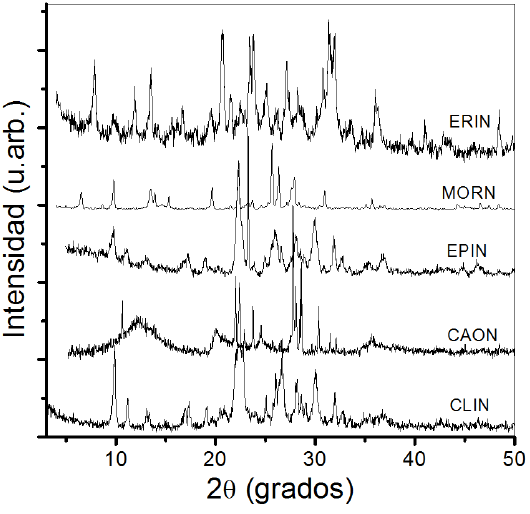
En la Figura 2 se presenta el patrón de difracción de las muestras en estudio. Se observa que la muestra CLIN exhibe la presencia mayoritaria de la zeolita clinoptilolita (tarjeta JCPDS 3-0427), más cuarzo en 2θ~27° (JCPDS 3-0427) y pequeñas cantidades de montmorillonita (JCPDS 29-1498). Las señales características para CLI están ubicadas en 2θ: 9.85°,11.08°, 13.03°, 14.84°, 16.86°, 17.02°, 19.04°, 20.73°, 22.35°, 23.88°, 25.42°, 26.24°, 27.00°, 28.09°, 30.01°, 32.31°, 32.57°, 34.80° [3].
El patrón de DRX de MORN (Figura 2) es típico de mordenita (JCPDS 29-1257) [19]. Los picos en su patrón son agudos, mostrando la buena cristalinidad del substrato. Los picos característicos de la mordenita aparecen a los valores de siguientes 2θ: 6.59°, 9.85°, 13.56°, 15.38°, 19.70°, 22.35°, 25.69°, 26.45°, 27.96° y 30.99° [19].
También, se observa la presencia de cuarzo en 2θ~27° y pequeñas cantidades de caolinita (JCPDS 001-0527). Para EPIN (Figura 2) el patrón de DRX indica la presencia de impurezas pequeñas de mordenita y cuarzo. En general, todas las muestras de la epistilbita presentan una notable cristalinidad con patrones de difracción relativamente agudos. Las señales características para EPI están ubicadas en 2θ: 9.97°, 22.96°, 25.85°, 29.96°, 39.99°, 47.72°, 60.0° [20].
El patrón de DRX de la erionita natural (ERIN) (Figura 2) demuestra las señales características ubicadas en siguientes 2θ: 7.7°, 9.7°, 11.76°, 13.34°, 19.44°, 20.7°, 21.3°,22.48°, 23.48°,25.17°, 27.05°, 28°, 30.43°, 31.42°, 32°, 33.41° y 35.89° [21].
Finalmente, el patrón de difracción correspondiente a la arcilla indica que la muestra está constituida de caolinita (JCPDS 001-0527), más cuarzo y albita (JCPDS 01-071-1150) (Figura 2). Las señales características están ubicadas en 2θ: 12.42°, 19.96°, 22.02°, 23.47°, 27.69°, 30.44°, 31.89°, 35.53° y 53.26° [22].
Las micrografías de las muestras (Figura 3) visualizan agregados de cristales en forma de bloques en el caso de la mordenita MORN y epistilbita EPIN, en el caso de la erionita ERIN se observan tetraedros, cubos y placas conjuntas correspondientes a su estructura, mientras que para la clinoptilolita CLIN se observan cristales con geometrías diversas y para CAON se muestran rendijas paralelas delgadas y otros agregados de partículas del suelo.

Figura 3 Imágenes de SEM de zeolitas y arcilla: a) Mordenita, b) Erionita, c) Caolinita, d) Clinoptilolita y e) Epistilbita.
De los datos de composición química evaluados por EDS (Tabla 2) se puede observar el establecimiento de la siguiente secuencia de la relación Si/Al: MORN>CLIN>ERIN>EPIN>CAON. En cuanto a Fe2O3 la secuencia es: EPIN>CAON>ERIN>CLIN>MORN. Por su parte para CaO: CLIN>CAON>MORN>EPIN>ERIN, y finalmente para Na2O la secuencia es: MORN>ERIN>CLIN>CAON>EPIN.
Tabla 2 Composición química en zeolitas y arcillas (% en peso), EDS.
| CLIN | CAON | ERIN | EPIN | MORN | |
|---|---|---|---|---|---|
| SiO2 | 67.07 | 33.39 | 54.85 | 45.38 | 72.12 |
| Al2O3 | 11.31 | 17.12 | 11.21 | 18.03 | 11.96 |
| Fe2O3 | 1.21 | 2.52 | 1.8 | 3.67 | 0.83 |
| CaO | 3.57 | 2.76 | 1.22 | 1.38 | 1.94 |
| MgO | 0.68 | — | 1.19 | 0.66 | — |
| Na2O | 2.90 | 2.52 | 3.69 | 1.65 | 5.98 |
| K2O | 0.52 | — | 2.31 | — | 1.25 |
| Si/Al | 5.93 | 1.95 | 4.89 | 2.516 | 6.01 |
| PxC | 6.81 | 39.74 | 18.84 | 29.23 | 5.92 |
Las isotermas de adsorción de N2 en los sólidos estudiados se exponen en la Figura 4. Mientras que las isotermas de las MORN y ERIN constituyen una combinación de isotermas del Tipo I-IV dentro de la clasificación de la IUPAC [23], las isotermas de las zeolitas CLIN, EPIN y de la arcilla CAON dentro de esta misma clasificación corresponden a un Tipo IV puro.
A diferencia del nítido comportamiento Tipo I que presentan las zeolitas sintéticas durante los procesos de adsorción de gases, casi todas las zeolitas naturales presentan isotermas de adsorción que se desvían del carácter Tipo I especialmente en la zona de altas presiones relativas. Esto se debe tanto a la formación de capas multimoleculares de adsorción como al fenómeno de condensación capilar que se desarrollan en los mesoporos o porosidad secundaria de las zeolitas naturales. La forma híbrida I-IV de las isotermas de adsorción de las zeolitas naturales ERIN y MORN puede ser debida a la presencia de impurezas y materiales amorfos (arcillas, cuarzo, etc.) mezclados con los adsorbentes microporosos. Por su parte las isotermas de adsorción de EPIN, CLIN y CAON describen la formación de un ciclo de histéresis tipo H3 característico por la presencia de poros en forma de placas paralelas o de rendija.
En la Tabla 3 se reportan los resultados texturales (áreas superficiales, volúmenes y diámetros de poro) obtenidos del análisis de las isotermas N2. Se establece el siguiente orden secuencial con respecto a la superficie específica evaluada por el método BET (ASBET): MORN > ERIN > EPIN > CAON > CLIN. Un comportamiento similar lo presenta el volumen total de poros VΣ el cual fue evaluado a p/p0 = 0.95 por la regla de Gurvitsch [24]. Se observa que los valores de la constante CB de la ecuación BET adquiere valores negativos para las zeolitas ERIN, MORN y EPIN mostrando una inoperancia de este modelo teórico de adsorción. Esto puede ser explicado por el hecho de que la adsorción en microporos no está contemplada dentro del modelo BET, dado que se supone que la adsorción multimolecular no es físicamente posible en cavidades tan pequeñas como los microporos.
Tabla 3 Parámetros de adsorción de zeolitas y arcilla
| Absorbente | ASL (m2 g-1) |
ASB
(m2 g-1) |
CB | VΣ
(cm3 g-1) |
DpBJH
(nm) |
|---|---|---|---|---|---|
| CLIN | 21 | 13 | 65 | 0.031 | 3.51 |
| ERIN | 244 | 169 | -70 | 0.101 | — |
| EPIN | 45 | 62 | -111 | 0.048 | 1.77, 3.51 |
| MORN | 211 | 137 | -120 | 0.106 | 3.51 |
| CAON | 66 | 45 | 270 | 0.064 | 3.51, 9.82 |
ASB la superficie específica determinada por medio de la ecuación BET;
ASL es la superficie específica determinada por medio de la ecuación Langmuir;
CB es la constante de BET;
VΣ el volumen total de poro;
DpBJH el diámetro de poro calculado por el método BJH.
Por su parte, los valores de las propiedades texturales de la arcilla CAON y las zeolitas CLIN se describen adecuadamente con la ecuación BET. La Figura 5 muestra las curvas de distribución de los mesoporos obtenidas utilizando la ecuación BJH. La zeolita MORN muestra una distribución unimodal bien definida con diámetros de poro ~3.5 nm, mientras que las zeolitas EPIN y CLIN exhiben un carácter bimodal, con valores en 1.77 y 3.5 nm. Comportamiento similar lo exhibe la arcilla CAON pero con valores ubicados en 3.5 y 9.8 nm. Finalmente los valores de la zeolita ERIN no se adaptaron a esta ecuación en virtud de una ausencia considerable de mesoporos.
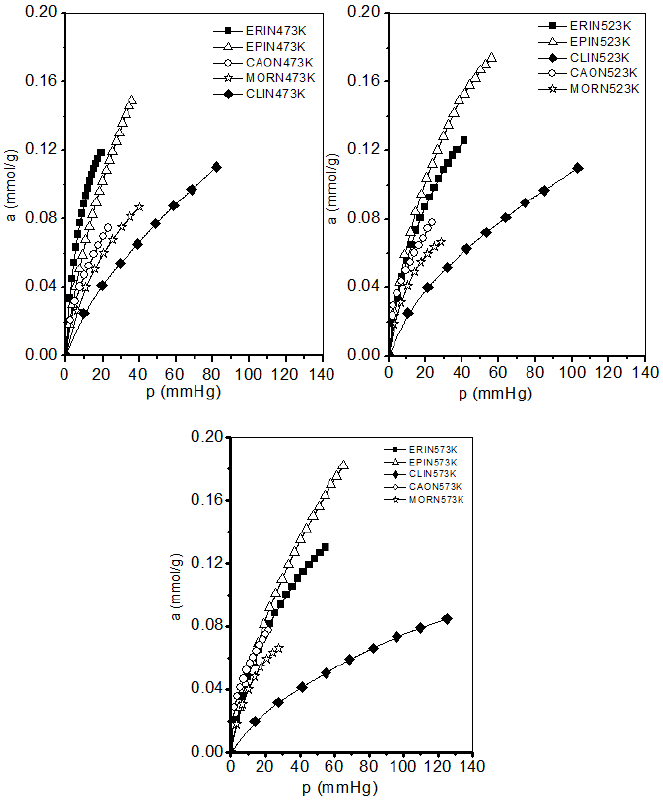
El método dinámico de cromatografía de gases a grados de cobertura nulos fue utilizado para evaluar las isotermas de adsorción obtenidas de los datos de las curvas de elución del CO2 sobre las muestras usadas en este estudio. Isotermas de adsorción de CO2 a diferentes temperaturas son presentadas en la Figura 6. Se observa que a una p = 20mmHg se establece la siguiente secuencia en cuanto a la cantidad de sustancia adsorbida a 473 K: ERIN > EPIN > CAON > MORN > CLIN; a 523 K: EPIN > ERIN> CAON> MORN > CLIN; y finalmente a 573 K la secuencia es la siguiente: EPIN > ERIN = CAON > MORN > CLIN.
Los valores de las constantes de Langmuir KL, Freundlich KF y Henry KH con sus respectivos coeficientes de correlación lineal están dados en la Tabla 4. Se observa que a bajas presiones las isotermas correspondientes a MORN y CAON son más notorias respecto a los demás adsorbentes, observándose que la mayor capacidad de adsorción lo presentan las zeolitas EPIN y ERIN en todo el intervalo de presiones y temperaturas estudiado.
Tabla 4 Parámetros de adsorción de CO2 a distintas temperaturas, ecuaciones de Freundlich, Langmuir y Henry.
| T (K) | KF | n | R f | am | Kh | R l |
|---|---|---|---|---|---|---|
| CLIN | ||||||
| 473 | 5.13 | 1.436 | 0.999 | 0.168 | 2.94 | 0.996 |
| 523 | 5.57 | 1.551 | 0.999 | 0.146 | 2.8 | 0.995 |
| 573 | 3.57 | 1.514 | 0.999 | 0.122 | 1.69 | 0.995 |
| ERIN | ||||||
| 473 | 21. | 1.636 | 0.988 | 0.155 | 20 | 0.996 |
| 523 | 11. | 1.528 | 0.99 | 0.179 | 8 | 0.998 |
| 588 | 10 | 1.579 | 0.993 | 0.173 | 7 | 0.996 |
| EPIN | ||||||
| 473 | 14 | 1.573 | 0.996 | 0.229 | 9.6 | 0.997 |
| 523 | 10 | 1.417 | 0.999 | 0.281 | 6.3 | 0.998 |
| 573 | 12 | 1.426 | 0.999 | 0.191 | 10.6 | 0.995 |
| MORN | ||||||
| 473 | 3.8 | 1.651 | 0.988 | 0.010 | 5.19 | 0.999 |
| 523 | 3.86 | 1.718 | 0.989 | 0.009 | 6.7 | 0.998 |
| 573 | 3.73 | 1.574 | 0.990 | 0.014 | 7.27 | 0.999 |
| CAON | ||||||
| 453 | 14.8 | 1.840 | 0.998 | 0.088 | 14 | 0.985 |
| 523 | 12.8 | 1.739 | 0.999 | 0.092 | 11 | 0.979 |
| 573 | 11.9 | 1.691 | 0.998 | 0.099 | 10 | 0.992 |
KF y KH: constantes de Freundlich y Henry, respectivamente; en × 103 mmHg-1.
am en mmol g-1
RF y RL: coeficientes de correlación lineal de Freundlich y Henry, respectivamente.
En la Figura 7 se presentan los resultados de la variación del calor isostérico de adsorción q iso de CO2 en función de la cantidad adsorbida sobre CLIN, ERIN, CAON, EPIN y MORN. El calor isostérico de adsorción de ERIN primero aumenta ligeramente al aumentar la cantidad de CO2 adsorbido, y a medida que se incrementa la cantidad de sustancia adsorbida comienza a decrecer continuamente. El comportamiento de qst en ERIN para a > 0.03mmol g-1 es un fenómeno que se observa frecuentemente al estudiar la adsorción de gases y vapores en distintos adsorbentes naturales. La explicación clásica se fundamenta en que existen distintos sitios de adsorción desde un punto de vista energético, los cuales son ocupados jerárquicamente por las moléculas del adsorbato (desde los de mayor energía hasta los de menor energía), es decir la superficie es energéticamente heterogénea [25]. Se observa que los valores de los qst en esta zeolita exceden los valores del calor de licuefacción indicando el establecimiento de enlaces de tipo químico entre el CO2 y los centros activos que están ubicados en el enrejado de esta zeolita. Similar comportamiento lo presenta la arcilla CAON y las zeolitas MORN y CLIN.
Los valores menores en el qst lo presenta la zeolita EPIN. Para la adsorción a grados de cobertura bajos, el qst está relacionado a la interacción entre la superficie del adsorbente y las fuerzas moleculares de adsorción. En esta zona, la accesibilidad y el tamaño de poro pueden ser factores importantes como es el caso para las zeolitas MORN, CLIN y EPIN, debido a que su porosidad está bloqueada por cuarzo (ver patrones de DRX) o en el caso de la arcilla por la presencia de albita y cuarzo.
En el caso de la zeolita ERIN estudiada, los resultados muestran que el qst del CO2 es muy alto en toda la zona de cobertura de adsorción. Las ligeras fluctuaciones en las curvas del qst que exhiben todos los adsorbentes estudiados podrían ser relacionadas a interacciones laterales entre las moléculas adsorbidas o a efectos cooperativos entre estas mismas moléculas [26].
Estos resultados pueden ser explicados considerándose las propiedades físicas y químicas de la molécula de CO2: su diámetro crítico es igual a 3.1Å, con una polarizabilidad de 1.9 A 3 [27]. Este provoca que la molécula de dióxido de carbono se vea influenciada en mayor grado por el campo eléctrico que crean los cationes presentes en el sólido. Es muy probable que las diferencias en las propiedades de este gas sean los responsables de que el CO2 se adsorba en sitios poco accesibles y a que esta molécula interaccione más específicamente con el campo eléctrico de los iones de Na+ del sólido [28].
Los valores de los calores isostéricos (q st , kJ mol-1) de adsorción del CO2 en las zeolitas estudiadas están dados en la Tabla 5. A manera de comparación en esta misma tabla están listados valores de calores isostéricos de adsorción en zeolitas 5A, 13A y 13X, además de materiales SBA-15 funcionalizados con aminas terciarias y que han sido reportados previamente [29,30]. De esta tabla se observa que los mayores valores corresponden a la zeolita ERIN.
Conclusiones
En este estudio, se observa que suelos deforestados y enriquecidos con zeolitas de origen natural pueden servir como sumideros muy eficientes para el secuestro de CO2. La adsorción de este gas depende de la estructura y composición química de la zeolita y arcilla en cuestión. Las isotermas de adsorción de CO2 determinadas experimentalmente en los diversos substratos como componentes del suelo cumplen satisfactoriamente con los modelos de adsorción de Freundlich y Langmuir. Las interacciones obtenidas a través del cálculo de los calores de adsorción se incrementan a medida que se va incrementando la cantidad de sustancia adsorbida describiendo comportamientos heterogéneos. Las magnitudes del calor isostérico de CO2 son diferentes para cada componente del suelo y están relacionadas directamente a las interacciones entre cierto tipo de centros de adsorción o cationes predominantes en cada zeolita o del caolín.











 text new page (beta)
text new page (beta)