Introducción
Es importante el estudio de materiales en estado sólido por su amplia gama de aplicaciones en adsorción [1], en separación [2] y en catálisis [3], entre otras. De ahí surge el interés de los investigadores por obtener materiales con mejores propiedades texturales y estructurales. Lo que ha impulsado a implementar estrategias de síntesis innovadoras con nuevas composiciones que permiten evolucionar hacia materiales estructurados de propiedades específicas acordes a la aplicación deseada [4]. Por ello, surgieron los materiales mesoporosos ordenados M41S (IUPAC: 2 nm < d p < 50 nm), cuya síntesis y caracterización fue desarrollada por los investigadores de Mobil Oil en 1992. En este tipo de materiales, la MCM-41 (Mobile Composition of Matter) es la fase más representativa [5, 6]. La MCM-41 tiene características remarcables tales como poros con tamaños bien definidos y formas uniformes, los cuales se encuentran ordenados para producir arreglos de canales hexagonales que no se intersectan [3]. De elevadas áreas específicas y excelente estabilidad térmica, hidrotérmica e hidrolítica. Las paredes de los canales son de sílice amorfa y la porosidad puede ser elevada (~ 80 % de su volumen total). La porosidad y la morfología de la MCM-41 está determinada por diferentes parámetros usados durante la síntesis como el tipo de surfactante y la fuente de sílice, composición de los materiales iniciales, el pH, la temperatura, el tiempo de añejamiento, aditivos y los solventes usados. El tetraetilortosilicato (TEOS) y el silicato de sodio (Na2SiO3) son la fuente de sílice más utilizada en la síntesis de los materiales meposorosos ordenados [7, 8]. Los surfactantes pueden ser aniónicos, catiónicos o neutros o bien utilizar otras vías con plantillas no surfactantes. Dependiendo del surfactante seleccionado se obtendrá un diámetro de poro específico [3]. Actualmente, la síntesis de la MCM-41 por el método hidrotermal es la más utilizada, donde la temperatura empleada puede llegar hasta los 150 °C [1, 9]. Por ello es deseable el uso de una menor temperatura, dado la implicación de un menor consumo de energía.
A raíz del descubrimiento de los materiales mesoporosos se han sintetizado otros sólidos, originando una gran variedad de estructuras. En 1998 Zhao et al.[10] de la Universidad de California (Santa Barbara) desarrollaron nuevos materiales denominados como materiales SBA (Santa Barbara Acids), con los cuales se incrementó el tamaño de poro y la estabilidad. Estos materiales mesoporosos silíceos también poseen numerosas aplicaciones como catalizadores, soportes y adsorbentes [11]. Son de elevado orden, y se sintetizan en medio ácido por medio de copolímeros de tribloque no-iónicos y bloques de óxido de polipropileno. El material SBA-15 es una combinación de micro y mesoporos uniformes y ordenados hexagonalmente (4-14 nm) en 2D. Sus paredes son gruesas de sílice microporosa, lo que le confiere mayor estabilidad hidrotérmica [12]. Yu et al.,[13] sugirieron que el proceso de formación involucra tres etapas: auto ensamblaje cooperativo en compuestos agregados de surfactante-sílice; formación de una fase de cristal líquido rica en agregados y la separación de esta fase de la solución y un mayor crecimiento de la mesoestructura sólida impulsado por la condensación de las especies de sílice.
En este trabajo se presenta el estudio comparativo de la síntesis de materiales mesoporosos en su forma silícea pura (MCM-41 y SBA-15) y con la inclusión de hierro por síntesis directa, su caracterización; y un somero estudio de la captura de hidrógeno, como una posible aplicación de estos materiales, debido a las excelentes propiedades texturales y morfológicas que presentan. Este estudio preliminar permitirá visualizar una posible aplicación a los materiales obtenidos.
Materiales y métodos
Las síntesis de los materiales MCM-41 se realizó de acuerdo a lo reportado por Cai et al.[14] y Grubert et al.[15], modificando algunos parámetros tales como, disminución de la concentración de tensoactivo, temperatura (30 °C) y tiempo de agitación (20 h). Los reactivos empleados fueron los siguientes: hidróxido de amonio (NH4OH), bromuro de cetiltrimetilamonio (CTAB, (C19H42N•Br)), tetraetilortosilicato (TEOS, Si(C2H5O)4)) como fuente de silicio) y agua desionizada con relaciones molares: 4.63:0.016:0.13:33 (NH4OH:CTAB:TEOS:H2O); utilizando el siguiente procedimiento: se preparó una solución al 26 % en peso de NH4OH y agua desionizada en agitación continua y a 30 °C, se adicionaron 6 g de CTAB y enseguida TEOS, dejándose homogeneizar y precipitar durante 20 h.
Por otro lado, en la síntesis de los materiales SBA-15 [16] se emplearon los siguientes reactivos: TEOS, ácido clorhídrico (HCl) 2M, agua desionizada e NaOH 5M con relaciones molares: 0.023:0.19:0.83:0.07 (TEOS:HCl:H2O:NaOH). Además, se emplearon 2g de Pluronic-P123 (poli(etilenglicol)-bloque-poli(propilen glicol)-bloque-poli(etilenglicol) (EO)20(PO)70(EO)20), como agente estructurante. En esta síntesis la agitación se mantuvo constante durante 24 h a 40 °C; posteriormente, el pH se ajustó a 2.6 empleando una solución de NaOH 5M y se dejó madurar sin agitación a 95 °C durante una semana.
Los materiales mesoporosos modificados con hierro FeMCM-41 y FeSBA-15 se sintetizaron por vía directa, empleando nitrato de hierro nonahidratado (Fe(NO3)3•9H2O) como precursor de hierro en una relación molar de Si/Fe = 50, siguiendo los pasos mencionados previamente; en el caso de FeMCM-41 también se sintetizaron con relaciones molares de Si/Fe = 20 y 10. Una vez terminado cada proceso de síntesis, los materiales se lavaron al vacío con agua desionizada y un poco de etanol, dejándose secar a 60 °C. Finalmente, los sólidos "frescos" obtenidos, fueron molidos y calcinados a 600 °C durante 6 h, en una rampa de 2 °C/min en flujo de aire.
Los materiales calcinados fueron caracterizados por las siguientes técnicas: difracción de rayos-X (XRD, por sus siglas en inglés) en un equipo Phillips X’Pert, (Cu kα, λ = 1.54 Å) para determinar la estructura de los sólidos. Microscopia electrónica de transmisión de alta resolución (HRTEM) en el equipo TITAN (300 kV), para visualizar la estructura y realizar la medición de los diámetros de poro. La textura de los materiales previamente calcinados, se determinó por fisisorción de nitrógeno (a -196 °C) en un equipo BELSORP-MAX. Las muestras previamente se trataron a 150 °C por 20 h bajo flujo de nitrógeno. Las áreas específicas se han evaluado por el método BET (Brunauer-Emmett-Teller) y la distribución de tamaño de poro a partir de la rama de desorción por el método BJH (Barrett, Joyner y Halenda). La morfología de los sólidos se realizó en un microscopio electrónico de barrido (SEM) FEI Nova 200 Nanolab (15 kV, 0.14 nA) a 60,000x. Mientras que el análisis semicuantitativo de composición química elemental, se adquirió en un detector de rayos-X característicos (OXFORD) acoplado a un SEM (LEO 440) (25 kV y 700 pA). Los espectros UV-visible fueron obtenidos en un espectrofotómetro UV-visible de la marca Varian (Cary 1G) en un intervalo de longitud de onda de 200 a 900 nm.
Finalmente, se evaluó la capacidad de sorción de H2 de los materiales obtenidos en un equipo BELSORP-MAX. Las pruebas se realizaron a -196 °C (nitrógeno líquido) y a temperatura ambiente (25 °C) y a baja presión (100 kPa). Previamente, los materiales fueron tratados a 150 °C bajo flujo de nitrógeno durante 20 h.
Resultados y discusiones
La XRD a bajo ángulo de los materiales se muestra en la Figura 1. Se presentan las tres reflexiones en la región de 2θ = 0.5 a 5.5 °, los planos se indexaron como (100), (110) y (200), y la simetría es p6mm. Los materiales muestran la formación de la estructura hexagonal altamente ordenada. Sin embargo, en las muestras modificadas con hierro, el ordenamiento de los poros se ve disminuido dado que la intensidad del pico en el plano (100) es menor. Este comportamiento suele atribuirse a la reducción en la periodicidad [17]. También se tiene un desplazamiento del plano, lo cual indica una modificación en los parámetros de la celda. Los datos se presentan en la Tabla 1. En los resultados a alto ángulo (no mostrados), únicamente se aprecia la señal de la sílice amorfa proveniente de las paredes. No hay reflexiones que se asocien a fases segregadas de óxidos de hierro.

Figura 1 Difractogramas a bajo ángulo de los materiales mesoporosos calcinados a) MCM-41, b) FeMCM-41(50), c) SBA-15, d) FeSBA-15(50), e) FeMCM-41(20) y f) FeMCM-41(10).
Tabla 1 Propiedades fisicoquímicas de los materiales sintetizados.
| Material |
|
|
|
|
|
|
|---|---|---|---|---|---|---|
| MCM-41 | 3.48 | 4.02 | 1343 | 2.43 | 0.67 | 1.59 |
| FeMCM-41(50) | 3.69 | 4.26 | 1377 | 2.43 | 0.92 | 1.83 |
| SBA-15 | 10.30 | 11.89 | 652 | 6.18 | 1.25 | 5.71 |
| FeSBA-15(50) | 10.13 | 11.70 | 741 | 6.18 | 1.27 | 5.52 |
| FeMCM-41(20) | 3.70 | 4.28 | 935 | 1.52* | 0.62 | 2.76 |
| FeMCM-41(10) | 4.11 | 4.75 | 797 | 1.55* | 0.53 | 3.19 |
** Se empleó t-plot por estar en la región de microporos; Sbjh: Área Superficial Específica (BJH); Dp: Diámetro de poro; Vp: Volumen de poro; tw: espesor de pared.
La HRTEM (Figura 2), permite visualizar el arreglo hexagonal de los materiales mesoporosos. En la MCM-41 los diámetros son menores que en la SBA-15. En este último es más fácil visualizar el arreglo de los poros, así como en el patrón de difracción y confirmar que el orden es de largo alcance. Cuando el haz de electrones se encuentran en paralelo se aprecia la estructura ordenada tipo panal de abeja (Figura 2a y c), incluso se puede apreciar el hábito en la muestra SBA-15 (Figura 2c) [18]. Mientras que con el haz ubicado en forma perpendicular a los canales, se pueden observar dichos canales en paralelo (Figura 2b y d). Las isotermas de fisisorción de N2 son tipo IV (de acuerdo a la IUPAC), Figura 3. Los poros de los materiales MCM-41 son pequeños, y por ende tienen un lazo de histéresis muy estrecho, del tipo H4. El material de sílice MCM-41 tiene una distribución relativamente uniforme. Mientras que, los materiales de fase SBA-15 tienen una distribución de poro unimodal y el lazo de histéresis es más amplio y es del tipo H1, atribuido a llenado de mesoporos uniformes y de geometría cilíndrica [19,20], el cual es típico para materiales con estructura hexagonal en dos dimensiones [21]. Los resultados del análisis textural (Tabla 1), muestran que los Dp para los materiales MCM-41 son mucho menores y sus paredes más delgadas, en cambio las áreas específicas son prácticamente el doble que las que poseen los materiales de fase SBA-15.

Figura 2 Resultados de HRTEM de la sílice mesoporosa. a) MCM-41 y c) SBA-15 el haz en paralelo hacía el eje de los canales, b) MCM-41 y c) SBA-15 el haz en dirección perpendicular al eje de los canales.
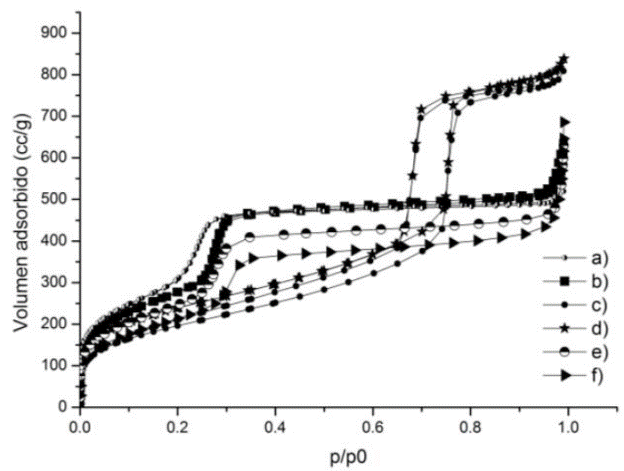
Figura 3 Isotermas de fisisorción de N2 de los materiales a) MCM-41, b) FeMCM-41(50), c) SBA-15 d) FeSBA-15(50), e) FeMCM-41(20) y f) FeMCM-41(10).
Los resultados de SEM nos permitieron dilucidar la morfología y la dimensión de las partículas. La muestra de MCM-41 (Figura 4a) exhibe morfología tipo almendra con una distribución de partícula de ~ 1 μm. En la muestra de FeMCM-41 (Figura 4b) las partículas adquieren otra morfología con variación en sus diámetros (desde 1 μπι hasta 130 nm). Mientras, que la morfología en las muestras SBA-15 y FeSBA-15 (Figura 4c y d), se tienen agregados de partículas tipo lazo, además el diámetro de partícula en SBA-15 es ligeramente menor que la del mesoporoso modificado FeSBA-15 y relativamente uniformes en ambos materiales (~ 4.3 μm).

Figura 4 Micrografías SEM a 60000 x, de los materiales mesoporosos calcinados: a) MCM-41, b) FeMCM-41(50), c) SBA-15 y d) FeSBA-15(50).
En la Tabla 2 se presentan los resultados del análisis semicuantitativo de composición química elemental EDX de los sólidos sintetizados y calcinados. Se encontró que en las zonas estudiadas en ambos materiales adicionados con hierro, la incorporación de éste, es ligeramente menor a la cantidad teórica calculada; lo anterior puede deberse a la posible formación de complejos por el medio ácido o bien por la adición de TEOS.
Tabla 2 Resultados de composición química por EDX de los materiales sintetizados en porcentaje molar.
En la determinación de la naturaleza del hierro en la MCM-41 y SBA-15 se empleó el análisis UV-vis, Figura 5. Las muestras modificadas con hierro presentan una banda de absorción relevante en el intervalo de 220 - 350 nm con un máximo en 250 nm, el cual se relaciona con los iones de hierro (III), los cuales están coordinados tetraédricamente [22]. Además, no se tiene señal intensa en los 420 nm, la cual se relaciona al Fe octaédrico. Lo cual coincide con la XRD, donde no se observó la presencia de reflexiones características de Fe2O3. Este resultado confirma que el hierro se ha incorporado exitosamente en la estructura y es acorde con los resultados de otros investigadores [22].
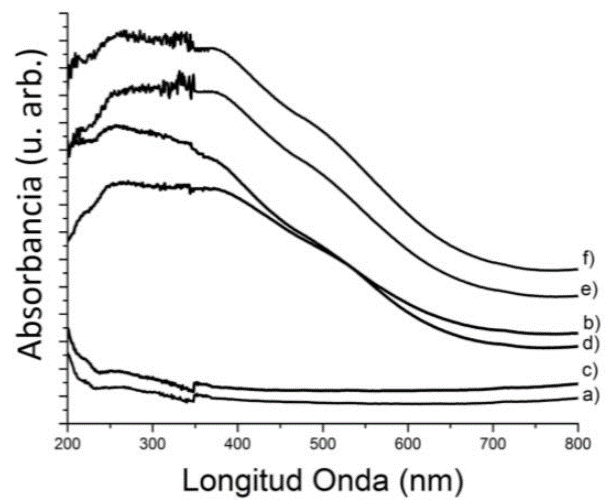
Figura 5 Espectros UV- vis de los materiales a) MCM-41, b) Fe-MCM-41(50), c) SBA-15 y d) Fe-SBA-15(50), e) FeMCM-41(20) y f) FeMCM-41(10).
Las isotermas de adsorción de hidrógeno (-196 °C) de los materiales se muestran en la Figura 6. Los valores de la capacidad máxima de adsorción de hidrógeno se aprecian en la Tabla 3. Analizando los resultados podemos observar claramente el efecto de incorporar y de incrementar la concentración de hierro en los materiales. Los materiales incorporados con Fe mostraron una mayor capacidad de adsorción de hidrógeno que los materiales puros. Este incremento puede ser debido a la formación de aductos Mn+(H2) dentro de la estructura de los materiales mesoporosos [26]. Además, en los materiales de FeMCM-41 al disminuir la relación molar Si/Fe se observa un ligero incremento en la capacidad de adsorción debido a una mayor concentración de iones de Fe (III) en coordinación tetraédrica. Sin embargo, el material FeMCM-41(10) muestra una ligera disminución en la capacidad de adsorción de hidrógeno debido a un colapso de la estructura y disminución del área específica (Figura 1 y Tabla 1). Ningún lazo de histéresis (no mostrado) fue observado en todas las muestras, indicativo de que el mecanismo de adsorción es fisisorción [25]. Debido a la importancia de adsorber hidrógeno a temperatura ambiente, se realizaron estudios de estos materiales a 25 °C y a baja presión (Figuras 7 y 8). En la Tabla 3 se puede observar que la capacidad de adsorción de todos los materiales es menor a la obtenida a la temperatura del nitrógeno líquido. Este mismo comportamiento ha sido observado en la literatura por otros investigadores [23,24]. Las isotermas de sorción de hidrógeno en todos los materiales mesoporosos a 25 °C no fueron reversibles (Figuras 7 y 8) indicativo de que el proceso es gobernado por la quimisorción [25]. Es decir, que las principales interacciones entre la estructura mesoporosa y las moléculas de hidrógeno implican una interacción química entre éstas y los sitios de hierro. También se puede observar que aun despúes de dos ciclos de sorción/desorción (Figuras 7 y 8), la capacidad de sorción de hidrógeno en casi todos los materiales se mantiene prácticamente constante (Tabla 3), siendo estos materiales prometedores para el almacenamiento de hidrógeno.

Figura 6 Adsorción de H2 a -196 °С de los materiales a) MCM-41, b) FeMCM-41(50), c) SBA-15 d) FeSBA-15(50), e) FeMCM-41(20) y f) FeMCM-41(10).
Tabla 3 Capacidad de adsorción de hidrógeno a diferentes temperaturas y 101 kPa para los materiales sintetizados.
| Material | H2 (cc/g) | Ciclo 1 H2 (cc/g) | Ciclo 2 H2 (cc/g) |
|---|---|---|---|
| T (°C) | -196 | 25 | 25 |
| MCM-41 | 38.86 | 32.83 | 37.32 |
| FeMCM-41(50) | 40 | 30.94 | 31.71 |
| SBA-15 | 38.16 | 23.73 | 23.97 |
| FeSBA-15(50) | 44.25 | 27.15 | 29.01 |
| FeMCM-41(20) | 45.36 | 34.72 | 33.11 |
| FeMCM-41(10) | 45.08 | 29.44 | 28.98 |

Figura 7 Primer ciclo de sorción de H2 a 25 °C de los materiales a) MCM-41, b) FeMCM-41(50), c) SBA-15 d) FeSBA-15(50), e) FeMCM-41(20) y f) FeMCM-41(10).
Conclusiones
Se sintetizaron y modificaron con Fe por el método directo, materiales MCM-41 y SBA-15. Éstos mostraron elevada área específica (651 - 1377 m2) y volumen de poro (hasta 1.27 cm3), así como el típico arreglo hexagonal de los poros. Lo anterior, en el caso del material MCM-41, nos confirma que a bajas concentraciones de tensoactivo y baja temperatura (prácticamente ambiente), es posible obtener materiales mesoporosos ordenados, con moderada inclusión de hierro. Ello se muestra en los patrones de XRD obtenidos; la mayoría de los trabajos publicados utilizan temperaturas elevadas para realizar la síntesis (> 90 °C).
Los materiales SBA-15 modificados con hierro mostraron mayor capacidad de adsorción, diámetros y espesores de pared mayores a los de la MCM-41, por ende son más estables y permiten la entrada de gases más fácilmente. Las isotermas de adsorción de H2 indicaron que la inclusión del hierro en la estructura de los materiales, aumenta la capacidad de adsorción de H2. Se observa que a mayor proporción de hierro se mejora la adsorción (FeMCM-41: Si/Fe = 20), dado que este material adsorbió ligeramente por arriba del material de FeSBA-15(50); en los materiales también se observó una relación entre el diámetro de poro y el volumen de poro ya que habilitan la captura del H2. La adsorción de hidrógeno a -196 °C es gobernada por el mecanismo de fisisorción, mientras que a temperatura ambiente el mecanismo es quimisorción [25]. Los valores de la adsorción de hidrógeno para este tipo de materiales son congruentes a los reportados en la literatura [25].











 nova página do texto(beta)
nova página do texto(beta)



