1. Introducción
Las películas de dióxido de titanio (TiO2) han demostrado gran potencial en diversas aplicaciones como: fotocatálisis [1], celdas solares para la producción de energía eléctrica [2], sensor de gas [3], recubrimiento protector de corrosión [4], recubrimientos ópticos [5], y como recubrimiento de implantes óseos [6]. Éstas han sido elaboradas mediante distintos procesos de depósito como R-F sputtering [7], depósito por láser pulsado [8], haz de iones [9], y CVD [10], entre otros. Sin embargo, estos métodos tienen altos costos y la preparación de películas con aéreas grandes presenta dificultades desde el punto de vista técnico. El método de electrodeposición a partir de soluciones acuosas ha demostrado ser una técnica muy exitosa para el depósito de varios óxidos metálicos, pues ofrece ventajas tecnológicas como: simplicidad y economía, control en espesor, uniformidad y velocidad de depósito; así como la posibilidad de depósito en sustratos de forma compleja [11]. Las características de las películas se pueden controlar por la variación de los parámetros de depósito como el tipo de solución, potencial aplicado, corriente, temperatura, pH y parámetros externos aplicados durante la electrólisis.
Se ha reportado que una de las vías de obtención de TiO2 por electrodeposición es a través de una sal metálica en solución acuosa, lo que genera la formación de un hidróxido de titanio que precipita, por lo que el depósito requiere un medio muy ácido y un ambiente libre de Oxígeno, por ejemplo cuando se trabaja con TiCl4 [12]. Zhitomirsky et. al. [13, 14] desarrollaron una metodología de electrosíntesis catódica, que emplea peroxocomplejos de titanio para sustituir a los iones de titanio utilizando una sal de titanio, como TiOSO4 o TiCl4, en presencia de peróxido de hidrógeno para obtener el TiO2. La ventaja del uso de los peroxoprecursores se debe a su estabilidad en soluciones acuosas bajo ciertas condiciones, por lo que es posible utilizar agua, como disolvente y fuente de OH- al producirse hidrólisis, ya que estos iones son necesarios para la deposición. El incremento del grosor de la película con el tiempo, incrementa la resistividad haciendo necesario elevar el potencial, para mantener estable la corriente de depósito. Por otra parte, Tacconi et. al. [15] prepararon películas de TiO2 acompañado de WO3 mediante la técnica de pulsos de voltaje. El voltaje de los pulsos fue de -0.45 V y -0.95 V para la deposición de WO3 y TiO2, respectivamente. Esta elección del potencial permitió que la corriente obtenida durante el proceso de depósito tuviera un transiente similar al tren de pulsos de potencial.
La morfología característica obtenida al crecer películas de TiO2 por métodos electroquímicos, es de poros abiertos. Otra característica de estos crecimientos es que aun en las películas más compactas, se han observado grietas [16]. Cuando se emplean altas densidades de corriente ( ≥ 20 mA/cm2) se presenta un recubrimiento incompleto de la superficie, y/o poca adherencia de la película al sustrato debido a la evolución de los gases en el cátodo [17]. En la obtención de dióxido de titanio mediante electrodepósito, aún es necesario evaluar cómo afectan al material obtenido los distintos factores de crecimiento, para poder determinar los parámetros óptimos para crecer películas con características controladas. Entre los factores, que podrían afectar en forma determinante las propiedades del material obtenido se encuentran: la homogenización del electrolito y la destrucción/control de las burbujas producidas por la hidrólisis.
En este trabajo el depósito de TiO2 se realizó empleando un peroxoprecursor por lo que se diseñó y construyó una celda electrolítica para controlar de manera precisa la reacción electroquímica de TiO2 fijando los electrodos y añadiendo un sistema de agitación para la eliminación de las burbujas producidas. Se estudió el efecto de la frecuencia de los pulsos de voltaje aplicados sobre la cantidad de material depositado y la morfología superficial de las películas.
2. Detalles Experimentales
2.1. Diseño de la celda electroquímica.
Las celdas electroquímicas comerciales presentan ciertos inconvenientes: a) los electrodos no están completamente fijos; b) al realizar un crecimiento sobre una cara de una placa metálica, sumergida completamente en el electrolito, la otra cara de la placa se debe de aislar con pastas comerciales para este propósito, este tipo de pastas tienen sus restricciones ya que no soportan ambientes muy ácidos y se disuelven, contaminando el electrolito; y c) al producirse las reacciones de óxido-reducción, se produce oxígeno e hidrogeno en forma de burbujas, estas se depositan en los electrodos, afectando la electrodeposición en el cátodo y restándole capacidad de captar electrones al electrodo de conteo.
Teniendo en cuenta los inconvenientes anteriores, se diseñó y construyó una celda electroquímica con elementos fijos, con un dispositivo de agitación para eliminar las burbujas producidas y optimizar el proceso de electrodeposición. Un esquema de esta celda es presentada en la figura 1. El material utilizado en su construcción fue teflón, el cual es inerte en medios ácidos. Para el agitador microsónico se utilizó el motor de un cepillo de dientes comercial.
2.1.- Crecimiento y caracterización de las muestras.
El electrolito se preparó a una concentración de 0.05 M de TiCl4 y 0.5 M de H2O2 en una mezcla de metanol-agua en una relación 3:0.5, empleando reactivos marca Baker. Se utilizó como sustrato, acero inoxidable 304 de 0.80 x 0.80 pulgadas, para obtener una superficie del sustrato sin rayas y acabado espejo se utilizó una pulidora de 10 niveles. El pulido del sustrato inició empleando una lija del número 300, terminando con alúmina de 0.05 micras. Para eliminar los residuos del pulido, los sustratos se lavaron en un baño ultrasónico durante 5 minutos con agua y jabón neutro, después fueron enjuagados con agua bi-destilada, seguida de acetona para eliminar los residuos de jabón. Para la eliminación de las grasas y el polvo, los sustratos se sometieron a un proceso secuencial de limpieza ultrasónica en hexano, acetona e isopropanol por diez minutos cada uno. La preparación del sustrato incluyó una erosión química mediante una solución de H2O2/H2SO4 en una relación 3:1 [18] en volumen, durante una hora. Se utilizó una celda electroquímica de 3 electrodos para la preparación de las películas, la cual empleó como electrodo de conteo una malla de platino; como electrodo de referencia Ag/AgCl; y como electrodo de trabajo el sustrato de acero inoxidable. Las películas de TiO2 fueron electrodepositadas utilizando un potenciostato/galvanostato Bank Electroniks modelo LPG03. Cada depósito se realizó por una hora a un pH de 0.9 (±0.3) y una temperatura inicial de la solución de 13 °C, con una potencia de agitación de 5.4 mW, en una cámara de temperatura constante a 20 °C, la celda se colocó en un ángulo de 45 °, para evitar que las partículas formadas durante el proceso, precipitaran en el centro del sustrato. Como potencial de depósito se emplearon pulsos de voltaje de Vc= -2500 mV y Va= -500 mV. Se varió la frecuencia de los pulsos cuadrados entre 0 a 1 Hz; como frecuencia de 0 Hz nos referimos a la aplicación de un voltaje constante igual a -2500 mV. El proceso y la instrumentación necesaria para generar los pulsos de voltaje para el depósito electrolítico están reportados en la literatura [19]. Las muestras obtenidas fueron deshidratas a 120 °C; y posteriormente tratadas térmicamente a 450 °C en una atmosfera de Ar durante 2 horas. La morfología superficial de las películas de TiO2 se estudió mediante un Microscopio Electrónico de Barrido (SEM) JEOL 6390LA. Las muestras fueron analizadas por Difracción de Rayos X (XRD) en un equipo SIEMENS D5000 a ángulo razante de 1.5 ° y empleando un voltaje de aceleración de 35 KV y una corriente de 25 mA.
3. Resultados
Para determinar los valores de los voltajes a utilizar, en el crecimiento de películas de TiO2, se realizó un voltamperograma lineal del sistema electrolítico, el cual se presenta en la figura 2. En él se observan la región catódica o de reducción (izquierda) y la región anódica o de oxidación (derecha). La depresión en el valor de -600 mV corresponde a la frontera entre las dos regiones. La elección de los valores de potencial se realizó de forma tal que la variación se produjera entre un voltaje catódico Vc (depósito) y un voltaje anódico Va (descarga). En base a este experimento se fijaron los pulsos de Voltaje con Vc= -2500 mV y Va= - 500 mV.

Figura 2 Voltamperograma del sistema electroquímico, a 0.05 M TiCl4, 0.05 M H2O2, en mezcla de metanol- agua 3:05% en vol.
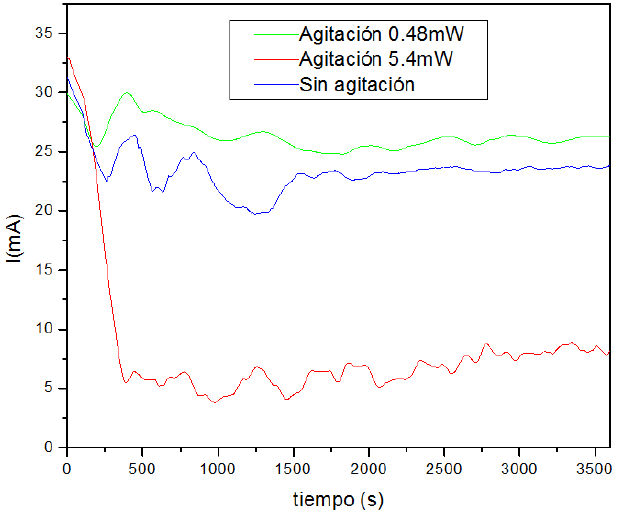
Un parámetro fundamental del proceso de electrodeposición es la corriente, debido a que partir de ésta se puede obtener la cantidad de material depositado empleando la ley de Faraday. Con el objeto de ver la influencia del dispositivo de agitación durante los crecimientos, se hicieron tres películas a voltaje constante de -2500 mV, con diferentes potencias del agitador microsonico (0.48 mW, 2.5 mW) y 5.4 mW). En la figura 3 se presenta la variación de la corriente con respecto a la potencia que se aplicó al motor de agitación. Se puede observar cómo para la película sin agitación la corriente tuvo una caída de aproximadamente 27 mA, durante los primeros minutos del crecimiento; sin embargo, para los crecimientos donde se aplicó la agitación, esta caída se atenúa hasta que la corriente se mantiene casi constante desde el inicio del depósito.
El incremento en las curvas de corriente demuestra el efecto positivo del dispositivo de agitación, debido a que una mayor corriente está relacionada con un aumento en la cantidad de material depositado. Este incremento puede deberse a la destrucción de burbujas, homogenización de la solución y un aumento de la energía cinética de los iones en el electrolito.
Para ver el efecto de la frecuencia de los pulsos de voltaje sobre las propiedades de las películas de TiO2, ésta se varió entre 0 Hz y 1 Hz. Cada depósito se realizó por una hora a un pH de 0.9 (±0.3) y una temperatura inicial de la solución a 13 °C, con un nivel de agitación de 5.4 mW, en una cámara de temperatura constante a 20°C. Aplicando pulsos cuadrados de voltaje de Vc= -2500 mV a Va= -500 mV. En la tabla 1 se presentan los nombres de las muestras y la frecuencia de los pulsos empleada para su crecimiento.
Para mostrar la relación del cambio en los valores de corriente entre los depósitos pulsados a diferente frecuencia, se construyeron las curvas de la corriente de cada depósito mediante los valores instantáneos del Vc, debido a que es el potencial el que determina la corriente efectiva, que sirve para estimar la cantidad de carga transportada hacia el electrodo de trabajo. Las curvas de corriente mostraron un incremento de la misma en los depósitos pulsados (0.15 Hz - 1 Hz), en relación a la película crecida a voltaje constante (0 Hz). Al aumentar la frecuencia de los pulsos, la corriente obtenida del depósito M015 al M045 va en aumento; a partir de 0.45 Hz, la corriente decrece para los depósitos M065 y M085; sin embargo, para la película M100, la corriente alcanza los valores más altos. Casi todos los depósitos presentaron buena adherencia y no se tuvo problemas durante el proceso de enjuague con agua destilada y secado con nitrógeno, excepto para la muestra crecida a la frecuencia de 1 Hz en la que se obtuvo un crecimiento de mala calidad pues la muestra presento grietas y no fue estable al procedimiento de enjuague y secado. A partir de las curvas de corriente se integró el área bajo la curva y se obtuvo la cantidad de carga transferida q y el número de moles transportados. La estimación de los moles transferidos nos proporciona una estimación sobre la cantidad de electrones que fluyen en la solución del peroxo-complejo de titanio
Para determinar la masa depositada sobre el electrodo, tenemos los moles transferidos y se necesita saber la estequiometria del complejo para lo cual se tomó lo reportado por Mϋhlenbach et al. [20] donde obtuvieron n = 3, como la estequiometria para el compuesto naranja-rojo formado en soluciones muy ácidas, resultando
En la figura 4 se observa la variación de la masa depositada en relación con la frecuencia de los pulsos de voltaje, para la muestra M000 hubo un depósito de 160 miligramos y se incrementó con los pulsos, las películas con mayor cantidad de masa depositada fueron M045 y M100 con 457 y 491 miligramos, respectivamente.
La morfología de las películas obtenidas después de la deshidratación se presenta en la figura 5, (a-g), donde se observa la variación de la superficie como función de la frecuencia de los pulsos cuadrados de voltaje. La película M000 presentó una morfología uniforme en su mayoría y con cúmulos de material dispersos sobre ella, además fue un depósito muy delgado ya que se observan las imperfecciones del substrato. Las muestras M015 a M085 mostraron un crecimiento por islas, con diferentes morfologías, estando el material firmemente adherido al substrato. La película M100 se muestra cúmulos separados y sobrepuestos explicando la poca adherencia que esta película presentó. Las películas M015 y M065 presentaron las mejores características morfológicas, aunque la M065 tuvo una mayor cantidad de masa depositada.

Figura 5 Micrografías de las películas crecidas, (a) M000, (b) M015, (c) M025, (d) M045, (e) M065, (f) M085, (g) M100
En los difractogramas de rayos-X (no presentados), de las películas deshidratadas y sin tratamiento térmico, se observó que los picos de difracción correspondían al sustrato utilizado; para la identificación de los picos característicos del acero inoxidable 304, se utilizó como base el estudio de N. Karimi et al. [21]. No se observaron picos correspondientes al TiO2, lo cual sugeriría que las muestras tienen una estructura amorfa. Posteriormente las muestras fueron tratadas térmicamente a 450 °C, durante 2 horas, en una atmosfera inerte de Argón. En la figura 6, se muestran los difractogramas de las muestras tratadas térmicamente; como se puede apreciar, las películas presentan un pico correspondiente al plano (101) de la fase anatasa del dióxido de titanio, señalada en la figura como (a), para realizar la identificación de esta fase se utilizó la tarjeta 211272 de la base de datos Powder Diffraction File. Los picos señalados de la b-e, (Fe2O3, Mn1.5Cr1.5O4, Cr2O4, α-Fe, γ-Fe), pertenecen a los compuestos formados por el acero inoxidable a través del tratamiento térmico [21].
4. Conclusiones
Se prepararon películas de TiO2 por medio de la técnica de electrodeposición pulsada, asistida por agitación. La agitación tiene una influencia positiva para mantener constante la corriente durante el crecimiento. La frecuencia óptima de los pulsos de voltaje fue de 0.45 Hz, en la cual se tuvo mayor cantidad de material depositado y mejores características morfológicas de las películas. La metodología presentada podría implementarse fácilmente para fabricar películas en áreas grandes.











 nueva página del texto (beta)
nueva página del texto (beta)