1. Introducción
El consumo actual de combustibles fósiles hace necesario que las normatividades ambientales sean cada vez más rigurosas. El proceso convencional para remoción de azufre de los distintos cortes de petróleo es la hidrodesulfuración (HDS) y sólo a condiciones severas de operación es posible obtener diesel con ultra bajo contenido de azufre (< 10 ppm S) [1]. Para cumplir con las exigencias gubernamentales en cuanto a la calidad de los combustibles, se han propuesto tecnologías complementarias, entre las que destacan la desulfuración oxidativa [2], la cual consiste en la extracción de los compuestos organoazufrados con un disolvente polar y la subsecuente oxidación mediante un agente oxidante [3]. Con este propósito se ha estudiado la actividad catalítica del tungsteno para la formación de sulfonas a partir de tioéteres tanto en catálisis homogénea con un sistema de Na2WO4 y CH3CO2H [4], como con catalizadores de WO3 soportados en SiO2 [5], lo que lo hace ideal para catalizar el proceso de ODS.
Para mejorar la actividad diferentes soportes catalíticos se han utilizado, entre ellos la γ-alúmina y la titania (anatasa), obteniéndose catalizadores más activos soportados en titania que sobre alúmina. Debido principalmente a que la titania es una fase activa para la ODS [6]. El uso de un soporte mixto de alúmina y titania es una buena alternativa para incrementar la actividad de los catalizadores soportados en alúmina e incrementar el área específica de los soportados en titania. La composición y las propiedades del soporte determinan las especies de W presentes en la superficie. Especies tetraédricas de W están presentes sobre alúmina, mientras que especies octaédricas de W están presentes en el soporte mixto [7]. Por lo que la estructura, la dispersión y la reducibilidad de la fase activa dependen de la carga de W y de la temperatura de calcinación y por lo tanto, se espera que al cambiar estas características la actividad catalítica sea modificada. El presente trabajo es el resultado de la investigación realizada sobre la evaluación de la actividad catalítica de óxidos de tungsteno soportados en alúmina o sobre un óxido mixto de alúmina-titania en el proceso de ODS.
2. Experimental
2.1 Preparación de catalizadores
Los catalizadores de WO3 con densidades superficiales de 0.5, 1.0 y 1.6 átomos de W/nm2 soportados en alúmina (Condea, 216 m2/g) o Al2O3-TiO2 (preparado por el método sol-gel con una relación equimolar, 322 m2/g) fueron preparados por impregnación incipiente de una disolución acuosa de (NH4)6H2W12O40·xH2O (Aldrich) a la concentración necesaria. Después de 12 h de madurado, se secó a 120 °C durante 24 h y se calcinó a 500 °C por 6 h en presencia de aire. Los catalizadores fueron nombrados de acuerdo a la fase activa (W), al soporte (A = Al2O3, AT = Al2O3-TiO2) y al porcentaje en masa de WO3 como WA4, WA8, WA12, WAT5, WAT11 y WAT17. Dichos porcentajes corresponden a las densidades superficiales de 0.5, 1.0 y 1.6 átomos de W/nm2 respectivamente. Estos catalizadores en su estado oxidado fueron parcialmente reducidos en un equipo de TPR (a 10 °C/min hasta 900 °C) y las muestras obtenidas se rotularon con una R adicional.
2.2 Caracterización de catalizadores
Para la caracterización de los catalizadores se empleó un difractómetro de rayos X de polvos Siemens D500 con radiación Cu Kα para conocer las fases cristalográficas de las muestras. El análisis químico se llevó a cabo por EDX con un detector Oxford-ISIS acoplado a un microscopio electrónico de barrido JEOL JSM-5900-LV con el que se observó la distribución de las especies presentes y se determinó la carga de W depositada en el soporte. La reducción de los catalizadores se realizó en un equipo convencional de TPR, el cual fue operado con una rampa de calentamiento de 10 °C/min hasta 900 °C, con un flujo de 25 mL/min de una mezcla de H2 al 70 % vol. en Ar.
2.3 Pruebas de actividad en la reacción de ODS
En las pruebas de actividad catalítica se ocupó una mezcla reactiva que consiste en dibenzotiofeno (DBT) y sus alquilderivados (4-MDBT y 4,6- DMDBT) disueltos en acetonitrilo con una concentración total de 600 ppm de S. Las reacciones por lotes se llevaron a cabo en un reactor de 250 mL provisto de un agitador, una chaqueta con agua a temperatura constante, un termómetro, un puerto de muestreo y un sistema de reflujo para condensar vapores y mantener la presión constante. Al reactor se le agregó 50 mL de la mezcla reactiva, 0.1 g de catalizador y H2O2 (30 % vol. en agua) como agente oxidante a fin de mantener una relación molar de O/S = 6. La reacción se mantuvo con agitación vigorosa a una temperatura de 60 °C. El avance de la reacción fue monitoreado a los 15, 30, 60 y 90 minutos, con un cromatógrafo de gases HP 5890 Serie II equipado con un sistema de inyección automática de muestras HP 7673, con una columna capilar PONA (goma de metil silicona, 50 m × 0.2 mm × 0.5 μm) y un detector de ionización de flama.
2.4 Pruebas de estabilidad del catalizador
Estos experimentos se realizaron un reactor de lecho fijo (longitud = 29 cm, diámetro interno = 6 mm) empacado con 1 g de catalizador y partículas inertes. Se alimentó acetonitrilo con una concentración total de 200 ppm de S de DBT y H2O2 a la temperatura de reacción por medio de una bomba (Cole Parmer Masterflex 7553-70). Las condiciones de operación son las siguientes: WHSV = 23.6 h-1, presión atmosférica, O/S = 6 y temperatura de reacción = 60 °C.
3. Resultados y discusión
Primero se presentarán los resultados obtenidos de las caracterizaciones por: SEM, TPR y DRX, para posteriormente discutir los resultados de actividad catalítica.
3.1 Caracterización de catalizadores
En la Fig. 1 se muestra el mapeo superficial de W, Al, Ti y O para el catalizador WAT5. Del análisis por SEM-EDX se observa una buena distribución del tungsteno sobre la superficie de los soportes de alúmina y Al2O3-TiO2, ya que no se presenta aglomeración de las fases. Para los otros catalizadores también se observa una distribución elemental similar. Los resultados cuantitativos muestran que los contenidos de W en los diferentes catalizadores es similar al teórico con una variación de ±2 %.

Figura 1 Distribución elemental de WAT5 obtenida por SEM-EDX. a) Micrografía del catalizador, b) O, c) Al, d) W y e) Ti.
De acuerdo a los resultados de los catalizadores soportados en Al2O3-TiO2, el contenido atómico corresponde aproximadamente a la cantidad teórica para la formación de titanato de aluminio (Al2TiO5). Trabajos previos [8, 9] muestran que es posible la formación de titanato de aluminio resultando estable a las condiciones a las cuales se realizó la calcinación de los catalizadores.
Los termogramas de TPR de los catalizadores soportados en alúmina se presentan en la Fig. 2, donde se observa un solo pico de reducción que inicia alrededor de los 800 °C, atribuido a la reducción de especies de W6+ a W0. Se puede apreciar una ligera disminución de las temperaturas de inicio de reducción al aumentar la carga de WO3. Al disminuir la carga de WO3 en alúmina, disminuye la reducibilidad del tungsteno porque la interacción con la alúmina es mayor [10, 11]. La reducción de las especies de óxido de tungsteno que se encuentran presumiblemente en coordinación tetraédrica [7, 11, 12], presentan únicamente un pico de reducción a alta temperatura debido a una fuerte interacción con el soporte. La presencia del pico se puede atribuir a que la reducción de las especies de óxidos de tungsteno se da en un solo paso, ya que la alúmina no es capaz de estabilizar los estados de oxidación intermedios del tungsteno [12]. También puede ocurrir cambio de fase del WO3 amorfo a conformación ortorrómbica en el intervalo de 330 - 740 °C y a temperaturas mayores presenta arreglo tetraédrico [13, 14], pero los picos de reducción no muestran cambios de fase, sólo representan reducciones de los compuestos dado que el detector de conductividad térmica sólo evalúa el consumo de H2.
El catalizador preparado sobre el óxido mixto (WAT17) muestra tres picos de reducción en el termograma de la Fig. 3. El primer máximo se encuentra entre 553 y 678 °C, que corresponde también al termograma del soporte (AT); este pico puede ser atribuido a la reducción de Ti4+ a Ti3+ y probablemente también ocurra la transición de la fase anatasa a rutilo, la cual se da cerca de 600°C [7, 12]. El segundo pico es atribuido a la transición de W6+ a W4+ con máximo a 745 °C y el tercer máximo de reducción se encuentra cerca de 832 °C que corresponde al cambio de W4+ a W0. Para los catalizadores con menor contenido de W (WAT11 y WAT5) el segundo pico de reducción no es apreciable, pero la reducción de la titania y el tercer pico son evidentes.
El comportamiento de reducción del óxido de tungsteno soportado sobre Al2O3-TiO2 difiere considerablemente a cuando es soportado en alúmina. La reducción de WO3 soportado en TiO2 se ha reportado que ocurre en dos etapas [12], la primera es el paso de W6+ a W4+ y la segunda, donde W4+ pasa a W0. La aparición de una segunda etapa de reducción se debe a que las especies de W4+ son estabilizadas por la titania. El efecto estabilizador de la titania se debe a que el radio iónico de la anatasa y rutilo (0.068 nm) es muy parecido al WO2 (0.064 nm), la longitud de enlace metal-oxígeno es bastante similar (anatasa 0.195 nm, rutilo 0.194, WO2 0.200 nm) y en todos los casos se tiene un arreglo tetragonal [12]. Durante el tratamiento por TPR puede darse la transformación de TiO2 anatasa a rutilo, mientras el WO3 se reduce a WO2 y enseguida es acomodado en la red cristalina de la titania.
Con el propósito de evaluar la presencia de diferentes especies cristalinas en los catalizadores, se obtuvieron los difractogramas de DRX. Estos se presentan en la Fig. 4 para la muestra WA12 antes y después de ser reducida parcialmente por la técnica de TPR. El catalizador en su forma oxidada (WA12) sólo muestra picos de difracción correspondientes a γ-Al2O3. A esta escala de medición, se puede sugerir que el tungsteno se encuentra bien disperso formando una fase amorfa o bien cristalitos menores de 4 nm, que no resultan detectables para el difractómetro. WA12R muestra los picos de difracción correspondientes a la alúmina, un pico en 33.6° que corresponde a WO3 y el resto corresponden a tungsteno metálico (2θ = 39.9, 40.2, 43.9, 58.2, 69.7, 73.1 y 75.3°). Estos resultados corroboran que la reducción de W6+ se da de manera directa a W metálico, sin la presencia de otros estados de oxidación del tungsteno, pero ésta no es completa porque se tiene la presencia de WO3.
En la Fig. 5 se presentan los difractogramas para WAT17, donde se observan picos característicos de la especie de WO3. Trabajos previos [15] reportan que el óxido mixto Al2O3-TiO2 no presenta fases cristalinas cuando se encuentran interaccionando fuertemente, siendo esto una posible explicación de la ausencia de picos en el difractograma asociados con el soporte de AT.
El difractograma de la muestra WAT17R indica la presencia de W0, WO2 (2θ = 35.5 y 36.1°), γ-Al2O3 (2θ = 37.7, 39.5, 54.9 y 67.0°), rutilo (2θ = 27.5, 41.2, 54.3 y 69.7°) y α-Al2O3 (2θ = 25.8, 43.0, 52.5, 57.5, 68.1 y 76.8°). La existencia de WO2 se debe a que la titania es capaz de estabilizar este estado de oxidación intermedio del tungsteno y la presencia de W0 puede ser atribuido a que el W4+ se estabiliza sólo parcialmente sobre TiO2. Además, al tener un soporte conformado por un óxido mixto de alúmina y titania, durante la reducción, sobre la alúmina se obtendría a W0 y sobre la titania al WO2.
A temperaturas mayores de 700 °C se ha reportado la descomposición de Al2TiO5 fácilmente en α-Al2O3 y TiO2 rutilo [8, 9, 16]. Si se asume que se ha formado titanato de aluminio en esta muestra, de acuerdo con los resultados y lo reportado en la literatura, entonces la presencia de α-Al2O3 y rutilo es atribuible a la segregación del soporte. Sin embargo, no se observa la presencia de Al2TiO5 por DRX, lo que sugiere que éste se pudo haber formado al reaccionar parcialmente el óxido mixto en las primeras etapas del tratamiento de reducción y descomponerse a temperaturas más altas, o bien, que parte del soporte se transformó a Al2TiO5 durante la calcinación, pero con una estructura no identificable para el equipo de DRX.
Durante el proceso de impregnación las especies solubilizadas de las sales metálicas varían respecto al pH de la disolución, esto se relaciona también con el contenido que se depositará en la superficie del soporte dependiendo de su punto de carga cero (PCC). De acuerdo con la literatura [17], al impregnar los soportes al pH de la solución de metatungstato de amonio el cual es alrededor de 4, las especies HW6O20 3- y HW6O20(OH)2 5- (politungstatos octaédricos) predominan y los PCC de los soportes se encuentran a un pH mayor (alúmina 8.5 y titania 6.0). El PCC de la mezcla de óxidos podría ser considerado como un valor intermedio. Dado que los PCC de los soportes se encuentran a pH más alto que la solución impregnante de W, en el soporte AT habrá relativamente menor número de cargas positivas (H+) que negativas (OH-) respecto a la alúmina. Esto puede causar que las especies aniónicas de politungstatos en la solución se dispersen en mayor medida en la alúmina que en AT, pudiendo dar lugar a que en alúmina se presente una mayor interacción metal-soporte. Dado que en AT las pocas especies de politungstatos que no pueden adsorberse (debido a que hay ligeramente más cargas negativas) es posible que se aglomeren, produciendo partículas ligeramente más grandes y con menor interacción metal-soporte. Una mayor dispersión del W en la alúmina causaría que se tengan especies de tungsteno con coordinación tetraédrica, las cuales son más difíciles de reducir que las especies en coordinación octaédrica. En este caso, tienen mayor interacción con el soporte, como se ha comprobado con la técnica de TPR, la cual muestra más altas temperaturas de reducción respecto a los catalizadores soportados en el óxido mixto, que tienen preferencia a formar especies octaédricas [7, 18].
3.2 Actividad de los catalizadores en ODS
A partir de los resultados de producción de sulfona en función del tiempo y dado el exceso estequiométrico de peróxido de hidrógeno, se obtuvieron los coeficientes cinéticos de las reacciones de ODS considerando una cinética de pseudo primer orden [1-3], éstos resultados que representan la actividad catalítica se muestran en las Tablas 1 y 2. Las pruebas de actividad en reactores por lotes muestran que al aumentar la carga de WO3, en los catalizadores en su forma oxidada soportados en Al2O3, aumenta el valor de los coeficientes cinéticos y por lo tanto la producción de sulfonas provenientes de la oxidación de los DBTs (Tabla 1). La tendencia se conserva al evaluar estos catalizadores después de haber sido parcialmente reducidos, pero obteniéndose una mayor actividad en comparación de los catalizadores oxidados soportados en alúmina. Este aumento en la actividad puede ser atribuido a la presencia de W0.
Tabla 1 Actividad de los catalizadores soportados en Al2O3, como coeficientes cinéticos de pseudo primer orden (min-1) para la ODS.

Tabla 2 Actividad de los catalizadores soportados en Al2O3-TiO2, como coeficientes cinéticos de pseudo primer orden (min-1) para la ODS.
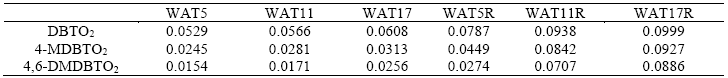
Los resultados obtenidos con los catalizadores soportados en Al2O3-TiO2 (Tabla 2), indican que el aumento de la cantidad de W también provoca un aumento en la actividad catalítica. De igual manera, estos catalizadores después del tratamiento por TPR dan una mayor producción de sulfonas, logrando el 100 % para todos los compuestos azufrados a los 90 min, con un aumento en la rapidez de reacción al aumentar la cantidad de fase activa. WAT17R muestra a partir de los 30 minutos una conversión casi total de los DBTs a sus respectivas sulfonas. Con WAT5R y WAT11R la conversión total se obtiene hasta los 60 minutos de transcurrida la reacción.
Al comparar el desempeño de los catalizadores oxidados soportados en alúmina respecto al soporte mixto de AT con las mismas densidades superficiales (0.5, 1.0 y 1.6 átomos de W/nm2), se tiene que con el soporte mixto se obtienen mayores actividades catalíticas. Esto puede deberse a: (1) la presencia de TiO2, (2) la cristalinidad del WO3 y (3) las diferentes especies de W presentes en el catalizador.
(1) La titania ha sido estudiada como catalizador en la reacción de ODS [6], mostrando ser activa en la formación de sulfonas, por lo que su presencia en el soporte mixto puede promover la actividad catalítica. (2) Los resultados obtenidos por DRX confirman la presencia de cristalitos de WO3 en los catalizadores soportados en AT y en pequeña cantidad para los catalizadores parcialmente reducidos soportados en alúmina, mientras que cuando se ocupa únicamente alúmina como soporte no se observa la presencia de cristalitos de WO3, lo que puede ser atribuido a que el trióxido de tungsteno no se encuentre en forma cristalina o a la presencia de pequeños cristalitos no detectables para el equipo de DRX. (3) Los catalizadores contienen diferentes especies que pueden ser activas para la ODS: WO3, WO2, W0 y en su caso la presencia de titania. En particular, la actividad catalítica observada para la ODS de los catalizadores soportados en el óxido mixto y que fueron parcialmente reducidos se puede atribuir a la presencia de WO2 y W0, y posiblemente a las especies de Ti4+ y Ti3+ del soporte. Por lo que el análisis catalítico de este sistema es complejo por sus diferentes contribuciones y es necesario ahondar a detalle sobre la contribución de cada uno de estos factores, lo que se realizará en futuros estudios sobre este proyecto.
3.3 Estabilidad del catalizador
Con la intención de evaluar la estabilidad catalítica, la reacción de ODS se llevó a cabo en un reactor de flujo continuo ocupando los catalizadores que presentaron la mayor actividad catalítica en el reactor por lotes, obteniéndose con éstos una conversión total invariable en 25 horas de operación. Por lo que en la Figura 6 se presentan sólo los resultados del catalizador WA12, que en las pruebas por lotes presentó una actividad intermedia, para poder observar mejor la estabilidad catalítica. Los resultados muestran una ligera desactivación del catalizador, teniendo un promedio de producción del 82.6 % hasta las 14 h de reacción y después el valor disminuye un poco y aparentemente se mantiene constante en 78.4% hasta las 25 horas de operación. A las 8 y 15 horas de operación se realizó un paro por la noche y al día siguiente se continuo operando en régimen permanente.
Bajo estas condiciones no es posible convertir todo el DBT presente, contrario a lo que ocurre en el reactor por lotes donde se logra una producción del 100 % de DBTO2 a la misma temperatura. Esto es debido a las diferentes condiciones de operación en ambos sistemas, en este caso el espacio velocidad es de 23.6 h-1 y constantemente se desplazan los productos de la reacción, evitando la presencia de agua como posible inhibidor de la reacción [19]. Por lo que en este periodo corto de evaluación, los catalizadores muestran alta actividad catalítica y estabilidad a las condiciones de operación.
4. Conclusiones
Se prepararon catalizadores a base de óxido de tungsteno con contenidos de 4 a 17 % en masa y los resultados muestran que al aumentar la carga de tungsteno se incrementa apreciablemente la actividad hacia la oxidación de dibenzotiofenos, obteniéndose altas producciones de sulfonas. Los catalizadores soportados en Al2O3-TiO2 mostraron mayor actividad que los soportados en Al2O3, lo cual puede ser atribuido a la presencia de especies de Ti, que son también activas en ODS. Con los catalizadores parcialmente reducidos se obtiene una mayor producción de sulfonas, mostrando que las especies de W4+ y W0 son más activas en la ODS que el WO3.











 nueva página del texto (beta)
nueva página del texto (beta)







