1. Introducción
En la actualidad existen diversos residuos peligrosos que dañan la calidad de vida de los ecosistemas, como son los clorofenoles. Estos se encuentran en al menos 166 de los 1,467 sitios de la Lista de Prioridades Nacionales identificados por la Agencia de Protección Ambiental (EPA). La exposición a altos niveles de clorofenoles puede causar daño al hígado, al sistema inmunitario, reproductor y nervioso. Dentro del grupo de los clorofenoles se encuentra el 2,4,6-triclorofenol, el cual está clasificado por la EPA dentro del grupo B2 como posible carcinógeno. Los clorofenoles se introducen en el medio ambiente por efluentes industriales que contaminan los cuerpos acuosos. Los clorofenoles derivan del uso incontrolado de pesticidas, fungicidas, herbicidas, así como de procesos de desengrasado de metales, procesado de maderas, blanqueo de papel con cloro, e incluso pueden generarse en la potabilización del agua como resultado de la cloración de los fenoles, formando subproductos de la reacción del hipoclorito con ácidos fenólicos, siendo el 2-clorofenol, el 2,4-diclorofenol y el 2,4,6-triclorofenol los que aparecen con mayor frecuencia en el agua de consumo humano 1-2. Dentro de las diferentes metodologías para la eliminación de estos compuestos se encuentran la adsorción con carbón activado, la cual presenta la desventaja de requerir un pos-tratamiento para eliminar los compuestos tóxicos del material adsorbente. Otro proceso ampliamente usado es el tratamiento biológico aeróbico o anaeróbico empleando organismos específicos capaces de eliminar o bioacumular estos compuestos, sin embargo, estos procesos tienen la desventaja de requerir largos tiempos de residencia y una baja biodegradabilidad. Otra alternativa de tratamiento es la degradación mediante oxidación química empleando sustancias como H2O2, MnO4 - y O3, las cuales han demostrado tener gran eficacia a pesar de tener la desventaja de ser moléculas inestables, y su alto costo de producción y operación 3, 4, 5.
En las últimas décadas los procesos de oxidación avanzada han demostrado ser eficientes en la degradación de compuestos recalcitrantes, siendo la degradación fotocatalítica de los métodos más prometedores al permitir alcanzar la mineralización completa, empleando catalizadores sólidos semiconductores, generalmente del tipo óxidos simples o mixtos 6-7.
Dentro de los compuestos empleados como precursores de óxidos, las hidrotalcitas han mostrado ser una opción para obtener materiales fotocatalíticamente activos. Las hidrotalcitas son compuestos arcillosos cuya estructura consiste en láminas de fórmula estructural [(MII)1-x(MIII)x(OH)2]x+ [Ax/n n-]mH2O, donde MII y MIII son los cationes metálicos de las láminas y A- son los aniones interlaminares. Existen diferentes métodos para su preparación, siendo el proceso sol-gel uno de los métodos más efectivos, al mejorar las propiedades fisicoquímicas de los sólidos 8. En este trabajo se muestran los resultados obtenidos al emplear hidrotalcitas (sintetizadas por el método sol-gel con diferente relación Mg/Al) calcinadas a 500°C como catalizadores en la degradación fotocatalítica del 2,4,6-triclorofenol en fase acuosa empleando radiación ultravioleta como fuente de luz.
2. Materiales y métodos
Las hidrotalcitas con diferente relación molar Mg/Al se obtuvieron por el método sol-gel disolviendo en etanol (con una pequeña cantidad de ácido clorhídrico) las cantidades estequiométricas de etóxido de magnesio (como fuente de magnesio) y acetilacetonato de aluminio (como fuente de aluminio). Las soluciones se pusieron a reflujo a 70°C con agitación constante hasta la formación de los geles. Los geles se lavaron, secaron y calcinaron a 500°C. Los materiales obtenidos se identificaron como HT-A, HT-B y HT-C correspondientes a la relación Mg/Al= 1, 4 y 7 respectivamente. Las hidrotalcitas secas y calcinadas se caracterizaron fisicoquímicamente. Los análisis térmicos se llevaron a cabo en un Termoanalizador TA instruments a una velocidad de calentamiento de 10°C/min en atmósfera de aire a una velocidad de 100 mL/min y utilizando α-alúmina como estándar de referencia. Los difractogramas fueron obtenidos en un difractómetro de polvos INEL Equinox acoplado a un ánodo de cobre y usando una radiación monocromática de CuKα, cuya longitud de onda (λ) es de 1.5418 Ả. Las isotermas de adsorción-desorción de nitrógeno se determinaron en un equipo automatizado Micromeritics ASAP 2010 con un pretratamiento a 150°C y vacío hasta 0.5 mmHg, empleando la teoría BET para determinar el área específica. La energía de banda prohibida (Eg) de las muestras se calculó a partir de los espectros de absorción de ultravioleta de reflectancia difusa a partir de la ecuación Eg= (1239b/- α), donde α y b son coeficientes que fueron linealizados en la región apropiada del espectro 9.
La fotodegradación se llevó a cabo en un reactor tipo Batch a temperatura ambiente con agitación magnética continua, flujo de aire de 2 ml/s y 200 mg de catalizador. Una solución (200 ml) que contenía 100 ppm de del 2,4,6-triclorofenol (Aldrich) se irradió con una lámpara UV-lamp-Pen-Ray (UVP) radiación de 254 nm y emisión de 2.5 mW/cm2, colocada en un tubo de cuarzo, sumergido en la solución. La temperatura se estabilizó a 25°C con recirculación de agua conectado a la camisa exterior del reactor. El procedimiento general de la reacción fue el siguiente: la solución de 2,4,6-triclorofenol con catalizador se agitó en la oscuridad (luz UV-off) durante 1 h, y se tomó una muestra para verificar la adsorción de la molécula, posteriormente se irradió con la luz UV y el progreso de la reacción se siguió hasta la desaparición del 2,4,6-triclorofenol en función del tiempo usando un espectrofotómetro de UV-vis Cary 100 siguiendo la longitud de onda característica para el 2,4,6-triclorofenol (λ= 310.5 nm). Para corroborar la degradación de la molécula también se utilizó un Analizador Shimadzu 5000 TOC.
3. Resultados y discusión
Los perfiles de descomposición térmica de las hidrotalcitas HT-A, HT-B y HT-C se muestran en la Figura 1. Como se puede observar, las tres hidrotalcitas sintetizadas presentan un perfil muy similar, mostrando picos asociados a reacciones endotérmicas. La primera de ellas con una pérdida aproximada del 15% la cual muestra un pico ancho e intenso centrado a 100 ºC en la curva del DTA atribuido a la desorción de agua y del solvente sorbidos en el material. Un hombro a 250°C corresponde a la eliminación del agua interlaminar fuertemente ocluida en los sólidos, la cual corresponde al 5% del peso. La segunda reacción endotérmica del DTA, que muestra en el TGA una pérdida del 30% centrada entre 350 y 400°C, es atribuida a la descomposición de los grupos hidroxilos enlazados y a la eliminación de los iones carbonato interlaminares.

Figura 1. Análisis térmico diferencial (DTA) y análisis termogravimétrico (TGA) de las hidrotalcita Mg/Al sintetizadas por el método sol-gel.
Los sólidos son estables hasta 500ºC con una pérdida total de masa del 45-50 %, donde finalmente la estructura laminar colapsa para formar la espinela del óxido mixto Mg/Al y la periclasa. Una de las ventajas del método sol-gel es que permite obtener sólidos térmicamente más estables 8.
Las reacciones térmicas de las hidrotalcitas se pueden representar de la siguiente manera:
Con el estudio del perfil de descomposición térmica de las hidrotalcitas sintetizadas se encontró la temperatura óptima de tratamiento térmico, la cual fue de 500°C para garantizar que el sólido se encuentra en la fase catalíticamente activa para el proceso de fotodegradación en la forma de óxidos metálicos.
Los patrones de difracción de rayos X de los precursores sintetizados por el método sol-gel se muestran en la Figura 2a. En estos se pueden observar las señales características de la fase cristalina hidrotalcita (003), (006), (009), (015), (018), (110) y (113) (tarjeta JCPDS 22 0700), además de trazas de la fase cristalina tipo brucita (tarjeta JCPDS 7-239) 10, 11. Como se puede observar en el patrón de difracción, los sólidos presentan una buena cristalinidad, sin embargo, es el sólido HT-A de relación Mg/Al=1 el que tiene una mayor cristalinidad, lo cual implica un mejor arreglo cristalino debido a la presencia de una mayor cantidad de aluminio dentro de la red. En la Figura 2b se muestran los patrones de difracción de los materiales tratados a 500°C. En estos se puede observar que las hidrotalcitas han evolucionado estructuralmente identificándose una fase cristalina del tipo periclasa MgO (JCPDS 4-0829), acompañada de una fase cristalina de α-alúmina (JCPDS 46-1212) y una fase dispersa amorfa de espinela MgAl2O4. El este caso el sólido que presenta una mayor cristalinidad es el HT-C a 500°C debido a que evoluciona al óxido de magnesio aproximadamente a 460°C, de acuerdo con su perfil de descomposición térmica, lo cual le permite tener una mejor cristalinidad a 500°C; el sólido Mg/Al=1 muestra una mayor pureza cristalina de la fase óxido de magnesio, y una mejor dispersión de la fase de espinela. En la Figura 2c se observa los patrones de difracción de las hidrotalcitas reconstruidas por efecto memoria al haberse restructurado prácticamente al 100% en comparación con los patrones de las hidrotalcitas originales.
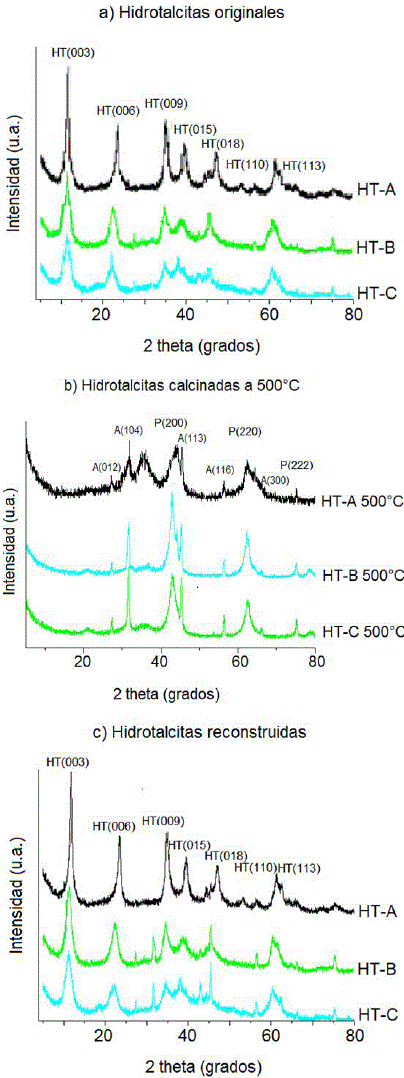
Figura 2. Difractogramas: a) Hidrotalcitas Mg/Al obtenidas por el método sol-gel, b) Hidrotalcitas calcinadas a 500°C, c) Hidrotalcitas reconstruidas por efecto memoria después del proceso de fotodegradación.
Las isotermas de adsorción-desorción de N2 de las hidrotalcitas sintetizadas por el método sol-gel, así como de las hidrotalcitas calcinadas a 500°C se muestran en la Figura 3a y 3b respectivamente. En esta figura se puede observar que en todos los casos las isotermas son del tipo IV de acuerdo a la clasificación de la IUPAQ, con ciclos de histéresis tipo H2, asociados a condensación capilar producida en los mesoporos de materiales en forma de láminas o placas, en donde los poros se caracterizan por tener un poro grande pero con una pequeña abertura. Cuando los sólidos se calcinan a 500°C la forma de la isoterma se modifican ligeramente haciéndose un poco más alargadas, lo cual está asociado con el hecho de que los poros se hacen más tubulares debido a la modificación de la estructura.

Figura 3. Isotermas de adsorción-desorción de N2: a) Hidrotalcitas Mg/Al y b) Hidrotalcitas calcinadas a 500°C.
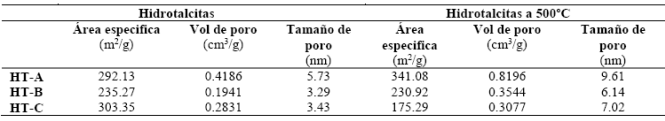
En la Tabla 1 se muestran los valores de las áreas específicas de las hidrotalcita, así como de los catalizadores obtenidos al calcinar las hidrotalcitas a 500°C, determinadas por el método de BET y el tamaño promedio calculado por el método BJH. Como se puede observar la porosidad se modifica debido a la descomposición térmica de los materiales. Para las hidrotalcitas se obtuvieron altos valores de áreas específicas alrededor de los 303 m2/g, atribuidas al método de síntesis el cual favorece la formación de una mayor cantidad de mesoporos. En el caso del catalizador HT-A a 500°C el valor del área específica aumenta ligeramente, lo cual esta atribuido a la disminución de la cristalinidad de la periclasa y al aumento de la estructura amorfa de la espinela. En la hidrotalcita HT-B a 500°C su área específica sufre un pequeño decremento asociado a una evolución térmica más rápida que la del catalizador HT-A. Para la hidrotalcita HT-C a 500°C el valor del área específica sufrió una disminución muy significativa asociado a un mayor colapso de la estructura laminar del precursor.
Los resultados de la fotodegradación catalítica están relacionados directamente con la proporción molar de Mg/Al ya que al aumentar , se observa una disminución en el área específica (que va de 341 a 175 m2/g), así como un cambio en el valor de Eg, debido a que las hidrotalcitas calcinadas a 500°C presentan valor de Eg que van de 3.38 a 4.85, siendo el material HT-A el que presenta el valor más cercano al valor del TiO2, que va de 3.0 a 3.2 12. Por otro lado en la Figura 4 se muestran los espectros de UV-vis durante la reacción fotocatalítica para la degradación del 2,4,6-triclorofenol. El sistema de reacción se siguió durante 180 minutos para cada uno de los catalizadores, sin mostrar variaciones en los espectros de adsorción de la molécula durante la primera hora de adsorción (ausencia de luz), lo cual nos indica que la molécula no fue adsorbida por el catalizador.

Figura 4. Espectros Uv-vis de la degradación fotocatalítica del 2,4,6-triclorefenol por los catalizadores óxidos mixtos a 500 °C.

Figura 5. a) Velocidad de degradación relativa de 100 ppm de triclorofenol, b) Concentración relativa de Carbono Orgánico total (COT) contra el tiempo.
En los espectros se observa la caída de absorción en la longitud de onda a λ= 310.5 nm a partir del encendido de la fuente de irradiación, la cual es característica para la molécula del 2,4,6-troclorofenol, esto nos indica la degradación del contaminante correspondiente, incluyendo la parte aromática. Además tal y como se puede observar los catalizadores HT-A 500°C y HT-B 500°C muestran una mayor eficacia en la reacción, ya que degradaron la mayor parte del contaminante a lo largo de los 180 minutos. El catalizador HT-A 500°C es el más activo, ya que la degradación se lleva acabo de una manera más rápida durante los primeros 90 minutos, a comparación del catalizador HT-C a 500°C, pues la degradación se llevó a cabo de una manera más lenta y gradual. En la gráfica 5a se muestra el comportamiento de la velocidad de degradación del 2,4,6-triclorofenol correspondiente a la cantidad de moléculas degradadas en función del tiempo, en donde se puede ver que la capacidad de degradación es mayor para el caso del catalizador HT-A alcanzando valores del 90 %, disminuyendo esta capacidad para los sólidos HT-B y HT-C en función de la relación Mg/Al. La capacidad de degradación se corroboró mediante el análisis del COT, que se muestra en la en la gráfica 5b, en donde se puede observar que la mineralización se realiza de manera significativa durante los primeros 90 minutos.
El catalizador que mostró una mayor eficacia en la degradación fotocatalítica es el HT-A 500°C de relación Mg/Al = 1, ya que alcanzó una degradación del 94.18 % de las 100 ppm del 2,4,6-triclorofenol, lo cual se atribuye a que este material es el que presenta una mayor área específica y por lo tanto el catalizador está más en contacto con la molécula, lo cual le permite una mayor eficiencia en la reacción. A demás se atribuye a que al calcinar la hidrotalcita y exponerla al contacto con el agua, esta interactúa con el catalizador provocando la hidroxilación de los catalizadores, pues la síntesis de materiales que contienen cationes Mg2+ y Al3+, dan lugar a la obtención de materiales con propiedades semiconductoras, por lo que la irradiación de luz UV da paso a la generación de pares electrón-hueco, con el electrón deslocalizado hacia la carga electrodeficiente del Al3+, generando un hueco, el cual interactuará con el agua para dar paso a la generación de radicales OH• que serán los principales agentes degradantes en la reacción 13,14, por lo tanto es de esperarse que el óxido mixto con la mayor cantidad de Al sea el más activo, por lo que los óxidos mixtos HT-A, HT-B y HT-C presentan una tendencia de mayor a menor, lo cual está vinculado directamente con el aumento en la relación de Mg/Al presente en la estructura del catalizador.
En la Figura 6 se muestra el comportamiento cinético de la reacción, la cual se ajusta a una reacción de pseudo-primer orden ln (Co/C)= Kt, estos datos fueron ajustados por mínimos cuadrados, en donde la pendiente es la constante de velocidad (K), con coeficiente de correlación 0.99, alcanzando una fracción molar de mineralización hasta de 0.875 para el catalizador HT-A 500 °C.
En la Tabla 2 se presentan los datos obtenidos para el cálculo de la cinética de degradación como son el tiempo de vida media, constantes de velocidad y porcentaje de eliminación del 2,4,6-triclorofenol. En ésta se puede observar que el fotocatalizador HT-A 500°C es el más activo, ya que presenta el menor tiempo de vida media 37.27 min y un porcentaje de eliminación del 94.18 %.
4. Conclusiones
Los materiales sintetizados por el método sol-gel presentan estructura cristalina tipo hidrotalcita combinada con una pequeña fase remanente de brucita, los cuales al calcinarse a 500°C evolucionan a una fase cristalina de periclasa y una fase amorfa de espinela, con clasificación de isotermas de fisisorción de N2 Tipo IV asociadas con materiales mesoporosos, con áreas específicas entre 341.1 y 175.3 m2/g. Las hidrotalcitas calcinadas a 500°C presentan valores de Eg que van de 3.38 a 4.85, los cuales son valores cercanos al TiO2. Las hidrotalcitas calcinadas a 500°C muestran una buena actividad fotocatalítica presentando eficiencias de degradación del 2,4,6-triclorofenol con un orden decreciente de 94.18% HT-A 500°C > 86.15% > HT-B 500°C > 63.89% HT-C 500°C en menos de 2 horas; con lo cual se concluye que el catalizador más activo es el HT-A el cual presenta una relación Mg/Al = 1, debido a que presenta una mayor área específica y contiene una mayor cantidad de aluminio segregado en la estructura amorfa de la espinela, lo cual está relacionado con la generación de radicales hidroxilo, responsables de la fotodegradación.











 nova página do texto(beta)
nova página do texto(beta)