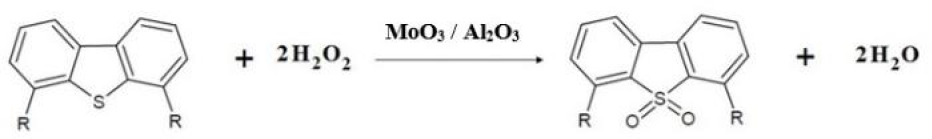1. Introducción
La normatividad actual en materia de calidad ambiental es cada vez más estricta alrededor del mundo. En México la NOM-086-SEMARNAT-SENER-SCFI-2005 establece las especificaciones de los combustibles fósiles para la protección ambiental, dicha norma limita el contenido máximo de azufre en diesel a 15 ppm. Normas similares en la Unión Europea (EURO VI) y en Estados Unidos (EPA- 2014), establecen un contenido máximo de azufre en diesel a menos de 10 ppm [1-2].
El proceso de hidrodesulfuración drodesulfuración (HDS) es comúnmente utilizado para remover el azufre de los combustibles fósiles, sin embargo, la obtención de combustibles de ultra bajo contenido de azufre (< 10 ppm) requerirá de importantes reconFiguraciones en las unidades de hidrotratamiento como pueden ser: el diseño de reactores que trabajen con un menor LSHV o mayor volumen de catalizador, realizar la HDS en un proceso multi etapas, evitar el envenenamiento del catalizador debido a la alta producción de H2S [3-6] o bien el uso de catalizadores avanzados para la HDS a base de soportes mixtos, catalizadores trimetálicos preparados de manera no convencional [7-8], entre otros. Diversas tecnologías orientadas a la remoción de los compuestos refractarios de azufre han sido investigadas en recientes años, por ejemplo, biodesulfuración, destilación reactiva, adsorción selectiva, extracción con líquidos iónicos y desulfuración oxidativa. El proceso de desulfuración oxidativa (ODS) ha disminuido el contenido de azufre de fracciones previamente hidrotratadas a cantidades menores de 10 ppm, por lo tanto este proceso es considerado complementario al proceso de HDS. El proceso de ODS consiste en la oxidación de los compuestos de azufre a sus respectivas sulfonas (en presencia de un agente oxidante y un catalizador) y posteriormente o simultáneamente su remoción, la cual se lleva a cabo por medio de diversas alternativas como pueden ser, adsorción, destilación, extracción física, etc. Se han reportado procesos homogéneos y heterogéneos de ODS, siendo los procesos heterogéneos los que adquieren mayor relevancia debido a la ventaja de operar con catalizadores sólidos [9-11]. Los cuales generalmente tienen como fase activa Mo(VI), Ti(IV), V(V) o W(VI), utilizando soportes como Al2O3, TiO2, MgO o SiO2 [12], en presencia de diferentes agentes oxidantes como H2O2 o TBHP.
Algunos estudios de catalizadores de MoO3 soportados utilizando diferentes agentes oxidantes, han mostrado buenos resultados cuando se utiliza Al2O3 como soporte y H2O2 o TBHP como oxidante [13-18]. Sin embargo, pocos trabajos han discutido el desempeño catalítico de catalizadores de MoO3 soportados, cuando son utilizadas diferentes condiciones de preparación.
En este sentido, en el presente trabajo, se prepararon catalizadores de MoO3 soportados, modificando algunas condiciones del método de preparación como son: el pH de la solución de impregnación, la temperatura de calcinación, la atmósfera durante la calcinación, el tipo de soporte y el contenido de Mo, con el propósito de incrementar la interacción entre las especies de Mo y el soporte, para favorecer la actividad catalítica. Todos los catalizadores preparados fueron evaluados en el proceso de ODS de un diesel modelo utilizando H2O2 como oxidante y se caracterizaron por medio de reducción a temperatura programada (TPR), microscopía electrónica de barrido acoplada con análisis de energía dispersiva de rayos X (SEM-EDX) y difracción de rayos X (DRX).
2. Experimental
Todas las sustancias utilizadas fueron productos comerciales (Sigma-Aldrich) sin algún tratamiento posterior. Los compuestos modelo de azufre utilizados (DBTs) fueron: dibenzotiofeno (DBT, 98 %), 4- metildibenzotiofeno (4-MDBT, 96 %) y 4,6- dimetildibenzotiofeno (4,6-DMDBT, 97 %). Peróxido de hidrógeno (H2O2, 30%) fue utilizado como agente oxidante. Mezcla modelo. Acetonitrilo (MeCN, 99.9%) fue utilizado como disolvente de los DBTs para obtener una mezcla con un contenido total de azufre de 609 ppm: 217 de DBT, 206 de 4-MDBT y 186 de 4,6-DMDBT.
2.1. Preparación de catalizadores y caracterización
Los catalizadores se prepararon por impregnación de soluciones acuosas de heptamolibdato de amonio (HMA) con contenidos elementales de 7 y 20 % de Mo (masa/masa) sobre γ- Al2O3 (Sasol de 207 m2/g) y boehmita (AlOOH) correspondientes a 0.5 y 1.5 monocapas teóricas de Mo. Se utilizó ácido oxálico (98 %) para acidificar las soluciones de impregnación a pH = 1, 2 y 5, con la finalidad de aumentar la interacción entre el soporte y la fase activa [19-20]; debido a la modificación del equilibrio de las especies octaédricas (Mooct) y tetraédricas (Moth) de Mo a diferentes valores de pH [21-23]. El soporte seleccionado se impregnó por el método de volumen de poros (vp) o por el método de exceso de volumen (ev), las muestras obtenidas fueron sometidas a tres horas de maduración y posteriormente a doce horas de secado a 100 °C. Los catalizadores se calcinaron en atmósfera estática de aire por cuatro horas a 400 °C (M4), 500 °C (M5), 600 °C (M6) o en atmósfera con flujo de O2 (O5) o N2 (N5) a 500°C por cuatro horas, con una velocidad de calentamiento de 3 ó 10 °C/min para ambos procesos de calcinación, con la finalidad de determinar si la formación de diferentes especies de Mo influye en la actividad catalítica de la ODS al modificar la temperatura y atmósfera de calcinación [23-24]. A menos que se especifique otro contenido de MoO3 los catalizadores se etiquetaron como Mo-SMAC con contenido de MoO3 del 7%, donde S = soporte (A = Al2O3 y B = boehmita), M = método de impregnación (vp o ev), A = valor de pH de la solución de impregnación (1, 2 o 5) y C = condiciones de calcinación (M4, M5, M6, O5 o N5), como se menciona anteriormente. Por ejemplo Mo-Aev2M5, corresponde al catalizador de Mo soportado en Al2O3, impregnado por exceso de volumen con una solución de impregnación a pH = 2 y calcinado en mufla con atmósfera estática de aire a 500 °C.
2.2. Pruebas de actividad catalítica
Todas las pruebas de actividad se realizaron en un reactor intermitente, con 50 mL de la mezcla modelo (DBT, 4-MDBT y 4,6-DMDBT, disueltos en MeCN), 0.5 mL de H2O2 con una relación molar oxígeno/azufre de 6 (O/S = 6) y 0.1 g de catalizador. La mezcla reactiva se mantuvo en agitación vigorosa a 750 rpm para garantizar un régimen cinético, la operación del reactor se llevó a cabo a presión atmosférica y a una temperatura constante de 60 °C.
Para seguir el avance de reacción se tomaron pequeñas muestras a los tiempos 15, 30, 60 y 90 min y fueron analizadas en un cromatógrafo de gases (GC-FID) HP5890 series II provisto de un sistema de inyección automática (HP7673) y una columna PONA de 50 m, los productos de reacción fueron identificados a partir de su tiempo de retención y corroborados en un GC con detector PFPD (Varian CP-3800) y un espectrómetro de masas (CG-MS, HP G/1800B). Para evaluar la relación O/S en el medio de reacción se realizaron titulaciones y odométricas.
Los catalizadores se caracterizaron por microscopia electrónica de barrido (SEM) en un microscopio Jeol JSM- 5900 LV equipado con un sistema de análisis elemental de energía dispersiva de rayos X (EDX), con la finalidad de determinar la composición y distribución superficial de las especies de Mo por medio de un análisis estadístico en diferentes puntos del catalizador. Un equipo de reducción a temperatura programada (TPR) fue utilizado para estudiar la reducibilidad de las especies superficiales de Mo, por medio de la comparación de las temperaturas máximas de reducción (Tmax) de las especies de Mo (Mooct y Moth) y del grado de reducción total de los catalizadores por medio del estado de oxidación promedio (EOP), empleando un flujo de H2/Ar (30 % H2 v/v, 25 mL/min) a presión atmosférica y una velocidad de calentamiento de 10 °C por minuto, desde la temperatura ambiente hasta 900 °C.
Los patrones de difracción se obtuvieron en un difractómetro de polvos Siemens D500 con radiación Cu Kα, para determinar la presencia de estructuras cristalinas de óxidos de Mo.
3. Resultados y discusión
Primero se presentan los resultados correspondientes a las caracterizaciones fisicoquímicas de los catalizadores de Mo y posteriormente los resultados de actividad catalítica en la reacción de ODS.
3.1. Caracterización
Por medio de un análisis estadístico de los resultados de SEM-EDX se determinó la composición elemental de Mo en los catalizadores, los cuales mostraron que los contenidos nominales de Mo son similares a los contenidos teóricos (7 y 20 %). La Figura 1 muestra micrografías representativas de SEM-EDX de Mo-Aev2M5 y Mo-Bev2M5, donde se observa el mapeo elemental de Mo, O y Al. En ambos catalizadores, se aprecia una adecuada distribución del Mo sobre la superficie y no se observa la presencia de cúmulos o aglomerados de Mo, lo cual indica una apropiada preparación de los catalizadores. Las micrografías de los demás catalizadores mostraron también una adecuada distribución del Mo sobre la superficie del catalizador.
Los difractogramas de rayos X de los catalizadores de Mo (no mostrados) presentan los picos de difracción característicos de la γ-Al2O3 (JCPDS 10-0425) y sólo el catalizador con 20 % de Mo exhibe los picos de difracción correspondientes a MoO3 (23.5, 26, 27 °, JCPDS 5-508). Por lo tanto, y en concordancia con los resultados observados por SEM-EDX, se sugiere una adecuada distribución del Mo en la superficie del soporte para los catalizadores con baja carga (7%), de acuerdo con la literatura respecto a la nula o baja aglomeración a bajos contenidos de Mo [9, 12].
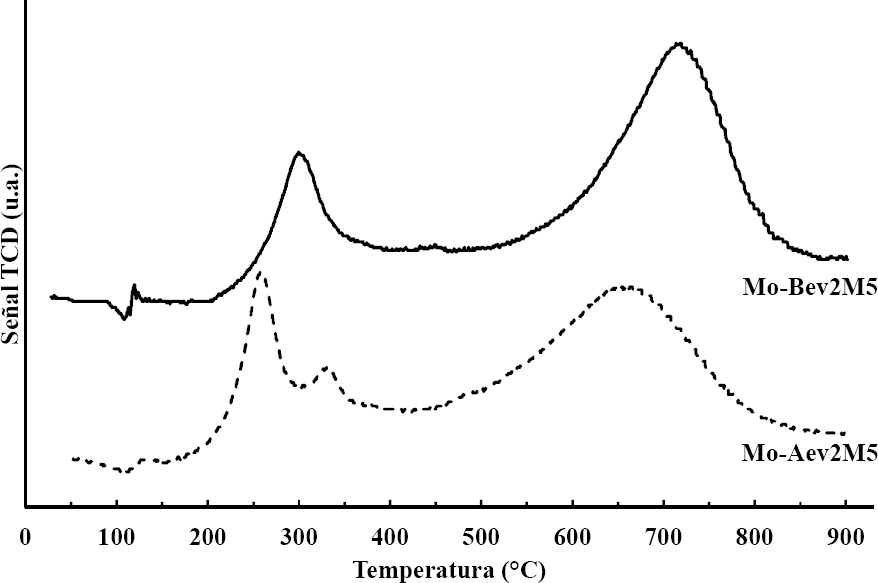
El análisis de los perfiles de TPR de los catalizadores ofrece información útil acerca de la interacción entre las especies soportadas y el soporte. De manera general se observa que los termogramas de los catalizadores (ver Figura 2) presentan dos zonas de reducción principales (una de baja temperatura y una de alta temperatura) y una zona de reducción intermedia. La zona de reducción de baja temperatura (Tmax < 310 °C) corresponde a la reducción de especies de Mo coordinado octaédricamente [Mooct 6+ a Mooct 4+] y que interactúan débilmente con el soporte, las cuales son generalmente especies poliméricas de Mo en multicapa y altamente dispersas [25-26]. La zona de reducción de alta temperatura (~500-850 °C) corresponde a la segunda reducción de las especies octaédricas de Mo [Mooct 4+ a Mooct 0] junto con la reducción de las especies de Mo coordinadas tetraédricamente [Moth 6+ a Moth 4+], las cuales se encuentran presumiblemente en monocapa [27]. Se observa también una zona de reducción intermedia (~300- 400 °C), la cual es atribuida a la reducción de Mo polimérico en forma de pequeños cristalitos. La cuantificación del área bajo la curva proporciona el consumo de H2 para cada etapa de reducción, por lo tanto, se puede cuantificar el grado de reducción del Mo en cada catalizador. Lo cual en conjunto con las temperaturas máximas de reducción (Tmax), permite llevar a cabo un análisis más detallado acerca de las especies superficiales de Mo.
En la Tabla 1 se presentan los resultados cuantitativos de los termogramas de TPR para los catalizadores, como son: la temperatura máxima de reducción (Tmax) para cada pico, la relación de especies de Moth a Mooct de acuerdo al área bajo la curva del termograma de cada especie y estado de oxidación promedio (EOP) del Mo. Los cuales serán discutidos con los termogramas correspondientes a continuación.
Tabla 1 Resultados cuantitativos obtenidos del TPR de los catalizadores.

(*) Estado de oxidación promedio del Mo después de TPR
En la Figura 2 se presentan los perfiles de TPR de los catalizadores preparados con diferentes soportes (Mo-Aev2M5 y Mo-Bev2M5). Al comparar éstos en la zona de reducción de baja temperatura, se observa un desplazamiento de la Tmax del catalizador preparado en boehmita (Mo-Bev2M5) hacia mayor temperatura (~ 44 °C) respecto a Mo-Aev2M5 (ver Tabla 1). El desplazamiento hacia mayor temperatura de reducción puede ser atribuido a la mayor interacción de las especies Mooct con el soporte, resultado de la formación simultánea de la Al2O3 (a partir del AlOOH) y de los óxidos de Mo, en la etapa de calcinación de los catalizadores. En la región de reducción de alta temperatura, se observa un desplazamiento de la Tmax hacia mayor temperatura para Mo-Bev2M5 respecto a Mo-Aev2M5 (~ 50 °C), debido a la menor reducibilidad de las especies Mooct 4+ para Mo-Bev2M5. El catalizador Mo-Aev2M5 muestra un pico en la zona intermedia de reducción, lo cual indica que este catalizador presenta especies poliméricas de Mo, sin embargo no forman cristales como lo indican los resultados de DRX. En la Tabla 1 se observa que el EOP es mayor para Mo-Bev2M5 respecto a Mo-Aev2M5 (3.5 > 3.0), lo cual indica que el grado de reducibilidad total del catalizador Mo-Bev2M5 es menor respecto a Mo-Aev2M5. Se observa además que la relación de especies Moth/Mooct es menor para Mo-Bev2M5 respecto al catalizador preparado en Al2O3, lo cual puede ser atribuido a una mayor cantidad de Mooct y/o a una menor cantidad de especies Moth dado que la superficie del soporte es diferente.
Los resultados de TPR de los catalizadores preparados a diferente pH (Mo-Aev1M5, Mo-Aev2M5 y Mo-Aev5M5) y con diferente método de impregnación (Mo-Avp1M5) se muestran en la Figura 3, donde los termogramas muestran las tres zonas de reducción descritas con anterioridad. El catalizador preparado a pH = 2 presenta claramente un desplazamiento de la Tmax hacia mayor temperatura en la zona de baja temperatura respecto a los demás catalizadores preparados a diferente valor de pH (ver Tabla 1). Lo cual muestra la mayor interacción de las especies de Mo con el soporte, debido a la modificación del equilibrio entre las especies de Moth y Mooct y a la disolución parcial de la Al2O3 a pHs bajos [22, 28-29]. La menor relación de especies Moth / Mooct en Mo-Aev1M5, podría indicar que las especies Mooct que se reducen a una menor temperatura son debidas a un mayor apilamiento de las mismas. El catalizador preparado a pH = 1 presenta mayor intensidad del pico correspondiente a las especies poliméricas de Mo (290 - 350°C), lo cual indica que la preparación a bajos pHs promueve la aparición de éstas. En la Tabla 1 se observa que el EOP menor es del catalizador preparado a pH 2 (Mo-Aev2M5), seguido por el catalizador preparado a pH 5 y después el preparado a pH 1, mostrando que el catalizador preparado a pH = 2 es el que presenta la mayor reducción total. Además, el catalizador preparado a pH = 2 presenta la mayor relación de especies Moth/Mooct respecto a los demás catalizadores preparados a diferente pH, lo cual indica la menor cantidad de especies Mooct en el catalizador preparado a pH = 2.

Figura 3 TPR de los catalizadores preparados a diferente pH: 1 (Mo- Aev1M5), 2 (Mo-Aev2M5) y 5 (Mo-Aev5M5) por el método de exceso de volumen y a pH = 1 por el método de impregnación de volumen de poros (Mo-Avp1M5).
El termograma inferior de la Figura 3 muestra el perfil de TPR del catalizador preparado por impregnación de volumen de poros (Mo-Avp1M5), donde se observa que las Tmax de sus tres picos son mayores respecto a su contraparte preparado por exceso de volumen (Mo-Aev1M5) y también, que la zona intermedia de reducción (320 - 370 °C) tiene una menor intensidad; lo cual indica que la interacción entre el soporte y la fase activa es mayor debido a que la formación de especies poliméricas de Mo no se favorece cuando el soporte se impregna por medio del método de impregnación de volumen de poros. Los resultados cuantitativos de la Tabla 1 indican que el catalizador preparado por el método de impregnación de volumen de poros (Mo-Avp1M5) es el que presenta una mayor relación de especies Moth / Mooct respecto al catalizador preparado por exceso de volumen (Mo-Aev1M5); además se obtiene también que el EOP es menor para Mo-Avp1M5 respecto a Mo-Aev1M5, indicando que el grado de reducción total es mayor en el catalizador preparado por la técnica de volumen de poros respecto al preparado por exceso de volumen.
La Figura 4 muestra los termogramas de los catalizadores calcinados a 500 °C en atmósfera continua de oxígeno a diferentes velocidades de calentamiento (3 y 10 °C/min), éstos presentan perfiles de TPR similares entre sí, pero se observa un ligero desplazamiento de las Tmax hacia mayor temperatura en las tres zonas de reducción para Mo-Aev1O5 (a 10 °C/min) respecto al catalizador calcinado con la velocidad de calentamiento de 3 °C/min; atribuible a la menor reducibilidad de las especies de Mo y por lo tanto la mayor interacción entre el soporte y la fase activa para el primer catalizador. Los resultados de la Tabla 1 indican que la relación de especies Moth / Mooct es mayor para el catalizador calcinado con la rampa de 10 °C respecto al catalizador calcinado con la rampa de 3 °C, también se observa que el EOP es menor para el catalizador calcinado a 10 °C respecto al catalizador calcinado a 3 °C, por lo que el tratamiento a menor velocidad de calentamiento permite un reacomodo diferente de las especies superficiales de Mo.

Figura 4 TPR de los catalizadores con 7% de Mo preparados a diferentes velocidades de calentamiento: 3 °C/min (Mo-AevO5-3°C/min) y 10 °C/min (Mo-AevO5-10°C/min) y del catalizador con 20 % de Mo.
El perfil de TPR del catalizador con 20 % de Mo (Mo(20)-Aev1O5-10 °C/min) muestra que la intensidad de la zona intermedia es muy alta y casi comparable con la intensidad del pico de reducción de las especies octaédricas, mostrando que la cantidad de especies poliméricas de Mo es mayor que en catalizadores con menor contenido de Mo, cuyo comportamiento es característico de catalizadores de Mo con contenidos mayores a la monocapa [19-20, 27].
En la Tabla 1 se observa que el EOP de Mo(20)-Aev1O5- 10°C/min es el mayor respecto a los catalizadores calcinados en atmósfera continua de oxígeno y de todos los demás catalizadores mostrados en la Tabla 1 y la relación de especies Moth/Mooct es la menor de los catalizadores calcinados con oxígeno, lo que concuerda con un catalizador que tiene un recubrimiento superior a una monocapa. Donde una vez recubierta la superficie, preferentemente por especies de Moth, el exceso de Mo es por especies de Mooct menos dispersas y más fáciles de reducir. Por lo que al analizar con cuidado los resultados de la Tabla 1, podemos observar que existe una correlación entre la relación de las especies Moth/Mooct y el EOP, lo cual se ilustra en la Figura 5.
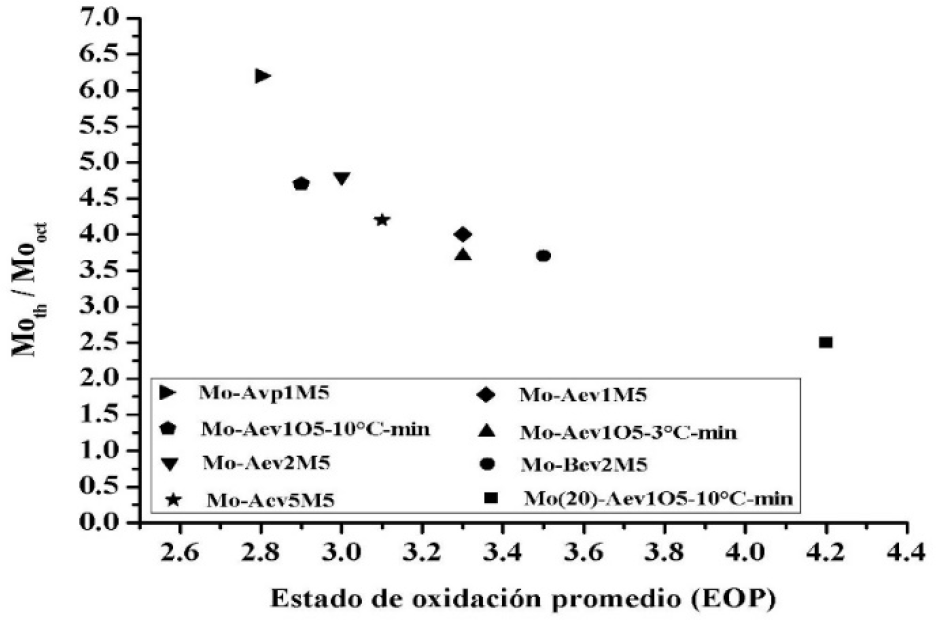
Figura 5 Correlación entre la relación de especies Moth/Mooct y el estado de oxidación promedio del Mo en los catalizadores de MoO3/Al2O3 después de TPR.
De manera general, al aumentar la relación Moth/Mooct, el estado de oxidación promedio del Mo disminuye. Esta tendencia será discutida posteriormente en relación a la actividad catalítica de la ODS de estos catalizadores.
3.2. Desulfuración oxidativa
En el presente trabajo se estudió la reacción de oxidación de compuestos de azufre (Esquema 1 ) presentes en una mezcla modelo, utilizando H2O2 como agente oxidante con catalizadores de óxidos de Mo soportados en alúmina, preparados a diferentes condiciones.
Se ha reportado que en los procesos heterogéneos de ODS la tendencia de la reactividad de las moléculas de azufre está relacionada con el impedimento estérico de cada molécula, es decir, el orden de reactividad observado para las moléculas modelo utilizadas es: DBT > 4-MDBT > 4,6-DMDBT [1-3, 9-10]. La actividad catalítica será discutida en términos de esta reactividad relativa y la producción a sulfona (DBTsO2). La producción a sulfona se define como la relación de sulfona producida respecto a la cantidad inicial del compuesto dibenzotiofénico.
Los resultados de actividad ODS de los catalizadores preparados con diferentes soportes (A o B) mostraron que la producción a sulfona de los DBTs es similar: 100 %, 90 % y 83 %, para DBTO2, 4-MDBTO2 y 4,6-DMDBTO2, respectivamente. En los perfiles TPR de la Fig. 2, se observa que el catalizador Mo-Bev2M5 no presenta especies poliméricas de Mo y que existe un desplazamiento de las Tmax hacia mayores temperaturas respecto al catalizador Mo-Aev2M5. En la Tabla 1 se observa que los valores de la relación Moth/Mooct son diferentes para ambos catalizadores (4.8 y 3.7 para Mo-Aev2M5 y Mo-Bev2M5, respectivamente) y así también lo son los EOP (3.0 y 3.5, respectivamente). Sin embargo la actividad catalítica es similar para ambos catalizadores, lo cual debe indicar que no hay una diferencia apreciable al impregnar sobre Al2O3 o boehmita, aunque los resultados de TPR muestran diferencias en la interacción entre las especies de Mo y el soporte, lo que más bien debe representar diferencias en la estabilidad del catalizador a largos tiempos de operación, por lixiviación de las especies débilmente ancladas al soporte [19].
En la Figura 6 se presentan los resultados de la producción de DBT sulfona con catalizadores preparados con soluciones impregnantes a diferente pH. Se observa que en 90 min se obtiene el 100 % de producción para DBT sulfona con el catalizador preparado a pH 2 (Mo-Aev2M5) y el 95 % con el catalizador preparado a pH = 1 (Mo-Aev1M5,), mientras que para el catalizador preparado a un pH de 5 (Mo- Aev5M5) la actividad catalítica es alrededor del 88 %. De acuerdo con los resultados de la Fig. 3 el catalizador preparado con la solución impregnante a pH = 2, presentó mayores Tmax que el catalizador preparado con la solución de impregnación de pH = 5. Los resultados de la Tabla 1 muestran que la relación de especies Moth / Mooct es mayor en el catalizador preparado a pH = 2 y se observa también que el EOP de Mo-Aev2M5 es el menor respecto a los catalizadores preparados a pH = 1 y pH = 5, es decir que este presenta la mayor reducibilidad total de las especies de Mo. Por lo que se puede proponer que el aumento de la interacción entre el soporte y la fase activa favorece la actividad catalítica ODS, debido a la formación de especies más estables a la lixiviación y a especies de Mo fácilmente reducibles, las cuales deben ser generadas al utilizar disoluciones ácidas de Mo [29-30].

Figura 6 Producción de DBTO2 con catalizadores preparados a diferentes pH: 1 (Mo-Aev1M5), 2 (Mo-Aev2M5) y 5 (Mo-Aev5M5).
En la Tabla 2 se presentan los resultados cinéticos para estos catalizadores, junto con los demás catalizadores, como constantes de pseudo primer orden para la reacción de ODS, considerando un exceso estequiométrico del H2O2 (O/S=6). Acorde a los perfiles de la Fig. 6 y la discusión anterior el orden de actividad de los catalizadores preparados a diferentes pH es: pH2 > pH1 > pH5.
Tabla 2 Constantes cinéticas de pseudo primer orden para la ODS de DBT y 4-MDBT para los catalizadores de MoO3 / Al2O3.
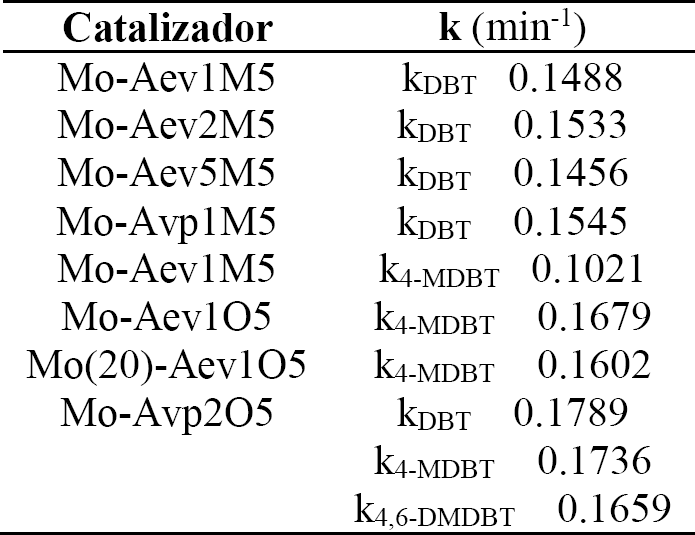
Al comparar los valores de las constantes cinéticas de pseudo primer orden de la Tabla 2 para los catalizadores preparados a diferentes valores de pH, observamos que el mayor valor corresponde para el catalizador preparado a pH = 2 (Mo-Aev2M5) siguiendo el catalizador preparado a pH = 1 (Mo-Aev1M5) y luego el preparado a pH = 5 (Mo- Aev5M5). Los resultados anteriores muestran que el catalizador con la mayor relación de especies Moth/Mooct (Mo-Aev2M5) es el que presenta la mayor actividad catalítica, además de que éste es el que presenta el menor valor del EOP y por lo tanto, la mayor reducibilidad de especies de Mo.
En la Fig. 7 se presenta la producción de DBT sulfona para los catalizadores preparados por diferente método de impregnación: volumen de poros (Mo-Avp1M5) y exceso de volumen (Mo-Aev1M5). Para Mo-Avp1M5 se obtiene el 100 % de producción a sulfona de DBT a los 90 min y para Mo-Aev1M5 se alcanza el 95 % de DBTO2 con una kvp-DBT = 0.1545 y kev-DBT = 0.1488 (ver Tabla 2). Los resultados de caracterización por TPR (Fig. 3) muestran que el catalizador preparado por exceso de volumen (Mo-Aev1M5) presenta menores Tmax para las especies octaédricas y poliméricas de Mo respecto al catalizador preparado por volumen de poros (Mo-Avp1M5), y que este último presenta la mayor relación de especies Moth/Mooct, por lo tanto el EOP de Mo-Avp1M5 es menor respecto a Mo-Aev1M5 (2.8 < 3.3). Lo anterior indica que el catalizador con el mayor grado de reducción total (menor EOP) presenta la mayor relación de especies Moth/Mooct y también la mayor actividad catalítica.
Los resultados de producción a sulfona para catalizadores calcinados en mufla en atmósfera constante de aire a diferentes temperaturas (M4, M5 y M6) indicaron que la actividad catalítica se favorece cuando se calcina el catalizador a 500 °C (M5), observando una disminución de la actividad catalítica en ~ 5 % cuando se calcinaron los catalizadores a 400 °C y 600 °C (M4 y M6), lo cual sugiere que la calcinación de los catalizadores a 500 °C promueve estructuras activas de Mo para la reacción ODS y a diferentes temperaturas de calcinación se ve afectada la formación de dichas estructuras [28].

Figura 7 Producción de DBTO2 de los catalizadores preparados por el método de volumen de poro (Mo-Avp1M5) y por exceso de volumen (Mo-Aev1M5).
La Figura 8 muestra la producción a 4-MDBT sulfona de los catalizadores calcinados en diferentes atmósferas, Mo-Aev1M5 y Mo-Aev1O5, donde se obtiene una considerable mayor producción a sulfona con el catalizador calcinado en atmósfera continua de oxígeno con kO5-4MDBT = 0.1679 y kM5-4MDBT = 0.1021 (ver Tabla 2). En la Figura 4 se muestra el perfil de TPR del catalizador calcinado en atmósfera continua de oxígeno a una velocidad de calentamiento de 10°C/min y se observa que presenta un perfil similar al del catalizador calcinado en atmósfera estática de aire (Fig. 3). Los resultados de la Tabla 1 muestran que el EOP del catalizador con la rampa de calentamiento de 10 °C es menor respecto al EOP del catalizador calcinado con la rampa de 3°C, debido a la mayor relación de especies Moth/Mooct en el primer catalizador. Lo cual sugiere, en conjunto con los resultados de actividad catalítica, que posiblemente la presencia de oxígeno promueve la aparición de estructuras distorsionadas de Mo6+ [28]; las cuales pueden presentar menor cantidad de enlaces terminales Mo-O debido a que se favorece la presencia de Moth (ver Tabla 1). De manera similar que en discusiones anteriores, se observa que el catalizador con el menor EOP (Mo-Aev1O5) presenta la mayor relación de especies Moth/Mooct y la mayor actividad catalítica.
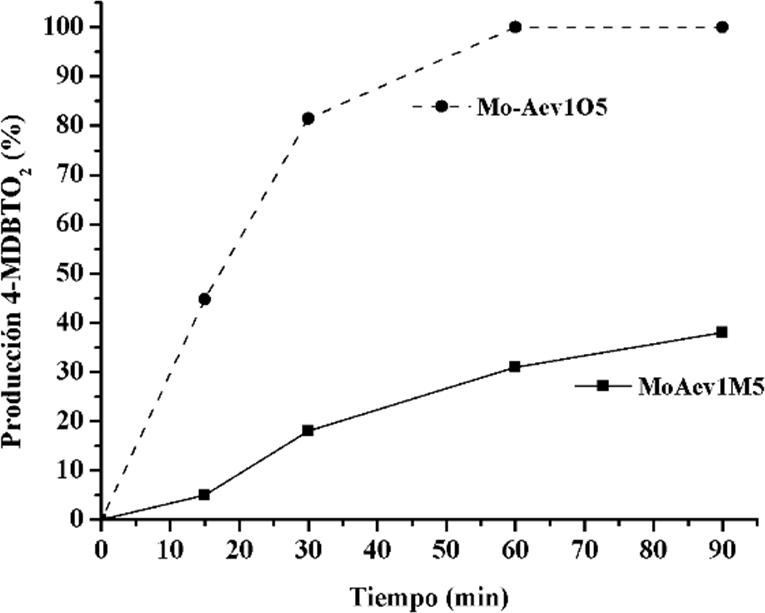
Figura 8 Producción de 4-MDBTO2 con catalizadores calcinados en atmósfera estática de aire (Mo-Aev1M5) y con flujo de O2 (Mo- Aev1O5).
En la Figura 9 se muestran los resultados de producción a sulfona de catalizadores con diferente contenido de Mo (Mo-Aev1O5 y Mo(20)-Aev1O5), donde se observa que a los 90 min se obtiene el 100 % de producción a sulfona del 4-MDBT para ambos catalizadores, con kMo7, 4-MDBT = 0.1679 y kMo(20), 4-MDBT = 0.1602 (ver Tabla 2). Los perfiles TPR de ambos catalizadores (Fig. 4) muestran que el catalizador de mayor carga presenta una zona intermedia de reducción de gran intensidad, zona de reducción que corresponde a las especies poliméricas de Mo. Los resultados de la Tabla 1 indican que el catalizador con el 20% de Mo presenta la menor relación de Moth/Mooct y por lo tanto el mayor EOP respecto al catalizador con el 7% de Mo. Lo cual corrobora que las especies Moth son las principales responsables de la actividad catalítica, debido a que el catalizador con la mayor relación Moth / Mooct presenta la mayor actividad catalítica como ha sido mostrado por los valores de las contantes cinéticas de pseudo primer orden.

Figura 9 Producción de 4-MDBTO2 de catalizadores con diferente contenido de Mo: 7 % (Mo-Aev1O5) y 20 % (Mo(20)-Aev1O5).
Como se ha mostrado anteriormente, la dependencia existente entre el EOP y la relación de especies Moth/Mooct también mantiene correlación con la actividad catalítica. Es decir, los catalizadores que presentan la mayor relación de especies Moth/Mooct y por lo tanto el menor EOP son aquellos que presentan la mayor actividad catalítica. En base a lo mencionado anteriormente, se realizó la preparación de un catalizador con las condiciones que proporcionan la mayor relación de especies Moth/Mooct y por lo tanto el menor EOP.
Finalmente en la Figura 10 se muestran los resultados de actividad ODS para los tres compuestos dibenzotiofénicos con el catalizador preparado con las mejores condiciones encontradas en este estudio: impregnación por volumen de poro, calcinación en atmósfera de oxígeno a 10 °C/min y pH de la solución impregnante de 2. Se observa que a los 60 min se obtiene prácticamente el 100 % de producción para DBT y 4-MDBT y más del 90 % para 4,6-DMDBT. La alta actividad de este catalizador es producto de la mayor relación de especies Moth/Mooct, lo cual ha sido logrado tomando en cuenta las condiciones que favorecen la presencia de las especies Moth y por lo tanto promoviendo el menor EOP.
En la tabla 2 se presentan los resultados de las constantes cinéticas para este catalizador, donde se puede observar la mayor actividad catalítica para los DBTs, logrando así la oxidación total del 98 % de los compuestos de azufre en la mezcla modelo diesel.
4. Conclusiones
En este trabajo se presenta un estudio sobre las condiciones de preparación de catalizadores de MoO3/Al2O3 para la reacción de ODS de un diesel modelo. Los resultados sugieren que el aumento en la interacción de las especies de Mo con el soporte favorece la actividad catalítica debido a la presencia de especies de Mo más estables y por lo tanto menos susceptibles a ser lixiviadas. Se determinó que la formación de especies activas de Mo (Moth) para la reacción de ODS es función del pH de la solución de impregnación, debido a que la relación de especies de Mo tetraédricas a octaédricas (Moth/Mooct) se ve modificada con el pH, así como también por el método de impregnación del soporte y el proceso de calcinación. Los resultados mostraron que existe una estrecha correspondencia entre la relación de especies de Mo tetraédricas y octaédricas (Moth / Mooct) y la actividad catalítica; mostrando que a mayor cantidad de especies de Moth se favorece la actividad catalítica ODS. La actividad del catalizador preparado a las mejores condiciones (Mo-Avp2O5) encontradas en este estudio, claramente evidencian que es posible alcanzar ultrabajos contenidos de azufre (< 10 ppm) utilizando catalizadores de óxidos de Mo preparados de manera no convencional.











 nova página do texto(beta)
nova página do texto(beta)