Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Superficies y vacío
versión impresa ISSN 1665-3521
Superf. vacío vol.26 no.3 Ciudad de México sep. 2013
Efecto del gas utilizado en el tratamiento térmico y la impurificación con Eu en las propiedades estructurales de nanofibras de TiO2 depositadas por electrohilado
Cruz-González N.1, Fernández Muñoz J.L.1, Zapata-Torres M.1, García-Hipólito M.2
1 Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada-IPN Calz. Legaria # 694, Col. Irrigación, Del. Miguel Hidalgo, México D.F.
2 Instituto de Investigaciones en Materiales-UNAM A.P. 70-360, Coyoacán 04510, México D.F.
Recibido: 2 de abril de 2013
Aceptado: 30 de agosto de 2013.
Resumen
En este trabajo estudiamos la influencia de la atmósfera utilizada en el tratamiento térmico; así como la impurificación con Europio, en la transformación estructural de nanofibras de TiO2 crecidas por la técnica de electrohilado. Las muestras de TiO2 fueron tratadas térmicamente en atmósferas de Nitrógeno y Aire. Las muestras de TiO2:Eu fueron tratadas térmicamente en una atmosfera de aire. La morfología fue estudiada por Microscopia Electrónica de Barrido (SEM por sus siglas en ingles); y su estructura cristalina fue analizada por difracción de rayos-X y Raman. La atmósfera de Nitrógeno promueve una transformación de la fase anatasa a rutilo a menor temperatura, comparada con la atmosfera de aire. La impurificación con Eu incrementa la temperatura de transformación de la fase anatasa a rutilo.
Palabras Clave: Nanofibras; TiO2; Transformación de fase.
Abstract
In this work we studied the influence of annealing atmosphere and Eu doping in the structural transformation on TiO2nanofibers, grown by electrospinning technique. The TiO2 samples were annealing to different temperatures under controlled atmosphere of Nitrogen and air. The TiO2:Eu samples were annealing in air atmosphere. The morphology has been studied by Scanning Electron Microscopy (SEM) and crystalline structure was analyzed by X-Ray Diffraction (DRX) and Raman. The nitrogen atmosphere promotes at lower temperatures the anatasa to rutilo transformation, compared with the air atmosphere. The Eu impurification increases the annealing temperature for the anatasa to rutile transformation.
Keywords: Nanofibers; TiO2; Phase transformation.
1. Introducción
El dióxido de Titanio (TiO2) es uno de los óxidos semiconductores más importantes; tiene una variedad de aplicaciones tales como dispositivos catalíticos, sensores, celdas solares, y otros dispositivos optoelectrónicos [1, 2]. El TiO2 tiene tres fases cristalinas: anatasa, rutilo y brookita; teniendo propiedades fisicoquímicas diferentes para cada una de ellas [3]. Este material es muy conocido por sus propiedades fotocatalíticas [4, 5]; sin embargo, la eficiencia de las reacciones fotocatalíticas está limitada por la alta razón de recombinación de los pares-electrón hueco fotoinducidos. Es bien conocido que hay muchos factores que ejercen influencia en el comportamiento fotocatalítico, entre estos están: el tamaño, el área superficial, la estructura porosa y la fase cristalina. La construcción de nano estructuras o microestructuras de TiO2 con morfologías y propiedades interesantes ha atraído recientemente la atención [6]; y han sido fabricados materiales nanoestructurados de TiO2, tales como, esferas [7], nanovarillas [8], nano fibras [9], nanotubos [10], nanolaminas [11].
Las estructuras de una dimensión del TiO2, tales como las nanofibras, poseen propiedades únicas y ventajas para las reacciones fotocatalíticas. Las nanofibras poseen un área superficial grande, disminuyen la razón de recombinación electrón-hueco y poseen una alta razón de carga superficial; lo cual tiene efectos favorables en las reacciones fotocatalíticas [12]. Una forma simple de fabricar las nanofibras de TiO2 es utilizando la técnica de electrohilado, en la cual se utiliza una mezcla de un alcóxido de Titanio y un polímero, tal como PVP; con una subsecuente calcinación, la cual es empleada para remover el polímero y cristalizar el TiO2 [9]. La remoción del polímero es necesaria debido a que al principio la superficie de las nanofibras es PVP, al remover este se expone en la superficie el TiO2, el cual es el material que necesitamos que interaccione con la solución para que se lleve a cabo la reacción electrolítica.
Varios estudios [13, 14] han reportado que la fase anatasa exhibe mejores propiedades fotocatalíticas que la rutilo, esto es debido la formación de una capa hidroxilica , la cual es la responsable de las reacciones fotocatalíticas. Es por eso que el control de la estructura cristalina a nanoescala es muy importante para que el TiO2 sea aplicado. El control de la fase puede ser realizada mediante el tratamiento térmico a una determinada temperatura, o bien incorporándole impurezas.
Amarjargal et al. [15] reportó que la adición de nanopartículas de plata en nanovarillas de TiO2 promueve la transición de la fase anatasa a rutilo a temperaturas más bajas; Setiawati et al. [16] encontró que la impurificación de las nanoparticulas de TiO2 con Eu y Sm aumenta la temperatura de transición de la fase anatasa a rutilo; Tobaldi et al. [17] preparó mezclas de TiO2 con elementos de tierras raras, utilizando reacción en estado sólido, encontrando que la adición de las tierras raras en el TiO2 modifica las temperaturas de transición de las fases anatasa a rutilo; Cacciotti et al. [18] estudió el efecto de la impurificación con iones de tierras raras en nanofibras de TiO2, encontrando que la temperatura de transición de la anatasa a rutilo se mueve a valores mayores, esto lo realizó para concentraciones del 1% y 3% de los iones de tierras raras.
En este trabajo, se estudió el efecto del gas utilizado en el tratamiento térmico y la impurificación con Eu en las propiedades estructurales de las nanofibras de TiO2 crecidas por electrohilado. Las muestras fueron caracterizadas por Termogravimetría, Espectroscopia Raman, Microscopia Electrónica de Barrido y Difracción de Rayos X; se encontró que existe dependencia del gas utilizado y de la incorporación de Eu, sobre la temperatura de transición de la fase anatasa a rutilo.
2. Procedimiento Experimental
En este estudio, se utilizaron como precursores para obtener las nanofibras de TiO2 los siguientes reactivos: isopropóxido de titanio (IV) (TPT) al 97% (Aldrich), Acetilacetonato de Europio (Aldrich), Polivinil Pirolydona (PVP 1'300,000)(Alfa Aesar), Etanol anhidro (Química Meyer) yÁcido Acético glacial. Se preparó una solución al 13 % en peso de PVP/etanol, para esto se disolvieron 0.5142 gramos de PVP en 5 mililitros de etanol anhidro y se mantuvo en agitación magnética por 3.5 horas hasta la completa disolución del polímero. Adicionalmente se preparóuna solución con 1546 microlitros de TPT disueltos en 1905 microlitros de ácido acético y 1270 microlitros de Etanol. La solución de TPT se adicionó gota a gota la solución de PVP y se dejó en agitación durante 48 horas para una completa homogenización de la mezcla a temperatura ambiente.En el caso del TiO2 impurificado con Eu, se añadieron 2.5, 5.0, 7.5, 10 y 12.5 % de Acetilacetonato de Europio (con respecto al TPT) a la solución precursora de TiO2.El equipo de electrohilado utilizado consiste en una fuente de alto voltaje (Modelo 210-30P, BertanAssoc Inc., USA), una bomba de infusión para controlar la tasa de flujo de inyección (Modelo NE-300. New Era PumpSystems, Inc., USA), una jeringa de 5 militros con una aguja de acero inoxidable con un diámetro interno de 0.70 mm (22G) (TerumoCorporation, Philippines) y un conector a tierra. El equipo se colocó en una cámara de acrílico para reducir el efecto de las corrientes de aire sobre la trayectoria del flujo electro-depositado. La solución polimérica fue cargada en la jeringa y en la punta de acero inoxidable se aplicó un voltaje de 15 kV. La velocidad de flujo fue de 0.05 mililitros por hora y la distancia de la punta de la aguja al colector de 12 cm. Las nanofibras obtenidas se secaron en una estufa de convección marca BRINDER a 110 °C durante1 hora, y posteriormente se calcinaron a diferentes temperaturas 400 °C, 600 °C, 700 °C y 800 °C durante dos horas en atmósferas de nitrógeno y oxígeno, para las nanofibras de TiO2; y en una atmósfera de oxígeno para las nanofibras de TiO2:Eu. Las nanofibras se trataron térmicamente en un horno tubular autoconstruido en el laboratorio, un tubo de cuarzo, dos tapas de aluminio con entrada y salida de gas, un termopar tipo K como sensor de temperatura, disipadores de calor y sistema de enfriamiento.
Se determinó el cambio de peso de las fibras en función de la temperatura usando un analizador termogravimétrico Modulado de Alta Resolución (TGA Q 5000, TA Instruments, Inc., USA). Las muestras se colocaron en la balanza del sistema (0.5 - 1 microgramos) y fueron calentadas de 25°C a 800°C en porta muestra de platino (platinum-HT) a una velocidad de calentamiento de 7°C/min, en atmósferas de nitrógeno y oxígeno, con una velocidad de flujo de 50 microlitros por minuto.
La morfología de las nanofibras fue observada en un microscopio electrónico de barrido (SEM) (JEOL JSM-6390LV, Akishima, Japón). La estructura cristalina de las muestras se determinó utilizando un difractómetro de rayos-X (BRUCKER D8, Alemania). Los difractogramas se adquirieron en el rango de 20° a 80° en 20 con un paso de 0.02°.Los resultados de la espectroscopiaRaman se obtuvieron usando un espectrómetro RamanJovinYvon con un láser de He-Ne de longitud de onda de 632 nm el cual tiene acoplado un microscopio Olympus BX40. Las muestras se barrieron en el rango de 60 - 1100 cm-1.
3. Resultados y Discusión
Con el propósito de estudiar el efecto del gas utilizado en el tratamiento térmico, se realizaron estudios de termogravimetría a las nanofibras de TiO2/PVP, en atmósferas de nitrógeno y oxígeno. En la figura 1 se presenta la pérdida de peso de las nanofibras, con respecto a la temperatura. Podemos observar que la pérdida de peso se da en forma escalonada teniendo la primera caída importante a los 83.45 °C correspondiente a la perdida de solventes tales como el agua y etanol; después se ve que la pérdida de peso es en forma gradual, la cual se atribuye a la pérdida de compuestos orgánicos producto de la descomposición del PVP al comienzo de la formación del TiO2, la pérdida de peso se mantiene estable para temperaturas cercanas a los 600°C. Cuando se utilizaron nitrógeno y oxígeno como atmósferas, las nanofibras perdieron el 72 % y 78% de su peso respectivamente, observándose una cinética de pérdida de peso diferente para cada una de las atmósferas.

En la figura 2 (a) observamos una micrografía del SEM de la muestra de TiO2, a la cual se le dio un tratamiento térmico en atmósfera de aire seco a 400 °C. En ésta podemos observar que las fibras se encuentran orientadas en forma aleatoria y tienen diámetros no uniformes. Se tienen muchos espacios vacíos, los cuales están interconectados con las fibras, resultando una red fibrosa en 3D. En la figura 2 (b), 2(c) y 2(d) presentamos micrografías SEM de alta resolución, para las nanofibras de TiO2 tratadas térmicamente en atmósfera de aire seco a 400°C, 600°C y 800°C, respectivamente. En éstas podemos observar, que a medida que se va incrementando la temperatura de tratamiento térmico la superficie se vuelve más rugosa y con tamaños de grano más grandes, lo cual nos indica que el tratamiento térmico está promoviendo la coalescencia de los granos.

La espectroscopia Raman es una técnica que nos permite analizar e identificar la composición de las fases presentes en las muestras, permitiendo distinguir las diferentes estructuras en las nanofibras de TiO2. La formación de las nanofibras y la transición de las fases anatasa a rutilo pueden ser monitoreadas por la espectroscopia Raman debido a que las dos fases tienen espectros distinguibles. En el caso de monocristales de anatasa, se han identificado seis bandas permitidas en los espectros Raman de primer orden: 144 cm-1 (Eg), 197 cm-1 (Eg), 399 cm-1 (B1g), 513 cm-1 (A1g), 519 cm-1 (B1g), 639 cm-1 (Eg). Para monocristales de rutilo, se tienen cuatro bandas permitidas en los espectros Raman de primer orden: 143 cm-1 (B1g), 447 cm-1 (Eg), 612 cm-1 (A1g), 826 cm-1 (B2g) [19].
La figura 3 muestra los espectros Raman de las nanofibras del compuesto TiO2/PVP calcinadas a 400°C, 600°C, 700°C y 800°C. En la figura 3(a) podemos observar los espectros calcinados bajo una atmósfera de nitrógeno.

El correspondiente a una temperatura de tratamiento de 400 °C, tiene bien definido un sólo modo vibracional en 144 cm-1, el cual corresponde a la fase anatasa; para el espectro correspondiente a 600°C, podemos observar un ligero corrimiento del primer pico, el cual podría corresponder al modo vibracional B1g de la fase rutilo, los demás picos que aparecen corresponden a la fase rutilo, sugiriendo que es la única fase que se encuentra presente a la temperatura de 600°C. Para las muestras tratadas a 700°C y 800°C, se observan modos vibracionales de la fase rutilo. En la figura 3 (b) se muestran los espectros de las muestras calcinadas en atmósfera de oxígeno. El correspondiente a 400°C, no tuvo picos definidos, sugiriendo que la muestra tuvo baja cristalinidad. Los espectros correspondientes a 600°C, 700°C y 800°C mostraron una combinación de modos vibracionales correspondientes a las fases anatasa y rutilo, aumentando la intensidad relativa de la fase rutilo a medida que aumenta la temperatura de tratamiento térmico. Lo anterior sugiere que una atmósfera de tratamiento térmico de nitrógeno favorece la transformación de la fase anatasa a rutilo, a una temperatura menor que si tuviéramos una atmósfera de aire seco.
La figura 4 muestra los espectros de difracción de rayos X de las nanofibras del compuesto TiO2/PVP calcinadas a 400°C, 600°C, 700°C y 800°C. Éstos fueron indexados utilizando las tarjetas 731764 y 211276 de los archivos de difracción de polvos (PDF, por sus siglas en inglés) correspondientes a las fases anatasa y rutilo, respectivamente. En la figura 4(a) podemos observar los espectros de difracción de las muestras calcinadas en atmósfera de nitrógeno; el correspondiente a 400 °C presenta las características de un material con baja cristalinidad, estando en forma definida sólo el pico correspondiente al plano (101) de la fase anatasa, a partir de 600°C, los espectros presentan características más cristalinas estando más definidos los picos correspondientes a la fase rutilo. En la figura 4(b), presentamos los difractogramas de las muestras calcinadas en aire. Podemos observar que la muestra de 400 °C es poco cristalina, y presenta solamente el pico que corresponde al plano (101) de la fase anatasa. Para las muestras de 600°C, 700°C y 800°C, se puede observar que se tiene una mezcla de las fases anatasa y rutilo, y que la intensidad de los picos de difracción de la fase rutilo va aumentando conforme aumenta la temperatura de tratamiento térmico. Es importante resaltar que la fase anatasa no es completamente transformada a la fase rutilo, aun para temperaturas de 800°C, cuando se utiliza aire seco como atmósfera en el tratamiento térmico; mientras que cuando se utiliza nitrógeno, la fase anatasa se transforma a la rutilo para una temperatura de 600°C. Estos resultados están de acuerdo a lo observado en la espectroscopia Raman.

El porcentaje de las fases anatasa y rutilo, contenidas en las muestras se determinó utilizando la ecuación de Spurr [20]:

Donde PA es el porcentaje de la fase anatasa; Ia la intensidad integral del pico (101) de la fase anatasa; IR la intensidad integral del pico (110) de la fase rutilo. En la figura 5 se presenta el porcentaje del contenido de la fase anatasa en función de la temperatura de tratamiento térmico, para los dos gases utilizados. En ésta podemos ver que cuando utilizamos nitrógeno, a partir de 600 °C, tenemos la fase completamente transformada, mientras que cuando utilizamos aire, el porcentaje de la fase anatasa va disminuyendo gradualmente, y aún para la temperatura de 800°C, todavía tenemos alrededor del 5% de la fase anatasa.

Con el objetivo de estudiar la influencia de la impurificación con Eu, en la transición de fase de anatasa a rutilo. Se sometieron a tratamiento térmico en atmósfera de aire las nanofibras de TiO2/PVP impurificadas con Eu. En la figura 6 se muestran los espectros de difracción de rayos Xde las muestras de TiO2 impurificadas con 2.5% y 10% mol en la solución, tal como estád escrito en la parte de detalles experimentales. En la figura 6(a) podemos observar los patrones de difracción de las muestras calcinadas a las diferentes temperaturas, para un contenido de Eu de 2.5%. La muestra de 400 °C, presenta solamente picos relacionados con la estructura de la fase anatasa, a partir de 600°C, empieza a aparecer picos relacionados con la fase rutilo, y aún para la temperatura de 800 °C, la intensidad de los picos de difracción relacionados conla fase anatasa son intensos. En la figura 6(b), la cual es para 10% mol de Eu, podemos observar que para 400°C el difractograma presenta características amorfas, teniendo para temperaturas mayores un comportamiento similar al descrito en la figura 6(a). Lo anterior es indicativo, de que la incorporación de Eu en la matriz de TiO2, hace que la transición de la fase anatasa a rutilo sea realizada a temperaturas más elevadas.

Utilizando la ecuación de Spurr, se determinó el porcentaje de la fase anatasa, con respecto a la concentración de Eu. En la figura 7 podemos observar el porcentaje de la fase anatasa contenida en la muestra. Para la temperatura de 400°C no está la de TiO2-Eu10 y TiO2-Eu12.5, ya que estas muestras presentaron un espectro de difracción carente de picos, debido a su carácter amorfo. Para 400 °C, todas las muestras tienen el 100% de la fase anatasa, para las demás temperaturas las muestras que están impurificadas con Eu, mantienen la fase anatasa en porcentajes mayores al 60 %.
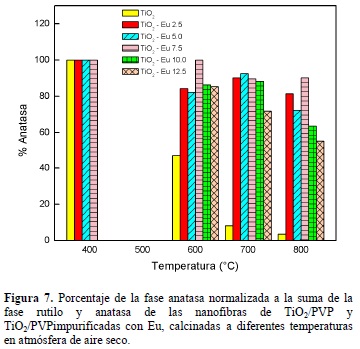
La fase cristalina anatasa es una fase inestable a altas temperaturas, y sus temperaturas de transformación pueden ser variadas en un amplio rango. En el presente trabajo se encontró que la transición de la fase anatasa a la rutilo es obtenida a menores temperaturas, si las nanofibras son calcinadas en atmósfera de nitrógeno. La incorporación de Eu en el TiO2, crea cierto grado de desorden estructural; asimismo promueve que la transición de la fase anatasa a rutilo se lleve a cabo a temperaturas mayores, lo anterior es independiente del porcentaje de Eu incorporado en el TiO2. Por sus propiedades fotocatalíticas es preferible tener la fase anatasa. Por eso es de gran importancia obtener nanofibras con una temperatura alta para la transición de la fase anatasa a rutilo. Esto es debido a que cuando se obtienen las nanofibras es necesario calcinarlas para eliminar el PVP de su superficie y hacerla de esta manera activa. Se ha reportado que la incorporación de Eu aumenta la actividad fotocatalítica de las nanofibras de TiO2; se están realizando estudios para encontrar si esto es debido a que el Eu influye en mantener la fase anatasa, o porque la luminiscencia de este ion influye enla generación de pares electrón-hueco en el TiO2.
4. Conclusiones
La calcinación de las nanofibras deTiO2/PVP en atmósfera de nitrógeno promueve la transición de la fase anatasa a rutilo a menores temperaturas, que si utilizáramos una atmósfera de aire seco. El aire seco produce una mayor pérdida de peso en las nanofibras de TiO2/PVP, correspondiendo éste a una mayor pérdida del PVP. La incorporación de iones de Eu a las nanofibras de TiO2/PVP produce una pérdida de cristalinidad, pero aumentan la temperatura de transformación de la fase anatasa a rutilo, para todas las concentraciones de iones de Eu utilizadas.
Agradecimientos
Los autores agradecen a la M. en C. Alejandra García Sotelo por su asistencia técnica. Este trabajo fue financiado por el CONACyT bajo el proyecto CB2010-01 15235 y la SIP -IPN, bajo el proyecto 20131790.
Referencias
[1] Li D, Xia Y; Nano Letters 3, 555 (2003). [ Links ]
[2] Viswanathamurthi P, Bhattarai N, Kin CK, Kim HY, Lee DR; Inorg Chem Commun 7, 679 (2004). [ Links ]
[3] Akira Fijishima, Xintong Zhang, Donald A. Tryk: Surface Science Reports 63, 515 (2008). [ Links ]
[4] Lee KM, Suryanarayanan V, Ho KC; Sol Energy Mater Sol Cells 91, 1416 (2007). [ Links ]
[5] Zhang X, Xu S, Han G; Mater Lett 63, 1761 (2009). [ Links ]
[6] Chen X, Mao SS; J. Nanosci. Nanotechnol 6, 906 (2006). [ Links ]
[7] Li X, Xiong Y, Li Z,Xie Y; Inorg. Chem. 45, 3493 (2006). [ Links ]
[8] Cozzoli PD, Kornowski A, Weller H; J. Am. Chem Soc. 125 14539 (2003). [ Links ]
[9] Li D, Xia Y; Nano Lett. 3, 555 (2003). [ Links ]
[10] Liu Z, Zhang X, Nishimoto S, Jin M, Rryk DA, Marakami T, Fujishima A; J. Phys. Chem. C 112, 253 (2007). [ Links ]
[11] Chen Y, Tian G, Ren Z, Tian C, Pan K, Zhou W, Fu H; Eur. J. Inorg. Chem 2011, 754 (2011). [ Links ]
[12] Almquist CB, Biswas P; J. Catal. 212, 145 (2002). [ Links ]
[13] Sclafani A., Herrmann J.M.; J. Phys. Chem 100, 13655 (1996). [ Links ]
[14] Hadjiivanov K.I., Klissurski D.G.; Chem. Soc. Rev. 25, (1996) 61. [ Links ]
[15] Altangerel Amarjargal, Leonard D. Tijing, Cheol Sang Kim: Ceramics International 38, 6365 (2012). [ Links ]
[16] Setiawati E, Kawano K; Journal of Alloys and Compounds 451, 293 (2008). [ Links ]
[17] Tobaldi DM, Sever Skapin A, Pullar RC, Seabra MP, Labrincha JA; Ceramics International 39, 2619 (2013). [ Links ]
[18] Ilaria Cacciotti, Alessandra Blanco, Giuseppe Pezzotti, Gualtiero Gusmano, Chemical Engineering Journal 166, 751 (211). [ Links ]
[19] Porto SPS, Fluery PA, Damen TC; Phys. Rev. 154, 522 (1967). [ Links ]
[20] Spurr RA, Myers H; Anal. Chem. 29, 760 (1957). [ Links ]














