Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Superficies y vacío
versión impresa ISSN 1665-3521
Superf. vacío vol.26 no.2 Ciudad de México jun. 2013
Preparación de nanoestructuras porosas de TiO2 por anodización a bajo potencial en electrólito acuoso de CH3COOH/HF
Reynaud Morales A.G.1*, Cuevas Arteaga C.1
1 FCQI-CIICAp-Universidad Autónoma del Estado de Morelos Av. Universidad 1001, Col. Chamilpa, 62209, Cuernavaca, Mor., México. *areynaud@uaem.mx
Recibido: 19 de noviembre de 2012
Aceptado: 13 de mayo de 2013
Resumen
En el presente trabajo se reporta la fabricación de capas nanoestructuradas porosas de dióxido de titanio (TiO2) por anodización electroquímica en un rango de bajo potencial (1V vs. Ecorr - 3V vs. Ecorr) de hojas de titanio en un electrólito acuoso (CH3COOH/ HF). Este tipo de estructuras en nano-escala ha causado gran interés en años recientes debido a las altas expectativas que se tienen en relación a las aplicaciones de los nanomateriales, principalmente en energía solar y sensado de gases. La morfología de las películas resultantes fue analizada por microscopía electrónica de barrido (MEB). Se encontró que el espesor de las capas, el ordenamiento de los poros, así como el diámetro de los mismos dependen fuertemente del tiempo de anodización y de la morfología de la superficie inicial de titanio. La evolución de la corriente en función del tiempo fue registrada, obteniéndose curvas similares a las reportadas en la literatura a altos potenciales. La aplicación de bajos potenciales, aunque conveniente en el aspecto económico, impone una restricción en las posibilidades de optimización del proceso, la cual se intenta compensar con un ajuste en los pretratamientos electroquímicos y mecánicos con el fin de obtener un mayor grado de ordenamiento en los nanoporos, para lo cual se requerirán más investigaciones.
Palabras Clave: Dióxido de titanio; Nanomateriales; Anodización; Energía solar; Sensado de gases.
Abstract
Fabrication of titanium dioxide (TiO2) nanostructured porous layers is reported in this work, via electrochemical anodization in a low potential range (1V vs. Ecorr - 3V vs. Ecorr), from titanium foils immersed in an aqueous electrolyte (CH3COOH /HF). This type of nanoscale structures have caused great interest in recent years because of the high expectations that have been established for nanomaterials applications, mainly concerning solar energy and gas sensing. The morphology of the resulting films was analysed by scanning electron microscopy (SEM). Layer thickness, pore arrangement and pore diameter were found to be strongly dependent on the anodizing time and on the initial morphology of the titanium surface. Current density evolution for this process was registered, yielding similar curves to those reported in literature at higher potentials. The application of low potentials, though economically convenient, imposes a restriction on the optimization possibilities for the process. Such a restriction is intended to be offset with an adjustment in electrochemical and mechanical pretreatments in order to achieve a higher ordering degree of nanopores, for what further research will be required.
PACS: Materials Science, specific materials, (81.05.-t) nanoscale materials, nanocristalline materials (81.07.Bc).
Keywords: Titanium dioxide; Nanomaterials; Anodization; Solar energy; Gas sensing.
1. Introducción
El dióxido de titanio (TiO2) en forma de nanoalambres, nanotubos y estructuras nanoporosas, es un material que ha atraído la atención de la comunidad científica y tecnológica en los últimos años [1-7]. La arquitectura de este tipo de material es deseable por su alta relación superficie-volumen, por su alta actividad superficial y su gran sensibilidad. Las estructuras nanoporosas son de gran importancia dentro de la amplia variedad de materiales nanoestructurados, ya que éstas pueden también ser utilizadas como "moldes" para fabricar otras nanoestructuras [8]. En particular, las aplicaciones más importantes de las capas nanoestructuradas porosas de TiO2, son aquellas que involucran el aprovechamiento de sus propiedades semiconductoras, a saber: en dispositivos de fotoelectroquímica/ fotocatálisis (e.g: generación de gas hidrógeno)1 [4], celdas electrocrómicas [9], sensores de gases [10], celdas solares (DSSC's o celdas sensibilizadas por colorante)[7]. Sobre esta última aplicación cabe mencionar que el uso eficiente de la energía solar es uno de los objetivos principales de la ciencia y la ingeniería actuales, especialmente en estos momentos en que se incrementa la preocupación por detener el fenómeno del calentamiento global [11,12]. Debido a lo anterior, existe una importante demanda en la investigación sobre la fabricación de películas porosas de TiO2 provenientes de hojas de titanio o de películas de titanio depositadas en substratos tales como silicio, óxido de indio-estaño (ITO por sus siglas en inglés) o cuarzo entre otros. La técnica que, de hace unos años a la fecha se ha revelado como la más eficiente para este propósito ha sido la anodización, i.e., la imposición de un sobrepotencial fijo sobre el metal (el cual, además de titanio, puede ser otro elemento de transición, e.g: tantalio, niobio, tungsteno, zirconio) inmerso en un electrólito, el cual puede ser de naturaleza muy diversa, desde soluciones acuosas ácidas o neutras hasta soluciones orgánicas viscosas, pero que invariablemente contendrá iones haluro (fluoruro en la mayoría de los casos, el ión cloruro es en ocasiones utilizado). El papel que juega el ión haluro en el electrólito es el de un ion complejante que favorece la disolución localizada del metal, produciéndose de ésta manera los poros, grietas o tubos y desarrollándose así la estructura nanoporosa requerida, en forma de capas del óxido metálico, con un grado de auto-organización u auto-ordenamiento que va de mediano a elevado, dicho grado de auto-ordenamiento en general ha mostrado estar en proporción directa con la mejora en las propiedades semiconductoras y de superficie del material [13].
Desde el año 1999, en el cual Zwilling et al. [14] reportaron el primer trabajo sobre anodización del titanio en un medio acuoso conteniendo ácido crómico y ácido fluorhídrico, las investigaciones sobre este tema se han enfocado en el esclarecimiento del mecanismo de iniciación y crecimiento de la capa de óxido porosa, buscando dilucidar la influencia de diversos parámetros, tales como el potencial aplicado, la velocidad de barrido del mismo, los pretratamientos electroquímicos, el tiempo de anodizado (parámetros de la anodización propiamente dicha), así como de parámetros inherentes a la solución utilizada, tales como la concentración, tipo de soluciones corrosivas y temperatura (parámetros químicos, físicos y fisicoquímicos), finalmente se han estudiado otras variables previas al proceso de anodización, como lo son los pretratamienos mecánicos tales como el laminado y el pulido, así como la influencia de las variaciones en los óxidos nativos iniciales. Diversos trabajos han evidenciado que este conjunto de variables o parámetros de distinta naturaleza modifica de manera contundente las características estructurales y de tamaño de las nanoestructuras obtenidas y por consecuencia, las propiedades funcionales del material [7,13,15]. La aplicación de bajos potenciales, aunque conveniente en el aspecto económico, impone una restricción en las posibilidades de optimización del proceso, tal como lo han mostrado los escasos estudios previos realizados a bajos potenciales [15-17]. Dichos estudios han sido realizados en un rango de sobrepotencial de 3V vs. Ecorr a 5 V vs. Ecorr, encontrándose sin embargo, resultados prometedores, ya que se han logrado valores de eficiencia considerables en las caracterizaciones fotovoltaica y optoelectrónica (entre otras) de las nanoestructuras de TiO2 producidas. Es necesario, por tanto, explorar más en el campo, tan pobremente sondeado, de las anodizaciones a bajo potencial. El presente trabajo se ha orientado a este fin, analizando la influencia de la aplicación de potenciales constantes de 1V vs. Ecorr y 3V vs. Ecorr sobre hojas de titanio pre-tratadas mecánica y/o electroquímicamente, en mezclas acuosas de ácidos acético y fluorhídrico, para obtener capas de óxido de titanio nanoestructurado, con un mediano grado de auto-ordenamiento. Se busca dilucidar los parámetros clave, cuya optimización permitirá mejorar dicho grado de auto-ordenamiento, con el propósito de caracterizarlas posteriormente en cuanto a su desempeño en aplicaciones fotovoltaicas, fotoelectroquímicas y de sensado.
2. Desarrollo Experimental
Se cortaron probetas de titanio planas de área superficial cuadrada (1 cm x 1 cm) a partir de una lámina de titanio de 0.25 mm de grosor (99.7 % de pureza, Sigma-Aldrich). Las probetas fueron pulidas mecánicamente a espejo, reservándose algunas sin pulir con el fin de evaluar el efecto de este pretratamiento mecánico. Posteriormente fueron limpiadas ultrasónicamente con alcohol isopropílico, agua y etanol. Como celda electrolítica se utilizó una celda estándar de plástico de 0.05 L de capacidad. Se empleó un arreglo convencional de tres electrodos: 1) las probetas de titanio planas de 1 cm2 de área como electrodo de trabajo, 2) electrodo de Ag/AgCl (1M KCl) como electrodo de referencia y 3) malla de platino como contraelectrodo. Las mediciones electroquímicas fueron registradas por medio de un potenciostato/galvanostato ACM instruments (No. de serie 1256) acoplado a una PC provista del software para adquisición de datos ACM versión 5. Los electrólitos utilizados fueron soluciones acuosas de ácido acético (CH3COOH) con pequeñas concentraciones de ácido fluorhídrico (HF). En particular se manejaron dos combinaciones de concentraciones de CH3COOH/HF, i.e: 1) CH3COOH + 0.5 wt% HF mezclado en proporción 1:7 y 2) CH3COOH + 0.3 wt% HF mezclado en proporción 1:7. Todas las soluciones se prepararon con reactivos grado analítico y agua desionizada. Es importante mencionar que el porcentaje de 0.5 wt% HF se refiere a un porcentaje peso-volumen. Previamente a los procedimientos electroquímicos las probetas fueron lavadas nuevamente con un chorro de alcohol isopropílico y secadas con flujo de nitrógeno gaseoso. Las anodizaciones y/o polarizaciones fueron llevadas a cabo bajo una campana extractora a una temperatura de ~25°C. Posteriormente a los procedimientos electroquímicos las muestras fueron lavadas con agua desionizada y secadas con flujo de nitógeno gaseoso. Las nanoestructuras porosas de TiO2 obtenidas tras las anodizaciones fueron amorfas, sin embargo, la aplicación de un proceso de recocido que indujese la cristalinidad no se llevó a cabo por estar fuera del objetivo del presente trabajo, quedando de este modo como una labor prospectiva. El presente trabajo se dividió en dos fases de investigación. La primera de ellas consistió en evaluar el efecto de la concentración de ión fluoruro sobre la morfología de la superficie con el fin de establecer concentraciones adecuadas para las anodizaciones. Esto se llevó a cabo registrando curvas de polarización potenciodinámica, aplicando una rampa de potencial de 0 vs. Ecorra 3000 mV vs. Ecorr con una velocidad de barrido de 5 mV/s. Para esta primera etapa se manejaron concentraciones de CH3COOH + 0.5 wt% HF (proporción 1 :7), CH3COOH + 0.3 wt% HF (proporción 1 :7) , así como solución de CH3COOH al 13 wt% para efecto de comparación. Una vez determinado un rango de concentraciones adecuado para la adición de HF, se procedió a la segunda fase de esta investigación, la cual consistió en las anodizaciones, éstas se llevaron a cabo a tiempos variados de anodización, con las combinaciones de concentración de HF y CH3COOH señaladas previamente, aplicándose primero un pretratamiento electroquímico que consistió en una prueba galvanostática utilizando como electrólito una solución 1 M de hidróxido de potasio (KOH), esto con el fin de originar una capa inicial compacta de óxido sobre la cual pudiese darse la iniciación de los poros, de acuerdo a las investigaciones previas reportadas en la literatura. La duración de esta prueba fue variable, por lo cual el tiempo de formación de dicha capa constituye un parámetro más en este estudio. La densidad de corriente aplicada en este pretratamiento fue de 3 mA/cm2. Posteriormente al pretrata-miento galvanostático se llevó a cabo la anodización propiamente dicha en las diferentes soluciones de CH3COOH/HF, para lo cual se efectuó una rampa de potencial desde 0 mV vs. Ecorr hasta un sobrepotencial determinado (1000 vs. Ecorr ó 3000 mV vs. Ecorr) a una velocidad de barrido de 500 mV/s y luego se mantuvo dicho potencial constante durante el resto de la anodización por medio de una prueba potenciostática. Se llevaron a cabo caracterizaciones de MEB (microscopía electrónica de barrido) de las muestras anodizadas, para lo cual se utilizó un microscopio de emisión de campo modelo LEO 1450 VP, provisto de un analizador MEB-EDX (energía dispersiva de rayos X). Algunas muestras fueron recocidas a 480 °C para ser caracterizadas en su estructura cristalográfica por Difracción de rayos X (DRX), usando un equipo Rigaku Dmax 2200 con radiación Cu-Κα (λ=0.15405 nm).
3. Resultados y Discusión
La figura 1 muestra la comparación de las curvas de polarización correspondientes a la primera fase de la investigación, en la cual se investigó el efecto sobre la superficie del titanio, de la adición de ácido fluorhídrico en distintas concentraciones a las soluciones de ácido acético, para así determinar un rango de concentraciones de ión fluoruro adecuado para llevar a cabo las anodizaciones. De acuerdo a la literatura previa se ensayaron dos concentraciones de ácido fluorhídrico: 0.3 wt% y 0.5 wt% adicionadas a una solución de ácido acético glacial en proporción (7:1) (una parte de ácido acético glacial por 7 partes de solución de HF a 0.3 ó 0.5 wt%). La concentración de una solución que sólo contiene ácido acético para la misma proporción en volúmen corresponde a una concentración de aproximadamente 13 wt% de CH3COOH, por lo tanto se utilizó una solución acuosa de ácido acético con esta concentración, carente de ácido fluorhídrico, para efectos de comparación. Como se observa en la figura, las densidades de corriente (I) aumentan con el incremento en la concentración de HF, analizando la pendiente de Tafel anódica en las tres curvas se puede advertir la misma tendencia para la densidad de corriente de corrosión (Icorr), pasando de 3.5x10-3 mA/cm2 para la solución de ácido acético al 13 wt% (sin HF) a 4 mA/cm2 para la solución de ácido acético con 0.3 wt% HF y finalmente a 7 mA/cm2 para la solución de ácido acético con 0.5 wt% HF. Las densidades de corriente (I) a lo largo del barrido aumentan en una década aprox. al pasar de la solución en ausencia de HF a la de 0.3 wt% HF, y en aproximadamente 1.5 décadas al pasar de la solución sin HF a la de 0.5 wt% HF. También se observó un desplazamiento del potencial de corrosión (Ecorr) hacia valores más negativos conforme aumenta la concentración de ácido fluorhídrico, exhibiendo un Ecorr de +80.8 mV vs. Ag/AgCl en la solución de ácido acético en ausencia de HF, un Ecorr de -981.5 mV vs. Ag/AgCl en la solución con 0.3 wt% HF y de -1035.4 mV vs. Ag/AgCl en la solución que contiene 0.5 %wt HF. La curva en ausencia de HF tiene un comportamiento muy particular, que se manifiesta por una zona activa seguida de una corriente límite (I) constante, con magnitud aproximada de 0.25 mA/cm2. Por su parte, las curvas correspondientes a las soluciones con 0.3 wt% HF y 0.5 wt% HF mostraron también un comportamiento característico, muy similar entre ellas, pero claramente distinto del de la solución carente de HF. Ambas presentan al inicio una región activa, posteriormente una zona pasiva, en la cual la densidad de corriente medida (I) disminuye hasta un valor fijo, en el caso de la solución de ácido acético con 0.3 wt% HF, de 11 mA/ cm2 se reduce a 3 mA/cm2, mientras que en la solución de ácido acético con 0.5 wt% HF disminuye de 28 mA/cm2 a aproximadamente 6 mA/cm2. En esta transición de un estado activo a uno pasivo pueden observarse, para este sistema en particular, una especie de "escalones" característicos en los cuales la densidad de corriente tiene pequeñas etapas de corriente constante y otras etapas de decrementos. Este fenómeno, el cual a nuestro conocimiento no ha sido reportado en la literatura, podría deberse a un proceso particular de disociación del ácido acético (el cual formaría complejos iónicos en solución o eventualmente precipitados sobre el titanio) que influenciaría directamente el comportamiento de la corriente catódica del contralectrodo e indirectamente el de la corriente anódica. Esto habría de corroborarse por el análisis de las especies presentes en la solución, lo cual está fuera del propósito de la presente investigación. Al final de las curvas se mantiene un valor fijo para la densidad de corriente, con magnitudes grandes en comparación con la corriente límite alcanzada en ausencia de HF, de 4.1 mA/cm2 y 6.4 mA/cm2 para 0.3 wt% HF y 0.5 wt% HF respectivamente. En el caso de la solución conteniendo 0.3 wt% HF, se observa un fenómeno muy particular el cual no se presenta a las otras concentraciones ensayadas, al menos no en el intervalo de potencial al cual se polarizaron las muestras. Dicho fenómeno sucede una vez alcanzado el estado de pasividad (tras la transición activo-pasivo escalonada ya descrita) a una corriente aproximada de 3 mA/cm2 y consiste en una re-activación, manifestada por un pequeño y segundo incremento de corriente, a un potencial aproximado de +230 mV vs. Ag/AgCl, para rápidamente volver a disminuir, aunque en menor medida, finalmente estabilizándose en un valor aproximado de 4.1 mA/cm2. Este súbito pico o "saliente" en la curva anódica ha sido atribuido en la literatura a la iniciación de un proceso equilibrado de formación-disolución de óxido, i.e., la iniciación propiamente dicha del crecimiento auto-organizado de nanoporos [18]. Este pico no se observa en la solución de acético con 0.5 wt% HF, al menos no de manera evidente, lo cual indicaría que la formación de poros auto-organizados a esta última concentración es más difícil de lograr.
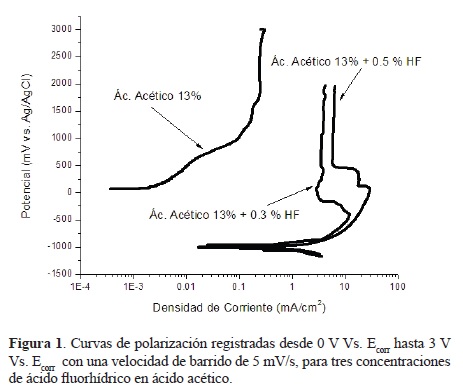
Entre mayor sea la definición de dicho pico, más posibilidades hay de que se presente la iniciación de un crecimiento auto-organizado de nanoporos, ya que el fenómeno se ubica perfectamente en un punto fijo de potencial, siendo éste de +230 mV vs. Ag/AgCl para el caso de la solución a 0.3 wt% HF+ 13 wt% CH3COOH, por lo cual se asume que ésta concentración de HF, de entre las dos ensayadas, es la adecuada para llevar a cabo las anodizaciones.
La segunda fase de la investigación corresponde a las anodizaciones potenciostáticas, i.e., la aplicación de un sobrepotencial constante de 1 V vs. Ecorr ó 3 V vs. Ecorr, al cual se llegó de manera gradual por medio de un barrido de potencial rápido (rampa de potencial o curva de polarización rápida) de 500 mV/s (después de haber realizado u omitido el pulido y la prueba galvanostática) en el electrólito de HF+ CH3COOH. A pesar de haber determinado que la concentración de CH3COOH + 0.3 wt% HF (1 :7) era más adecuada que la de CH3COOH + 0.5 wt% HF (1 :7), se decidió también experimentar con ésta última. La figura 2 muestra la comparación de dos curvas de la densidad de corriente registrada contra el tiempo de anodización (I Vs. t), durante el proceso de anodización (prueba potenciostática) de dos probetas de titanio en un electrólito de CH3COOH/0.3%HF (1:7) a 3 V vs. Ecorr. La prueba potenciostática duró 1 hora con 15 minutos para la primera probeta y 1 hora con 30 minutos para la segunda de ellas.
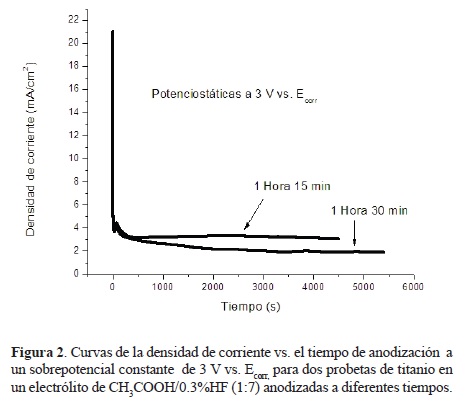
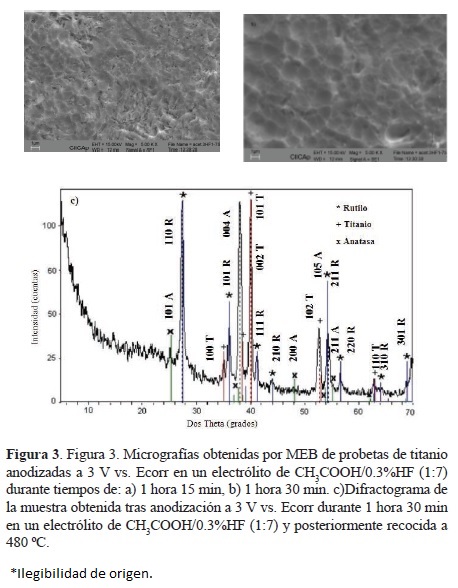
Se puede apreciar que la evolución de las curvas transita por tres etapas distintas, las cuales han sido ya reportadas en la literatura [8, 19-22] para la obtención de nanoporos y nanotubos de TiO2 a medianos y altos potenciales (de 10 V vs. Ecorr a 120 V vs. Ecorr). Estas etapas se relacionan de manera compleja con los mecanismos cinéticos de formación de poros más comúnmente aceptados en la literatura, los cuales involucran variables significativas como la acidez local (gradientes de concentración de ión hidrógeno) y la expansión de volúmen entre otras [22]. A lo largo de dichas etapas el proceso se orienta a la búsqueda de un equilibrio entre la velocidad de formación de óxido (proceso electroquímico) y la velocidad de disolución localizada del mismo, (proceso químico llevado a cabo por el ión haluro). La primera etapa corresponde a la formación de una capa compacta de óxido, debido a la cual la corriente desciende bruscamente, la segunda etapa se manifiesta por un pequeño pico o incremento de la corriente, correspondiente a la formación de grietas o picaduras localizadas, dicha formación corresponde a la iniciación del auto-ordenamiento, ya que la corriente incrementada debe repartirse sobre las primeras picaduras formadas, las cuales sufren un proceso contínuo de pasivación-reactivación-repasivación, durante el cual la velocidad de disolución del óxido se incrementa, para finalmente, en una tercera etapa, lograr un estado estacionario por formación de múltiples poros auto-organizados, este equilibrio se observa como un valor cuasi-estable de la densidad de corriente y corresponde a un intervalo en que las velocidades de formación y disolución del óxido son aproximadamente iguales entre sí . Existe una cuarta etapa antes de la cual debe detenerse la anodización, ya que en ella se regresa a un estado inestable, debido al propio crecimiento de la capa nanoporosa (manifestado por un decremento en la corriente), el cual hace imposible mayor crecimiento de óxido (se impide el transporte de los iones O2- hacia la interfase metal-óxido), por tanto, la velocidad de disolución se hace mayor que la de formación de óxido y el crecimiento auto-organizado de poros se detiene, destruyéndose la capa porosa o volviéndose nuevamente compacta. Como podemos observar en la figura 2, el proceso ha sido detenido en la tercera etapa, por lo cual se esperaría la formación de una capa auto-organizada nanoporosa de TiO2, la cual es corroborada en la figura 3, en la cual se muestra el resultado de la microscopía de barrido efectuada a ambas probetas. En la misma figura se muestra un resultado del análisis estructural por DRX, típico de estas probetas (en particular una de ellas anodizada a 3 V vs. Ecorr, durante 1 hora con 30 minutos), el cual se discutirá más adelante. El sistema CH3COOH/HF constituye un medio difícil de ajustar, la organización y profundidad de los nanoporos obtenidos no es tan grande como en otros sistemas (H3PO4 o H2SO4 por ejemplo) debido a que el ácido acético es un ácido muy débil. Es importante mencionar aquí que las condiciones de la capa de óxido inicial juegan un papel determinante en el proceso de anodización, lo cual se evidencia por la simple observación de la figura 2, ya que la probeta anodizada durante 1 hora con 15 minutos muestra en su curva una corriente ligeramente mayor durante todo el tiempo de anodización que aquella anodizada durante 1 hora con 30 minutos, lo que es indicativo de una capa más delgada de óxido nativo, ambas probetas fueron pulidas y no se sometieron a ningún pretratamiento electroquímico previo a la anodización: una capa inicial es más delgada que la otra debido a la naturaleza artesanal del pulido manual. La capa de óxido nativo inicial influye igualmente sobre la morfología de las nanoestructuras porosas obtenidas, lo anterior se concluyó después de realizar un estudio en el cual se anodizaron algunas probetas con y sin pulido previo, así como también después de variar los tiempos de la prueba galvanostática preliminar. En el caso de las probetas con pulido previo a la anodización, se observó que la capa de óxido inicial formada al aplicar la prueba galvanostática era más delgada (debido al hecho de partir de una morfología superficial más uniforme), lo cual llevó a obtener una capa nanoporosa mejor organizada, con menor dispersión de diámetros de poro y con menos rugosidad en comparación con las probetas no pulidas, en las cuales la formación de nanoporos auto-organizados fue más difícil de lograr, los capas nanoporosas obtenidas mostraron un grado más bajo de organización y una alta rugosidad (elevaciones y depresiones en la superficie nanoporosa). Se estudió también el efecto del tiempo de anodización, observándose que dicho tiempo es determinante en la morfología nanoporosa obtenida, esto fue evidente de manera particular en probetas anodizadas por tan sólo 5 minutos, en las cuales aún se observó una capa de óxido compacta bajo la cual apenas comienzan a revelarse los nanoporos no completamente crecidos y aún en proceso de auto-organización. El tiempo aproximado en el cual se logra una corrrecta auto-organización de los nanoporos es de alrededor de una hora y media para este sistema.
En lo que respecta a la prueba galvanostática (realizada previamente a la rampa de potencial y prueba potenciostática), se determinó la influencia del grosor de la capa de óxido inicial obtenida por medio de la misma. Para ello, se variaron los tiempos de dicha prueba, aplicando una densidad de corriente de 3 mA/cm2 durante tiempos de 3, 8 y 15 minutos. En la figura 4 se muestra la relación existente entre el grosor de la capa de óxido nativo inicial y el comportamiento de la corriente durante la anodización. Asimismo se muestra el efecto del grosor de dicha capa inicial sobre la morfología de las nanoestructuras porosas de TiO2 obtenidas, mediante las micrografías.
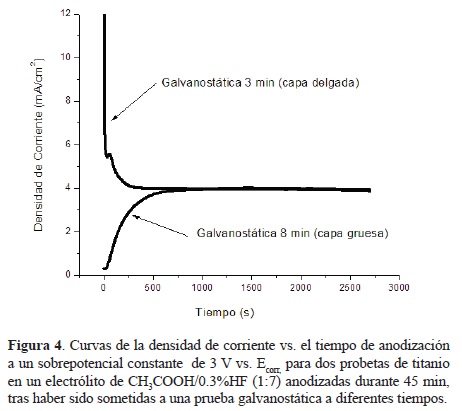
En las imágenes se aprecia que en el caso de la muestra anodizada a partir de una capa inicial delgada de óxido (3 minutos de galvanostática), tiene lugar la formación de una estructura nanoporosa con un grado mediano de auto-organización, a 45 minutos de anodización, mientras que en el caso de la muestra anodizada a partir de una capa inicial gruesa de óxido (8 minutos ó más de galvanostática), la capa nanoporosa auto-organizada obtenida se disolvió completamente, revelándose incluso la microestructura del titanio. La evidencia de que la capa nanoporosa existió, aunque fue disuelta, es el hecho de que se llegó a un valor de corriente bajo y similar al de la otra muestra (~ 4 mA/cm2 en ambos casos), además de que se observaron restos de óxido semi-poroso desprendido sobre la superficie metálica (véase recuadro en la micrografía). El comportamiento de las curvas se entiende lógico : en la anodización de la capa delgada, la corriente inicia bajando bruscamente, ya que aún se sigue formando más óxido compacto, en la anodización de la capa gruesa, por su parte, la corriente inicia subiendo de manera brusca, debido a que ya existe una capa inicial tan espesa que no permite más formación de óxido y el proceso comienza con el agrietamiento o picadura. Este tipo de anodización ya ha sido reportado en la literatura [21], sin embargo es muy inestable y no se ha descubierto aún la manera de ajusfarlo, por lo que es común que la capa nanoporosa se destruya y ocurra un revelado de la microestructura, como en este caso. Las observaciones anteriores respecto de la prueba galvanostática llevaron a considerar que, en el sistema de ácido acético, tal vez la prueba galvanostática no era necesaria, ya que al parecer con el simple crecimiento del óxido compacto al inicio de la anodización era suficiente para establecer las condiciones de iniciación del auto-ordenamiento de poros, a diferencia de otros sistemas (e.g. electrólitos viscosos) en los cuales esta prueba es necesaria para la iniciación del proceso [23].
Otro parámetro investigado fue la influencia de la concentración de ácido fluorhídrico. En general se determinó que la solución de CH3COOH + 0.5 wt% HF (1:7) es sumamente inestable, ya que con sólo agregar 10 minutos más de anodización (e.g : comparando muestras anodizadas a 50 min y una hora) las capas nanoporosas se destruyen completamente, cuando aún no se encuentran perfectamente auto-organizadas. Tras una comparación con las nanoestructuras porosas obtenidas en solución CH3COOH + 0.3wt% HF (1:7), al mismo sobrepotencial (3V vs. Ecorr) y mismo tiempo de anodización (1 hora) se concluyó que el espesor de las capas nanoporosas es mayor para la concentración de 0.5wt% HF , por lo que se cocncluyó que el contenido de 0.3 wt%HF proporciona el espesor óptimo de las capas auto-organizadas, lo que permite un proceso de anodización estable y una nanoestructura final más robusta y persistente. Finalmente se estudió el efecto del sobrepotencial, aplicando 1 V vs. Ecorr y 3 V vs. Ecorr de sobrepotencial constante después del barrido correspondiente desde el potencial de corrosión hasta dicho valor de potencial. El diámetro de los poros parece aumentar con el sobrepotencial aplicado, tal como está reportado para altos potenciales [13,22]. Por ejemplo, se observaron diámetros de 500 nm o menos para una muestra anodizada a 1 V en solución CH3COOH + 0.5 wt% HF (1:7) durante 5 minutos, mientras que para una muestra anodizada a 3 V vs. Ecorr en la misma solución durante el mismo tiempo, los diámetros son de alrededor de una micra.
Con el fin de presentar evidencia experimental de la presencia de dióxido de titanio en las muestras, se realizaron estudios estructurales de difracción de rayos X (DRX). Un difractograma típico de aquellos obtenidos para las muestras anodizadas en CH3COOH/0.3%HF (1:7) a 3 V vs. Ecorr durante 1 hora con 30 minutos, se muestra en la figura 3c, la muestra fue recocida en atmósfera de oxígeno a 480°C. Los archivos de difracción utilizados como referencia son los siguientes: Para anatasa JCPDS 21-1272, para rutilo JCPDS 21-1276 y para titanio JCPDS 44-1294. Se advierte la presencia de rutilo y anatasa, así como los picos de titanio, correspondientes al titanio subyacente (hoja de titanio). Es notable la alta intensidad de los picos de rutilo, así como su abundancia con respecto a los de anatasa y titanio. Esto concuerda con resultados obtenidos en otros electrólitos y a altos potenciales para la obtención de nanotubos de TiO2 por anodización [13,15].
4. Conclusiones
Se demostró la factibilidad para producir nanoestructuras porosas de dióxido de titanio en capas auto-organizadas sobre sustratos de hojas de titanio metálico, por la técnica electroquímica de anodización, a bajos potenciales (de 1 V vs. Ecorr a 3 V vs. Ecorr) en soluciones acuosas de ácido acético con ácido fluorhídrico. La restricción impuesta por el bajo potencial se pone de manifiesto en el efecto que tienen los óxidos nativos iniciales de las muestras anodizadas. Las condiciones de morfología de estos óxidos nativos están a su vez determinadas por 1) la naturaleza artesanal del pulido mecánico (siendo éste necesario para tener uniformidad en la superficie metálica a anodizar), 2) la formación de una capa inicial compacta de óxido sobre la cual se inicia el auto-ordenamiento (la cual, para el sistema de ácido acético con fluorhídrico puede formarse de manera óptima sin la aplicación previa de una prueba galvanostática). El grado de auto-ordenamiento de los poros y su diámetro dependen de manera importante del sobrepotencial de anodización, del tiempo y de la concentración de la solución. Con un contenido de 0.5 wt% de HF, el sistema es muy inestable y fuertemente dependiente del tiempo de anodización, por lo cual es difícil la obtención de nanoestructuras porosas. Para la concentración de 0.3 wt% de HF es posible la obtención de nanoporos con un grado de auto-ordenamiento considerable, a tiempos de aproximadamente una hora y media de anodización, ya que la velocidad de formación de óxido es lenta en comparación con la velocidad de disolución química del mismo (dada por el ion fluoruro). Las películas nanoporosas obtenidas son lo suficientemente estables para su aplicación en pruebas fotovoltaicas y de sensado de gases. Una perspectiva de este trabajo la constituye una colaboración con otra institución, con el fin de evaluar dichas películas. En general el sistema CH3COOH/HF constituye un electrólito difícil de ajustar para la formación de nanoestructuras porosas auto-organizadas, debido a su escasa fuerza ácida, por lo cual una perspectiva de este trabajo es optimizar completamente los parámetros clave, a saber: concentración del electrólito y pretratamiento mecánico (pulido), para estar así en condiciones de aplicar las nanoestructuras porosas obtenidas a dispositivos fotoelectrolíticos, fotovoltaicos y de sensado. Los ajustes en el pretratamiento mecánico podrían complementarse con nuevos pretratamientos electroquímicos con el fin de mejorar la estabilidad de las películas nanoporosas, se estaría así en condiciones de usarlas como soportes para aplicaciones catalíticas [24] o soporte-semiconductor en celdas solares de última generación [25].
Agradecimientos
Los autores agradecen al Dr. René Guardián Tapia por las micrografías de MEB. Este trabajo fue apoyado en el aspecto económico por el Consejo Nacional de Ciencia y Tecnología, gracias a la beca otorgada a A.G. Reynaud Morales para la realización de una estancia posdoctoral en el posgrado del CIICAp-UAEM.
Referencias
[1]. O. K. Varghese, G. K. Mor, C.A. Grimes, M. Paulose, N. Mukherjee, J. Nanosci, Nanotechnol, 4, 733, (2004). [ Links ]
[2]. M. Paulose, O. K. Varghese, G. K. Mor, C. A. Grimes, K. G. Ong, Nanotechnology, 17, 398, (2006). [ Links ]
[3]. G. K. Mor, K. Shankar, O. K. Varghese, C. A. Grimes, J. Mater. Res., 19, 2989, (2004). [ Links ]
[4]. G. K. Mor, K. Shankar, M. Paulose, O. K. Varghese, C. A. Grimes, Nano Lett., 5, 191, (2005). [ Links ]
[5]. O. K. Varghese, M. Paulose, K. Shankar, G. K. Mor, C.A. Grimes, J. Nanosci, Nanotechnol, 5, 1158, (2005). [ Links ]
[6]. G. K. Mor, K. Shankar, M. Paulose, O. K. Varghese, C. A. Grimes, Nano Lett., 6, 215, (2006). [ Links ]
[7]. M. Paulose, K. Shankar, O. K. Varghese, G. K. Mor, B. Hardin, C. A. Grimes, Nanotechnology, 17, 1446, (2006). [ Links ]
[8]. X. Yu, Y. Li, W. Ge, Q. Yang, N. Zhu, K. Kalantar-zadeh, Nanotechnology, 17, 808, (2006). [ Links ]
[9]. S. Berger, A. Ghicov, Y. C. Nah, P. Schmuki, Langmuir, 25, 4841, (2009). [ Links ]
[10]. O. K. Varghese, D. Gong, M. Paulose, K. G. Ong, C. A. Grimes, Sensor Actuat. B:Chem, 93, 338, (2003). [ Links ]
[11]. A. Heller, in : Photocatalytic Purification and Treatment of Water and Air, D.F. Ollis, H. Al-Ekabi, Eds. Elsevier, Amsterdam, NL, 139, (1993). [ Links ]
[12]. S. Licht, B. Wang, S. Mukerji, T. S 17. S. Licht, B. Wang, S. Mukerji, T. Soga, M. Umeno, H. Tributsch, J. Phys. Chem. B, 104, 8920, (2000). [ Links ]
[13]. G. K. Mor, O. K. Varghese, M. Paulose, K. Shankar, C. A. Grimes, Sol. Energy Mater. Sol. Cells, 90, 2011, (2006). [ Links ]
[14]. V. Zwilling, E. Darque-Ceretti, A. Boutry-Forveille, D. David, M. Y. Perrin, M. Aucouturier, Surf. Interface Anal., 27, 629, (1999). [ Links ]
[15]. R. Ge, W. Fu., H.Yang, Y. Zhang, W. Zhao, et al., Mater. Lett., 62, 2688, (2008). [ Links ]
[16]. M. O. Concha Guzmán, A.G. Reynaud Morales, C. Cuevas Arteaga, M. E. Rincón González, Superficies y Vacío, 23(S), 183, (2010). [ Links ]
[17]. S. Bauer, S. Kleber, P.Schmuki, Electrochem. Commun., 8, 1321, (2006). [ Links ]
[18]. P. Schmuki, H. Tsuchiya, L. V. Taveira, L. F. P. Dick, J. M. Macak, Self-organized porous titanium oxide nanotubes, in: P. Schmuki, D.J. Lockwood, H.S. Isaacs, Y. Ogata, M. Seo (Eds.), Proceedings of the Symposium "Pits and Pores, Formation, Properties and Significance for Advanced Materials", PV of ECS Hawaii Meeting, The Electrochemical Society, (2004). [ Links ]
[19]. R. Beranek, H. Hildebrand, P. Schmuki, Electrochem. Solid-State Lett., 6, B12, (2003). [ Links ]
[20]. L. V. Taveira, J. M. Macak, H. Tsuchiya, L. F. P. Dick, P. Schmuki, J. Electrochem. Soc., 152, B405, (2005). [ Links ]
[21]. J. M. Macak, H. Tsuchiya, A. Ghicov, K. Yasuda, R. Hahn, S. Bauer, P. Schmuki, Curr. Opin. Solid State Mater. Sci., 11, 3, (2007). [ Links ]
1 La generación de gas hidrógeno en los dispositivos fotoelectroquímicos de este tipo tiene lugar en el contraelectrodo o cátodo, usualmente de platino. El fotoánodo de TiO2, al ser un semiconductor tipo n funge como absorbedor de fotones y separador de cargas, en él, los huecos generados son transportados al agua, oxidándola y generando gas oxígeno en la superficie del mismo.














