Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Superficies y vacío
versión impresa ISSN 1665-3521
Superf. vacío vol.26 no.2 Ciudad de México jun. 2013
Reducción química de NiO-8YSZ para la obtención de Cermets Ni-8YSZ útiles como ánodos en celdas de combustible de óxido sólido
Samperio-Gómez I.L.1*, Bolarín-Miró A.M.1**, Sánchez-De Jesús F.1, Cortés-Escobedo C.A.2
1 Área Académica de Ciencias de la Tierra y Materiales, Universidad Autónoma del Estado de Hidalgo, Carr. Pachuca-Tulancingo Km 4.5, Pachuca 42184, Hidalgo, México. * ivanlowy21@gmail.com,** anabolarin@msn.com
2 Centro de Investigación e Innovación Tecnológica, Instituto Politécnico Nacional, Cda. Cecati S/N, Col. Sta. Catarina, C.P. 02250, Azcapotzalco, México D.F., México.
Recibido: 7 de febrero de 2013
Aceptado: 2 de mayo de 2013
Resumen
En este trabajo se realizó un estudio termodinámico sobre las condiciones de procesamiento y tratamiento térmico de reducción química necesarias para obtener un cermet que sea útil como ánodo en las celdas de combustible de óxido sólido (CCOS). Se fabricaron compactos de mezcla de polvos de NiO y 8YSZ, modificando la relación en peso de los componentes: 30, 50 y 70 % en peso de NiO. Las presiones de compactación se variaron desde 400 hasta 1000 MPa. Posteriormente se llevó a cabo la reducción del NiO a Ni metálico en atmósfera de hidrógeno (H2) a una temperatura de 1100 °C durante 2 h en un horno de tubo. La densidad y porosidad de los compactos se determinó mediante el método de Arquímedes. Empleando microscopía electrónica de barrido se obtuvieron cualitativamente la porosidad y la morfología de los compactos así como la presencia y distribuición del Ni metálico en el cermet. Los resultados muestran las condiciones para obtener cermets de Ni-8YSZ con propiedades adecuadas para su aplicación como ánodos en celdas de combustible de óxidos sólidos.
Palabras clave: Reducción química; Ni-YSZ; Ánodo; Cermets.
Abstract
In this work a thermodynamic study about the heat treatment processing conditions and chemical reduction in order to obtain useful cermets as anode in Solid Oxide Fuel Cells (SOFC) were performed. Compacts of a mixture of NiO and 8YSZ, modifying the weight of the components: 30, 50 and 70% in weight of NiO, were made. Compaction pressures were varied from 400 to 1000 MPa. Cermet formation took place subsequently reducing NiO to metallic Ni under hydrogen atmosphere (H2) at 1100 °C for 2 h in a tube furnace. The density and porosity of the compact were determined by applying Archimedes method. By means of scanning electron microscopy were obtained the porosity and the morphology qualitatively, as well as the presence and homogeneity of the metallic Ni cermets. The results show that Ni-8YSZ cermets can be obtained in the experimental conditions tested, which should be analyzed for use as anodes in fuel cells.
Keywords: Chemical reduction; Anode; Ni-YSZ; Cermets.
1. Introducción
Las celdas de combustible de óxido sólido (CCOS) son dispositivos electroquímicos que permiten generar corriente eléctrica a partir de la energía de una reacción química [1]. Estas se destacan porque también pueden emplear hidrocarburos como combustible en lugar de H2 principalmente CH4 [2]. El ánodo es la parte de la pila que está en contacto con el combustible y debe ser un material poroso a la vez que conductor eléctrico en el cual el H2 y/o el CO se oxiden por el oxígeno transportado electroquímicamente a través del electrolito. De acuerdo con diversas investigaciones [3-5], tanto por sus propiedades de reformación de hidrógeno, como de adsorción del mismo, el níquel es el elemento utilizado más ampliamente.
Dada la dificultad de procesamiento de mezclas de polvos de Ni y YSZ [6], se han desarrollado diversos métodos para la obtención de cermets Ni-YSZ [7], así pues se han obtenido por el método de combustión de geles [8], aplicando un recubrimiento electrolítico de polvos cerámicos [9], obteniendo el recubrimiento por precipitación química [10] y co-precipitación [11], todos seguidos de una sinterización en estado sólido, aunque, comúnmente, se utiliza molienda mecánica de los óxidos precursores para obtener NiO-8YSZ, para, posteriormente, reducirlo con un agente como el H2 o mezclas de CO/CO2 [12,13-14], obteniendo el cermet Ni-8YSZ [12, 15]. Además, el Ni es estable en contacto con la 8YSZ y aunque el NiO se disuelve en pequeña cantidad, no se han reportado efectos negativos en la reacción electroquímica de oxidación. Uno de los problemas de este material es su alto coeficiente de expansión térmica respecto a la 8YSZ. Por esta razón, se emplea NiO, con un coeficiente de expansión similar al de la YSZ y posteriormente se somete a un proceso de reducción química para la obtención del cermet. Adicionalmente, se debe emplear zirconia (ZrO2) estabilizada con Ytria (Y2O3) al 8% en peso (8YSZ) debido a que con este porcentaje queda estabilizada la fase cúbica de la zirconia, mucho más adecuada para este tipo de aplicaciones [16].
El objetivo de este trabajo es establecer las condiciones teóricas de reducción química del NiO, para obtener cermets Ni-8YSZ (con diferentes porcentajes en peso); posteriormente obtener y caracterizar estos compuestos experimentalmente, para su posible aplicación como ánodos en celdas de combustible.
2. Desarrollo Experimental
Con el fin de establecer las condiciones experimentales, se realizó un análisis teórico del proceso de reducción, empleando el software HSC Chemistry 6® [17], el cual permitió establecer las condiciones de reducción del óxido de níquel sin afectar al 8YSZ. Además, se determinó la energía libre de Gibbs para temperaturas entre 100 y 1000 °C, con el fin de conocer la espontaneidad de las probables reacciones secundarias, tales como la reducción de la YSZ y formación de hidróxidos de zirconio.
Paralelamente, mezclas de polvos de NiO (Sigma-Aldrich, con pureza del 99.9%) y 8YSZ (Sigma-Aldrich, con una pureza 99.9%) en proporciones 7:3, 1:1 y 3:7 en peso, respectivamente, se compactaron uniaxialmente en una prensa hidráulica, modificando la presión de compactación (400, 600, 800 y 1000 MPa.). Los compactos obtenidos fueron reducidos en atmósfera de hidrógeno (99.99% de pureza), en un horno de tubo (Marca Barnstead-Thermolyne 21100) a una temperatura de 1100 °C durante un tiempo de 2 horas, con un caudal fijo de 50 ml normales/min y empleando una rampa de calentamiento y enfriamiento de 10 °C/min., para promover la reducción del NiO. La técnica de difracción de rayos X (DRX) se utilizó para la caracterización estructural de los cermets, utilizando un equipo de la marca Philips modelo X-Pert. Los difractogramas fueron obtenidos bajos las condiciones del ángulo de 2θ en el intervalo desde 20 hasta 90°, con un incremento de 0.02 (2θ), empleando una lámpara de radiación de Cu-Κα (λ=1.5418 Å). El análisis morfológico de las partículas se llevó a cabo en un microscopio electrónico de barrido (MEB) de la marca JEOL 1300, los análisis fueron hechos a 30 KV a una distancia de trabajo de 39 mm y aumentos de 2500 y 5000X. Se obtuvieron espectros de dispersión de energía (EDS) para conocer la composición química de la muestra y determinar si fue posible la reducción de NiO a Ni metálico.
3. Resultados y Discusión
Para determinar la temperatura a la cual se debe efectuar la reducción del óxido de níquel para obtener níquel metálico, se utilizó el software de simulación HSC Chemistry 6®, con el cual se realizó la simulación de las reacciones químicas. Con este software se llevaron a cabo los cálculos de la factibilidad de las posibles reacciones que se pueden llevar a cabo durante proceso de reducción de las pastillas o compactos obtenidas de NiO-8YSZ. Esto se observa en el diagrama mostrado en la figura 1. Dado que pueden existir reacciones secundarias asociadas con la presencia de hidrógeno y con la energía suministrada al sistema, se realizó un estudio termodinámico de las posibles reacciones, que se muestran a continuación:
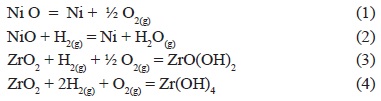
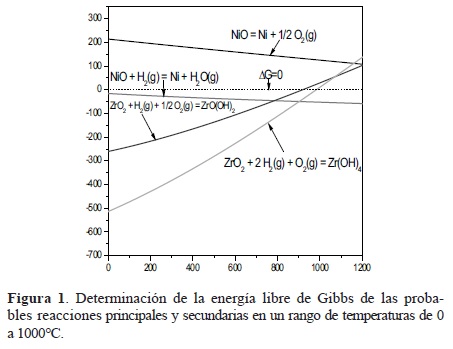
Para determinar la factibilidad de estas reacciones, se realizó el cálculo de la variación de la energía libre de Gibbs con respecto a la temperatura desde 0 hasta 1200°C. Este cálculo se muestra en la Figura 1. En esta figura se puede observar que la reacción (1) tiene una ΔG positiva en todas las temperaturas, por lo que la reacción en ese sentido no es favorable termodinámicamente.
Sin embargo, al realizar el cálculo para la reacción de reducción del óxido de níquel en presencia de hidrógeno (2), se observa que en todas las temperaturas la ΔG es negativa, por lo que, termodinámicamente es factible que la reducción pueda efectuarse en cualquier rango de temperatura, aunque deben considerarse también factores cinéticos.
Otras reacciones que podrían repercutir negativamente en la reducción del NiO, son las de la zirconia con el hidrógeno de acuerdo con las reacciones (3) ó (4), para la formación de hidróxidos de zirconio, para lo que se requeriría cierta presión de oxígeno. Una vez más, se determinó la espontaneidad de dichas reacciones en diferentes temperaturas y el resultado de los cálculos también se muestra en la Figura 1. Aquí se puede observar que la ΔG es negativa hasta temperaturas inferiores a 900°C y 1000°C para las reacciones (3) y (4), respectivamente, por lo que podrían darse estas reacciones en el rango de temperaturas de trabajo, si se tiene una relación molar de por lo menos 2:2:1 de ZrO2:H2:O2.
De acuerdo con lo anterior, las condiciones apropiadas de tratamiento para la reducción del óxido de níquel en presencia de hidrógeno serán a temperaturas mayores a 1000°C, por ejemplo 1100°C para reducir de un modo selectivo al NiO → Ni0. Además, se debe usar una atmósfera de hidrógeno, con una presión parcial de oxígeno mínima, de esta forma podrá obtenerse el cermet Ni-YSZ a partir de NiO.YSZ.
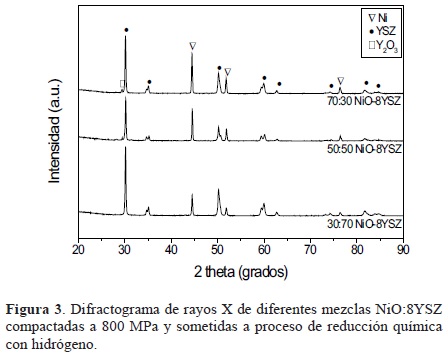
Paralelamente a la determinación de las condiciones termodinámicas de tratamiento térmico de reducción, se obtuvieron compactos en verde de mezclas de los óxidos de partida, modificando las proporciones de óxidos, los cuales se sometieron posteriormente a un proceso de reducción química en atmósfera de hidrógeno y bajo las condiciones de reducción extraídas en el análisis termodinámico. En la Figura 2, se presentan los difractogramas de rayos X de los compactos en verde consolidados a 800 MPa (sin sinterizar), se pueden observar las reflexiones correspondientes a cada una de las fases presentes de los materiales de partida, NiO y 8YSZ, pudiéndose apreciar como varía la intensidad relativa de los picos en función del cambio de las proporciones de cada uno de los óxidos. Lo anterior permite confirmar la presencia de los óxidos de partida en los compactos y su proporción relativa. En la Figura 3, se muestran los difractogramas de rayos X de los mismos compactos pero sometidos a un proceso de reducción química. En este caso es posible distinguir que los picos o reflexiones correspondientes al NiO se han desvanecido y han aparecido nuevas reflexiones, correspondientes a la presencia de Ni metálico. Además, ninguno de los difractogramas presenta picos que correspondan a otro tipo de compuesto, lo cual confirma que el proceso de reducción se llevó a cabo.

La Figura 4 muestra una comparación de los difractogramas obtenidos para compactos 50:50 en verde (parte inferior) y los reducidos (parte superior), los cuales confirman que el oxido de níquel se reduce sin afectar la fase cristalina de la zirconia estabilizada (8YSZ). Para esta composición la reducción del NiO es total, dado que no se aprecian los picos correspondientes a esta fase en el compacto reducido. En la Figura 5 se presentan el efecto de la presión de compactación sobre la reducción de los óxidos, a través de los difractogramas de compactos en verde compactados a presiones de 400 y 800 MPa, posteriormente sinterizados (reducidos) a una temperatura de 1100 °C, durante un tiempo de 2 h y en atmósfera de H2. Los difractogramas permiten establecer que, en las condiciones de presión de compactación analizadas, no se produce un efecto negativo sobre la capacidad de reducción del H2 sobre el NiO a consecuencia de un mayor nivel de densificación. Por lo tanto, al incrementar la presión (densidad de los compactos) no se hace más difícil el paso del gas reductor entre la pieza compactada, por lo tanto no disminuye la cantidad de NiO reducido. Lo anterior se evidencia al observar similares reflexiones en los difractogramas, independientemente de la presión de compactación seleccionada.


El aspecto superficial de los compactos se presenta en la Figura 6, donde se muestran micrografías de compactos de mezclas de NiO:8YSZ en proporciones 30:70, 50:50 y 70:30 prensados a 800 MPa y posteriormente reducidos, donde se comprobó mediante EDS la composición a base de Zr, Ni y O, que si se analiza conjuntamente con los resultados de difracción de RX mostrados anteriormente, permite confirmar la presencia de partículas reducidas de níquel metálico, mediante el análisis puntual con EDS sobre dichas partículas. Adicionalmente, las micrografías muestran una distribución homogénea de partículas de níquel por toda la matriz cerámica de 8YSZ.

4. Conclusiones
En este trabajo se obtuvieron las condiciones teóricas y experimentales para la obtención de cermets de Ni-8YSZ a partir de mezclas cerámicas de NiO-8YSZ en proporciones 30:70, 50:50 y 70:30. Las condiciones de reducción seleccionadas fueron: temperatura de 1100 °C durante un tiempo de 2 h y en atmósfera de H2, esto permitió obtener cermets que pueden ser útiles como ánodos en celdas de combustible, independientemente de la composición de la mezcla de cerámicos y de la presión de compactación empleada para su conformado.
Referencias
[1]. M. Morales, J. J. Roa, X. G. Capdevila, M. Segarra, S. Piñol, Boletín de la Sociedad Española de Cerámica y Vidrio, 49, 67, (2010). [ Links ]
[2]. D. G. Lamas, G. E. Lascalea, M. D. Cabezas, R.O. Fuentes, I. O. Fábregas, M. E. Fernández de Rapp, N. E. Walsöe de Reca, S. Larrondo, R. Tejeda, N. Amadeo. Jornadas Sam/Conamet/Simposio material, 13, 1030, (2003). [ Links ]
[3]. J. W. Fergus, R. Hui, X. Li, D. P. Wilkinson, J. Zhang, Solid Oxide Fuel Cells. 1ra. ed. (Boca Raton, Florida, 2009). [ Links ]
[4]. M. Mukhopadhyay, J. Mukhopadhyay, A. D. Sharma, R. N. Basu, International Journal of Hydrogen Energy, 37, 2524, (2012). [ Links ]
[5]. P. Chinda, S. Chanchaona, P. Brault, W. Wechsatol, The European Physical Journal Applied Physics, 54, 23405, (2011). [ Links ]
[6]. H. S. Hong, U. S. Chae, K. M. Park, S. T. Choo, Materials Science Forum, 486-487, 662, (2005). [ Links ]
[7]. N. Bahiyah Baba, W. Waugh, A. M. Davidson, Engineering and Technology, 49, 715, (2009). [ Links ]
[8]. T. S. Lin, D. C. Jian, K. N. Sun, Key Engineering Materials, 437, 336, (2007). [ Links ]
[9]. J. A. Arias, D. Hotza, Revista Latinoamericana de Metales y Materiales, 33, 172, (2012). [ Links ]
[10]. S. D. Kim, H. Moon, S. H.hyun, J. Moon, J. Kim, H. W. Lee, Solid State Ionics, 177, 931, (2006). [ Links ]
[11]. S. Mosch, N. Trofimenko, M. Kusnezoff, T. Betz, M. Kellner, Solid State Ionics, 179, 1606, (2008). [ Links ]
[12]. Y. Lia, Y. Xiea, J. Gongb, Y. Chena, Z. Zhangb, Materials Science and Engineering: B., 86, 119, (2001). [ Links ]
[13]. H. Abe, K. Murata, T. Fukui, W. J. Moon, K. Kaneko, M. Naito, Thin Solid Films, 496, 49, (2006). [ Links ]
[14]. M. Mukhopadhyay, J. Mukhopadhyay, A. Das Sharm, R.N. Basu, Materials science and Engineering B-Advanced Functional Solid-State Materials, 163, 120, (2009). [ Links ]
[15]. T. Talebi, M. H. Sarrafi, M. Haji, B. Raissi, A. Maghsoudipour, International Journal of Hydrogen Energy, 35, 9440, (2010). [ Links ]
[16]. T. Hibino, S. Wang, S. Kakimoto, M. Sano, Solid State Ionics, 127, 89, (2000). [ Links ]
[17]. A. Roine, □ HSC Chemistry. Copyright ©, Outokumpu Research Oy. All rights reserved. (2002). [ Links ]














