Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Superficies y vacío
versão impressa ISSN 1665-3521
Superf. vacío vol.25 no.4 Ciudad de México Dez. 2012
Influencia del tiempo de gelificación sobre las propiedades estructurales, vibracionales y eléctricas del compósito PEG0.2/V2O5
Londoño-Calderón C. L. *, Jurado J. F., Vargas-Hernández C.**
Universidad Nacional de Colombia Sede Manizales, Colombia GTA - Laboratorio de Propiedades Ópticas de los Materiales (POM). *cllonconoc@unal.edu.co, **cvargash@unal.edu.co.
Recibido: 26 de febrero de 2012
Aceptado: 31 de agosto de 2012
Resumen
Se estudiaron las propiedades estructurales, vibracionales y eléctricas de películas V2O5·nH2O y PEG0.2/V2O5 en función del tiempo de gelificación. Las películas fueron sinterizadas por sol-gel mediante la ruta del pentóxido de vanadio sobre sustratos de vidrio previamente tratados. La caracterización se llevo a cabo mediante Difracción de Rayos-X, Espectroscopia Raman y el método de las cuatro puntas convencional de van der Pauw. Los resultados indican que el aumento en el tiempo de gelificación del sol precursor (V2O5.nH2O) incrementa la calidad cristalina, el grado de hidratación, y la concentración de iones V5+ en las películas. En el compósito híbrido (PEG0.2/V2O5) los iones VO2+ actúan como enlazantes entre las cadenas poliméricas haciéndolas más compactas, lo cual facilita la movilidad de los portadores de carga eléctrica entre los iones vanadios. Los resultados mostraron una transición de fase semiconductor-metal alrededor de 34°C, una transición óptica del tipo indirecta (para V2O5·nH2O) y una transición vítrea alrededor de Tg=-69°C.
Palabras clave: PEG; V2O5·nH2O; Materiales Híbridos; Raman.
Abstract
Structural, vibrational and electrical properties of V2O5·nH2O and PEG0.2/V2O5 films as a function of gelation time were studied. The films were sintered by sol-gel using vanadium pentoxide route on glass substrates previously treated. Films were characterized by X-Ray Diffraction, Raman Spectroscopy and the four-point van der Pauw conventional method. The results indicated that when the gelation time of the precursor (V2O5·nH2O) is increased, the crystalline quality, the degree of hydration, and V5+ ion concentration are increased. In the hybrid composite (PEG02/V2O5), VO2+ ions act as bonding between the polymer chains, making them more compact to facilitate the mobility of electric charge carriers between vanadium ions. The results showed a semiconductor-metal transition about 34°C, an indirect optical transition (V2O5·nH2O) and a vitreous transition around Tg=-69°C.
Keywords: PEG; V2O5·nH2O; Hybrid Materials; Raman.
1. Introducción
Recientes avances tecnológicos y el deseo de obtener dispositivos más funcionales han generado una enorme demanda de nuevos materiales. Muchas de las propiedades de los metales, cerámicos o plásticos son bien conocidas, sin embargo, dichos materiales no pueden satisfacer todas las necesidades tecnológicas para la gran cantidad de nuevas aplicaciones. En la actualidad existe un gran interés por parte de Científicos e Ingenieros en mezclas de materiales que pueden mostrar propiedades superiores comparadas con las fases puras [1]. Una prueba de este hecho se evidencia en la gran atención suscitada en décadas pasadas, para la síntesis por sol-gel de óxidos de metales de transición, la cual se caracteriza por aplicaciones del proceso que deriva de las diferentes formas especiales obtenidas directamente del estado del gel, combinadas con el control de composición, microestructura y bajas temperaturas de procesamiento, generando una amplia gama de aplicaciones, como por ejemplo, formación de fases en forma de matriz, fases reforzadas, compósitos cerámico-cerámico, orgánico-inorgánico y cerámico-metal [2]. Las simples condiciones asociadas con la química del sol-gel permiten la síntesis de materiales híbridos en los cuales moléculas orgánicas o biológicas están encapsuladas dentro de una red de óxido, incluso aquellos organismos tales como parásitos protozoos pueden ser atrapados en matrices sol-gel [3]. Inmerso en esta familia de óxidos de metales de transición sinterizados por la metodología de sol-gel, se encuentra el V2O5·nH2O (péntoxido de vanadio hidratado), el cual posee una estructura cristalina del tipo monoclínica laminar [4] cuya distancia basal depende fuetemente de la cantidad de agua insertada en el compósito [5]. Debido a estas propiedades sus principales aplicaciones están enfocadas a la obtención de materiales con propiedades óptimas como cátodos para baterías de litio [6], cuyo desempeño se ve altamente favorecido por la presencia del polímero polietilenglicol (PEG) [7], sin embargo pocos estudios de la mezcla entre pentóxido de vanadio (V2O5) y polímeros de la familia de óxidos de etileno (PEG y PEO), sinterizados por el método sol-gel han sido reportados [8] y la mayoría de estas investigaciones han presentado nanocompósitos conductores iónicos/electrónicos, en los cuales la adición del componente polimérico incrementa el espaciamiento entre planos basales del V2O5 sugiriendo una intercalación del tipo interlaminar [9].
En este trabajo se reportan los resultados de la caracterización (estructural, vibracional, óptica, eléctrica y térmica) del material híbrido PEG0.2/V2O5, obtenido por disolución directa del precursor polimérico sobre el sol de pentóxido de vanadio hidratado, utilizando para la síntesis la ruta del ácido peroxovanádico.
2. Detalle Experimental
Para la obtención del material compósito híbrido PEG0.2/V2O5, se preparó un sol de V2O5·nH2O, por la metodología previamente reportada [10]. El sol resultante se mantuvo en reposo durante 24 horas, tiempo para el cual se le agregaron 4.55 g del polímero conocido como Poly(ethylene glycol) (PEG), de peso molecular 10000 (suministrado por la casa comercial MERCK, grado analítico), obteniendo una razón molar de 1 mol de pentóxido de vanadio por 0.2 moles del compuesto polimérico. Para permitir una mezcla homogénea de las fases; cada 48 horas se sometió la solución a agitación magnética durante 3 horas. Los sustratos de vidrio empleados fueron previamente tratados e introducidos lentamente sobre el sol obtenido en el proceso anterior y de esta forma lograr el crecimiento de las películas. Las muestras se dejaron secar a condiciones del ambiente. Mediante este procedimiento se depositaron las películas del compósito PEG0.2/V2O5 para tiempos de gelificación de 1, 3, 5, 7, 9 y 11 días. Las películas obtenidas los días 1, 3 y 5 no resultaron óptimas debido a la inhomogeneidad y pobre calidad cristalina. En este trabajo se utilizaron las muestras crecidas en tiempos de gelificación de 9 y 11 días, debido a su calidad cristalina, ordenamiento vibracional y respuesta eléctrica.
Las muestras fueron caracterizadas mediante Difracción de Rayos-x (DRX) con un equipo Buker AXS Advance A8 provisto de una fuente de radiación monocromática Cu-Ka, en un rango de medición comprendido entre 5° < 2θ < 50° con un paso de 0.02° por segundo; y vibracionalmente por medio de Espectroscopía Raman (ER) con un sistema LabRam HR800 Jobin Yvon Horiba de alta resolución que tiene una fuente láser de 473nm, potencia de 5.5mW y un área de medición de 2mm, los espectros fueron obtenidos en la región entre 100 y 3000 cm-1. El análisis óptico se realizó por Espectrofotometría UV-Visible (E-UV) con un sistema Perkin-Elmer de doble rayo en la región espectral de 400 a 800 nm. Todas estas medidas fueron realizadas a condiciones de medio ambiente. Para evaluar las propiedades térmicas se empleó Calorimetría Diferencial de Barrido (CDB), con un equipo Q100 TA Instruments, una sensibilidad de 0.2µW, en un rango de temperaturas entre -90 y 80°C, a una velocidad de 10°C/min y en presencia de una atmósfera de nitrógeno con flujo controlado. La Resistencia eléctrica en función de la temperatura fue obtenida empleando el método de las cuatro puntas convencional de Van der Paw, en el cual se utilizaron contactos de plata sobre la periferia de la muestra, haciendo circular una corriente eléctrica por dos de ellos y midiendo la diferencia de potencial entre los otros dos. Para las medidas del polímero precursor, se preparo una pastilla de PEG usando una prensa hidráulica marca Perkin Elmer a una fuerza de 40kN durante dos minutos. Las medidas fueron realizadas para regiones de temperatura comprendidas entre 0 a 200 °C y a dos presiones (10-4 mbar y atmosférica).
3. Resultados y Discusión
3.1. Difracción de Rayos-X
Los difractogramas DRX para las películas obtenidas a partir del sol-precursor (V2O5·nH2O), presentan un patrón característico asociado al pentóxido de vanadio hidratado (reflexiones (001)) (ver figura 1-i), que sugiere la presencia de nanocristales altamente orientados [11]. El aumento en la distancia interplanar (d001) indica una intercalación de agua entre las laminas V-O en el compósito hidratado (V2O5·nH2O) [12,13]. Los valores obtenidos del espaciamiento interplanar correspondiente al plano (001) fueron 13.26 y 13.46 Å, sugiriendo que aproximadamente una mol de agua ha sido intercalada en la estructura [5]. Los tamaños promedio de los cristales para los días 9 y 11 fueron de 49 ± 3 y 39 ± 6 Å, respectivamente. Estos fueron obtenidos mediante el uso de la formula de Scherrer [14]. Este resultado indica que con el aumento del grado de hidratación de la película la distancia interplanar se incrementa para solubilidades de un mol de agua. Los resultados de DRX (ver figura 1-ii) de las películas de PEG0.2/V2O5 mostraron los picos correspondientes del Poly(ethylene glycol) [15], con dos principales ubicados en 19.2 y 23.3°. Estos son usados como picos de control para el análisis de la cristalinidad de las películas sinterizadas. En la Tabla 1 se presentan las distancias interplanares y los tamaños promedio de los cristales en las diferentes muestras.


Se observa como la distancia interplanar disminuye con el tiempo de gelificación de la sustancia precursora para los picos principales de difracción, sugiriendo que las cadenas de V2O5 en el sol, pueden estar actuando como ligantes en el proceso de polimerización orgánica que producen celdas más compactas en el cristal. En éste son importantes los iones VO2+ que son responsables de la formación del V2O5 [16]. Por otro lado, el tamaño de los cristales obtenidos en los compósitos, son mayores que aquellos del precursor polimérico en polvo, sugiriendo un mejoramiento en la calidad cristalina de las películas de PEG0.2/V2O5.
El cambio en la orientación preferencial de crecimiento de las películas del compósito con respecto al polímero precursor PEG, sugiere un favorecimiento en el crecimiento de aquellos orientados en 19.2° (2θ), debido probablemente a que estos presentan una menor relación densidad de energía-esfuerzo [17]. Para la película crecida el día 11 posterior a la reacción entre los precursores, se observa la presencia de 2 nuevos picos (14.12 y 17.08°) aun sin identificar.
3.2 Espectroscopia Raman
Los espectros Raman obtenidos para las películas de V2O5·nH2O (ver figura 2-i) son muy similares a aquellos reportados para el α-V2O5 [18], adicionalmente se evidencia la presencia de una fase con un alto esfuerzo compresivo a lo largo de las direcciones cristalográficas a-b [19], con modos vibracionales asignados al pentóxido de vanadio en fase amorfa (837 y 875cm-1) [18]. Para la película de V2O5·nH2O crecida el día 11 posterior a la reacción de los precursores se observan los modos vibracionales asociados al V5+=O (1025cm-1) y V4+=O (925cm-1), los cuales junto al modo vibracional respectivo del oxígeno vanadil (V=O) pueden ser usados para hallar una aproximación de la razón de reducción (e = V4+/(V5++V4+)) del compósito [5]. Los valores hallados para 'e' a partir del porcentaje de intensidad relativa (I/I0) de los espectros Raman para las bandas ubicadas en 1025 y 925cm-1, fueron de 32.08 y 18.83% para las películas crecida los días 9 y 11, respectivamente. Los porcentajes de reducción y las distancias interplanares obtenidos por Raman y DRX sugieren un aumento en la concentración de iones vanadio V5+ con el incremento en el tiempo de gelificación de la solución precursora. Este comportamiento se puede asociar con el decrecimiento en las vacancias de oxígeno producidas por el aumento del grado de hidratación de las películas.

Los espectros Raman a temperatura ambiente para los compósitos PEG0.2/V2O5 son mostrados en la figura 2-ii. Se identifican los modos normales de vibración del poly(ethylene glycol) PEG en: 278, 362, 535, 852, 867, 1071, 1133, 1149, 1238, 1288, 1403, 1455, 1487, 2861, 2900 y 2953cm-1 (ver figura 3) [20,21]. Los modos normales de vibración del compósito polimérico en la región comprendida entre 200 < k < 600 cm-1 presentan un ligero corrimiento hacia regiones espectrales de altas energía con respecto al precursor PEG puro, mientras que el resto de modos exhiben un pequeño corrimiento hacia regiones de menor energía. Adicional a esto, en los espectros Raman del compósito se observan aquellos modos vibracionales correspondientes al oxígeno vanadil (V=O) ubicados en 283 cm-1 para vibraciones de flexión, 926 cm-1 para enlaces del tipo V4+=O y 1034 cm-1 asignado a vibraciones de las moléculas V5+=O. Las vibraciones asociadas con V4+=O y V5+=O, presentan grandes corrimientos (≈10 cm-1) respecto al precursor V2O5·nH2O, indicando que la presencia de las cadenas de PEG, modifica considerablemente la distancia entre enlaces V=O.
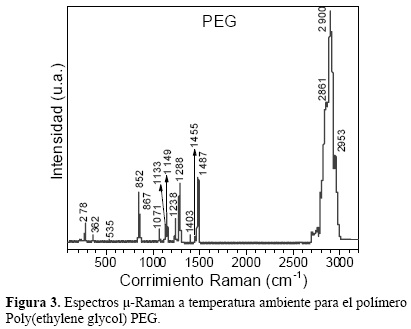
Para las películas PEG0.2/V2O5 se aprecia la aparición de una banda ubicada en 175 cm-1, la cual sugiere la existencia de una estructura laminar para el V2O5 fuertemente tensionada compresivamente a lo largo de los planos cristalográficos a-b [19]. También presentaron una alta sensibilidad a la potencia del láser incidente utilizado en las mediciones Raman (<40 mW), siendo necesario controlar el tiempo de exposición en cada muestra, tal como se ilustra en la figura 4.

3.3. Espectofotometria UV-Visible
Las películas de V2O5·nH2O depositadas con tiempo de gelificación de 9 días (ver figura 5-i-a), presentan espectros de transmitancia óptica típicos para materiales semiconductores, con una transición óptica indirecta [11], los cálculos indican un valor de Eg alrededor de 1.8 eV. Las películas de V2O5.nH2O crecidas el día 11 (figura 5-i-b) evidencian una absorbancia muy alta debido a su gran espesor (tabla 2), al igual que aquellas obtenidas con la mezcla del polímero (PEG0.2/V2O5), tal como se muestra en la figura 5-ii, lo cual dificulta la ubicación de la región lineal sobre la cual se realiza la extrapolación para la obtención de la energía del gap.


3.4. Caracterización Eléctrica
Las películas de V2O5·nH2O obtenidas los días 9 y 11 respectivamente, presentan en el rango de medición un comportamiento tipo semiconductor para la resistencia eléctrica en función de la temperatura (ver figura 6-i), el cual es explicado por el modelo del pequeño polarón [5,22]. De la gráfica se observa una disminución de la resistencia eléctrica con el aumento del tiempo de gelificación de las muestras, que puede estar asociado al mejoramiento en la calidad cristalina de las películas, al aumento en el grado de hidratación del gel, que aumenta la concentración de iones V5+ (según los resultados DRX y Raman) y favorecen la movilidad de los portadores de carga.

En régimen no adiabático, la conductividad es dada por:

En la figura 6-iii se muestra la grafica de ln(ρT-3/2) en función de T-1, para temperaturas por encima de 370 K el modelo del pequeño polaron es aplicable. Para altas y bajas temperaturas las energías de activación W obtenidas de la pendiente de la curva son: W=0.41 y 0.25 eV. La comparación entre las energías de activación para temperaturas por encima y por debajo de 370 K, es aproximadamente igual al valor de la energía necesaria para ionizar los defectos localizados. Los resultados anteriores sugiere un valor aproximado de 0.15 eV para esta energía de ionización. La energía de transición entre polarones libres y enlazados se incrementa desde 0.15 hasta 0.2 eV para los días 9 y 11 respectivamente, tales resultados pueden ser explicados por: el aumento en el grado de hidratación de las películas y los tiempos de gelificación del sol precursor que disminuye la presencia de vacancias de oxígeno, que son los lugares donde los polarones enlazados son formados [22]. En la figura 6-ii, se muestra la curva característica de resistividad eléctrica en función de la temperatura para el polímero precursor PEG en polvo, donde se observa un comportamiento metálico, que puede ser explicado por la movilidad adquirida por las cadenas poliméricas con el aumento en la temperatura, hecho que además dificulta la difusión de los pocos portadores de carga electrónica.
Las propiedades eléctricas de las películas del compósito (PEG0.2/V2O5) obtenidas se evaluaron en el rango de temperaturas comprendidas entre 12 y 45°C, debido a la alta sensibilidad de la muestras con la humedad relativa del medio ambiente y a la temperatura de fusión del compósito (63,3°C). Estas películas presentan una transición de fase eléctrica de semiconductor a metal. El comportamiento metálico está bien explicado por la presencia de las cadenas poliméricas cuyo efecto es absolutamente predominante para la región de altas temperaturas, mientras que el comportamiento semiconductor es debido a la presencia de iones vanadio, especialmente aquellos correspondiente a V4+ y V5+, cuyo salto de electrones sobre estados localizados genera pequeños polarones, tal efecto es más predominante sobre una red polimérica aproximadamente estática (bajas temperaturas).
3.5. Calorimetría Diferencial de Barrido (CDB)
Los termogramas de CDB del compósito PEG0.2/V2O5 (ver figura 7) presentan la transición vítrea alrededor de Tg=-69°C, que es característica del polímero precursor PEG lo cual corrobora la naturaleza semicristalina del compósito. Adicional a esto; aparecen los siguientes picos: uno exotérmico debido a la temperatura de cristalización en Tc=-46,0°C; uno endotérmico asociado a la temperatura asociado al H2O y uno asignado a la temperatura de fusión del Polyethyleneglycol en Tm=62,2°C.

4. Conclusiones
Se estudio la influencia del tiempo de gelificación sobre las propiedades físicas de los compósitos V2O5·nH2O y PEG0.2/V2O5. Para las muestras de V2O5.nH2O los resultados indicaron la presencia de nanocristales altamente orientados con modos vibracionales propios del pentóxido de vanadio, una energía de brecha prohibida del tipo indirecta y un comportamiento eléctrico que se explica por el modelo del pequeño polarón. El aumento en el tiempo de gelificación de las películas de V2O5·nH2O incrementa la concentración de iones V5+ y la movilidad de los portadores de carga en las películas.
Para las películas PEG0.2/V2O5·nH2O, el aumento en el tiempo de gelificación del sol precursor incrementa la calidad cristalina de las películas debido a que los iones VO2+ probablemente sirvan de enlazantes entre cadenas poliméricas que benefician la cristalización del componente orgánico produciendo celdas más compactas que facilitan el transporte de carga entre los iones vanadios. Las películas de PEG0.2/V2O5·nH2O presentaron una transición de fase semiconductor-metal alrededor de 34°C, una transición óptica del tipo indirecta (asociada V2O5-nH2O) y una transición vítrea alrededor de Tg=-69°C.
Agradecimientos
A los Laboratorios de la Universidad Nacional de Colombia sede Manizales por las siguientes mediciones: Física del Plasma (Difracción de rayos-X (DRX), Materiales Nano-estructurados y Funcionales (Espectroscopia UV-Visible), Magnetismo y Materiales Avanzados (Calorimetría Diferencial de Barrido (CDB)
Referencias
[1] G. Kickelbick, editor. Hybrid Materials Synthesis, Characterization and Applications. Wiley-VCH Verlag GmbH & Co. KGaA (Weinheim, 2007). [ Links ]
[2] C. J. Brinker and G. W. Scherer. Sol-Gel Science. The Physics and Chemistry of Sol-Gel Processing. Academic Press Limited (Boston San Diego New York London Sydney Tokyo Toronto, 1990). [ Links ]
[3] J. Livage, F. Beteille, C. Roux, M. Chatry, and P. Davidson. Acta Materialia. 46, 743 (1998). [ Links ]
[4] V. Petkov, N. P. N. Trikalitis, E.S. Bozin, S.J.L. Billinge, T. Vogt and M. G. Kanatzidis. J. AM. CHEM. SOC. 124, 10157 (2002). [ Links ]
[5] J. Livage. Chem. Mater. 3, 578(1991). [ Links ]
[6] I. Stojkovic, N. Cvjeticanin, S. Markovic, M. Mitric and S. Mentus. Acta Physica Polonica A. 117, 837 (2010). [ Links ]
[7] P. P. Prosini, T. Fujieda, S. Passerini, M. Shikano and T. Sakai. Electrochemistry Communications. 2, 44 (2000). [ Links ]
[8] Y. -J. Liu, D. C. DeGroot, J.L. Schindler, C. R. Kannewurf and M. G. Kanatzidis. Chem. Mater. 3, 992 (1991). [ Links ]
[9] Y.-J. Liu, J. L. Schindler, D. C. DeGroot, C. R. Kannewurf, W. Hirpo and M. G. Kanatzidis. Chem. Mater. 8, 525 (1996). [ Links ]
[10] C. L. Londoño-Calderón, C. Vargas-Hernández and J. F. Jurado. Revista Mexicana de Física. 56, 411 (2010). [ Links ]
[11] M. S. Al-Assiri, M.M. El-Desoky, A. Alyamani, A. Al-Hajry, A. Al-Mogeeth and A. A. Bahgat. Optics & Laser Technology. 42, 994(2010). [ Links ]
[12] A. S. Sonin. J. Mater. Chem. 8, 2557 (1998). [ Links ]
[13] A. A. Bahgat, A. Al-Hajry and M.M. El-Desoky. Phys. Stat. Sol. A. 203, 1999 (2006). [ Links ]
[14] B. D. Cullity. Elements of x-ray diffraction. Addison-Wesley Publishing Company, Inc, Massachusetts, 1956. [ Links ]
[15] R. Nair, S. Gonen and S.W.Hoag. International Journal of Pharmaceutics. 240, 11 (2002). [ Links ]
[16] C. J. Fontenot. Investigation of the peroxovanadate sol-gel process and characterization of the gels. PhD Thesis (Iowa State University, 2001). [ Links ]
[17] V. V. Atuchin, B.M. Ayupov, V.A. Kochubey, L.D. Pokrovsky, C.V.Ramana and Y.M.Rumiantsev. Optical Materials. 30, 1145 (2008). [ Links ]
[18] S.-H. Lee, H.M. Cheong, M.J. Seong, P. Liu, C.E. Tracy, A. Mascarenhas, J.R. Pitts and S.K. Deb. Solid State Ionics. 165, 111 (2003). [ Links ]
[19] E. Cazzanelli, G. Mariotto, S. Passerini, and W. H. Smyrl. J. Non-cryst. Solids. 208, 89 (1996). [ Links ]
[20] T. Mihara and N. Koide. Molecular Crystals and Liquid Crystals. 367, 605 (2001). [ Links ]
[21] Z. V. Feng, X. Li, and A. A. Gewirth. J. Phys. Chem. B. 107, 9415 (2003). [ Links ]
[22] C. Sanchez, M. Henry, J. C. Grenet, And J. Livage. J. Phys. C: Solid State Physics, 15, 7133 (1982). [ Links ]














