Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Superficies y vacío
versão impressa ISSN 1665-3521
Superf. vacío vol.25 no.3 Ciudad de México Set. 2012
Nanopartículas de Ni/NiO y Cu-Ag obtenidas mediante el método de Pechini: síntesis y caracterización
Puente-Urbina B. A., García-Cerda L. A.*
Centro de Investigación en Química Aplicada Blvd. Enrique Reyna Hermosillo #140, C.P. 25253, Saltillo, Coahuila, México. Correspondencia: lagarcia@ciqa.mx
de León-Quiroz E. L., López-Martínez M. G.
Facultad de Ciencias Químicas, U. A. de CoahuilaBlvd. V. Carranza e Ing. José Cárdenas V. s/n, Saltillo, Coahuila, México.
Recibido: 17 de diciembre de 2011
Aceptado: 12 de abril de 2012
Resumen
En este trabajo se estudia la síntesis y la caracterización de nanopartículas de Ni/NiO y de Cu-Ag obtenidas mediante la ruta de Pechini. Se prepararon geles precursores y se varió la relación molar de ácido cítrico a sales metálicas con el propósito de estudiar su efecto en los materiales obtenidos. Los geles precursores fueron calcinados a temperaturas entre 350 y 450 °C en atmósfera de aire a diferentes tiempos. La caracterización estructural y morfológica se realizó mediante difracción de rayos X (XRD) y microscopía electrónica de barrido (SEM) y de transmisión (TEM). Los resultados de difracción de rayos X mostraron la formación de partículas nanométricas de los diferentes metales, así como sus aleaciones. La obtención de las fases fue controlada mediante la temperatura y el tiempo de calcinación. Mediante microscopía electrónica de transmisión se obtuvieron micrografías que mostraron que en general las partículas obtenidas presentan un tamaño menor a los 50 nm.
Palabras clave: Nanopartículas; Sol gel; Pechini; Cu-Ag; Ni/NiO.
Abstract
In this paper we study the synthesis and characterization of nanoparticles of Ni/NiO and Cu-Ag obtained by Pechini route. Gel precursors were prepared and the molar ratio of citric acid to metal salts was varied in order to study its effect on the obtained materials. The gel precursors were calcined at temperatures between 350 and 450 ° C in air for different times. The structural and morphological characterization was performed by X-ray diffraction (XRD) and transmission electron microscopy (TEM). The results of X-ray diffraction showed the formation of nanoparticles of different metals and its alloys. The obtained phases were controlled by temperature and time of calcination. Transmission electron microscopy micrographs showed that in general the particles obtained have a size less than 20 nm.
Keywords: Nanoparticles; Sol gel; Pechini; Cu-Ag; Ni/NiO.
1. Introducción
Las nanopartículas son agregados de entre unos pocos y muchos millones de átomos o moléculas. Estos pueden estar formados de átomos o moléculas iguales, o por dos o más especies diferentes, se pueden estudiar en diferentes medios, tales como en fase vapor, suspensiones coloidales, o aisladas en diferentes matrices o en superficies [1, 2]. El interés en nanopartículas surge, en parte, porque constituyen un nuevo tipo de material que puede tener propiedades distintas de las de átomos y moléculas individuales o material en bulto. Una razón importante de este interés es la evolución de sus propiedades dependiente del tamaño y su estructura [2]. De hecho, tanto la forma geométrica y la estabilidad energética de los grupos puede cambiar drásticamente con el tamaño. Desde el punto de vista de aplicaciones, hay un continuo interés en este tipo de materiales debido a sus aplicaciones potenciales en campos como la catálisis y nanoelectrónica [2].
Por otra parte, la gama de propiedades de sistemas metálicos pueden ampliarse si se mezclan con otros elementos para generar compuestos intermetálicos y/o aleaciones. En muchos casos, hay una mejora en las propiedades específicas de la aleación debido a los efectos sinérgicos y la rica diversidad de composiciones, estructuras y propiedades de las aleaciones metálicas, lo cual da lugar a su aplicación en electrónica, ingeniería y catálisis.
Diferentes métodos han sido utilizados para preparar nanopartículas de Ni/NiO y Cu/Ag, entre los cuales se incluyen reducción térmica [3], molienda [4], reducción coloidal [5] y dendrímeros [6] entre otros. El método de Pechini [7] es una técnica por vía húmeda que tiene varias ventajas sobre otros métodos (mecánico o químico). Este proceso es simple, de bajo costo y muy versátil lo que permite obtener materiales con excelente homogeneidad, control composicional a bajas temperaturas de procesamiento (entre 300 y 600 °C). La idea general de este método es la distribución homogénea de cationes metálicos en una resina precursora polimérica, la cual inhibe su segregación y precipitación dentro del sistema. La posterior calcinación de este precursor resulta en la obtención de nanopartículas homogéneas a baja temperatura.
En este trabajo se reportan los resultados de la preparación y caracterización de nanopartículas de Ni/NiO y Cu-Ag obtenidas por el método de Pechini. Se prepararon materiales precursores por separado con diferentes concentraciones molares de Ni y Cu/Ag. Las nanopartículas se obtuvieron mediante tratamientos de calcinación a temperaturas entre 350 y 600 °C (dependiendo del tipo de nanopartículas). Se estudió la influencia de la concentración molar de los iones metálicos y de la temperatura del tratamiento de calcinación en las propiedades estructurales y morfológicas de los materiales obtenidos. Los materiales obtenidos fueron caracterizados por difracción de rayos-X (XRD), microscopia electrónica de transmisión (TEM) y magnetometría SQUID.
2. Desarrollo experimental
2.1 Preparación de las nanopartículas
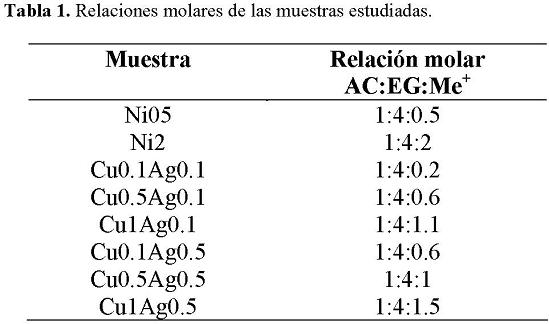
Se prepararon materiales precursores para la obtención de las nanopartículas, para esto se utilizaron diferentes sales metálicas (acetato de níquel, nitrato de plata y nitrato de cobre) en diferentes concentraciones. Se usaron ácido cítrico (AC) y etilenglicol (EG) como agentes quelantes y gelatinizantes respectivamente. La secuencia de preparación fue la siguiente: primeramente la cantidad requerida de ácido cítrico se disolvió en 60 ml de agua destilada, se agregó cada una de sales metálicas (de acuerdo al sistema a preparar) hasta tener una disolución total. Enseguida se añadió la cantidad requerida de etilenglicol y se continuó con la agitación hasta que la solución fue completamente homogénea. La relación molar de ácido cítrico y etilenglicol fue constante de 1:4. La Tabla 1 presenta las diferentes relaciones molares de AC:EG:sales metálicas (Me+) utilizadas para cada solución. Después de obtener las soluciones precursoras, éstas se colocaron en cajas de teflón y se secaron a 130 °C por 24 h, para obtener el material precursor; enseguida se molió el material seco en un mortero de ágata para ser calcinado a diferentes temperaturas, para el caso de nanopartículas de Ni/NiO las temperaturas fueron de 400 y 600 °C por 15 y 60 min; para el sistema Cu-Ag, se utilizó una temperatura de 350 por 60 min.
2.3 Caracterización
La evolución estructural de las muestras en función del tratamiento de calcinación fue estudiada por difracción de rayos X (XRD), usando un difractómetro Siemens D-5000 con una fuente de radicación de CuK�, operado a 25 mA y 35 Kv. Se realizó un barrido de 20 a 80° con pasos de 0.02° en la escala de 2θ. Los porcentajes de fases de las muestras fueron determinadas mediante el ajuste de los picos de difracción usando el software Jade 6 (whole profile fitting) desarrollado por Materials Data, Inc. Se estudió la morfología y el tamaño de las nanopartículas usando un microscopio electrónico de transmisión de alta resolución (HRTEM) FEI TITAN. Para el caso de las nanopartículas de Ni/NiO, se uso magnetometría SQUID para estudiar sus propiedades magnéticas.
El diámetro promedio (D) de las nanopartículas obtenidas fue calculado a partir del ancho medio del pico más intenso de cada una de las fases en los patrones de difracción de acuerdo a la ecuación de Scherrer [8]:

Donde D es el diámetro promedio, λ es la longitud deonda de la radiación del cobre (1.54056 Å), β es el ancho medio del pico de difracción más intenso (en radianes), θ es el ángulo de difracción.
3. Resultados y discusiones
3.1 Nanopartículas de Ni/NiO
Mediante difracción de rayos X, se estudiaron las posibles fases cristalinas que se formaron después del tratamiento de calcinación de los precursores. En la Figura 1 se presentan los espectros de difracción de rayos X de las muestras Ni05 y Ni2, obtenidas a 400 y 600 °C a los tiempos mostrados. De manera general, se observan los picos característicos de Ni/NiO en todas las muestras. En los espectros obtenidos a 400 °C por 15 min se observa la presencia de picos característicos localizados a 44.5, 51.8 y 76.3°, que corresponden a la fase cúbica del Ni metálico, además se observan 4 picos de menor intensidad y anchos localizados a 37.3, 43.3, 62.9, 75.4 y 75.6°, los cuales provienen del NiO, ambas fases identificadas están en concordancia con los estándares obtenido de una base de datos [9, 10]. Cuando la muestra fue obtenida a 600 °C, los picos correspondientes a ambas fases se definen mejor, se vuelven más intensos y más estrechos. En la muestra obtenida a 600 °C por 60 min, la intensidad del pico principal del Ni metálico disminuye su intensidad en comparación con la obtenida a 15 min, esto se debe a la formación del NiO a partir de las nanopartículas de Ni metálico. De acuerdo a la literatura, la formación de la fase metálica en las muestras con el tratamiento de calcinación se debe a que durante éste la fase orgánica (resina polimérica) se descompone y esto provoca que se genere una atmósfera reductora de CO que permite que los cationes metálicos, Ni+2 en este caso, se reduzcan a níquel metálico, como se ha reportado en otros sistemas [11]. Los porcentajes de las fases y el diámetro promedio de partícula tanto para el Ni como NiO se resumen en la Tabla 2. Para el caso de la muestra de Ni2, el comportamiento de los espectros de difracción son similares (resultados no mostrados).

Las nanopartículas de Ni/NiO tienen propiedades magnéticas y estas fueron medidas en un magnetómetro SQUID. En la Figura 2 se presentan las curvas de magnetización para las muestras Ni05 obtenidas a 400 y 600 °C por 15 y 60 min. El comportamiento observado en las muestras corresponde a un material ferromagnético. El valor de la magnetización máxima para las muestras obtenidas a 400 °C se incrementa al aumentar el tiempo del tratamiento. Este incremento se debe a que con el tiempo la fase del níquel metálico esta en mayor proporción como se observa en la Tabla 2, la cual es responsable del comportamiento magnético del sistema ya que el NiO se considera antiferromagnético. Para las muestras obtenidas a 600 °C, sucede lo contrario al incrementarse el tiempo el valor de de magnetización de cada muestra disminuye, debido a que la formación una mayor cantidad de NiO (Tabla 2). Actualmente se están haciendo estudios de las propiedades magnéticas en función de la temperatura para un mejor entendimiento del comportamiento de estos materiales.

Las imágenes de TEM de las nanopartículas de Ni/NiO obtenidas a 400 °C por 60 min se presentan en la Figura 3. De acuerdo con estas imágenes, la muestra está formada por partículas cristalinas, cuya morfología varía de cuasiesféricas hasta elipsoidales y morfologías irregulares. El tamaño de las nanopartículas varía entre 10 y 20 nm, este rango de valores está en concordancia con los resultados mostrados en la Tabla 3 obtenidos a partir de los espectros de difracción de rayos X. La figura 3b presenta una imagen de alta resolución (HRTEM) de las nanopartículas.


3.2 Nanopartículas de Cu-Ag
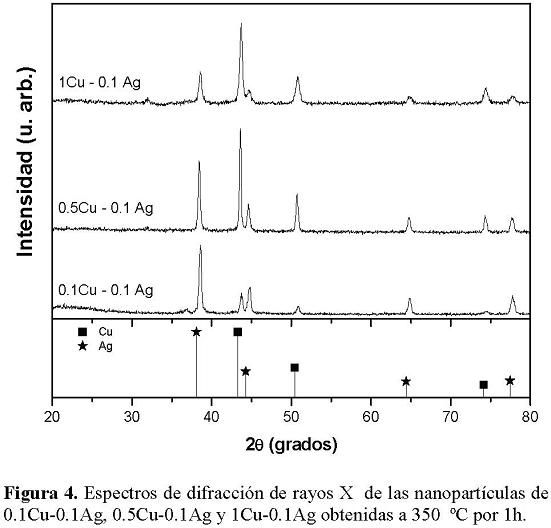
Los patrones de difracción de rayos X de las muestras conteniendo diferentes relaciones molares de Cu-Ag obtenidas a 350 ° C por 1 h se presentan en la Figura 4 y Figura 5. En los patrones correspondientes a las muestras 0.1Cu0.1Ag, 0.5Cu-0.1Ag y 1Cu-0.1Ag (figura 4), se observa la presencia de picos de difracción localizados a 38.2, 44.3, 64.4 y 77.5° que corresponden a la fase de plata con estructura cristalina cúbica centrada en las caras (fcc) y que están en concordancia con el patrón de difracción estándar representado por barras [12]. También hay 2 picos localizados a 43.3, 50.4 y 74.1°, los cuales corresponde a la fase de cobre con estructura fcc de acuerdo al estándar mostrado en la figura [13]. Se observa en los patrones que cuando se tiene una menor cantidad de Cu, el espectro está dominado por la fase de Ag y conforme se incrementa la concentración de Cu, la intensidad del pico correspondiente a la fase metálica de Cu aumenta y los picos de Ag disminuyen en intensidad. Como ya se mencionó anteriormente, la formación de las partículas metálicas se debe a la generación de una atmósfera reductora generada durante la calcinación del material precursor [11]. Al incrementar la cantidad de Ag a 0.5 moles, muestras presentadas en la figura 5. Se observa que solo se presentan las fases de Cu y Ag en todas las muestras, la relación de las intensidades de las fases metálicas de Cu y Ag es diferente. En estas muestras la fase de Ag domina el espectro de difracción en todos los casos, su intensidad siempre es mayor comparada con la del Cu, la intensidad de esta última fase se incrementa con el contenido de este metal. Los porcentajes de cada fase y los valores del diámetro promedio se presentan en la Tabla 3. En la Figura 6 se presentan una imagen de alta resolución (HRTEM) de las partículas de Cu-Ag. Se puede observar que las partículas son cristalinas y tienen una morfología semiesférica con un rango de tamaños entre 10 y 20 nm, los cuales concuerdan con los calculados a partir de los espectros de difracción de rayos X (Tabla 3).


Conclusiones
En este trabajo se prepararon nanopartículas de Ni/NiO y Cu-Ag usando el método de Pechini. Mediante modificaciones en la concentración de iones metálicos y las temperaturas de calcinación es posible controlar el porcentaje de cada una de las fases presentes en cada muestra. Los estudios con HRTEM, mostraron que es posible obtener partículas con una morfología semiesférica y con un tamaño entre los 15 y 50 nm (dependiendo del sistema). Mediante la ruta de síntesis propuesta es posible preparar materiales compuestos por nanopartículas metálicas y/o sus respectivos óxidos, el cual puede extender a otros metales como Fe, Cu y Co.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) por apoyo económico otorgado mediante el proyecto 133991. También agradecen a Dario Bueno y Gilberto Hurtado por las mediciones de SQUID, Esmeralda Saucedo y Enrique Díaz por las imágenes de HRTEM y Martín Adelaido Hernández Landaverde por el cálculo de los porcentajes de fase mediante el software Jade 6.
Referencias
[1]. J. Jellinek. Theory of Atomic and Molecular Clusters; (Ed.; Springer: Berlin, 1999) [ Links ]
[2]. R.L. Johnston. Atomic and Molecular Clusters; (Taylor andFrancis: London, 2002) [ Links ]
[3]. Y. Mi, D. Yuan, Y. Liu, J. Zhang, Y. Xiao, Mater. Chem.Phys., 89, 359 (2005) [ Links ]
[4]. J. Sort, J. Nogués, S. Amils, S. Suriñach, M.D. Baró, J. Magn. Magn. Mater., 219, 53 (2000) [ Links ]
[5]. Yu.V. Bokshits, G.P. Shevchenko, V.S. Gurin, A.N. Ponyavina, S.K. Rakhmanov, Mater. Sci. Eng. C, 27, 1149 (2007) [ Links ]
[6]. G. Li and Y. Luo, Inorg. Chem., 47, 360 (2008) [ Links ]
[7]. M.P. Pechini, US Patent No. 3330697, July 11, 1967. [ Links ]
[8]. B.D. Cullity, S.R. Stock. Elements of X-ray diffraction, 3rded. Prentice Hall, London, UK (2001). [ Links ]
[9]. JCPDS, International Center of Powder Diffraction Data: Swarthmore, PA, 1989; Card No. 04-0850. [ Links ]
[10]. JCPDS, International Center of Powder Diffraction Data: Swarthmore, PA, 1989; Card No. 04-0835. [ Links ]
[11]. E.R. Leite, N.L.V. Carreño, E. Longo, F.M. Pontes, A. Barison, A. G. Ferreira, Y. Maniette, J.A. Varela, Chem. Mater. 14, 3722 (2002). [ Links ]
[12]. JCPDS, International Center of Powder Diffraction Data: Swarthmore, PA, 1989; Card No. 04-0783. [ Links ]
[13]. JCPDS, International Center of Powder Diffraction Data: Swarthmore, PA, 1989; Card No. 04-0836. [ Links ]














