Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Superficies y vacío
versión impresa ISSN 1665-3521
Superf. vacío vol.25 no.2 Ciudad de México jun. 2012
Efecto del pH en la corrosión de acero al carbono en presencia de un medio amargo
Esparza Zúñiga E. M., Veloz Rodríguez M. A.*, Reyes Cruz V. E.
Área Académica de Ciencias de la Tierra y Materiales. Universidad Autónoma del Estado de Hidalgo Carr. Pachuca Tulancingo Km 4.5, Col. Carboneras, Mineral de la Reforma, Hgo. *mveloz@uaeh.reduaeh.mx, maveloz70@yahoo.com.mx.
Uruchurtu Chavarín J.
Centro de Investigación en Ingeniería y Ciencias Aplicadas. Universidad Autónoma del Estado de Morelos Av. Universidad 1001, Col. Chamilpa, Cuernavaca, Mor.
Recibido: 24 de enero de 2012
Aceptado: 5 de junio de 2012
Resumen
En este trabajo se presenta el análisis del comportamiento electroquímico de acero al carbono inmerso en agua amarga de la industria del petróleo, variando el pH. Las diferentes técnicas utilizadas denotan la presencia de tres etapas importantes en el proceso de corrosión: adsorción, difusión de especies y corrosión localizada. El análisis por Microscopia Electrónica de Barrido (MEB) mostró la presencia de productos de corrosión únicamente a pH 8.5, mientras que en todos los pH's evaluados se tiene presencia de cavidades o picaduras. El estudio de EDS confirma la presencia de oxígeno, calcio y cloro a pH 8.5 donde se tienen productos de corrosión.
Palabras Claves: Electroquímica; Corrosión; Películas.
Abstract
The analysis of electrochemical behaviour of carbon steel immersed in a sour water of the petroleum industry, varying the pH, was studied. Different techniques used show the presence of three important corrosion stages: adsorption, species diffusion and localised corrosion. MEB analysis showed the presence of corrosion products only at pH 8.5, while in all the pH tested there are cavities or pitting. The EDS study confirms the presence of oxygen, calcium and chlorides at pH 8.5, where the corrosion products are present.
Keywords: Electrochemistry; Corrosion; Films.
1. Introducción
En la industria del petróleo se presenta una gran cantidad de fallas en las tuberías que están en contacto con medios amargos [1], durante los procesos de producción, tales como la refinación. Los estudios que se han hecho tratando de apegarse a las condiciones de operación en las que se tienen medios amargos [2-11] han aumentado en los últimos 10 años, en que las características de los crudos obtenidos han cambiado para dar como resultado ambientes corrosivos mucho más agresivos que antes.
En estos medios se han realizado estudios para observar las diferentes velocidades de corrosión y crecimiento de películas con el fin de conocer y en su momento poder modificar las características del proceso de corrosión. Los más significativos fueron aquellos realizados en medios acuosos con contenidos de cloruros y H2S [2], donde se observó la formación de una capa de productos de corrosión de sulfuros, a un pH alcalino, que tenía características protectoras y adherentes. En un estudio para hierro puro en presencia de sulfuros y cloruros [3], a un pH ácido, se obtuvo un incremento en las corrientes de corrosión y una disminución en la protección de los productos de corrosión que contienen sulfuros.
En la evaluación de materiales metálicos sometidos a la corrosión en medios amargos, en la industria petrolera generalmente se hace uso de métodos como el NACE TM 0177 [12]; en el cual la alta agresividad del medio de evaluación resulta adecuada para tener resultados confiables en poco tiempo, así por ejemplo se ha estudiado la conducta de un acero al carbono AISI 1018 en soluciones amortiguadas de ácido acético y cloruros sin y con H2S [5], los resultados obtenidos muestran que la etapa que gobierna al proceso de corrosión es la de adsorción, además se confirmó la ausencia de productos de corrosión. Sin embargo la composición se encuentra alejada de las condiciones reales.
En la industria del petróleo se ha demostrado que los cambios de pH, provocan daños importantes al metal sin que se tenga claro qué parte del mecanismo de corrosión es la que se ve afectada, espor ello que se hace necesario un estudio en medios reales, que permita establecer algunas de las variantes que se presentan en la formación de productos de corrosión.
De esta forma, en el presente trabajo se planteó como objetivo determinar el efecto que tiene la modificación del pH en la corrosión de aceroal carbono AISI 1018 enuna muestra de aguas amargas de la industria del petróleo.Tomando como intervalo de variación del pH entre 5.5 a 8.5, que es el intervalo que se encontró en un año de análisis de datos estadísticos en el control de pH en la industria del petróleo.
2. Metodología Experimental
Se utiliza una celda típica detres electrodos con el acero al carbono AISI1018como electrodo de trabajo,una barra degrafito como contraelectrodo y un electrodo de calomel saturado como referencia.
Los electrodos fueron inmersos enuna muestra de agua amarga proveniente de la industria del petróleo, colectada de un domo de torre de destilación primaria, cuya composición semuestra en la Tabla 1. La variación del pH se hizo entre 5.5 y8.5 a intervalos de 0.25, enuna temperatura de 50°C, sin agitación. El pH de la solución se modificó agregando ácido clorhídrico (HCl) o hidróxido de sodio (NaOH), para disminuir o aumentar el pH, respectivamente. La solución fue de-aireadacon nitrógeno durante media hora. El electrodo de trabajo con un área superficial de 0.7 cm2, se desbastó antes de cada experimento, con una lija de grado 600 SiC.

Se elaboraron curvas de Polarización con un tiempo de inmersión de 10 minutos, previo a cada experimento y con los parámetros indicados en la tabla 2. Posteriormente, las muestras obtenidas se analizaron en el Microscopio Electrónico de Barrido (MEB) y en el detector de energía dispersiva (EDS), para ver lamorfología de los productos de corrosión.
También se utilizó la técnica de ruido electroquímico en donde se usó una celda simple que consiste de dos electrodos de trabajo "idénticos" de acero al carbono AISI 1018, y un electrodo de referencia de calomel. Los electrodos y la solución de trabajo tuvieron el mismo tratamiento y condiciones que para la técnica de polarización. Los parámetros utilizados se muestran en la tabla 2.
Otra técnica usada fue la de Espectroscopía de Impedancia Electroquímica (EIS), donde las mediciones se llevaron a cabo como se indica en la tabla 2, tomando como referencia el potencial de corrosión. En la obtención de los diagramas, se utilizó el mismo arreglo experimental que en el usado en las curvas de polarización.
El equipo utilizado para las técnicas de polarización, ruido electroquímico y EIS fue un potenciostatogalvanostato Autolab Mod. PGSTAT 30 con el software proporcionado por la misma compañía.
3. Resultados y Discusión
En la figura 1 se presentan las curvas de polarización obtenidas para el sistema, cuando se modifica el pH. En ésta, se observa que las corrientes anódicas son muy similares entre sí, pero la tendencia mostrada por las curvas podría indicar una superficie muy activa con disolución por transferencia de carga.

En la rama catódica (figura 1), se observa que las corrientes de reducción son menores para pH de 7, 7.5, y 8.5, contrario al pH 7.75, que es el que tiene mayores corrientes de reducción, indicando que a este pH se favorece este proceso. Además, todas las corrientes de reducción, indican un probable control por difusión, lo cual podría ser resultado de la formación de hidrógeno gaseoso (H2(g)) y su consecuente evolución.
Las imágenes obtenidas por MEB, para el barrido anódico y catódico, muestran la ausencia productos de corrosión y la presencia de algunas cavidades o picaduras en los pH de 5.5 a 8.25 pH (figura 2), pero a pH 8.5 en el barrido anódico se observa la formación de productos de corrosión porosos (figura 3); en las muestras con barrido catódico a pH 8.5 se observa la formación de productos de corrosión (figura 3) en pequeños aglomerados, indicando reacciones localizadas de gran rapidez que involucran el incremento en la cantidad de OH-interfacial dando lugar a un cambio brusco de pH en la superficie. Estos ataques localizados en ausencia de productos de corrosión estarían relacionados con la formación de burbujas de hidrógeno generadas en la superficie metálica.


Los resultados de EDS realizados a las muestras evaluadas en el intervalo de pH de 5.5 a 8.25, indican la ausencia de oxígeno, por lo que se tiene una superficie libre de productos de corrosión; no obstante, en algunos casos se presentan cloruros, los cuales podrían estar acumulados en las cavidades o picaduras. En la muestra evaluada a pH 8.5 se observa la presencia de oxígeno, cloruros y de calcio, lo que indica que los productos de corrosión podrían ser son óxidos, hidróxidos, calcitas o aragonitas tal como se postuló en la literatura [13].
Se realizó un análisis cuantitativo de los parámetros de corrosión obtenidos a los diferentes pH (Tabla 3), a partir de los resultados de polarización lineal y Tafel. En ésta se muestran el Potencial de corrosión (Ecorr), la Resistencia a la polarización (Rp) y las pendientes anódica (ba) y catódica (bc) obtenidas mediante regresión lineal a los datos y con el cruce de ambas en el potencial de corrosión.

En la Tabla 3 se observa que los valores del potencial de corrosión, son más catódicos que a pH 8.5, lo que implica que la reacción de reducción se ve favorecida con la disminución en el pH. Esto se corrobora con las pendientes catódicas que se obtienen ya que son valores muy altos indicativos de la presencia de procesos difusivos atribuibles a la evolución del hidrógeno o a los agentes corrosivos entrando por las cavidades que se forman. Por otro lado la resistencia de polarización muestra valores altos a pH 7, 7.5 y 8.5, contrario a pH 5.75, 7.75 y 8 indicando superficies más activas en estos últimos, lo cual es destacable ya que en los estudios reportados en la literatura donde se utiliza el Método NACE [12] los valores de Rp son bajos comparados con los obtenidos en el medio real.
Dado que el proceso de corrosión es espontáneo, muchos de los elementos característicos de éste pueden ser determinados a partir de la observación del comportamiento del material en el medio corrosivo respecto al tiempo. Es por ello que se realizó un estudio de ruido electroquímico al sistema en el intervalo de pH considerado.
En la figura 4a y 4b, se muestran los resultados de la serie de tiempo obtenidos de la técnica de ruido electroquímico para corriente y potencial. En la figura 4a, se muestra que a pH 7.25 y 8.5, se tienen fluctuaciones con amplitudes más grandes (2.5 x 10-9 a –2.6 x 10-9 A cm-2), contrario a las de 7 y 7.5 pH (6.1 x 10-10 a–2.8x10-10Acm-2), por lo que las primeras podrían tener corrosión más localizada, o con mayor intensidad.

En la figura 4b se muestra una caída de potencial lenta en el acero al carbono en los diferentes pH, con excepción de pH 5.5, en sentido catódico asociado con la región de actividad, alcanzando el estado estacionario, las de 6.25, 6.5, 7.75 y 8.5.
En la figura 4a y 4b se observa que, a pH 5.5, 5.75, 6, 6.75, 7, 7.25, 7.75 y 8, las fluctuaciones en corriente exhiben algunos aumentos relativamente rápidos y en esos mismos períodos se presentan pequeñas caídas del potencial correspondientes, lo cual podría representar que hay procesos de picado que están repasivando los sitios activos, o de repasivacion incompleta, aunque también podrían representar un bloqueo de estos sitios por la formación de burbujas de hidrógeno y su consecuente desprendimiento generando una caída de potencial y un aumento de la corriente como resultado de la reacción catódica.
Posteriormente, se hizo un análisis local de datos, a partir del registro 500 en adelante con los cuales se obtuvieron resultados cuantitativos de la técnica de ruido electroquímico (Tabla 4), tal como el índice de localización (IL) obtenido a partir del cociente de la desviación estándar de la corriente entre la raíz cuadrática media (rms) de la corriente [14]:

Como puede observarse en la Tabla 4 el IL es cercano a 1.0, excepto para pH 7, lo que sugiere que los diferentes sistemas presentan corrosión localizada, pero en el caso del pH neutro, se tiene más corrosión generalizada.
Estos resultados indican la presencia de varias etapas en el proceso de corrosión que son las causantes de las condiciones finales obtenidas en las muestras de acero al carbono AISI 1018.
Con la finalidad de establecer, el número de etapas involucradas tanto en el proceso anódico como en el catódico se realizaron pruebas con la técnica de espectroscopia de impedancia electroquímica (EIS). En las figuras 5 y 6, se muestran los diagramas de Nyquist y Bode (módulo y ángulo de fase), respectivamente.
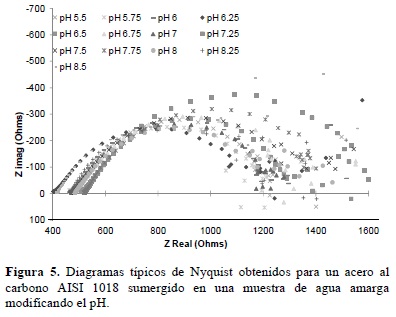

En la figura 5 se muestra que los procesos involucrados, prácticamente, son muy similares para todos los sistemas, observándose la presencia de un semicírculo a altas frecuencias y a bajas frecuencias una fuerte dispersión de los valores de impedancia. Esto último podría estar asociado a procesos de transporte de masa difusivos, adsorción de especies o corrosión localizada. Sin embargo, es más notorio la presencia de procesos difusivos a pH de 8.5, donde la película de productos de corrosión formada (figura 6), aumenta la resistencia, pues actúa como una barrera de difusión, en sentido opuesto al resto de los sistemas, donde la evolución de hidrógeno puede ser la que evite que los productos de corrosión se adhieran firmemente a la superficie del electrodo.
En el diagrama de Bode del modulo de impedancia y de ángulo de fase (figura 6), se observa que el sistema bajo diferentes pH tendría tres constantes diferentes de tiempo, la primera en el intervalo de frecuencias entre 10000 y 1 Hz, estaría asociada con la capacitancia de la doble capa y la resistencia a la transferencia de carga: el proceso de disolución metálica en sí. En el intervalo de frecuencias entre 1 y 0.1 Hz se visualizaría el proceso de formación, redisolución de productos de corrosión, así como a los primeros eventos de corrosión localizada; finalmente, las frecuencias menores a 0.1 Hz se asociarían con procesos difusivos, de adsorción de especies y de corrosión localizada plenamente desarrollada. Estas tres constantes de tiempo no se observan en el diagrama de Nyquist debido a que no hay una separación clara entre los semicírculos, lo cual indica la complejidad del proceso y el traslape que existe entre las etapas del mismo, lo cual se presenta más marcado en el pH de 8.5 donde la distorsión de los diagramas de impedancia empieza en frecuencias diferentes a todos los demás valores.
El análisis cuantitativo de los resultados de impedancia para el sistema, a diferentes pH, se hizo mediante una simulación con el circuito equivalente (figura 7), que permite obtener valores muy cercanos a los reales en cuanto a la resistencia de la solución (Rs) y la transferencia de carga (Rct). La capacitancia de la doble capa se ve afectada por las características de la superficie, como rugosidad o heterogeneidad, la cual se simula utilizando un elemento de fase constante (CPEdl), para representar el primer proceso que se presenta en los diagramas de impedancia. El segundo semicírculo correspondería a la resistencia de los productos de corrosión (R1) y a su capacitancia (CPE1) y el tercer semicírculo se relacionaría con los procesos difusivos y de corrosión localizada (CPE2 y R2). Es importante destacar que estos elementos constituyen el mejor ajuste a los resultados experimentales; y que sin embargo, no se tiene una reproducción total de los mismos, ya que en las frecuencias más bajas se tienen cierta dispersión de los datos experimentales y teóricos.

La Tabla 5 muestra los valores representativos obtenidos para las resistencias (resistencia de la solución, Rs; resistencia de transferencia de carga, Rct; resistencia de productos de corrosión R1 y la resistencia asociada a los procesos difusivos y corrosión localizada, R2), obtenidos del ajuste a los datos experimentales con respecto al circuito equivalente descrito.
En la Tabla 5 se observa que las resistencias a la solución presentan diferentes valores al cambiar el pH, ya que es uno de los factores de los cuales depende esta resistencia, aunque no muestran una tendencia.
En el caso de la resistencia de transferencia de carga se tiene un comportamiento predecible con respecto al aumento de pH, ya que a pH ácidos se observan las menores Rct y a medida que el pH aumenta se observan las mayores Rct excepto a 8.25 que es la que tiene la menor Rct, contrario a 8.5 donde se observa la mayor Rct, probablemente debido a que en este pH se observa la formación de productos de corrosión (figura 1). Lo anterior pone en evidencia un efecto protector contra la corrosión en la superficie metálica, indicando que en este valor de pH el proceso de transferencia de carga se ve más impedido, contrario a los pH donde se tienen menores resistencias.
En el caso de las R1, se observa que las menores resistencias se presentan a pH ácidos, seguidos por los pH básicos, siendo las mayores resistencias a pH neutros, excepto para el pH de 8.25, el cual presenta el menor valor de resistencia, indicando que en éste, se presenta mayor actividad superficial. Los valores de R2 para los diferentes pH se observa que a 8.25 pH se tiene la mayor resistencia esto sugiere que se tiene mayor corrosión localizada por la formación de productos y el proceso de difusión se ve más impedido, contrario al pH de 8 con la menor resistencia. Entonces se corrobora que el pH es un factor muy importante que determina el tipo y cantidad de productos de corrosión que se formen en la superficie metálica, así como el grado de daño que ésta pueda presentar. Además, los valores de las resistencias R1 y R2 son mayores que la Rct correspondiente, lo que sugiere, como interpretación física del circuito equivalente (figura 7), que el proceso de corrosión está principalmente caracterizado por la formación y redisolución de películas de corrosión no muy protectoras y la difusión de especies a través los productos que han permanecido en la superficie [15].
El análisis de las capacitancias asociadas a los elementos de fase constante CPEdl, CPE1 y CPE2, se muestran en la Tabla 6. En ella se observa que la Cdl calculada, se encuentra en el orden de los valores establecidos para la capacitancia en medios ácidos para hierro metálico (alrededor de 50 μF/cm2) o bien para el acero al carbono (~100 μF/cm2) [16], excepto en el sistema de 8.5, lo cual refuerza el planteamiento de la formación y redisolución de los productos de corrosión; mientras que a pH de 8.5 la presencia de la película de éstos (figura 3) hace que el valor de la capacitancia mostrada sea mayor tal como se ha reportado en la literatura [17], indicando también que la superficie metálica o el entorno (intercambio de moléculas cercanas debido al cambio de pH) se modifica.

Los valores de C1 a pH ácidos presentan una gran diferencia con respecto a las Cdl siendo mayores, lo cual es atribuido a los procesos de formación redisolución de los productos de corrosión y esto puede ser originado por la evolución de hidrógeno que evita que los productos de corrosión se adhieran firmemente a la superficie. Para los pH de neutro a básicos, los valores de C1 son menores, indicando la presencia de algún otro proceso, como la adsorción específica de iones con mayor afinidad por la superficie metálica libre, la cual se encuentra más activa o la presencia de procesos difusivos, posiblemente del hidrógeno, que evitan que los productos de corrosión puedan adherirse firmemente a la superficie. Prueba de esto último serían los valores bajos de ndl, contrario al pH de 8.5 donde el valor de ndl indica una mayor adherencia de los productos de corrosión (figura 3). Los valores de C1, a pH de 7, 7.75 y 8.25, indican que el espesor o el área cubierta por la capa de productos de corrosión son mayores que en el resto de los pH; pero el mayor valor es a 8.5, lo que indicaría la formación de una capa compacta de productos de corrosión. Los valores de C2, en términos generales, son muy similares a los de C1, indicando la gran relación que existe entre los procesos que se verifican hacia las bajas frecuencias y la probable competencia en el desarrollo de las etapas planteadas, lo cual se corrobora con la dispersión que existe en los puntos de impedancia obtenidos.
4. Conclusiones
Los resultados mostrados en este trabajo, indican que la variación en el pH, no modifica significativamente el mecanismo de disolución del acero al carbono AISI 1018 en presencia del medio amargo, excepto para un pH de 8.5 en donde los productos de corrosión favorecen la presencia de picaduras o cavidades que ocasionan daños muy severos al material expuesto.
El mayor efecto se presenta hacia la reacción catódica del sistema en donde se observa la presencia de productos de corrosión destacando aquellos formados por cloruros, calcio y oxígeno, dando lugar a óxidos, hidróxidos, calcitas o aragonitas.
Al menos tres etapas en el proceso de corrosión relacionadas con la formación y redisolución de productos de corrosión, la adsorción y difusión de especies hacia o a través de los mismos productos y las etapas iniciales de un proceso de picadura, se desarrollan de manera conjunta presentando una especie de competencia que depende del pH y que lleva a la formación de diferentes productos y daños al material metálico.
Agradecimientos
Los autores agradecen a SEP-CONACyT (proyecto 023889) y a PROMEP (UAEHGO-PTC-293). Al Dr. Juan Hernández Ávila, por su apoyo en MEB. Estella Esparza externa su gratitud al CONACyT por la beca otorgada para sus estudios de doctorado.
Referencias
[1]. Z. Foroulis, Corros Prevent Contr. 40, 84, (1993). [ Links ]
[2]. R. Cabrera-Sierra, M. Miranda-Hernández, E. Sosa, T. Oropeza, I. González. Corros Sci. 43, 2305, (2001). [ Links ]
[3]. H. Hoffmeister. Corrosion. 64, 483, (2008). [ Links ]
[4]. S-T. Kim, Y-S. Park. Corrosion. 64, 496, (2008). [ Links ]
[5]. M. A. Veloz, I. González. Electrochim Acta. 48, 135, (2002). [ Links ]
[6]. W. L. Prater. Corrosion. 64, 517, (2008). [ Links ]
[7]. G. O. Llevbare. Corrosion. 62, 340, (2006). [ Links ]
[8]. J. Feyerl, G. Mori, S. Holzleitner, J. Haberl, M. Oberndorfer, W. Havlik, C. Monetti. Corrosion. 64, 175, (2008). [ Links ]
[9]. M. A. Queaishi, R. Sardar. Corrosion. 58, 748, (2002). [ Links ]
[10]. X. Li, L. Tang, L. Li, G. Mu, G. Liu. Corros Sci. 48, 308, (2006). [ Links ]
[11]. E. Sosa, R. Cabrera, M. T. Oropeza, F. Hernández, N. Casillas, R. Tremont, C. Cabrera, I. González. Electrochim Acta. 48, 1665 (2003). [ Links ]
[12]. Método Estándar NACE TM 0177 National Association of Corrosion Engineers, NACE, (1996). [ Links ]
[13]. J. Marín, Tesis Doctoral, UAM-Iztapalapa, México, 2004. [ Links ]
[14]. D. A. Eden. "Electrochemical Noise - The first two octaves" Corrosion Source (2000) [ Links ]
[15]. E. Sosa, R. Cabrera-Sierra, M. E. Rincón, M. T. Oropeza, I. González. J Appl Electrochem. 32, 905, (2002). [ Links ]
[16]. M. A. Veloz, Tesis Doctoral, UAM-Iztapalapa, México, 2003 [ Links ]
[17]. H. Amar, J. Benzakour, A. Derja, D. Villemin, B. Moreau, T. Braisaz. Appl Surf Sci 252, 6162 (2006). [ Links ]














