Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Superficies y vacío
versão impressa ISSN 1665-3521
Superf. vacío vol.25 no.2 Ciudad de México Jun. 2012
Aplicación de peliculas delgadas de SnO2 y SnO2:Ru como sensores de propano
Aguilar-Leyva J., Maldonado A., Olvera M. de la L.*
SEES, Departamento de Ingeniería Eléctrica, CINVESTAV-IPN Apdo. Postal 14740, México D. F. 07000, México. *molvera@cinvestav.mx
Recibido: 13 de agosto de 2011
Aceptado: 28 de mayo de 2012
Resumen
En este trabajo se reportan las propiedades sensoras de películas de óxido de estaño puro, SnO2, y óxido de estaño impurificado intencionalmente con rutenio, SnO2:Ru, en una atmósfera controlada de propano, C3H8, a diferentes concentraciones y temperaturas de operación. Las películas, con espesor variable, fueron depositadas sobre substratos de vidrio sodocálcico mediante la técnica de rocío químico, a diferentes temperaturas de depósito, a saber, 300, 350, 400 y 450°C. Previamente a su caracterización, todas las películas fueron sometidas a un tratamiento térmico en vacío a 400 °C durante una hora, con el fin de estabilizar las características físicas de la superficie. Las sensibilidades de las películas fueron cuantificadas mediante la razón de cambio de la resistencia eléctrica superficial en una atmósfera de C3H8, respecto a su resistencia medida en aire. Sensibilidades máximas, del orden de 1.4 y 7.4 fueron obtenidas para las películas de SnO2 y SnO2:Ru, respectivamente.
Palabras clave: Películas Delgadas; Óxidos Semiconductores; Óxido de Estaño; Sensores de Propano.
Abstract
In this work we report the sensing properties of undoped and ruthenium-doped tin oxide thin films (SnO2, SnO2:Ru) with different thicknesses, in a controlled atmosphere of propane gas (C3H8) at different operation temperatures. The films were deposited onto soda-lime glass substrates by the spray pyrolysis technique at different deposition temperatures, namely, 300, 350, 400, and 450°C. All the films were annealed in vacuum at 400°C during 1 h in order to stabilize the surface physical characteristics. The sensing properties of the films were characterized by the surface electrical resistance ratio in a C3H8 atmosphere, and air as reference. Maximum sensitivities, on the order of 1.4 and 7.4 were obtained for undoped SnO2, and, SnO2:Ru thin films, respectively.
Keywords: Thin films, Semiconductor Oxides; Tin Oxide; Propane Gas Sensors.
1. Introducción
Un gran número de óxidos metálicos, OM, son adecuados para la detección de gases reductores u oxidantes, entre los que podemos mencionar los siguientes: ZnO, Cr2O3, Mn2O3, Co3O4, NiO, CuO, CdO, MgO, SrO, BaO, In2O3, WO3, TiO2, V2O3, Fe2O3, GeO2, Nb2O5, MoO3, Ta2O5, La2O3, SnO, CeO2, y Nd2O3. Sin embargo, el más utilizado hasta la fecha ha sido el SnO2 [1-3].
El funcionamiento de los llamados "sensores resistivos" de estado sólido se basa en el cambio que sufre la resistencia eléctrica superficial del material cuando es expuesto a una atmósfera reductora (u oxidante). El cambio de resistencia es producido por la interacción del oxígeno superficial con los gases de la atmósfera. Durante este proceso se generan (o atrapan) electrones libres en la superficie del OM, dando lugar a una disminución (o incremento) de la resistencia eléctrica superficial [4-7]. En el caso particular de este trabajo, fue utilizado gas propano, C3H8, el cual tiene un carácter reductor, registrándose una disminución de la resistencia eléctrica superficial de las películas.
En general, los sensores a base de OM han sido utilizados para sensar gases flamables y tóxicos que pueden estar presentes en una atmósfera normal; por ejemplo: gas natural (CH4), gas LP (Liquefied Petroleum) y monóxido de carbono (CO).
Respecto a los sensores de gases a base de SnO2, en la literatura científica podemos encontrar un número importante de publicaciones que reportan sobre la caracterización de películas delgadas, depositadas por diversas técnicas de crecimiento, para la detección de diferentes tipos de gases, tales como, H2, SO2, NO2, NH3, H2S, CH4, CO2, CO, LPG, etc. [7-10]. Sin embargo, hasta donde hemos consultado, no existen reportes sobre la aplicación de películas de SnO2 impurificadas con Rutenio (SnO2:Ru), depositadas mediante la técnica de rocío químico, como sensores de C3H8.
Es bien sabido que la adición de un elemento catalizador en la región superficial del óxido semiconductor incrementa su sensibilidad, e incluso puede mejorar la selectividad de la respuesta a un gas específico y disminuir la temperatura de operación. El efecto del catalizador se debe a la diferencia entre las funciones de trabajo del OM y el elemento catalizador, ya que al ponerlos en contacto se produce un vaciamiento de electrones hacia la región de la superficie que conlleva al incremento de la cantidad de oxígeno previamente adsorbido. En consecuencia, como se describió antes, este oxígeno adsorbido superficialmente puede reaccionar con los gases de la atmósfera en una segunda etapa; este fenómeno es evidenciado a través del cambio de resistencia eléctrica de la superficie. De esta manera, entre mayor sea la cantidad de oxígeno adsorbido, mayor será la magnitud de la sensibilidad. Entre los elementos catalizadores más empleados está el paladio, Pd, y el platino, Pt, sin embargo, en este trabajo nosotros estamos explorando la actividad catalítica del Ru para sensar C3H8.
Respecto a la selectividad de la respuesta de un sensor a un gas particular, ha sido demostrado ampliamente que ésta depende de la selección del elemento catalizador y de la optimización de la temperatura de operación, ya que el tipo y número de reacciones entre el oxígeno adsorbido y un gas particular depende de estos factores.
En este trabajo se reportan las propiedades sensoras de películas de SnO2 y SnO2 impurificadas con 3 % at. de Ru con diferente espesor y depositadas a diferentes temperaturas de depósito mediante la técnica de rocío químico pirolítico. La caracterización eléctrica fue realizada en un ambiente controlado de C3H8, a diferentes concentraciones y temperaturas de operación.
2. Procedimiento Experimental
Se depositaron películas de SnO2 puras e impurificadas intencionalmente con Ru mediante la técnica de rocío químico a partir de una solución 0.2 M de cloruro estánico penta-hidratado (SnCl4·5H2O- Merck) disuelto en alcohol etílico (Merck). Como precursor de Ru se utilizó cloruro de rutenio (RuCl3·H2O- Alfa Aesar) a una razón atómica [Ru]/[Sn]= 3 % at. Todas las películas fueron depositadas sobre substratos de vidrio sodocálcico (dimensiones: 2 cm x 1 cm) a diferentes temperaturas de depósito, Ts= 300, 350, 400 y 450oC. Para variar el espesor de las películas se emplearon dos tiempos de depósito, que fueron 1.5 y 6 min. Los espesores se midieron con un perfilómetro KLA Tencor P15, con una resolución de 0.15 nm, para lo cual se construyó un escalón durante el depósito cubriendo una pequeña parte de la muestra.
La notación utilizada para la identificación de las diferentes muestras, es como sigue: SO300-A, donde SO identifica a una muestra no impurificada (que puede ser también SOR para el caso de las muestras impurificadas con Ru), el 300 se refiere a la temperatura de sustrato (que puede ser también 350, 400 o 450 °C), y A es el tiempo de depósito de 1.5 min (que puede ser también B para 6 min). Previo a la caracterización eléctrica en C3H8, todas las películas fueron sometidas a un tratamiento térmico en vacío durante 1 h a 400 oC, esto con el fin de estabilizar las condiciones de la superficie. Los contactos óhmicos, para realizar las mediciones eléctricas, fueron dos líneas metálicas paralelas que se fabricaron de manera posterior al tratamiento térmico, utilizando un adhesivo de pintura de plata (Alfa Aesar).
Las mediciones eléctricas consistieron en monitorear la resistencia eléctrica superficial de las películas con un multímetro digital de alta resistencia, Keithley 2001. Los sensores fueron calentados mediante una resistencia eléctrica colocada en el interior de una placa de cobre. Este arreglo se encuentra dentro de una cámara de vacío, donde se controla electrónicamente la concentración de C3H8, CC3H8, así como la temperatura de operación de los sensores, Tm. En la Fig. 1 se muestra un esquema del sistema utilizado para realizar las mediciones eléctricas. Cabe mencionar que antes de introducir el C3H8 a la cámara, ésta es inicialmente evacuada hasta una presión de 1 mbar y después llenada con nitrógeno puro en fase gaseosa, el cual es evacuado posteriormente hasta obtener nuevamente una presión de 1 mbar. La magnitud de CC3H8 contenido en la cámara es estimada de manera indirecta a partir de la ecuación de estado mediante la medición de la presión final de la cámara, considerando a los gases como ideales con una presión residual de nitrógeno de 1 mbar. La sensibilidad de las películas se calculó utilizando la siguiente expresión,


Donde Ro y Rg son las resistencias de la película medidas en una atmósfera de referencia (aire) y C3H8, respectivamente.
Adicionalmente, se realizó el análisis de la morfología superficial mediante microscopía de barrido electrónico, SEM, utilizando un microscopio JEOL JCM-6300. Las imágenes de SEM obtenidas nos permitieron determinar la relación entre las propiedades sensoras de las películas con su morfología superficial.
3. Resultados y Discusión.
La Fig. 2 presenta las magnitudes de los espesores de las dos series de películas depositadas, SOR-A y SOR-B, para las diferentes temperaturas de depósito empleadas. En ésta se observa un incremento del espesor con la temperatura de depósito, de 10 a 28 nm para un tiempo de depósito de 1.5 min y de 40 a 75 nm para 6 min. Este resultado muestra que la razón de crecimiento es proporcional a la energía térmica suministrada en el proceso de formación de las películas.

Las Figs. 3-7 reportan los valores de sensibilidad, S, en función de la temperatura de depósito y de CC3H8, calculados a partir de la expresión matemática (1). En la Fig. 3 se muestra la variación de S para las películas dopadas con Ru, SOR-A y SOR-B, depositadas a diferentes temperaturas de depósito, y medidas a Tm y CC3H8 constantes, a valores de 300°C y 500 ppm, respectivamente. En esta figura se puede apreciar que las películas más gruesas presentan una sensibilidad ligeramente mayor. Este resultado refiere que la superficie de las películas más gruesas presenta mayor actividad química con el C3H8. Por otro lado, se observa que ambas series de películas muestran la misma tendencia de la sensibilidad, esto es, S aumenta con la temperatura de depósito. De lo anterior se deduce que las películas depositadas a una temperatura de depósito mayor, Ts=450°C, son más convenientes para detectar C3H8. Las sensibilidades máximas fueron del orden de 4.5 y 7.5, y fueron obtenidas para las películas SOR450-A y SOR450B, esto es, películas depositadas a 450°C durante de 1.5 y 6 min, respectivamente.




La Fig. 4 muestra el comportamiento de S en función de Tm de las películas de SnO2 y SnO2:Ru depositadas a 450°C, SO450-A, SO450-B, SOR450-A y SOR450-B, medidas en un intervalo de temperatura de 23 a 300°C, y CC3H8= 500 ppm. De esta gráfica es evidente que en todos los casos Tm favorece la respuesta de las películas al gas, lo cual es resultado de la catálisis o activación de las reacciones de adsorción-desorción entre la superficie de la película y el C3H8 con el incremento de Tm. De esta gráfica, se puede observar también la conveniencia de utilizar películas gruesas, ya que la sensibilidad de las series B es mayor. No obstante, cabe mencionar que, contrario al efecto del espesor observado en este trabajo, resultados obtenidos con otros dopantes, como es el caso de Pd y Pt, muestran que las películas más delgadas son las que presentan la máxima sensibilidad [11]. La máxima sensibilidad se presentó en la muestra SOR450-B con un valor de 7.5, como se comentó anteriormente.
Respecto al efecto del Ru, también se observan sensibilidades mayores en las películas SOR450-A y SOR450-B, lo cual comprueba la actividad catalítica del Ru en las películas de SnO2 en presencia de un gas reductor, como lo es el C3H8. El efecto catalítico del Ru se atribuye a la generación de estados libres superficiales que atrapan iones de oxígeno inmediatamente después del depósito, los cuales, posteriormente, son removidos mediante su reacción con el C3H8, generando electrones libres en la región de la superficie; fenómeno que es evidenciado por el cambio en la resistencia eléctrica de la superficie de la película.
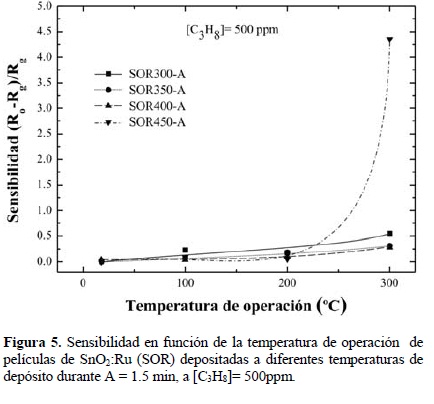
En las Figs. 5 y 6 se presentan las gráficas de S en función de Tm para las muestras SOR-A y SOR-B depositadas a diferentes temperaturas de depósito, 300, 350, 400 y 450 °C, y medidas en una CC3H8= 500 ppm. De la misma manera que en la Fig. 4, en éstas se observa que S aumenta ligeramente con Tm, con excepción de la muestras depositadas a Tm =450°C que muestran una mayor respuesta, registrándose valores máximos del orden de 4.5 y 7.5, respectivamente, para una Tm = 300°C.
Una vez más confirmamos que el proceso de desorción de oxígeno superficial que ocurre en presencia de C3H8 requiere de la aplicación de una energía de activación, en este caso, procedente del calentamiento de las muestras, el cual es referido como Tm.
La Fig. 7 muestra el comportamiento de S de la película SOR450-B como función de CC3H8, para las diferentes Tm empleadas. En ésta se observa que a temperatura ambiente no hay respuesta al gas, pero a Tm mayores la S aumenta con la CC3H8. La magnitud de S es significativa a partir de 200 °C, aunque la máxima respuesta se obtiene a Tm = 300°C. También se observa que a 200 y 300°C y CC3H8 superiores a las 300ppm, la forma de variación de S cambia, mostrando una razón de cambio mayor conforme aumenta CC3H8. Este comportamiento está asociado con el incremento de la actividad catalítica con el aumento de Tm y CC3H8.
En la Fig. 8 (a-d) se muestran las imágenes obtenidas por microscopía de barrido electrónico de la superficie de las películas SO450-A, SO450-B, SOR450-A y SOR450-B, respectivamente. Cabe mencionar que, debido a la baja magnitud del espesor de las películas las imágenes no son lo suficientemente claras como para hacer una estimación precisa del tamaño de los granos, no obstante se puede observar que, tanto el espesor de las películas como la presencia de Ru, influyen sobre la morfología superficial de las películas. Las películas más delgadas (Figs. 8a y 8c) muestran una morfología más lisa y uniforme que las películas gruesas (Figs. 8b y 8d). En contraste, las películas gruesas, además de mostrar la presencia de granos de mayor tamaño también presentan una apariencia más porosa. Las observaciones anteriores justifican la obtención de valores de sensibilidad mayores en películas gruesas. Este resultado se puede asociar directamente al incremento del área de la superficie expuesta, llamada área activa, en el caso de las películas gruesas.

Podemos observar también que el Ru contribuye, aunque de manera poco significativa, al aumento del tamaño de los granos. En conclusión podemos decir que el incremento de la sensibilidad mostrado en las películas impurificadas con Ru se debe principalmente al efecto catalítico del Ru y no a efectos inducidos por el mismo sobre la morfología de las películas. No obstante el efecto mostrado del Ru sobre las propiedades sensoras de las películas depositadas mediante la técnica de rocío químico, se desconoce la ubicación que tienen los átomos de Ru dentro de la red del SnO2. Al respecto, basados en los resultados de Chaudhary et al., donde a partir de voltamogramas cíclicos (mediciones I-V) de pastillas sinterizadas de SnO2:Ru demuestran la existencia del Ru en forma reducida (Ru+3) [12], podemos suponer que los átomos de Ru pueden estar substituyendo a los átomos de Sn en la red del SnO2. Este resultado podría ser sustentado con el hecho de tener una resistencia eléctrica menor en el caso de películas de SnO2:Ru en comparación las películas de SnO2, indicando con esto que la impurificación con Ru conduce a una ganancia de electrones de conducción, los cuales son liberados en el proceso de reducción. Este fenómeno lo podemos ilustrar de la siguiente manera: la red del SnO2 puro puede representarse mediante los grupos O=Sn=O, en tanto que, cuando se introduce el Ru, la situación se transforma en la siguiente: O_Ru=O+e. Entonces, el reemplazo del Sn con un Ru nos conduce a la ganancia de un electrón libre para la conducción.
En la Tabla 1 se presenta un resumen de los resultados obtenidos para las películas de SnO2 y SnO2:Ru depositadas a 450°C y medidas a Tm = 300°C y CC3H8= 500ppm.
4. Conclusiones
Los resultados obtenidos muestran que es posible emplear películas delgadas de SnO2, no impurificadas e impurificadas con Ru, crecidas por rocío químico para la elaboración de sensores de C3H8. De los resultados obtenidos se confirma que estas películas son una excelente opción para sensar este tipo de hidrocarburo.
Los valores máximos de sensibilidad, 4.5 y 7.5, fueron obtenidos para las películas más gruesas de SnO2 y SnO2:Ru, respectivamente, a Tm = 300oC y una concentración de 500 ppm de C3H8. Estos resultados sugieren que las propiedades sensoras de la película de SnO2, son mejoradas con la adición del Ru.
Agradecimientos
Los autores agradecen a M. A. Luna-Arias su apoyo técnico en este trabajo; así como el apoyo económico parcial del Consejo Nacional de Ciencia y Tecnología (CONACYT) a través del proyecto No. 155996.
Referencias
[1]. T. Seiyama, A. Kato, K. Fujiishi, M. Nagatani, Analytical Chemistry. 34,1502(1962). [ Links ]
[2]. P. Mitra, A.P. Chartterjee, H.S. Maiti, Materials Letters 35, 33 (1998). [ Links ]
[3]. K. Jim, H. Do Sang, S. Ishwar, L. H. Doek, W. J. Suk, Sensors and actuators B 107, 825 (2005). [ Links ]
[4]. P.T. Moseley, Solid State Gas Sensors, Bristol (1987). [ Links ]
[5]. M.J. Madau, S.R. Morrison, Chemical Sensing with Solid State Devices, Academic Press (1989). [ Links ]
[6]. I.A. Myasniko, V.Y. Suckarev, L.Y. Kupriyanov, S.A. Zavyalov, Semiconductor Sensors in Physico-Chemical Studies Handbook of Sensors and Actuators 4, Elsevier, Amsterdam (1996). [ Links ]
[7]. P. Mitra, A.P. Chartterjee, H.S. Maiti, Materials Letters 35, 33 (1998). [ Links ]
[8]. K. Jim, H. Do Sang, S. Ishwar, L. H. Doek, W. J. Suk, Sensors and actuators B 107, 825 (2005). [ Links ]
[9]. V.A Chaudhary, I.S. Mulla, K. Vijayamohanan, Sensors and Actuators B 50, 45 (1998) [ Links ]
[10]. P. Menini, F. Parret, M. Gerrero, K. Soulanica, L. Erades, A. Maisonnat B. Chaudret, Sensors and Actuators B 103, 111 (2004). [ Links ]
[11]. A.R. Phani, S. Manorama, V.J. Rao, Material Chemistry and Physics 58, 101 (1999). [ Links ]
[12]. R.S. Niranjan, V.A. Chaudhary, S.R. Sainkar, K.R. Patil, K. Vijayamohanan, I.S. Mulla, Sensors and Actuators B 79, 132 (2001). [ Links ]
[13]. S.V. Manorama, C.V. Gopal Redy, V.J. Rao, Applied Surface Science 174,93 (2001). [ Links ]
[14]. V. A.Chaudhary, I. S. Mulla, K. Vijayamohanan, Sensors and Actuators B 50, 45(1998). [ Links ]














