Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Superficies y vacío
versão impressa ISSN 1665-3521
Superf. vacío vol.25 no.1 Ciudad de México Mar. 2012
Comparación de metodologías basadas en curvas de polarización y anodización potenciostática en la obtención de nanoestructuras de TiO2 a bajo potencial
Concha Guzmán M. O.1, Cuevas Arteaga C.1 y Rincón González M. E.2
1 Facultad de Ciencias Químicas e Ingenierías, Centro de Investigación en Ingeniería y Ciencias Aplicadas–Universidad Autónoma del Estado de Morelos Av. Universidad 1001, Col. Chamilpa, C.P. 62210, Cuernavaca, Mor., México. *e–mail: mconcha@uaem.mx.
2 Centro de Investigación en Energía – Universidad Nacional Autónoma de México, Av. Xochicalco S/N, Col. Centro, Temixco, Mor., 62580.
Recibido: 3 de abril de 2011;
Aceptado: 16 de diciembre de 2011.
Resumen
El presente trabajo compara las técnicas electroquímicas de curvas de polarización (CP) y anodización potenciostática (CA) en la síntesis de nanoestructuras de TiO2 a bajo potencial. Previo a las pruebas electroquímicas, la superficie de la lámina de titanio se pretrató de manera diferente para uniformizar los efectos del pulido mecánico. Las nanoestructuras se formaron en una solución acuosa de ácido fluorhídrico y ácido sulfúrico, a diferentes concentraciones. Las micrografías obtenidas por microscopia electrónica de barrido indicaron estructuras porosas con diámetro de poro de 400 – 700 nm en la técnica de CA y de 200 – 400 nm en la técnica CP. En contraste, el espesor de las películas fue similar en ambas técnicas y de aproximadamente 1 um. Los resultados indican que es posible formar arreglos nanoporosos de TiO2 con metodologías electroquímicas más simples que las requeridas en la técnica de anodización potenciostática.
Palabras clave: Curva de polarización; Anodización potenciostática; Óxido de titanio; Nanoestructuras.
Abstract
In this work we compare the morphology obtained in the synthesis of TiO2 nanostructures at low potential using two electrochemical techniques: polarization curves (CP) and potentiostatic anodization (CA). Before testing, the titanium foil specimens were pretreated differently to homogenize the effect of mechanical polishing. The nanostructures were formed in aqueous solution of hydrofluoric and sulphuric acids at various concentrations. Scanning electron microscopy images showed porous structures with pore diameter of 400 – 700 nm in the CA technique and 200 – 400 nm in the CP technique. In contrast, the thickness of the films was similar and around 1 µm in both techniques. The results indicated that it is possible to form porous arrays of TiO2 with electrochemical and pretreatment methods simpler than those required by potentio static anodization.
Keywords: Polarization curves; Potentio static anodization; Titanium oxide; Nanostructures.
1. Introducción
Los materiales nanoestructurados de dióxido de titanio (TiO2) muestran alta biocompatibilidad, baja toxicidad y una amplia gama de propiedades funcionales de interés en aplicaciones ópticas, eléctricas y químicas [1–4]. Estas propiedades se atribuyen principalmente a la mayor área superficial relativa de las nanoestructuras y determinan los fenómenos que tienen lugar en fotoelectroquímica, fotocatálisis, celdas solares sensibilizadas por colorante, dispositivos electrocrómicos, sensores magnéticos, entre otros [5–9]. Considerables esfuerzos se han dedicado al desarrollo de materiales más eficientes, por lo que en la actualidad es de gran interés el control de orden y tamaño en los materiales nanoestructurados. Así mismo, es importante el estudio de métodos de fabricación económicos para obtener crecimientos auto–organizados de nanoestructuras de TiO2 [1, 2,10]. Los métodos de fabricación incluyen principalmente las técnicas hidrotérmica [11,12], el proceso sol–gel [13], y la anodización electroquímica [14]. De estos métodos, la anodización electroquímica generalmente es el método más útil para obtener arreglos nanoporosos o nanotubulares auto–organizados.
El proceso de formación de nanoporos por anodización electroquímica puede realizarse con una amplia variedad de electrolitos, siendo una característica común la presencia de iones haluros, principalmente los iones de flúor [15].
Otros parámetros que han sido reportados en la síntesis son: la baja temperatura [16], así como el uso de láminas de titanio con y sin pretratamiento químico y/o mecánico [17]. Entre los parámetros electroquímicos que afectan la geometría del nanoporo y su evolución a nanotubo está la intensidad del campo eléctrico, este factor es esencial en la determinación de las características del nanotubo (longitud, diámetro y espesor de la pared) [18–21]. Hay que enfatizar que la mayoría de los estudios se han concentrado en la formación de nanoestructuras a alto potencial, generalmente por arriba de 20 V [22], con tiempos de anodización de más de 5 horas.
Existen varios procesos clave durante el crecimiento del arreglo de nanotubos: la oxidación del titanio en la interfaz metal–óxido, la disolución del óxido barrera en la parte inferior del tubo, y la disolución química en la boca de los nanotubos ocasionando el ensanchamiento o destrucción de los mismos [23–26]. Estos procesos se deben a dos tipos fundamentales de reacciones y determinan la longitud final de los nanotubos [14, 27–29]. A alto potencial, la longitud de los nanotubos está correlacionada con la duración del anodizado, debido a que la velocidad de formación y disolución del óxido en la parte inferior del tubo es más rápida que la velocidad de disolución en la boca del mismo, de lo contrario los nanotubos son cortos o incluso no se obtienen [24].
Tomando en consideración que a bajo potencial la velocidad de disolución química en la boca del tubo o poro es del mismo orden que la reacción electroquímica de formación del óxido en la parte inferior del mismo, en el presente trabajo se comparan las metodologías utilizadas en la obtención de nanoestructuras porosas o tubulares de TiO2 mediante las técnicas electroquímicas de curvas de polarización (CP) y anodización potenciostática (CA).
2. Condiciones experimentales
Se utilizaron muestras de titanio (99.7% de pureza, Sigma–Aldrich) de 0.127 mm de espesor y 1cm2 de área de exposición. Previo a las pruebas electroquímicas de CA, la lámina de Ti fue tratada superficialmente mediante un pulido mecánico a espejo, un decapado en la solución de HF–HNO3, seguida de una prueba galvanostática en solución de KOH con el fin de formar una capa de óxido compacto. En las pruebas electroquímicas de CP, se utilizó la lámina de Ti inmediatamente después del pulido mecánico. En los experimentos electroquímicos se utilizó una celda convencional formada con tres electrodos: el auxiliar hecho con una malla de platino, el de referencia de Ag/AgCl (1M KCl) y el de trabajo hecho de lámina de titanio. La celda fue conectada a un potenciostato ACM Gill 8AC, registrando la respuesta del sistema mediante una PC. Las soluciones corrosivas se prepararon con reactivos de tipo analítico, variando las concentraciones de ácido fluorhídrico (48%, Fermont), mientras la solución de H2SO4 (J. T. Baker) se preparó con una concentración de 0.7 M. Justo antes de llevar a cabo los experimentos, las probetas se lavaron con alcohol y se secaron con un flujo de nitrógeno. En la técnica CA, el electrodo de titanio se mantuvo a un potencial eléctrico constante de 3 V y se midió la densidad de corriente contra el tiempo. Para la técnica de CP se aplicó una velocidad de barrido de 5 mV/s y un sobre potencial de 0 a 3 V. Todos los experimentos fueron realizados a temperatura ambiente (~ 23°C) dentro de una campana extractora de gases. Una vez concluida la prueba, las muestras se enjuagaron con agua destilada y se secaron con un flujo de nitrógeno gaseoso. Las micrografías se obtuvieron mediante un microscopio electrónico de barrido (MEB) marca LEO VP (presión variable) 1450, en su sección superior. Con el mismo equipo, mediante el dispersor de energía de Rayos X (EDX), se identificó y evaluó el contenido de elementos químicos presentes en la capa de óxido de la muestra a través un histograma espectral en el cual se clasificaron según su energía; el eje de las X son unidades de energía (Kiloelectrovolts) y el eje de las Y es el número de cuentas o intensidad. El espesor de la sección transversal de la muestra se estimó mediante imágenes del MEB, utilizando una aceleración de voltaje de 15 kV y una distancia de trabajo de 17 y 23 mm.
3. Resultados y discusión
3.1 Comparación de las técnicas electroquímicas de CP y CA
Los parámetros de las pruebas electroquímicas de curvas de polarización y curvas de anodización potenciostática en 0.2% HF + 0.7 M H2SO4 se presentan en la Tabla 1.
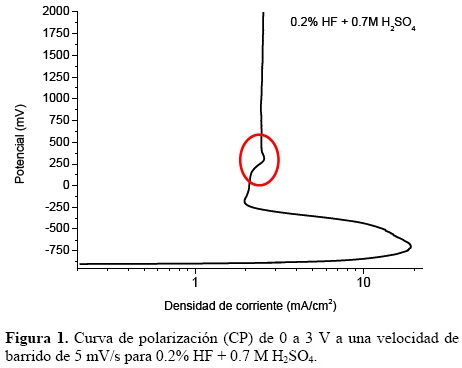
La CP muestra la densidad de corriente de la superficie del electrodo de titanio frente al potencial electroquímico de la superficie del electrodo de referencia de Ag/AgCl (a 1M de KCl). La curva puede variar dependiendo de las condiciones de oxidación en la superficie de la lámina de titanio. En la gráfica de la Figura 1 se presenta la curva de polarización de 0 a 3 V en 0.2% HF + 0.7M H2SO4 durante 10 minutos. Se puede observar que el potencial de corrosión corresponde a –875 mV y que la densidad de corriente aumenta hasta 20 mA/cm2. La formación de una capa de óxido en la lámina de Ti provoca que la densidad de corriente disminuya de 20 a 2 mA/cm2 al potencial de –125 mV. La pérdida de estabilidad y corrosión localizada de la película pasivante se refleja en el segundo incremento de la densidad de corriente en la gráfica de CP y se correlaciona con la formación auto–organizada de las nanoestructuras [22]. Este evento ocurre a un potencial de 250 mV con densidades de corriente de 1.8 mA/cm2. Nuevamente la lámina de titanio se repasiva y tiende a mantener una transpasividad (densidad de corriente constante) con el aumento en el potencial.
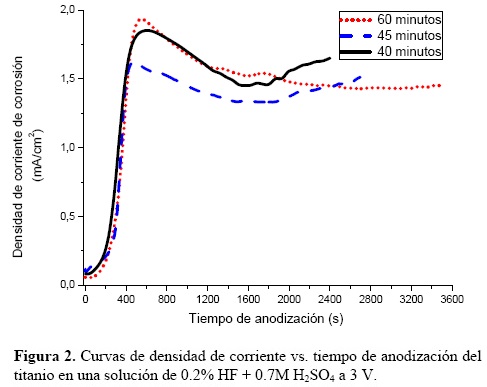
En relación a la técnica CA, las pruebas se realizaron después de los pretratamientos en la superficie de la lámina de titanio. El electrodo de titanio se mantiene a un potencial constante de 3 V y se mide la densidad de corriente con el tiempo. La evolución de la densidad de corriente respecto al tiempo de anodización se presenta en la Figura 2. La reproducibilidad del pulido y pretratamiento de la lámina de Ti se puede inferir del inicio de las tres curvas. La curva marcada a 40 minutos inicia con un aumento constante de la corriente hasta los 500 segundos a 1.8 mA/cm2, posteriormente baja constantemente a 1.5 mA/cm2 y nuevamente aumenta de forma continua por algunos segundos, para después proseguir aumentando hasta el final de la prueba a 1.7 mA/cm2. Un comportamiento muy parecido se observa en la probeta llevada hasta 60 minutos, lo que indica que la capa de óxido preformada en estas muestras es de espesor similar. En general, el incremento subsecuente de la corriente en las tres probetas indica el rompimiento del óxido en áreas localizadas. La secuencia de incrementos–decrementos de corriente indica la inestabilidad en la formación de poros auto–organizados y la regularidad de este comportamiento puede deberse a que la velocidad de disolución del óxido tiende a ser menor, por lo que contribuye de cierta manera a la formación y crecimiento de óxido.
La Figura 3 presenta las micrografías de la técnica de CA en función del tiempo de anodizado y de la técnica CP, en la solución de 0.2%HF + 0.7M H2SO4. El bajo potencial que se aplica en las pruebas electroquímicas de CA está directamente relacionado con la baja velocidad de los procesos electroquímicos de formación de óxido. Esto exacerba la importancia de los óxidos nativos y del pretratamiento [30], creando la heterogeneidad que se observa en las micrografías de las muestras obtenidas a 40, 45, y 60 minutos de tiempo de anodizado, a una magnificación de 10 KX. A 40 minutos [Fig. 3(a)] se obtuvo una morfología irregular, donde existe un gran número de poros de diferente tamaño y áreas donde no se generaron. Los poros presentes se encuentran distribuidos aleatoriamente sobre la superficie de la muestra, también se observan grietas por donde penetra la solución acuosa ácida produciendo la disolución del óxido y formación de poros. Los restos de óxido o manchas blancas sobre la morfología de la película porosa esta relacionada con el pretratamiento galvanostático. La presencia de esta capa de dióxido de titanio parece ser necesario para el proceso de anodización [31], debido a que muestra una resistencia al ataque químico en el flúor y funciona como una capa protectora, es decir, de sacrificio, que durante algún tiempo impide la disolución en la puntas del tubos [32]. A 45 minutos [Fig. 3(b)], la micrografía muestra una menor polidispersidad en el diámetro de los poros (entre 400–700 nm) y se observa un mayor ordenamiento. Persisten restos de costras del óxido preformado por el pretatamiento galvanostático que no fueron disueltas en su totalidad. A 60 minutos [Fig. 3(c)], aparentemente hay un gradiente de acidez a lo largo del poro, favoreciendo la rápida disolución del óxido en la punta vs. la formación de óxido en la parte inferior del tubo, apreciándose más el crecimiento lateral que el longitudinal de los poros, y la unión con otros poros vecinos para formar lagunas o cráteres. A bajo potencial el tiempo de anodización se relaciona más con el diámetro del poro que con su longitud. Por otro lado, con la técnica de CP se obtuvieron estructuras ordenadas de poros, cuyos diámetros oscilan entre los 200 y 400 nm [Fig. 3(d)]. En esta técnica el tiempo de exposición de las muestras es de 10 min, mucho menor que los tiempos de anodización empleados en CA, pero también está ausente la película preformada de óxido, lo que parece favorecer la formación auto–organizada de las nanoestructuras.
3.2 Composición química de la capa de óxido
Con el fin de conocer la composición de la capa porosa obtenida mediante la técnica electroquímica de CP, la Figura 4 contrasta los resultados de MEB–EDX de la lámina de Ti con el de la película formada (Figura 4a). Se pudo comprobar que la constitución de las películas de óxido de titanio (Figura 4b) generada por la técnica de CP es de aproximadamente 80% en peso Ti y 20% en peso oxígeno y no se detectó el flúor y el azufre de los ácidos utilizados. También se observa una capa de óxido que se logro desprender de la muestra mecánicamente fraccionada con un espesor promedio de 1.5 µm, mientras que para la película obtenida mediante la técnica de CA resulto ser de diferentes espesores de alrededor de 1µ como se observa en la Figura 4c, y una composición química de 30% en peso de oxígeno y 70% de Ti.
4. Conclusión
Los resultados del presente trabajo muestran que es posible encontrar parámetros de síntesis para obtener nanoestructuras porosas y auto–ordenadas de TiO2 a bajo potencial mediante las técnicas electroquímicas de CA y CP. Por CP se obtienen películas porosas en un tiempo de 10 minutos, con diámetros de poro entre 200 y 400 nm. Por la técnica de CA, se encontró que el tiempo está relacionado con el diámetro de los poros (entre 400 y 700 nm) y no tanto con la longitud del poro. El mayor tiempo de exposición para la obtención de nanoestructuras en el régimen potenciostático podría ser una consecuencia del óxido preformado en el pretratamiento de la lámina de Ti, y un factor en el mayor diámetro de poro de estas nanoestructuras.
Agradecimientos
A René Guardián Tapia por la ayuda técnica en la obtención de las micrografías del microscopio electrónico de barrido, y al Dr. Pedro Márquez por su equipo láser y tiempo brindado en el corte de las muestras, ambos del Centro de Investigación de Ingeniería y Ciencias Aplicadas–Universidad Autónoma del Estado de Morelos. María Olga Concha Guzmán agradece al CONACYT por la beca de maestría otorgada.
Referencias
[1]. J. M. Macak, B. G. Gong, M. Hueppe and P. Schmuki, Adv. Mate, 19, 3207–3031 (2007). [ Links ]
[2]. E. Roduner, Nanoscopic Materials: Size–Dependent Phenomena, Royal Society of Chemistry, Cambridge, 2006. [ Links ]
[3]. H. Tsuchiya, J. M. Macak, L. Mueller, Kunze, F. Mueller, P. Greil, S. Virtanen, and P. Schmuki, J. Biomed, Matter. Res., 77, 534 (2006). [ Links ]
[4]. J. Park, S. Bauer, K. v. d. Mark, and P. Schmuki, Nano Lett., 7, 1686 (2007). [ Links ]
[5]. J. M. Macak, M. Zlamal, J. Krysa and P. Schmuki, Small, 3, 300 ( 2007). [ Links ]
[6]. S. P. Albu, A. Ghicov, J. M. Macak, R. Hahn and P. Schmuki, Nano Lett., 7, 1286 (2007). [ Links ]
[7]. R. Hahn, A. Ghicov, H. Tsuchiya, J. M. Macak, A. G. Munoz, and P Schmuki, Phys. Status Solidi A. 204, 1281 (2007). [ Links ]
[8]. M. Paulose, K. Shankar, O. K. Varghese, G. K. Mor, and C. A. Grimes, J. Phys. D: Appl. Phys., 39, 2498 (2006). [ Links ]
[9]. O. K. Varghese, X. Yang, J. Kending, M. Paulose, K. Zeng, C. Palmer, K. G. Ong, and C. A. Grimes, Sens Lett., 4, 120 (2006). [ Links ]
[10]. X. Yu, Y. Li, W. Wlodarki, S. Kandasamy, K. Kalantarzadeh, Sensors and Actuators B: Chem., Doi: 10.1016/j.snb.2007.07.076, In press (2007). [ Links ]
[11]. Hoyer P., Langmuir, 12: 1411 (1996). [ Links ]
[12]. Kasuga T., Hiramatsu M., Hoson A., Sekino T. and Niihara K., Langmuir, 14, 3160 (1998). [ Links ]
[13]. Zhang M., Bando Y. and Wada K., Journal of Materials Science Letters, 20, 167 (2001). [ Links ]
[14]. Macak J. M., Sirotna K. and Schmuki P., Electrochim. Acta, 50, 3679 (2005). [ Links ]
[15]. Hahn R., Macak J. M., Schmuki P., Electrochem. Commun. 9, 947–952. (2007). [ Links ]
[16]. Macak J. M., Tsuchiya H., Berger S., Bauer S., Fujimoto S., Schmuki P. Chemical Physics Letters, 428 421 (2006). [ Links ]
[17]. Seyeux A., Berger S., LeClere D., Valota A., Skeldon P., Thompson G. E., Kunze J., Schmuki P. Journal of The Electrochemical Society, 156 K17 (2009). [ Links ]
[18]. Que Anh S. Nguyen, Yash V. Bhargava, and Thomas M. Devine, Journal of The Electrochemical Society, 156 E55 (2009). [ Links ]
[19]. J. M. Macak, H. Hildebrand, U. Marten–Jahns, P. Schmuki, J. Electroanal. Chem. 621, 254 (2008). [ Links ]
[20]. K. Yasuda. P. Schmuki, Electrochim. Acta 52, 4053 (2007). [ Links ]
[21]. J. M. Macak, P. Schmuki, electrochim. Acta 52,1258 (2006). [ Links ]
[22]. Bauer Sebastian, Cléber Sebastian and Schmuki Patrik, Electrochim. Comm. 8 1321 (2006). [ Links ]
[23]. Taveira L. V., Macak J. M., Tsuchiya H. Dick L. F. P. and Schmuki P., Electrochem Soc., 152, B405 (2005). [ Links ]
[24]. Gong D., Grimes C. A., Varghese O. K., Hu W. C., Singh R. S., Chen Z., and Dickey E. C., J. Mater. Res., 16 3331 (2001). [ Links ]
[25]. Paulose M., Varghese O. K., Mor G. K., Grimes C. A. and Ong K. G., Nanotechnology, 17, 398 (2006). [ Links ]
[26]. Shankar K., Mor G. K., Prakasam H. E., Yoriya S., Paulose M., Varghese O. K. and Grimes C. A., Nanotechnology, 18: 065707 (2007). [ Links ]
[27]. Cai Q., Paulose M., Varghese O. K. and Grimes C. A., J. Mater. Res. 20 230–236. (2005). [ Links ]
[28]. Yasuda K., Macak J. M., Berger S., Ghicov A. and Schmuki P., J. Electrochem. Soc. 154, C472 (2007). [ Links ]
[29]. J. Kunze, A. Seyeux, and P. Schmuki, Electrochem. Solid– State Lett., 11, K1 1 (2008). [ Links ]
[30]. M. O. Concha Guzmán, A. G. Reynaud Morales, M. E. Rincón González, C. Cuevas Arteaga. Superficies y Vacío. 23(S) 183 (2010). [ Links ]
[31]. F. Mura, A. Masci, M. Pasquali , A. Pozio, Electrochimica Acta 54, 3794 (2009). [ Links ]
[32]. J. Kunze, A. Seyeux, P. Schumuki, Electrochem. Solid–State Lett. 11, k11 (2008). [ Links ]




![Análisis del efecto del poli[bis(HEMA)-fosfaceno] y poli[(HEMA- g-PLA) fosfaceno] en la contracción de fotopolimerización de Bis-GMA:TEGDMA](/img/pt/prev.gif)









