Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Superficies y vacío
versión impresa ISSN 1665-3521
Superf. vacío vol.25 no.1 Ciudad de México mar. 2012
FTIR aplicada durante la deshidratación osmótica de mango Ataulfo (Magnífera indica L.)
Rosas Mendoza M. E.1,2* y Fernández Muñoz J. L.1
1 Departamento Ingeniería y Tecnología, FES–Cuautitlán UNAM Av. 1° de mayo s/n, Col Atlanta, Cuautitlán Izcalli, 54740 Edo. de México, México * merosas@servidor.unam.mx.
2 Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada del Instituto Politécnico Nacional, Calz. Legaria 694. Colonia Irrigación, 11500 México, D. F.
Recibido: 15 de marzo de 2011;
Aceptado: 29 de noviembre de 2011.
Resumen
El objetivo de este trabajo fue implementar un método para observar los cambios en la estructura molecular de mango Ataulfo (Magnífera indica L.) durante su deshidratación osmótica con una solución de sacarosa (45%) a 60° C. La técnica utilizada fue FTIR, en un equipo Perkin Elmer (Spectrum one), analizando las muestras deshidratadas a diferentes tiempos, como pastillas con KBr, entre 400–4000 cm–1 y 4 cm–1 de resolución. También fueron obtenidos los espectros de los sólidos insolubles en alcohol (AIS) extraídos del mango, así como de los compuestos puros de referencia: pectina, sacarosa, glucosa, fructosa y celulosa. Una vez obtenidos los espectros correspondientes al seguimiento de la deshidratación osmótica, estos fueron analizados en las frecuencias típicas de vibración para los átomos constituyentes de las moléculas de sacarosa y se obtuvo la cinética de difusión de la misma durante el proceso.
Palabras clave: Mango Ataulfo; FTIR; Deshidratación osmótica.
Abstract
The aim of this study was to implement a method to observe changes in Ataulfo mango (Magnífera indica L.) molecular structure, during osmotic dehydration with a sucrose solution (45%) at 60° C. The samples dried at different process times were analyzed, such as using KBr pellets, on a FTIR Perkin Elmer (Spectrum one), between 400–4000 cm–1 and 4 cm–1 resolution. Moreover, with this technique were obtained reference spectra for pure compounds of pectin, sucrose, glucose and cellulose, as well as the fresh mango and its extracted alcohol insoluble solids (AIS). Once the spectrums were obtained from the osmotic dehydration monitoring, these were analyzed over constituent atoms characteristic vibration frequencies of the sucrose molecules and were obtained its diffusion kinetic during the process.
Keywords: Mango Ataulfo; FTIR; Osmotic dehydration.
1. Introducción
El mango Ataulfo (Mangifera indica L.) es considerado como uno de los tres o cuatro frutos tropicales más finos, dado que el incremento de la demanda en los mercados europeo y estadounidense ha venido presionando a los países proveedores para que mejoren y estandaricen la calidad de las principales variedades, ya que en estos países se cuenta con protocolos sanitarios especiales para el mango fresco. Su extraordinario sabor, olor, color y textura lo hacen especial, no solo para su consumo en fresco, sino también como ingrediente en otros productos. Un método posible para procesar el mango es la deshidratación osmótica (DO) con soluciones de azúcar, trabajando a temperaturas suaves para conservar sus propiedades. Con esto se reduce la actividad de agua (aw) y enzimática, con cambios mínimos en las características del producto [1].
La deshidratación osmótica (DO) ha atraído gran atención desde hace varios años debido a sus ventajas potenciales, como: 1) mejor retención de color y sabor, 2) mejor conservación de la pared celular y 3) menos requerimientos de energía comparada con otros procesos de secado. A pesar de estas ventajas, sus aplicaciones comerciales siguen siendo limitadas. Para desarrollar un modelo fenomenológico que describa la transferencia de masa en la DO se debe conocer los fundamentos relacionados con la fisicoquímica, termodinámica y la bioquímica del sistema, así como los mecanismos y las cinéticas de transporte de masa [2].
Debido a los gradientes de actividad del agua y del soluto a través de la membrana celular del alimento, en el proceso osmótico se dan por lo menos dos flujos concurrentes: un flujo importante de agua del alimento hacia la solución y una transferencia simultánea de solutos desde la solución hacia el alimento. Sin embargo, el mecanismo que controla estos flujos simultáneos no se ha entendido completamente.
Desde la década de los 70's, la técnica de adquisición de datos por transformada de Fourier en el espectro infrarrojo (FTIR) ha revolucionado los métodos de análisis y el manejo de las muestras. Ha llegado a ser una técnica alternativa para el análisis de alimentos, de manera que resulta una herramienta muy útil para seguir y explicar los cambios en el producto durante su transformación [3,4].
Así, el objetivo de este trabajo fue el de implementar un método para observar los cambios en la estructura molecular de mango Ataulfo (Mangifera indica L.) durante su deshidratación osmótica con una solución de sacarosa (45%) a 60° C y la obtención de sus cinéticas de difusión.
2. Desarrollo Experimental
Los mangos fueron adquiridos en un mercado local y se mantuvieron bajo control de temperatura (14°C) y humedad relativa (90%) en una cámara climática CH–6090 (Figursa, EM, México). Se clasificaron en cinco estados de madurez, de acuerdo a pruebas analíticas de humedad, acidez titulable, firmeza y sólidos solubles [5]. Las características principales promedio de los mangos seleccionados para este estudio, correspondientes al estado de madurez 4, fueron: firmeza = 10.17 N, °Bx=18, acidez= 1.84 (g ac. cítrico/100 g), humedad = 85%. Una vez lavados y pelados, fueron rebanados longitudinalmente cerca del mesocarpio (hueso) de ambos lados; después se cortaron cubos de 1 cm. Las soluciones osmóticas se prepararon al 45% (w/w) de sacarosa, y se trabajó a 60° C a diferentes tiempos (30, 60, 90, 120, 150 y 180 min). Las muestras fueron retiradas cada 30 min y escurridas por 5 min antes de pesarse. La humedad inicial y a cada tiempo experimental, se determinó en estufa a 70 °C hasta peso constante.
Con los datos de humedad y peso de las muestras fue posible obtener los parámetros osmóticos del porcentaje de pérdida de agua y ganancia de sólidos (WL y SG, respectivamente), [6]:


donde ww0 representa el peso del agua y ws0 es el peso de los sólidos inicialmente presentes en la fruta; wt y wst son el peso de la fruta y el peso de los sólidos al final del tratamiento, respectivamente.
Para la transferencia de masa aproximada al equilibrio, se consideró una cinética de primer orden, donde los coeficientes fueron calculados de la siguiente manera [7]:

donde M y S se refiere a los g de agua y sólidos en la muestra; los subíndices 0, ∞ y t representan las concentraciones iniciales, en equilibrio y a cualquier tiempo.
Cada corrida se realizó por triplicado, ajustando estadísticamente los comportamientos promedio por intervalos de confianza al 95%.
Las muestras secas, obtenidas de la determinación de humedad, fueron analizadas como pastillas con KBr en un equipo FTIR Perkin Elmer (Spectrum one), entre 400–4000 cm–1 y 4 cm–1 de resolución. También con esta técnica se obtuvieron los espectros de referencia para compuestos puros de pectina, sacarosa, glucosa, fructosa y celulosa, así como del mango fresco y de los sólidos insolubles en alcohol (AIS) extraídos del mismo, de acuerdo al procedimiento descrito por Forni y colaboradores [8]. Se probó el efecto de diferentes concentraciones de muestra en las pastillas, espesores y número de escaneos para estandarizar el método de análisis. Se obtuvieron los espectros para 10, 50 y 100 escaneos con el fin de determinar su efecto sobre la muestra. El espesor de las pastillas fue determinado por un micrómetro digital después de cada prueba. Después de analizar estadísticamente el efecto de la concentración (ANOVA) y del número de escaneos (regresión lineal del comportamiento) con MINITAB 15, se obtuvieron los espectros correspondientes al seguimiento de la deshidratación osmótica de acuerdo al método ya estandarizado. Se realizó el análisis en las frecuencias típicas de vibración para los átomos constituyentes de las moléculas de sacarosa (900–1500 cm–1) y se obtuvo la cinética de difusión de la misma durante el proceso.
En la medición de los espectros de transmitancia, es difícil detectar bandas de baja intensidad cuando se solapan por bandas de mayor intensidad; su detección se facilita considerablemente midiendo la segunda derivada de la curva de transmitancia con respecto a la longitud de onda. La deconvolución de espectros FTIR fue obtenido con el método Savitsky–Golay (polinomio de segundo orden con 15 puntos) mediante el programa Origin pro 8, a fin de mejorar la resolución aparente y amplificar pequeñas diferencias [9].
3. Resultados y Discusión
Durante la deshidratación osmótica, se obtuvieron los parámetros osmóticos WL y SG, de donde se puede observar que el producto perdió aproximadamente 75% de agua y obtuvo un 45% de sólidos en tres h de proceso (fig. 1). La cantidad de sacarosa captada por las muestras (g/g de sólido seco) a cada tiempo experimental se muestra en la cinética de la figura 2, con lo que se corrobora lo observado con los parámetros osmóticos.


También se obtuvieron las velocidades de cambio en contenido de humedad (–dm/dt) y en contenido de sólidos (ds/dt) en función de los contenidos promedio de humedad y sólidos, respectivamente, para inferir los contenidos en equilibrio (M∞, S∞), así como para obtener los coeficientes de transferencia de masa (km, ks), que se muestran en la tabla 1. Aquí se observa que durante la primera media hora de proceso se triplica la velocidad de transferencia de agua, mientras que la de los sólidos se cuadriplica; esto es porque la deshidratación osmótica de alimentos incluye dos tipos de transferencia de masa: la difusión de agua del alimento a la solución y la difusión de solutos de la solución al alimento. En el primer tipo, la fuerza conductora de la transferencia de masa es la diferencia de presión osmótica, mientras en la segunda es la diferencia de concentraciones. Por lo tanto, la mayor captación de sólidos por el alimento ocurre en los primeros 30 min, según se observa con el valor de los sólidos en equilibrio (más del 50% del proceso de 3 h), y posteriormente la presión osmótica es la responsable de la salida de la mayor cantidad de agua (casi hasta un 6.5% del valor en equilibrio para 30 min).
Las muestras secas fueron entonces sometidas a una FTIR. El análisis de varianza de dos vías para los datos de concentración, así como la inspección visual de los espectros, dio como resultado que la mejor concentración para las pastillas con KBr era del 2% (0.05 g de peso total) las cuales tuvieron un espesor promedio de 0.30 mm. También que el número de escaneos (10, 50 y 100) no tuvo diferencia significativa en la obtención de espectros (fig.3). En la evaluación de las ecuaciones de regresión lineal del % de Transmitancia vs número de escaneos, se encontró una fuerte dependencia entre variables, además de observarse el cambio de pendiente en los valores correspondientes a las vibraciones de los grupos OH (3391 y 1636 cm–1), indicativo de la deshidratación de la muestra con los escaneos. Por lo tanto, el número de escaneos elegido como adecuado fue de 10, ya que se obtienen espectros con menos ruido y no se corre el riesgo de degradar la muestra.

De la comparación de espectros para sustancias puras, puede observarse que la fibra extraída (AIS) del mango tiene un comportamiento más parecido a la pectina que a la celulosa (fig. 4), principalmente en las frecuencias 1745 y 1640 cm–1, correspondientes a los grupos carboxil de la molécula. Estos espectros fueron útiles para diferenciar las vibraciones de las moléculas de los diferentes constituyentes del mango, las cuales se muestran en la tabla 2.


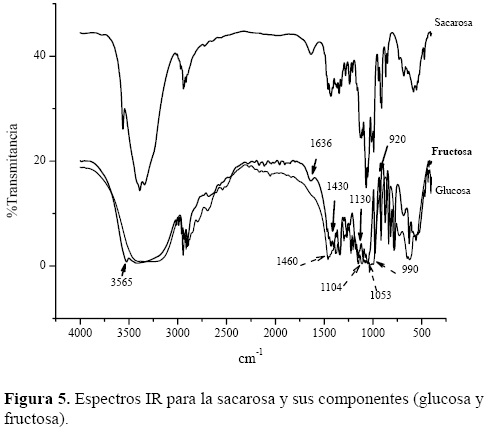
En la figura 5 se muestra el espectro de la sacarosa, así como de sus moléculas constituyentes, donde se observan los picos característicos de la fructosa y aquellos de los enlaces glucosídicos y del anillo de la glucosa (tabla 2).
La figura 6 muestra la condición inicial del mango (estado fresco), a los 30 min de proceso y la condición final para el mango deshidratado, en comparación con el espectro de la sacarosa, de manera que pueden observarse los picos característicos del soluto utilizado en la solución hipertónica durante el proceso; aquí se presentan los picos característicos de la sacarosa cristalizada, debido a que la muestra fue secada antes del IR. Esto es porque si la nucleación es considerada como un paso para establecer enlaces de hidrógeno sacarosa–sacarosa, el secado asegura que los sitios potenciales para el enlace hidrógeno no están ocupados por agua de hidratación [10] También es posible observar como desde los primeros 30 min ya se tienen desarrollados dichos picos, por lo que fue necesario repetir la experimentación en este tiempo, tomando muestras cada 5 min, de manera que se pudiera apreciar la difusión del soluto en solución hacia el producto.
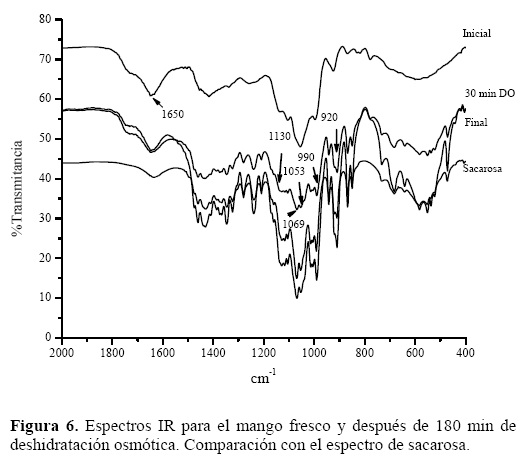
La forma del espectro en la región entre 900 y 1500 cm–1 es similar durante la deshidratación. Los picos entre 900 y 1200 cm–1, surgen de una combinación del estiramiento (stretch) de los enlaces C–O, C–C y la deformación (bend) de los C–O–H. Las posiciones de estos picos pasan progresivamente a un menor número de onda, y aumenta su ancho de banda. Estos cambios de frecuencia, inducidos por la deshidratación, derivan del nivel de modificación del hidrógeno en los grupos C–O–H [11]. Al parecer, las interacciones del enlace de hidrógeno entre sacarosa y agua en solución son sustituidas por enlaces de hidrógeno intermoleculares en la sacarosa durante la deshidratación, por lo que se ve afectada la movilidad del agua y del soluto y, por tanto, su velocidad de transferencia de masa, como se observa en la tabla 2.
La formación del enlace hidrógeno trae consigo un cambio en la frecuencia de la vibración de estiramiento del grupo receptor hacia valores más pequeños. El menor número de onda de la banda de estiramiento del OH (1650 cm–1) puede ser asignado a la de las moléculas del enlace de hidrógeno más fuerte con el carboxilato del polímero péctico, que son las moléculas de agua en la primera capa de hidratación. Significa que la proporción de agua fuertemente ligada es superior en un bajo contenido de agua en la muestra [10].
Para poder tener un mejor conocimiento de las interacciones de sacarosa– agua como se observa por sus características de transmitancia en la FTIR, es posible seguir las razones de intensidad de los picos característicos del agua y sacarosa. Esto se logra a través de la relación entre la intensidad de deformación (CH2)/(HOH), de los picos en 1460 y 1640 cm–1. Las discontinuidades constituyen una línea límite entre el estado diluido, donde prevalecen las interacciones agua–agua, y el estado concentrado, donde tienen lugar las interacciones agua–sacarosa y sacarosa–sacarosa. Para sacarosa, el efecto ha sido discutido previamente y asignado al plegado de la molécula alrededor del enlace glucosídico, permitiendo, en la solución concentrada, una estructura similar a la de cristal con dos enlaces hidrogeno intramoleculares [10]. La relación de intensidades integradas de los rangos de vibración 1460–1239 y 1130–990 cm–1 (CH2)/(COH) fue establecido para la sacarosa para comprobar el efecto de la concentración; los cambios bruscos son probablemente debidos al doblamiento de la molécula y el establecimiento de enlaces de hidrogeno intramoleculares cuando la concentración es mayor [11]. La figura 7 muestra estas proporciones y puede verse que la estructura cambia principalmente alrededor de 40% de sólidos solubles, donde las moléculas presentan menos movilidad debido a las interacciones de sacarosa– sacarosa y el plegamiento molecular. Este cambio se produce alrededor de los 120 min de deshidratación osmótica, aproximadamente.

Los espectros obtenidos en muestras a diferentes tiempos de deshidratación, fueron analizados en las frecuencias típicas de vibración para los átomos constituyentes de las moléculas de sacarosa, a partir de los cuales fue posible obtener las cinéticas para la difusión de azúcar durante la deshidratación osmótica (fig.8).
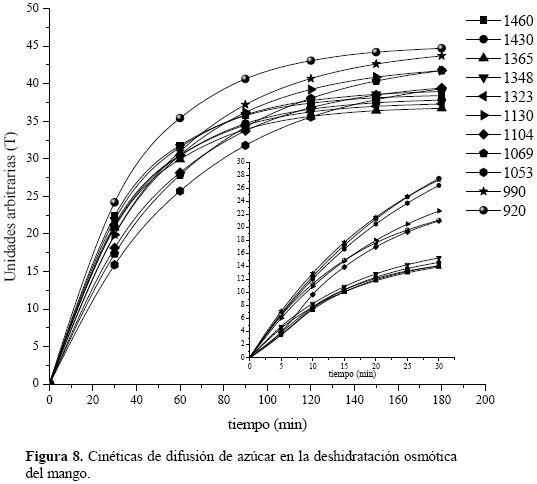
En las cinéticas obtenidas a partir de los espectros infrarrojos, puede observarse principalmente la evolución de los enlaces del tipo C–OH (1069 y 990 cm–1) y C–O–C (1053 cm–1) del enlace glucosídico entre las moléculas del azúcar, durante los primeros 30 min de deshidratación; mientras que después de 180 minutos los principales enlaces corresponden al C–H (920 cm–1) del esqueleto de los azúcares, a los C–OH entre moléculas y a aquellos adyacentes a un carboxilo (990 y 1130 cm–1) [11]. De esta manera es posible ir siguiendo los cambios en la estructura molecular del producto durante la deshidratación osmótica.
4. Conclusiones
El método estandarizado para la preparación de muestras, obtención, análisis y comparación de espectros infrarrojos, permite tener datos estadísticamente confiables para el estudio de la operación y del fenómeno de transferencia de masa en mangos, así como para la posterior construcción de las cinéticas de difusión.
La frecuencia de una vibración determinada, y por tanto, su localización en el espectro del infrarrojo, puede estar relacionada con dos factores: las masas de los átomos enlazados y la relativa rigidez del enlace. Por lo tanto es importante contar con muestras de concentración y espesor controlado, ya que la relación de la ley de Beer–Lambert entre concentración y absorción de luz está basada en el uso de espectroscopía para identificar sustancias.
A partir de la obtención de los parámetros osmóticos, velocidades de transferencia de masa y las cinéticas de difusión, es posible determinar el cambio en la estructura molecular y la concentración de algún componente de interés en la muestra.
Referencias
[1]. J. Martinez–Monzo, A. Calero, A.Ayala, A. Chiralt y P. Fito, in: Proceedings of the Eighth International Congress on Engineering and Food, ICEF 8. Eds. J. Welty–Chanes, G. V. Barbosa–Cáanovas y J. M. Aguilera (Lancaster: Technomic Publishing Co. Inc., 2001) p. 1264. [ Links ]
[2]. J. Shi y M. Le Maguer, Food Rev. Int. 18, 305 (2002) [ Links ]
[3]. D. W. Sun, Infrared spectroscopy for food quality analysis and control (Academic Press, EUA, 2009). [ Links ]
[4]. B. C. Smith, Fundamentals of Fourier transform infrared spectroscopy (CRC, EUA, 1996). [ Links ]
[5]. NMX–FF–058–SCFI–2006. Productos alimenticios no industrializados para consumo humano. Fruta fresca. Mango (Mangifera indica L.) – Especificaciones. Dirección general de normas. [ Links ]
[6]. H. Mujica–Paz, A. Valdez–Fragoso, A. Lopez–Malo, E. Palou y J. Welti– Chanes, J. Food Eng. 57, 305 (2003). [ Links ]
[7]. N. K. Rastogi y K. S. M. S. Raghavarao, Lebensm.–Wiss. u.– Technol. 37, 43 (2004). [ Links ]
[8]. E. Forni, D. Torreggiani, P. Battiston y A. Polesello, Carbohyd. Polym. 6, 379 (1986). [ Links ]
[9]. A. Savitzky y M. J. E. Golay, Anal. Chem., 36, 1627 (1964). [ Links ]
[10]. M. Mathlouthi y J. Genotelle, Carbohyd. Polym. 37, 335 (1998). [ Links ]
[11]. M. Kačuráková y M. Mathlouthi, Carbohyd. Res. 284, 145 (1996). [ Links ]














