Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Superficies y vacío
versão impressa ISSN 1665-3521
Superf. vacío vol.25 no.1 Ciudad de México Mar. 2012
Caracterización y aplicación de películas a base de gelatina–carboximetilcelulosa para la preservación de frutos de guayaba
Aguilar–Méndez M. A.1*, San Martín–Martínez E.1, Espinoza–Herrera N. L.2, Sánchez–Flores M.2, Cruz–Orea A.3 y Ramírez–Ortíz M. E.3
1 Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada del IPN Calz. Legaria 694, Col. Irrigación, C.P. 11500, México D.F., México. *maguilarme@ipn.mx.
2 Universidad Autónoma del Estado de México, Facultad de Química Paseo Colón esquina Paseo Tollocan S/N, C.P. 50000, Toluca, México.
3 Departamento de Física, Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional Av. Politécnico 2508, Col. San Pedro Zacatenco, C.P. 07360, México D. F., México.
4 Facultad de Estudios Superiores de Cuautitlán–UNAM Campo 1, Av. 1 de mayo s/n, 54740 Edo. de México, México.
Recibido: 3 de julio de 2011;
Aceptado: 28 de noviembre de 2011.
Resumen
El interés en el desarrollo y uso de empaques alimenticios a base de biomateriales ha venido creciendo debido en gran medida a la necesidad de reducir y sustituir el empleo de plásticos y envases sintéticos, por materiales menos agresivos con el medio ambiente. Además, estos materiales pueden actuar como barreras semipermeables preservando las características organolépticas de productos vegetales. En este sentido, en la presente investigación se elaboraron películas comestibles a base de gelatina y carboximetilcelulosa (CMC) estudiando el efecto del contenido de glicerol y pH en sus propiedades fisicoquímicas. Asimismo, se evaluó el efecto de las películas en la vida postcosecha de frutos de guayaba. La caracterización de las películas se realizó a través de la resistencia a la ruptura, coeficiente de difusión al vapor de agua y solubilidad en agua. Estas propiedades estuvieron en función del contenido de glicerol y el pH de la solución formadora de película. Los resultados indicaron que tanto la incorporación de glicerol como el pH influyeron de manera importante en las propiedades evaluadas. Los frutos recubiertos con películas de gelatina–CMC presentaron menores pérdidas de peso y menores pérdidas de firmeza en comparación con los frutos control, sin embargo, no se identificaron diferencias en °Brix.
Palabras clave: Películas comestibles; Gelatina; Carboximetilcelulosa; Guayaba.
Abstract
Development and use of food packaging based on biomaterials have gained significant interest due to the need to reduce and replace the use of plastics and synthetic packaging for eco–friendly materials. In addition, these materials can act as semipermeable barriers while preserving the organoleptic characteristics of plant products. In the present work, gelatin–carboxymethylcellulose based edible films were prepared studying the effects of glycerol content and pH on their physicochemical properties. Also, the effect of the films on the postharvest shelf–life of guava fruit was determined. The characterization of the films was performed through the puncture strength test, water vapor diffusion coefficient and water solubility. Results indicated that both, glycerol and pH were determinant on the evaluated properties. Fruits coated with edible films showed lower weight losses and lower firmness losses as compared to control fruits, however, no differences were found in °Brix.
Keywords: Edible films; Gelatin, Carboxymethylcellulose, Guava.
1. Introducción
El desarrollo de recubrimientos comestibles ha tomado mucha importancia debido a que el uso de estos materiales permite aumentar la vida de anaquel, mejorar las propiedades organolépticas y reducir el uso de materiales de embalaje no degradables en muchos productos alimenticios [1,2]. El empleo de películas o recubrimientos sobre la superficie de frutos y vegetales puede retardar la deshidratación, modificar el intercambio gaseoso (CO2 y O2) y prevenir la pérdida de sustancias aromáticas. La efectividad de estos materiales depende en gran medida de su composición, proceso de formación y el método de aplicación en el producto [3].
Polisacáridos, proteínas y lípidos han sido utilizados como materias primas en la fabricación de películas y recubrimientos comestibles [4]. Sin embargo, los materiales elaborados con un solo componente presentan pobres propiedades de barrera y/o mecánicas, dependiendo del tipo de biopolímero utilizado. Para contrarrestar estas deficiencias, es necesario emplear mezclas de entre 2 o más componentes con la finalidad de mejorar las propiedades y características del material resultante [5]. Adicionalmente, el uso de un agente plastificante mejora en gran medida la flexibilidad y elasticidad de películas comestibles [6]. En términos estructurales, los plastificantes son insertados en la matriz polimérica, incrementando el espacio libre entre las cadenas y provocando una disminución de las fuerzas intermoleculares a lo largo de la matriz [7].
La gelatina representa una alternativa viable como material formador de películas debido a su abundancia, bajo costo y disponibilidad [8]. Por su parte, la CMC es un derivado de la celulosa que ha recibido una atención considerable por sus aplicaciones en frutas y vegetales. Su carácter hidrofílico, alta viscosidad en soluciones diluidas, buenas propiedades formadoras de película e inocuidad, han diseminado su uso en la industria alimentaria [9].
Las pérdidas postcosecha en muchos productos hortofrutícolas son muy importantes. Se estima que en países desarrollados, entre 5–25% del total de frutas frescas y vegetales cosechados se pierden debido a varios factores. Sin embargo, en países en vías de desarrollo, este porcentaje puede alcanzar hasta un 80%, dependiendo del tipo de producto y de la región de cultivo. Para reducir estas pérdidas, es necesario entender los factores biológicos y medioambientales relacionados con su deterioro y el uso de tecnologías postcosecha que retrasen la senescencia y mantengan la calidad del producto lo mejor posible [1].
La aplicación de barreras físicas como recubrimientos en la superficie de frutos puede regular la permeabilidad al O2, CO2 y vapor de agua, retardando el proceso natural de maduración [5, 6]. El uso de cubiertas comestibles también permite mejorar las propiedades mecánicas de los productos hortícolas durante su manejo [7]. Otra de las ventajas que tienen los recubrimientos comestibles es que son biodegradables, y por lo tanto, "amigables" con el medio ambiente. En el futuro este tipo de materiales podrían estar disponibles para reemplazar parcial o totalmente a los empaques sintéticos [8].
La guayaba, al igual que muchas frutas climatéricas, es de naturaleza delicada, corta vida postcosecha, y susceptible de sufrir daños por frío. Todos estos aspectos, limitan el potencial de comercialización de este fruto [10]. El uso de un recubrimiento comestible puede ser una alternativa viable para mantener la calidad y extender la vida de anaquel de frutos de guayaba.
El objetivo del presente trabajo fue elaborar películas a base de gelatina–CMC, determinar sus propiedades de barrera al vapor de agua, mecánicas y de solubilidad, y evaluar su efecto como recubrimientos en la calidad postcosecha de frutos de guayaba.
2. Materiales y Métodos
2.1. Materiales
Para la elaboración de las películas se utilizó gelatina "tipo A" (Gelita México S. de R.L. de C.V.), carboximetilcelulosa (Sigma–Aldrich, EUA) y glicerol (Merck, Alemania). Los frutos de guayaba utilizados en esta investigación fueron adquiridos en un mercado local de la ciudad de Toluca, Estado de México. Previo a la experimentación se realizó una selección manual de los frutos con un estado de madurez uniforme.
2.2. Elaboración de películas a base de Gelatina–CMC
Soluciones acuosas de gelatina–CMC (1% p/v, relación 1:1) fueron preparadas siguiendo las condiciones de pH y concentración de glicerol establecidas en el diseño experimental (Tabla 1). Disoluciones de NaOH 0.1M y HCL 0.1M se utilizaron para ajustar el pH de las soluciones. Las soluciones fueron sometidas a un tratamiento térmico de 90±2 °C por 30 min, en una parrilla de calentamiento con agitación constante (Thermolyne, USA). Al finalizar el tratamiento, se colocaron 20 mL de la solución filmogénica en cajas petri recubiertas con teflón. El secado de las películas se realizó en una estufa de control digital (Modelo Fe–294AD, Feligneo, México,) a una temperatura de 28±2 °C por 24 h. Previo a la caracterización de las películas, éstas fueron acondicionadas en un desecador con una humedad relativa de 50±2%, empleando una solución saturada de Mg(NO3)2·6H2O.
2.3. Resistencia a la rupture
La resistencia a la ruptura se determinó empleando un texturómetro TA–XT2i, Texture Analyser (Stable Micro Systems, UK). Muestras de 2.5 cm de diámetro fueron fijadas entre dos placas de acrílico, las cuales tenían un orificio central de 1.6 cm de diámetro, y un anillo de plástico que sujetaba la película entre las placas. Un celda esférica de 1.27 cm de diámetro fue empleada en el análisis, a una velocidad de ensayo de 1 mm/s. La fuerza máxima justo antes del rompimiento fue tomada como resistencia a la ruptura (N).
Coeficiente de difusión al vapor de agua (CDVA)

Para la determinación del coeficiente de difusión al vapor de agua se utilizó la técnica fototérmica reportada por Aguilar–Méndez y col. [11]. En esta metodología, un haz de luz de una lámpara de tungsteno de 400 W fue mecánicamente modulado y dirigido a una celda fotoacústica cilindrica. La celda fotoacústica fue sellada por un lado con una ventana de cuarzo, a donde se adhirió por el lado interno una hoja de aluminio de 12 µm de espesor. De esta manera, únicamente se utilizaron ondas térmicas para detectar las variaciones de presión que se produjeron en la celda fotoacústica. En el lado opuesto de la celda se colocó la muestra bajo estudio y, a su vez, ésta fue expuesta a una solución acuosa saturada de KNO3 (Sigma Aldrich, USA), la cual proporcionó una humedad relativa constante (97%). Las fluctuaciones de presión producidas en la cámara fotoacústica, como consecuencia del calentamiento periódico de la hoja de aluminio, fueron detectadas por un micrófono de electreto acoplado a la celda a través de un canal fino. El voltaje de salida del micrófono fue conectado a un amplificador lock–in y la señal resultante (mV) fue finalmente almacenada en un computador. Las mediciones fueron realizadas a una frecuencia de modulación constante de 24 Hz. La evolución de la amplitud de la señal fotoacústica (S), en función del tiempo, puede ser descrita por una ecuación correspondiente a una cinética de primer orden (ecuación 1).
Donde S0 representa la amplitud inicial de la señal fotoacústica, ΔS es la excursión de la señal fotoacústica, t0 es el tiempo en el cual la humedad relativa es cambiada, y td es el tiempo característico de difusión del vapor de agua en la muestra dado por td= l2/(2D), donde D es el CDVA y l es el espesor de la muestra. Por lo tanto, del ajuste de la evolución temporal de la señal fotoacústica a la ecuación (1) y tomando td como parámetro de ajuste, es posible determinar el CDVA (D).
2.4. Solubilidad en agua
Se utilizó la metodología descrita por Wang y col. [12]. Muestras de películas fueron cortadas en círculos de 2.5 cm de diámetro y secadas a 100 °C por 24 h para obtener un peso constante. Posteriormente las muestras fueron inmersas en 100 mL de agua destilada por 24 h. Finalmente, las muestras fueron removidas del agua y secadas a las condiciones ya descritas. La solubilidad en agua de las películas fue reportada como pérdida de peso (%) mediante la ecuación (2).

2.5. Aplicación de recubrimientos en frutos de guayaba
Se seleccionaron los experimentos 5, 6 y 9 (Pel 5, Pel 6 y Pel 9, respectivamente) del diseño experimental, para su aplicación en frutos de guayaba. Esta selección se realizó en base a la concentración del plastificante (0.08, 0.50 y 0.92 % de glicerol), ya que fue esta variable la que más influencia tuvo en las propiedades evaluadas de las películas. Los frutos fueron previamente lavados y sanitizados en agua clorada (100 ppm cloro) durante 5 min, y posteriormente inmersos en la solución formadora de película durante 60 s. Los frutos fueron secados al ambiente y almacenados a una temperatura de 6 °C hasta la realización de los análisis.
2.6. Pérdida de peso en frutos de guayaba
La pérdida de peso fue determinada pesando los frutos recubiertos y no recubiertos durante un período de 15 días. Las mediciones se realizaron por quintuplicado. Los datos se expresaron en porcentaje utilizando la ecuación (2).
2.7. Firmeza del fruto
La firmeza de los frutos fue determinada utilizando un texturómetro TA–XT2i Texture Analyser (Stable Micro Systems, UK). La penetración de los frutos fue realizada con una celda en forma de aguja de 2 mm de diámetro. La distancia recorrida fue de 10 mm a una velocidad de 5 mm/s. Se realizaron 5 mediciones en cada fruto, realizando pruebas por quintuplicado de cada tratamiento. La fuerza máxima fue reportada como firmeza (N).
2.8. °Brix
La determinación de °Brix se realizó con un refractómetro Master T (Atago Co., Japón). Una gota del jugo de la fruta fue colocada sobre el refractómetro y se tomó la lectura señalada. El análisis se realizó por quintuplicado.
3. Resultados y Discusión
3.1. Resistencia a la rupture
La Figura 1 muestra que la resistencia a la ruptura de las películas aumentó a medida que la concentración de glicerol fue mayor. Esto debido a la disminución de las interacciones entre biopolímeros, especialmente interacciones proteína–proteína, lo que favoreció un incremento en la movilidad de las cadenas poliméricas [13]. Por otra parte, la disminución en el contenido del agente plastificante se reflejó en películas quebradizas y poco flexibles. El pH también influyó de una manera importante en esta propiedad, ya que los valores de resistencia se incrementaron al aumentar el pH. La solubilidad de las proteínas disminuye a medida que éstas se acercan a su punto isoeléctrico, ya que las interacciones electrostáticas intermoleculares tienden a ser máximas en este punto [14]. En el caso de la gelatina, su punto isoeléctrico se encuentra en un intervalo de pH de 4.8–5, por lo que valores de pH lejanos a este rango favorecen la solubilidad de la proteína manteniéndola dispuesta a interaccionar con los demás componentes. Como puede observarse en la superficie de respuesta (Figura 1), las mejores propiedades de resistencia a la ruptura en películas de gelatina–CMC se pueden obtener bajo condiciones de 0.92% de glicerol y un pH de 8.8.
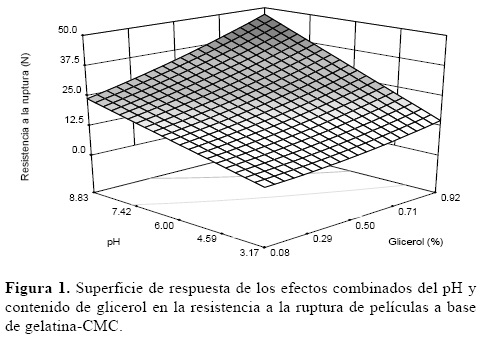
De acuerdo con el análisis de varianza, la probabilidad de ajuste para esta variable fue estadísticamente significativa (P<0.05). La ecuación (3) muestra el modelo matemático para la resistencia a la ruptura. Mediante este modelo es posible evaluar el efecto de cada uno de los factores y la interacción de ellos sobre la resistencia a la ruptura empleando para ello una superficie de respuesta (figura 1).
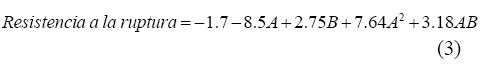
Donde A corresponde a la concentración de glicerol y B corresponde al pH.
3.2. Coeficiente de Difusión al Vapor de Agua (CDVA)
La superficie de respuesta (Figura 2) muestra que el CDVA aumentó en proporción a la concentración del plastificante.
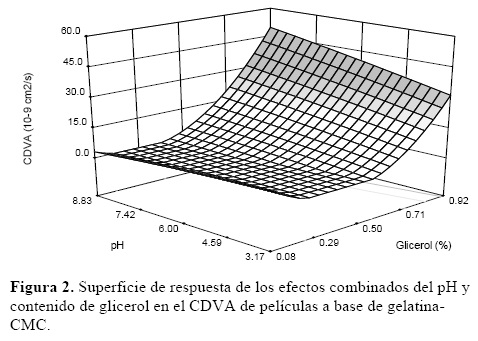
El glicerol tiene la capacidad de reducir las interacciones entre biopolímeros, lo que incrementa el espacio intermolecular y por lo tanto la permeabilidad de las películas. Además, dicho plastificante, al ser una molécula hidrofílica favorece la adsorción–desorción de las moléculas de agua [15]. Resultados similares fueron reportados por Bertuzzi y col. [16] en películas comestibles a base de almidón. Por otro lado, el CDVA aumentó ligeramente a medida que el pH se incrementó, esto empleando concentraciones de glicerol mayores a 0.7%.
De acuerdo con el análisis de varianza, la probabilidad de ajuste para esta variable fue estadísticamente significativa (P<0.05). La ecuación 4 muestra el modelo matemático para calcular el coeficiente de difusión al vapor de agua.
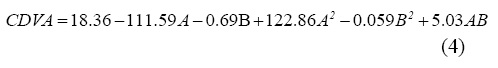
Donde A corresponde a la concentración de glicerol y B corresponde al pH.
3.3. Solubilidad en agua
La solubilidad involucra la penetración de las moléculas de agua en la matriz polimérica, esto es seguido por la disrupción de las fuerzas de Van der Walls entre las cadenas poliméricas [17]. De acuerdo con los resultados, la concentración de glicerol tuvo gran importancia en la solubilidad de las películas (Figura 3), debido a que es una molécula hidrófila, ésta es compatible con los biopolimeros que conforman la película[16], por lo que a mayor concentración de glicerol, la solubilidad de la película se favoreció. Esta propiedad también está relacionada con las propiedades de barrera al vapor de agua, ya que entre mayores sean los valores de barrera menor será su solubilidad en agua [18].

El modelo para esta variable dependiente mostró un buen ajuste con los datos experimentales (F<0.05). La ecuación (5) muestra el modelo matemático para la solubilidad.

Donde A corresponde a la concentración de glicerol y B corresponde al pH.
3.4. Pérdida de peso en frutos de guayaba
La pérdida de peso en los frutos es debida principalmente a la pérdida de agua causada por los procesos de transpiración y respiración. [19]. Uno de los propósitos de la aplicación de cubiertas sobre la superficie de frutos, es retardar la migración de humedad y la pérdida de compuestos volátiles [20].
La figura 4 muestra la pérdida de peso de los frutos de guayaba expresada en porcentaje, en función de los días de almacenamiento. Es evidente que todos los frutos presentaron una pérdida de peso progresiva con el tiempo de almacenamiento, sin embargo ésta fue más evidente en los frutos sin recubrimiento. Al finalizar el experimento (15 días) se observó que los frutos recubiertos con la película 5 fueron los que presentaron menores perdidas de peso, seguidos de aquellos recubiertos con las películas 9 y 6. Cabe señalar que estos resultados concuerdan con los de CDVA, ya que las películas 5 y 6 fueron las que presentaron los menores y mayores valores de CDVA respectivamente. El análisis de varianza arrojó diferencias estadísticamente significativas (P<0.05) entre los tratamientos. La Figura 5 muestra claramente el efecto del recubrimiento sobre el proceso de maduración de los frutos de guayaba. Al finalizar el experimento los frutos recubiertos presentaron una mejor apariencia producto de la extensión de su vida de anaquel.


3.5. Firmeza del fruto
La pérdida de textura es el cambio más notable que ocurre en frutas y vegetales durante su almacenamiento, y está relacionado con los cambios metabólicos y con la pérdida de humedad [21].
La figura 6 muestra que la firmeza de los frutos disminuyó a lo largo del periodo de almacenamiento. Sin embrago los frutos control presentaron menores valores de firmeza al finalizar el experimento (día 15). Es posible observar que los frutos recubiertos con la película 5 retuvieron mejor sus propiedades texturales. Estos resultados concuerdan también con los obtenidos para pérdida de peso, ya que estos frutos presentaron los menores valores. El análisis de varianza también arrojó diferencias estadísticamente significativas (P<0.05) entre frutos recubiertos y no recubiertos. La textura del fruto está determinada, en gran medida, por la composición de la pared celular. La degradación de la pared celular ocurre con la solubilización y depolimerización de las sustancias pécticas [18]. Durante la maduración de los frutos la degradación de estas sustancias se incrementa producto de la activación de enzimas como la pectinesterasa y galacturonasa. De acuerdo con Yaman y Bayoindirli [22], ambientes con atmósfera modificada, reducen la actividad enzimática causante de la degradación de las paredes celulares, permitiendo así la retención de la firmeza de frutas y vegetales.

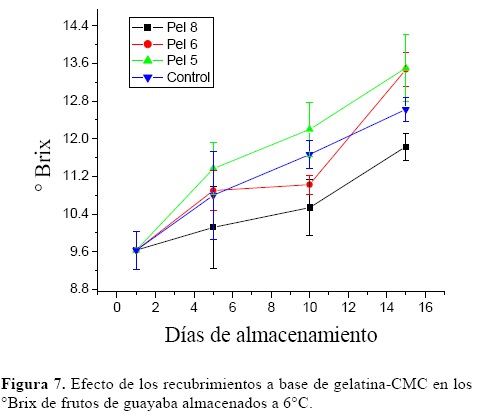
3.6. Brix
Los Brix representan el % de sacarosa que hay en el jugo del fruto y es un parámetro indicativo de la madurez de los frutos ya que los valores usualmente se incrementan en el periodo de maduración.
La figura 7 muestra que los valores de °Brix se incrementaron con el tiempo de almacenamiento y que los frutos recubiertos con la película 8 presentaron los menores valores. Sin embargo estadísticamente, no existieron diferencias entre los distintos tratamientos (P>0.05).
4. Conclusiones
La incorporación de glicerol y el pH tuvieron una influencia importante en las propiedades de películas a base de gelatina–CMC. Al incrementar la concentración del plastificante se mejoraron las propiedades mecánicas y se favoreció la solubilidad en agua de las películas. Sin embrago, las propiedades de barrera contra el vapor de agua disminuyeron a medida que aumentó el contenido de glicerol. El uso de recubrimientos a base de gelatina–CMC redujo visiblemente los signos postcosecha en frutos de guayaba. En general los frutos recubiertos presentaron menores pérdidas de peso y retuvieron mejor la firmeza que los frutos control. El ANOVA no arrojó diferencias estadísticamente significativas en la concentración de °Brix para los distintos tratamientos. Finalmente se puede concluir que el uso de los recubrimientos permitió duplicar la vida de anaquel de frutos de guayaba almacenados en condiciones de refrigeración.
Referencias
[1] R. Sharma, D. Singh and R. Singh, Biol. Control 50, 205 (2009). [ Links ]
[2] S. Xu, X. Chen and D. Sun, J. Food Eng. 50, 211 (2001). [ Links ]
[3] M. Martínez–Ferrer, C. Harper, F. Pérez–Muñoz and M. Chaparro, J. Food Sci. 67, 3365 (2002). [ Links ]
[4] L. Cisneros–Zevallos and J. M. Krochta, J. Food Sci. 68, 176 (2003). [ Links ]
[5] T. Diab, G. C. Biliaderis, D. Gerasopoulos and E. Sfakiotakis, J. Sci. Food Agr. 81, 988 (2001). [ Links ]
[6] P. Dutta, S. Tripathi, G. Mehrotra and J. Dutta, Food Chem. 114, 1173 (2009). [ Links ]
[7] B. Pérez y R. Báez, Alimentaria julio–agosto, 59 (2003). [ Links ]
[8] R. Geraldine, N. Ferreira, D. Alvarenga and L. Goncalves, Carbohydr. Polym. 72, 403 (2008). [ Links ]
[9] M. Tzoumaki, C. Biliaderis and M. Vasilakakis, Food Chem. 117, 55(2009). [ Links ]
[10] Singh, S. and Pal, R. Postaharvest Biol. Technol. 47, 296 (2008). [ Links ]
[11] M. A. Aguilar–Mendez, E. San Martin–Martinez, J. E. Morales, A. Cruz–Orea and M. R. Jaime–Fonseca, Anal. Sci. 23, 457 (2007). [ Links ]
[12] L. Wang, L. Liu, J. Holmes, J. Kerry and J. Kerry, J. Food Sci. Technol. 42, 1128 (2007). [ Links ]
[13] P. Sobral, J. Dos Santos and F. García, J. Food Eng. 70, 93 (2005). [ Links ]
[14] H. Bae, H. Park, S. Hong, Y. Byun, D. Darby, R. Kimmel and W. Whiteside, J. Food Sci. Technol. 42, 1179 (2009). [ Links ]
[15] M. Rodríguez, J. Osés, K. Ziani and J. Maté, Food Res. Int. 39, 840 (2006). [ Links ]
[16] M. Bertuzzi, E. Castro, M. Armada and J.C. Gottifredi, J. Food Eng. 80, 972 (2007). [ Links ]
[17] K. Turhan and F. Sahbaz, J. Food Eng. 61, 459 (2004). [ Links ]
[18] G. Olivas, D. Mattinson and G. Barbosa–Cánovas, Postharvest Biol. Technol. 45, 89 (2007). [ Links ]
[19] Y. Fan, Y. Xu, D. Wang, L. Zhang, J. Sun, L. Sun and B. Zhang, Postharvest Biol Technol. 53, 84 (2009). [ Links ]
[20] V. Del–Valle, P. Hernández–Muñoz, A. Guarda and M.Galotto, Food Chem. 91, 751 (2005). [ Links ]
[21] M. Rojas–Graü, R. Soliva–Fortuny and R. Martín–Belloso, Trends Food Sci. Technol. 20, 438 (2009). [ Links ]Â
[22] O. Yaman and L. Bayoindirli, Lebensm. Wiss. Technol. 35, 146 (2002). [ Links ]














