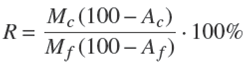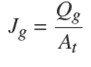1 Introducción
La historia del estado de Coahuila está relacionada estrechamente con la minería, con el descubrimiento y explotación del carbón mineral desde 1828. Actualmente en la región carbonífera de Coahuila se procesan entre 10,000 y 12,000 toneladas diarias de carbón, por medio de plantas de beneficio y coquizadoras (Panorama Minero del Estado de Coahuila, SMG, 2011). Sin embargo, se ha reconocido que la flotación de carbón presenta dificultades relacionadas con fenómenos electroquímicos de la pulpa mineral y la composición química del agua de proceso. Estos factores comprometen la recuperación y la calidad del carbón. A nivel industrial la demanda de agua se satisface con agua reciclada como fuente de abastecimiento principal. Sin embargo, esta práctica incrementa sustancialmente la concentración de sulfatos, carbonatos, cloruros y cationes metálicos (Espinoza y col., 2009). Paulson y Pugh (1996) indican que la recuperación de partículas hidrofóbicas en un sistema de flotación depende de las propiedades de los electrolitos, e.g., valencia, fuerza iónica, entre otras. De acuerdo a su contribución en la eficiencia metalúrgica (recuperación del carbón), estos autores clasificaron los electrolitos en tres grupos: "A" sales divalentes y trivalentes (Na2SO4, MgSO4, MgCl2), "B" sales monovalentes (LiCl, KCl, NaCl) y "C" ácidos fuertes y percloratos (NaClO4, HClO4, LiClO4). Asociándose a cada grupo: A, B y C, recuperaciones de 96.65% (±10.87%), 86.23% (±6.90%) y 28.82% (±3.06%) respectivamente. Sin embargo, esta clasificación no permite describir la participación de los electrolitos en el mecanismo de interacción de una burbuja de aire y la superficie de un mineral hidrofóbico. A este respecto Li y Somasundaran (1993) evaluaron la hidrofobicidad de un carbón bituminoso en soluciones de NaCl (0.2, 0.3 y 0.5 mol/L). Las observaciones más relevantes indican que a pH 3 la fuerza de atracción entre las burbujas y partículas es significativa, a pH 7 se actualiza la carga de las partículas (negativa) y con ello la fuerza es repulsiva. Este comportamiento se intensifica hasta pH 10, la interpretación de los resultados sugiere la participación de fuerzas electrostáticas a pH ácido. Mientras que a pH neutro y básico los resultados sugieren que la flotación de partículas de carbón está relacionada con mecanismos químicos (e.g. hidrofobicidad). Ozdemir y col. (2009) señalan que el comportamiento del carbón mineral en agua salina no depende únicamente de la química de superficie, como se había propuesto anteriormente (Klassen y Mokrousov, 1963). En contraste, se ha observado que el contacto burbuja- partículaesinstantáneoenpresenciadeaguapurae independiente del tamaño de partícula. Mientras que el contacto burbuja-partícula en agua salina requiere de tiempos más prolongados. Esta evidencia sugiere que el carbón mineral es más flotable en agua pura. En contraste, estudios experimentales revelan que el agua salina incrementa la recuperación de carbón y así mismo, la recuperación de ceniza. Wang y Peng (2013) interpretaron el comportamiento de la materia mineral (e.g., cuarzo, calcita, pirita, etc.) en la flotación de carbón, en términos de entrampamiento y arrastre de ceniza de la zona de colección a la espuma. Este efecto se intensifica en presencia de agua salina y disminuye en presencia de agua des- ionizada. Además, se encontró que el entrampamiento predomina y se intensifica con el incremento del grado de agregación de partículas de carbón, fenómeno que depende de la hidrofobicidad del sistema (Polata y col., 2003).
Los datos experimentales y modelos disponibles en la literatura han demostrado que los electrolitos en solución influyen significativamente en la coalescencia de burbujas (Phong y col., 2012; Marcelja, 2006). Las situaciones de operación que se han reportado indican que los iones de Na+ y Cl− controlan la coalescencia, equivalente al efecto que produce un espumante de aplicación industrial como el metil-isobutil-carbinol (MIBC) (Bournival y Pugh, 2012). Estudios fundamentales indican que los electrolitos incrementan la tensión superficial en la interfase agua-aire, mientras que el MIBC presenta un efecto inverso. Esta observación sugiere que la coalescencia de burbujas no solamente depende de la tensión superficial. Craig y col. (1993) sugirieron que la combinación de iones en solución resulta trascendental para controlar el efecto de la coalescencia. Los autores clasificaron los iones como: aniones α (Cl− , Br− , OH− , NO−
3 ), aniones β
En el contexto anterior, el objetivo particular del presente trabajo es analizar el efecto de soluciones de KI, Na2SO4, MgCl2 y NaCl sobre la recuperación de carbón mediante flotación de espuma en ausencia de espumante. El estudio pretende correlacionar la recuperación de carbón con la presencia de aniones y cationesespecíficosysuefectosobreladistribuciónde tamaños de burbuja en la zona de colección y sobre la distribución de tamaños de partícula que se recuperan en el concentrado.
2.1 Materiales y reactivos
La muestra de carbón mineral empleado en el presente estudio fue obtenida de la sub-cuenca Sabinas. La Tabla 1 presenta el análisis próximo de la muestra de carbón. La muestra de carbón se puede clasificar como bituminoso bajo volátil, de acuerdo con el contenido de materia volátil (>20%). La caracterización petrográfica permitió determinar la composición maceral del carbón por medio de la reflectancia media aleatoria medida con un espectrómetro MSP-COAL. Los resultados indicaron alto contenido de vitrinita y materia mineral, los resultados se muestran en la Tabla 2
El agua salina se preparó en el laboratorio empleando como base el agua de la red del campus (i.e., Escuela Superior de Ingeniería, Universidad Autónoma de Coahuila). El agua proviene de un pozo localizado dentro de la institución. La composición química del agua se muestra en la Tabla 3. Se elaboraron 4 soluciones salinas empleando sales inorgánicas grado analítico (>99%); KI, Na2SO4, MgCl2 y NaCl. La concentración de los electrolitos empleados en los experimentos fue de 0.05, 0.25 y 0.50 mol/L. Diesel grado industrial se empleó como colector; este reactivo es ampliamente utilizado en las plantas de flotación de la Región Carbonífera de Coahuila. Así mismo, se empleó agua desionizada (conductividad de 0.050 μS/cm) para evaluar la recuperación de carbón en ausencia de iones.
2.2 Flotación de carbón
Los experimentos de flotación se realizaron con una muestra de agua salina previamente elaborada. La suspensión se preparó con 200 g de carbón en 4.0 una celda de 2.5 L equipada con un sistema de agitación mecánico tipo Denver y la operación se realizó en modo batch (a 25°C). La Fig. 1 muestra la configuración general del equipo experimental. La suspensión agua-sólidos se alcanzó fijando la velocidad del impulsor en 900 rpm (tiempo estimado 10 minutos). Enseguida la dosificación de colector 1000 g/t de diesel por un intervalo de tiempo de 10 minutos. El pH de la suspensión se mantuvo entre 6 y 7 (i.e., pH natural). Cumplido el tiempo de acondicionamiento se incrementa la velocidad de agitación a 1200 rpm, se habilita el flujo de aire en la celda mecánica y con ello la remoción de material flotable durante 2 minutos, Simultáneamente se colectan muestras de dispersión de gas (i.e, tamañode burbuja y velocidad de aire). Las muestras de concentrado y colas se filtran, posteriormente se secan a 90 °C en una estufa. El análisis de ceniza se realizó con la combustión de una muestra de concentrado de 1 g en una mufla a 750 °C durante 2 h (ASTM D-3174- 04).La Ec.(1) se empleó para calcular la recuperación de combustible.
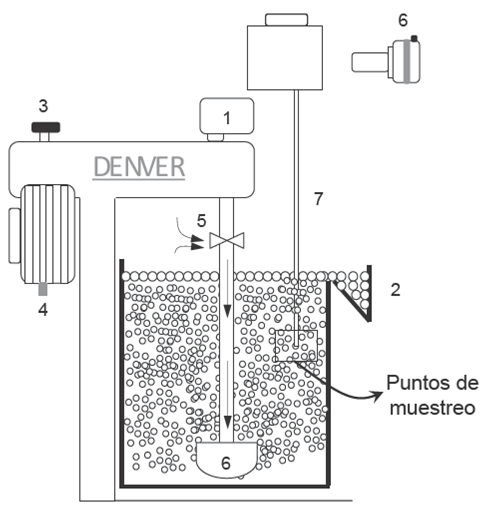
Fig. 1 Configuración esquemática del sistema de flotación. (1) Indicador de rpm, (2) celda de acrílico de 2.5 L, (3) ajuste de velocidad del impulsor, (4) interruptor de arranque, (5) válvula de aeración, (6) sistema de fotografía, (7) tubo muestreador.
En donde Mc y Mf corresponden al peso de la muestra en las corrientes de concentrado y alimentación respectivamente, Ac y Af es el contenido de ceniza en la muestra de concentrado y alimentación.
2.3 Medición de tamaño de burbuja y velocidad de aire
Las mediciones de tamaño de burbuja se realizaron en base a la técnica de muestreo desarrollada por Hernández-Aguilar (2004). El análisis de imágenes se realizó de acuerdo al protocolo descrito por Bailey y col. (2005). El dispositivo consiste de una cámara de visualización de 17 cm de ancho, 17 cm de alto y 17 cm de profundidad. La cámara se fabricó en acrílico de 4 mm de espesor, con una capacidad de 4.9 L (el frente de la cámara esta graduada con divisiones de 0.5 cm3). El depósito permite la conexión de un tubo (de pvc, cédula 40) de longitud adaptable y 1.27 cm de diámetro. En la parte superior la cámara de visualización tiene una tapa de 16 cm de diámetro que permite limpiar adecuadamente el interior. La filmación de las burbujas se realizó con un sistema de fotografía de alta resolución equipado con una lente modelo EF 100 mm f/2.8 Macro USM. Una fuente de luz de 400 W se coloca detrás de la cámara de visualización para mejorar la visibilidad de las burbujas. El análisis de las imágenes se realizó en off- line. Para representar las distribuciones (compuestas por 2500 objetos) de tamaños de burbuja se reporta el diámetro Sauter promedio, de acuerdo con la Ec. (2).
En donde di es el diámetro equivalente, obtenido del análisis de imágenes.
La velocidad superficial de aire (Jg , cm/s) se representa por la Ec. (3) y se deriva de la medición del flujo volumétrico de aire (Qg , cm3/s) dividido entre el área transversal de la celda (cm2). El Jg se medió con el método de la "probeta invertida". Es decir, midiendo el tiempo que tardan las burbujas en desplazar un volumen conocido de líquido. Dado que las dimensiones de la cámara de visualización son conocidas, este mismo dispositivo fue utilizado como volumen de referencia para cuantificar el flujo volumétrico de aire.
Finalmente la participación de las propiedades de la dispersión de gas se resume en la densidad de flujo de área superficial de burbuja( Ec.4).Esta variable integra el efecto del tamaño de burbuja (db ), representado por el diámetro Sauter promedio (d 32) y la velocidad superficial de aire (Jg ).
3 Resultados
3.1 Distribución de tamaños de burbuja en sistema agua-aire
La Fig. 2(a) ilustra el comportamiento de las burbujas en la zona de colección en sistema agua- aire. Al incrementar la concentración de los electrolitos incrementa la fuerza iónica y disminuye el tamaño de burbuja promedio. La tendencia de los datos sugiere que se alcanza un límite, después del cual el tamaño de burbuja permanece constante. Este comportamiento está relacionado con un concepto denominado concentración de transición (Craig y col., 1993) equivalente a la concentración crítica de coalescencia desarrollado para espumantes (Laskowski, 2003). En ambos casos la concentración resulta difícil de establecer. De acuerdo con la literatura la concentración de transición del cloruro de sodio (NaCl) es de 0.078 mol/L (Craig y col., 1993; Paulson y Pugh, 1996). Las observaciones experimentales de la Fig. 2(a) sugieren que es cercano a 0.25 mol/L. La información relacionada con el cloruro de magnesio y sulfato de sodio no ha sido establecida. La tendencia de los datos indica que la estabilidad de los tamaños de burbuja con estos electrolitos (i.e., MgCl2 y Na2SO4) se alcanza por encima de 0.05 mol/L. Debido a la información limitada del yoduro de potasio, convenientemente, se integraron los resultados obtenidos por Marrucci y Nicodemo (1966). Se observa que los resultados son equivalentes cuando la concentración es menor a 0.25 mol/L, sin embargo, el tamaño de burbuja continua disminuyendo por encima de 0.50 mol/L. Estas observaciones finalmente no permiten reconocer la transición y estabilidad de los tamaños de burbuja en presencia de KI. La interpretación de los resultados sugiere que los efectos que retardan el mecanismo de coalescencia de burbujas incrementan de acuerdo con la presencia de los electrolitos en el siguiente orden: KI < NaCl < MgCl2 < Na2 SO4. En presencia de KI las burbujas pierden forma esférica y viajan a velocidades altas. Como resultado durante la flotación estas burbujas presentan baja probabilidad de colectar material valioso (ver Fig. 2(b)). En presencia de Na2SO4 (NaCl y MgCl2 ) se observan múltiples y finas burbujas de apariencia rígida como esferas, que viajan lentamente (ver Fig. 2(c)). Estos tamaños de burbuja favorecen la probabilidad de colisión, adhesión y el transporte estable de material valioso hacia el concentrado.
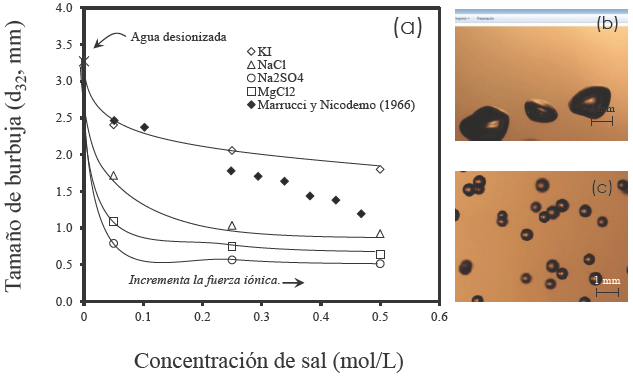
Fig. 2 (a) Impacto del tipo y concentración de sal sobre el tamaño de burbuja, se reporta el diámetro Sauter promedio. Se incluye los datos de Marrucci y Nicodemo (1967) para explicar el efecto del yoduro de potasio. (b) Observaciones experimentales de las burbujas en presencia de KI a 0.50 M. (c) Observaciones experimentales de las burbujas en presencia de Na2SO4 a 0.50 M.
3.2 Distribución de tamaños de burbuja en sistema agua-aire-sólidos
La Fig. 3a ilustra el comportamiento de las burbujas en la zona de colección en presencia de partículas de carbón. El efecto de los electrolitos sobre el tamaño de burbuja es equivalente a las observaciones en sistema agua-aire (Fig. 2a. Cuando la fuerza iónica incrementa el tamaño de burbuja disminuye. Sin embargo, en presencia de sólidos el tamaño de las burbujas incrementa ligeramente (O'Connor y col., 1990).
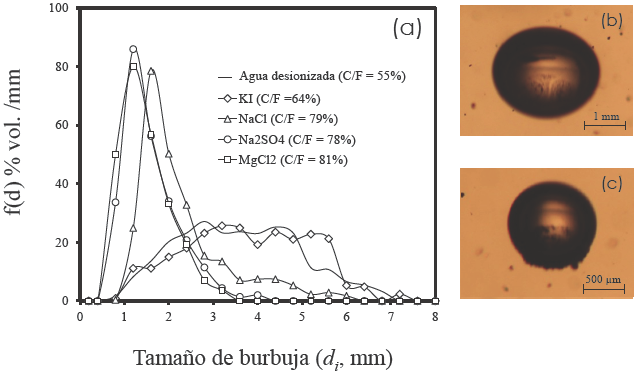
Fig. 3 (a) Distribución de tamaños de burbuja en presencia de sólidos; 0.50 M la concentración de las soluciones de KI, NaCl, Na2SO4 y MgCl2. (b) En presencia de KI la burbujas transportan ligeras cargas de material. (c) En presencia de MgCl2 las burbujas transportan notables cargas de material.
La solución de KI y el agua desionizada relacionan la presencia de burbujas grandes entre 1 y 6 mm. Las evidencias experimentales de la Fig. 3(b) indican que las burbujas se ven limitadas para transportar material. En contraste, las soluciones de NaCl, Na2SO4 y MgCl2 relacionan burbujas entre 0.5 y 3.0 mm. Las observaciones experimentales de la Fig. 3(c) indican que la carga de las burbujas es notable. El análisis de los datos sugiere que la presencia de los electrolitos incrementa el rendimiento metalúrgico en términos de la relación de concentración C/F en el siguiente orden: KI< Na2SO4<NaCl<MgCl2.
3.3 Recuperación de carbón
La Fig. 4 indica que la recuperación de carbón incrementa en función de la concentración molar de los electrolitos, excepto para el Na2 SO4 que presenta un efecto inverso. La teoría indica que la hidrofobicidad de carbón incrementa sustancialmente en presencia de agua pura (Ozdemir y col., 2009). La mayoría de los resultados experimentales reportados en la literatura ilustran lo contrario (Wang y Peng, 2013; Yoon y Sabey, 1989). Los resultados del presente trabajo indican que la recuperación de carbón con agua desionizada es de 40%, notablemente menor en comparación con las soluciones de KI, NaCl y MgCl2. Así mismo, es posible asociar que las soluciones de NaCl y MgCl2 promueven recuperaciones entre 53 y 89%. Mientras que las soluciones de KI promueven recuperaciones menores, entre 44 y 69.

Fig. 4 Recuperación de combustible en función del tipo y concentración de sal; así mismo se incluye el efecto del agua desionizada.
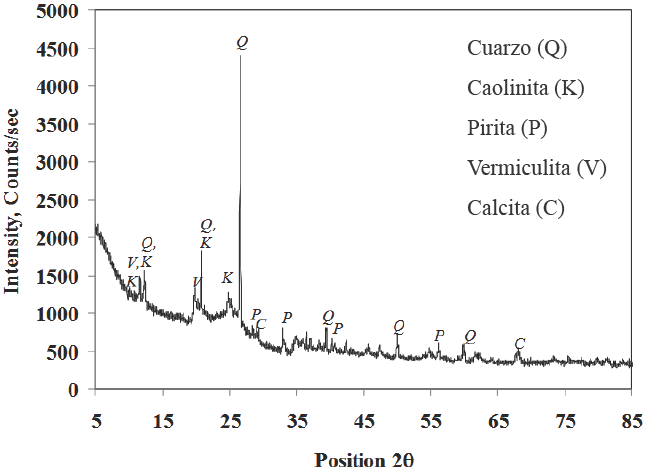
La teoría de Paulson y Pugh (1996) reconoce que la fuerza electroestática que experimenta una burbuja de aire y una partícula de carbón es repulsiva. Ambas interfaces son negativas a pH natural (Li y Somasundaran, 1993). Sin embargo, la presencia particular de los cationes de Na+ y Mg2+, influye significativamente en el comportamiento electrocinético de las burbujas y partículas (se reduce la magnitud del potencial zeta de la burbuja y la partícula). La adsorción de estos cationes sobre la superficie del carbón actúa de tal forma que, la fuerza de repulsión electroestática disminuye y permite que las fuerzas hidrofóbicas controlen la interacción burbuja-partícula (Pawlik y col., 2004). Esta teoría explica las recuperaciones que se alcanzan en presencia de NaCl y MgCl2. Sin embargo, esta hipótesis no justifica la recuperación de minerales hidrofílicos que se intensifica en presencia de Na2 SO4, como se muestra en la Fig. 5. El análisis de los datos sugiere que el contenido de ceniza incrementa en el concentrado en función de la fuerza iónica. La materia mineral incluye la presencia de cuarzo, caolinita, pirita, vermiculita y calcita los resultados se ilustran en la Fig. 6.
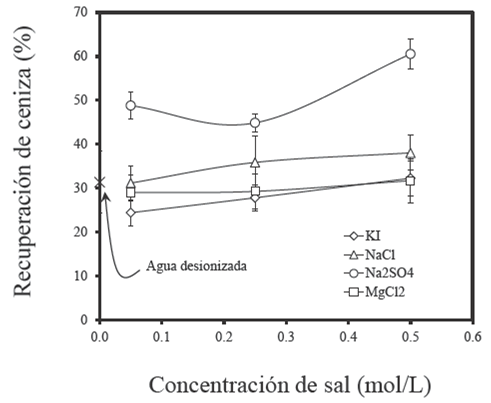
Fig. 5 Recuperación de ceniza en función del tipo y concentración de sal; así mismo se incluye el efecto del agua desionizada.
3.4 Recuperación de materia mineral
En la recuperación de materia mineral la participación del arrastre mecánico es significativa. El arrastre mecánico está relacionado con la formación de una monocapa de agua que cubre la burbuja y se mueve junto con ella. Esto permite la formación de una red de líquido intersticial o flujo de agua que se forma entre las burbujas de aire y que asciende a la zona de espuma. Cuando se incrementa el flujo de agua en la zona de espuma el arrastre de partículas hidrofílicas se intensifica. Es decir, el flujo de agua en la zona de espuma es inversamente proporcional al tamaño de burbuja en la zona de colección (Neethling y Cilliers, 2003). El análisis de la Fig. 7 sugiere que la fuerza iónica incrementa el área superficial total de burbuja (Zieminski y Whittemore 1971) que se representa en términos del concepto de Sb (Xu y col., 1991). Se observa que el yoduro de potasio está relacionado con bajos niveles de Sb, entre 32 y 36 s−1. Mientras que el sulfato de sodio alcanza los niveles más altos, en comparación con el resto de los electrolitos, entre 48 y 90 s−1. Cuando S b incrementa se favorece la probabilidad de colección de partículas hidrofóbicas. Sin embargo, en la misma medida cabe la posibilidad de incrementar la recuperación de agua y por lo tanto la recuperación de minerales ganga a través del arrastre mecánico (Nesset y col., 2005). Esto significa, que la presencia de sulfato de sodio tiene argumentos para intensificar la recuperación de materia mineral, por medio de la densidad de flujo de área superficial de burbuja (Sb ). La Fig. 8 indica que la presencia de Na2SO4 incrementa la presencia de hierro total en el concentrado y disminuye en presencia de agua desionizada. El análisis de los datos sugiere integrar el concepto de S b como un elemento apropiado en la comprensión de la recuperación de materia mineral. Sin embargo, el comportamiento del MgCl2 no coincide con esta hipótesis. En contraste, bajo magnitudes equivalentes de Sb , la presencia de MgCl2 favorece la recuperación de partículas de carbón. Estudios fundamentales indican que las especies inorgánicas disueltas en el agua interactúan con la dispersión de partículas, burbujas y pequeñas gotas de colector (diésel) en un sistema de flotación (Polata y col., 2003). La presencia de electrolitos en la pulpa mineral motiva la neutralización de las cargas superficiales de las partículas de carbón y elimina las repulsiones electrostáticas.

Fig. 7 Flujo de área superficial de burbuja en función del tamaño de burbuja representado por el diámetro Sauter.
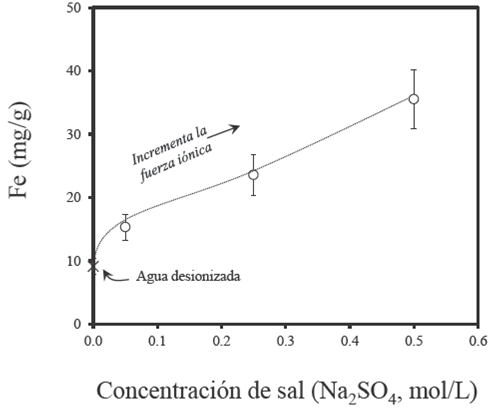
Fig. 8 Comportamiento de la concentración de Fe total en la cenizas cuando la concentración de Na2SO4 incrementa.
Esto permite que la colisión partícula/partícula se intensifique por el efecto de las fuerzas hidrológicas que predominan en el sistema. Las partículas forman un agregado porque se quedan adheridas después de chocar, bajo estas condiciones toma lugar el entrampamiento de materia mineral. La ceniza queda ocluida en el agregado de partículas de carbón. Sin embargo, Wang y Peng (2013) indican que la recuperación de materia mineral está asociada al entrampamiento de partículas menores a 38 μm cuando la concentraci´on de iones de Na+ y
Conclusiones
En base a los resultados obtenidos en el presente trabajo, se observó que la presencia de iones de Na+, Mg2+,
Nomenclatura
Ac |
contenido de ceniza en la corriente de concentrado (%) |
Af |
contenido de ceniza en la corriente de alimentación (%) |
At |
área transversal de la celda de flotación (cm2) |
C/F |
rendimiento metalurgico (%) |
db |
diámetro de burbuja (mm) |
di |
diámetro equivalente (mm) |
d32 |
diámetro Sauter (mm) |
J g |
velocidad superficial de aire (cm/s) |
Mc |
masa del concentrado (g) |
Mf |
masa de la alimentación (g) |
R |
recuperación de combustible (%) |
Sb |
flujo de área superficial de burbuja (s−1 ) |
Qg |
flujo volumétrico de aire (cm3/s) |











 nova página do texto(beta)
nova página do texto(beta)