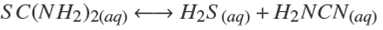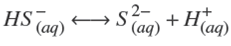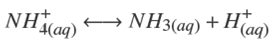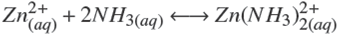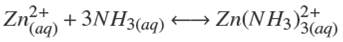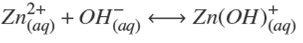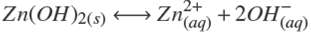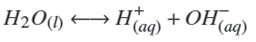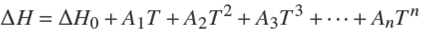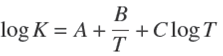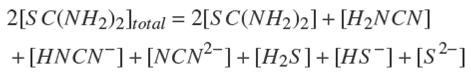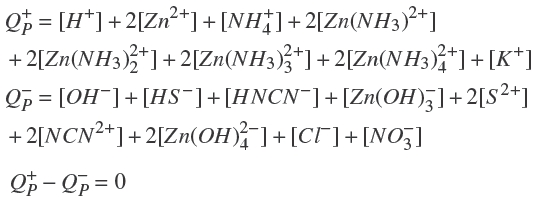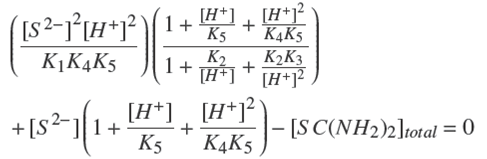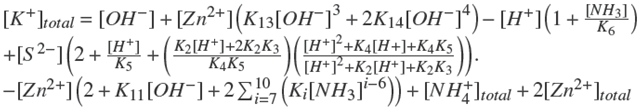1 Introducción
Las películas delgadas de ZnS son utilizadas actualmente para el desarrollo de sensores en el rango del UV y para aplicaciones solares como ventanas ópticas dadas sus propiedades electroluminiscentes y anti-reflejantes (Fang y col., 2013; Wang y col., 2003). Su importancia se incrementa por su potencial para sustituir al CdS por sus implicaciones nocivas al medio ambiente. Para su preparación, se han reportado diferentes técnicas tales como evaporación (Fang y col., 2005), electroquímica (Innocenti y col., 2001), vapor químico (Barreca y col., 2004) y depósito por baño químico (Liu y col., 2008). La técnica de depósito por baño químico (DBQ), es cada vez más utilizada para preparar el ZnS por su sencillez, bajo costo y control de las condiciones. Consiste en la mezcla de diferentes reactivos químicos solubles en agua a temperaturas menores de 90°C de tal forma que al liberarse el ión metálico de interés se encuentre con un anión que lo precipite en solución, cuya precipitación se controla por medio del pH y agentes complejantes. En la literatura científica se han reportado una gran variedad de reactivos utilizados para la formación de diferentes compuestos por la técnica de DBQ. Sin embargo, muy pocos han discutido las razones fisicoquímicas del porqué se consiguen depositar películas de buena calidad de dichos materiales. Los trabajos pioneros de Doña y Herrero (Doña y col., 1994; 1997) explicando el comportamiento fisicoquímico y la cinética de crecimiento del CdS continúan siendo una motivación para continuar estos esfuerzos en la síntesis de otros tipos de materiales usando análisis diferentes y complementarios. Así, se ha reportado el depósito de películas de ZnS con diferentes condiciones que van desde medios ácidos (Kang y col., 2010; Nabiyouni y col., 2011) hasta básicos (Oladeji y col., 2005) y temperaturas que van desde al ambiente (Shinde y col., 2011; O?Brien y col., 2002) hasta superiores a los 85 °C (Yu y col. 2014; Hyoung y col., 2008). Por otro lado, en dichos trabajos no se detallan los parámetros fisicoquímicos utilizados para el depósito, por lo que es difícil afirmar si las condiciones de depósito son las mejores que ofrece el medio (aq) propuesto. Se sabe que para determinar las mejores condiciones de preparación de las películas de ZnS se requiere realizar dos estudios complementarios: el análisis fisicoquímico de la solución y la cinética de crecimiento.
En este trabajo se propone una metodología para el análisis fisicoquímico del baño a través de la obtención de los diagramas de distribución de especies que aportan información importante para determinar las mejores condiciones para preparar películas delgadas ya sea de ZnS, ZnO y Zn(OH)2 de buena calidad óptica y estructural. Se discuten la estructura cristalina y las propiedades ópticas de las películas depositadas en las condiciones químicas controladas.
2 Análisis fisicoquímico
Termodinámicamente, el ZnS puede ser depositado si la relación [Zn2+][S2−] excede el producto de solubilidad en varios órdenes de magnitud. Esto depende de las diferentes especies químicas que pueden formarse dependiendo de la concentración y del tipo de reactivos empleados. Un modelo analítico debe predecir las especies a formarse cuando se llevan a cabo las reacciones químicas. Considerando los reactivos químicos utilizados en este trabajo (ZnCl2, NH4 NO3 , KOH y SC(NH2 )2 ), las principales reacciones químicas que pueden llevarse a cabo son:
Sobre la descomposición térmica de la tiourea (Vinogradova y col., 2010),
La disociación del ácido sulfídrico (Ellis y col., 1971; Kim y col., 2008; Millero, 1986),
La disociación del ión amonio (Bates y col., 1950),
La formación de los amino-complejos de zinc (Hubert y col., 2007),
La formación de los hidroxi-complejos de zinc (Bénezeth y col., 2002; Reiche y col., 1975),
La formación de precipitados de zinc (Millero, 1986; Bénezeth y col., 2002),
Y la disociación del agua (Patnaik, 2004),
Por otro lado, la constante de equilibrio K de cualquier reacción química en función de la temperatura se puede expresar como:
donde ∆H es la entalpía de la reacción en J?mol−1, T es la temperatura en Kelvin, y R es la constante universal de los gases ideales (8.3144 J?mol−1?K−1). Además, el cambio de entalpía en función de la temperatura se puede aproximar como:
donde ∆H 0 es el cambio de la entalpía de reacción a 298 K, y An son constantes. Tomando los dos primeros términos de la ecuación (19) e integrando desde T 0 hasta T, la ecuación (18) se convierte en:
Note que el logaritmo natural ha sido cambiado a logaritmo decimal y donde A, B y C son las constantes para cada reacción química.
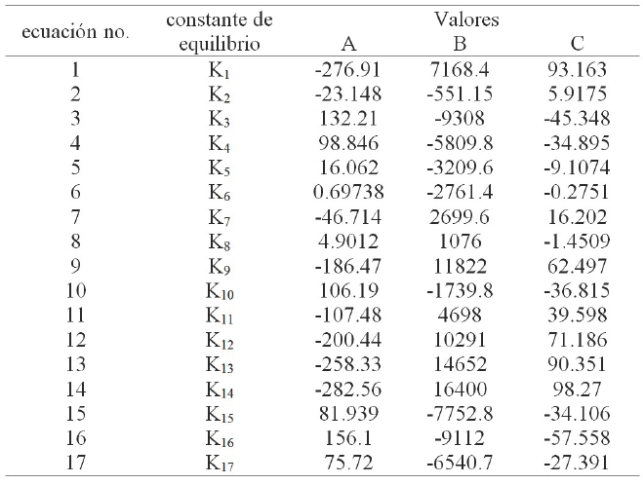
Los valores de K reportados en la literatura para diferentes temperaturas pueden ajustarse por regresión lineal usando la ecuación (20). Las constantes A, B y C estimadas de la ecuación (20) para las diferentes reacciones químicas (Ecs. 1-17) se enlistan en la Tabla 1.
Tabla 1 Constantes de equilibrio estimadas de la ecuación (20) para las reacciones químicas (1-17) propuestas.
Si no hay precipitación, existen 20 especies en solución acuosa que pueden relacionarse por medio de un balance de masa de los reactivos utilizados y por el balance de carga de la solución de la siguiente manera:
El balance de masa de la tiourea (SC(NH2)2):
El balance de masa del ión amonio:
El balance de masa del zinc:
El balance de carga de la solución:
La solución del sistema de ecuaciones genera un modelo analítico que predice la solubilidad máxima del Zn2+ por medio de las constantes de equilibrio químico (Ecs. 1-17) y por los balances de masa y carga (Ecs. 21-24). En este análisis, se ha despreciado el coeficiente de actividad de todas las especies químicas. La solución se lleva a cabo tal que se mantienen fijos los valores de [SC(NH2)2]
total
y [
Normalmente [OH−] y [H+] se relacionan por medio de la disociación del agua. Así, [Zn2+] puede ser estimado de las expresiones de equilibrio químico, Ecs. (15) y (16), dado que al menos debe formarse un precipitado: ZnS o Zn(OH)2 , entonces:
La concentración de [NH3] puede determinarse reemplazando [Zn2+] y [OH−] en la ecuación (22) y las expresiones del equilibrio químico (Ecs. 7-10), teniendo en cuenta que la concentración analítica del ión amonio es [
Luego, la concentración analítica del zinc o [Zn2+]total se calcula con la ecuación (23):
Finalmente, la concentración analítica del [K+]total se estima de la ecuación (24):
3 Diagramas de distribución de especies
3.1 Elaboración del diagrama de distribución de especies
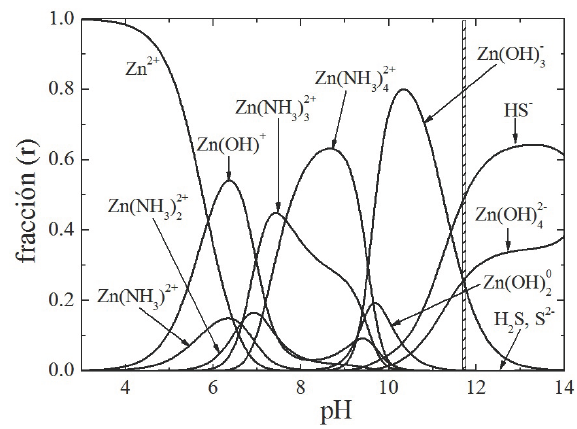
Para la elaboración de los diagramas de distribución de especies, se fijan las concentraciones y volúmenes de los reactivos a utilizar. Así, un bañoquímico típico con un volumen total de 440 ml para depositar películas de ZnS está conformado por: 0.0036 M de ZnCl2 (o ZnSO4), 0.364 M de KOH, 0.155 M de NH4NO3 y 0.037 M de SC(NH2)2. Dichos diagramas se obtienen considerando las reacciones químicas mencionadas en la Sección 2, así como las condiciones específicas. Para ello, se desarrolló un programa de cómputo que integra todas las reacciones propuestas, el cual nos permite variar la concentración de cada reactivo y la temperatura del baño para obtener el diagrama de especies correspondiente. Un ejemplo típico de un diagrama de distribución de especies como función del pH obtenido con las concentraciones de los reactivos mencionados y una temperatura del baño de 80 °C, se ilustra en la Figura 1. El diagrama muestra la fracción mol r (%) de los diferentes iones complejos que pueden ser formados como función del pH de la solución. Así, puede observarse que en la zona de pH entre 7 y 9 predomina la formación de los iones tetra-aminos del Zn y en la zona de pH entre 10 y 12, los dominantes son los iones hidroxilados del Zn. De acuerdo a este diagrama, podríamos realizar depósitos en ambas zonas para probar si alguno de estos tipos de complejos dominantes (Ec. 23) son precursores para formar las películas de ZnS, dependiendo del mecanismo de crecimiento sugerido. Experimentalmente se ha comprobado que para estas condiciones particulares de reactivos, concentraciones y temperatura del baño, el ZnS se deposita en la zona de los complejos hidroxilados (pH=11.7). Por el contrario, si las condiciones de pH están en la zona de los complejos aminados, el ZnS no se consigue depositar. Los diagramas de especies pueden verse modificados si cambia la temperatura del baño, si se cambian los reactivos químicos utilizados, o las concentraciones de los mismos.
3.2 Diagrama de distribución de especies: efecto de la temperatura
La Figura 2 muestra un grupo de diagramas de especies obtenidos para diferentes temperaturas del baño entre 60 y 90 °C usando las mismas concentraciones de los reactivos de la Figura 1. La fracción mol r (%) de cada ión formado se grafica como función del pH en el rango de 3 a 14. La temperatura del baño se sabe que juega un papel importante en la cinética de depósito del ZnS, ya que al incrementarlo, la razón de depósito (espesor de ZnS(s)/tiempo de depósito) aumenta y por lo tanto, se reduce el tiempo de depósito de la película. La franja vertical dibujada en los diagramas señala el valor del pH correspondiente al cruce de los iones
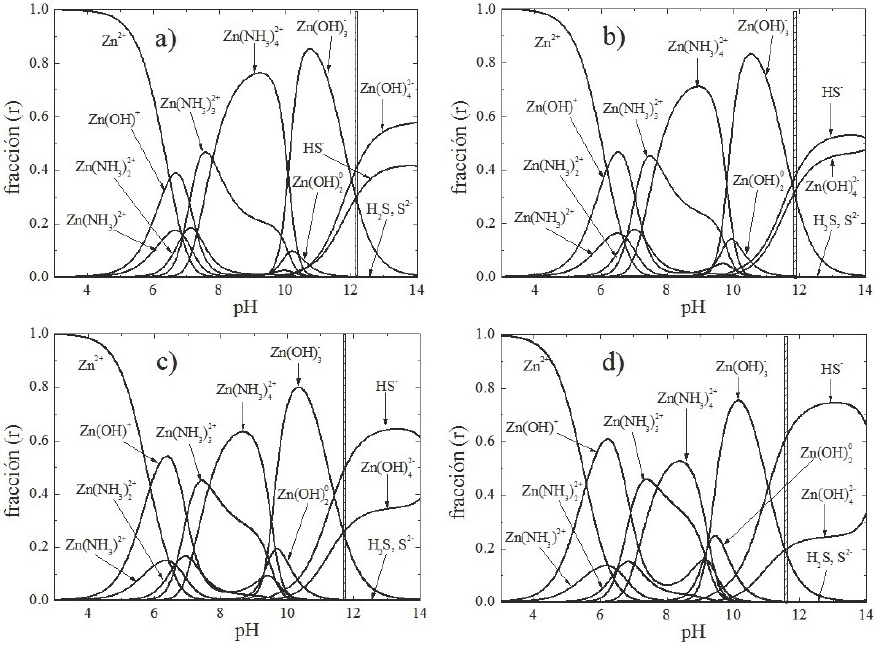
Fig. 2 Diagramas de distribución de especies para la formación del ZnS correspondiente a las mismas concentraciones de la Figura 1 y las temperaturas de: a) 60 °C, b) 70 °C, c) 80 °C y d) 90 °C.
3.3 Diagramas de distribución de especies: efecto de la tiourea
En el grupo de diagramas de distribución de especies mostrado en la Figura 3, se observa el efecto de la concentración de la tiourea, responsable de proporcionar los iones S2− al baño, para concentraciones desde 0.0364 hasta 0.364 M y temperatura del baño de 80°C. Las concentraciones de ZnCl2, KOH y NH4NO3 utilizadas son las mismas que las reportadas en la Figura 1. En este caso, la franja vertical dibujada indica el valor de pH medido, dando un valor similar para las distintas concentraciones de tiourea. En general, la concentración de tiourea no afecta en forma importante el valor del pH del baño ya que no se da una degradación importante que libere especies solubles que afecten al baño.
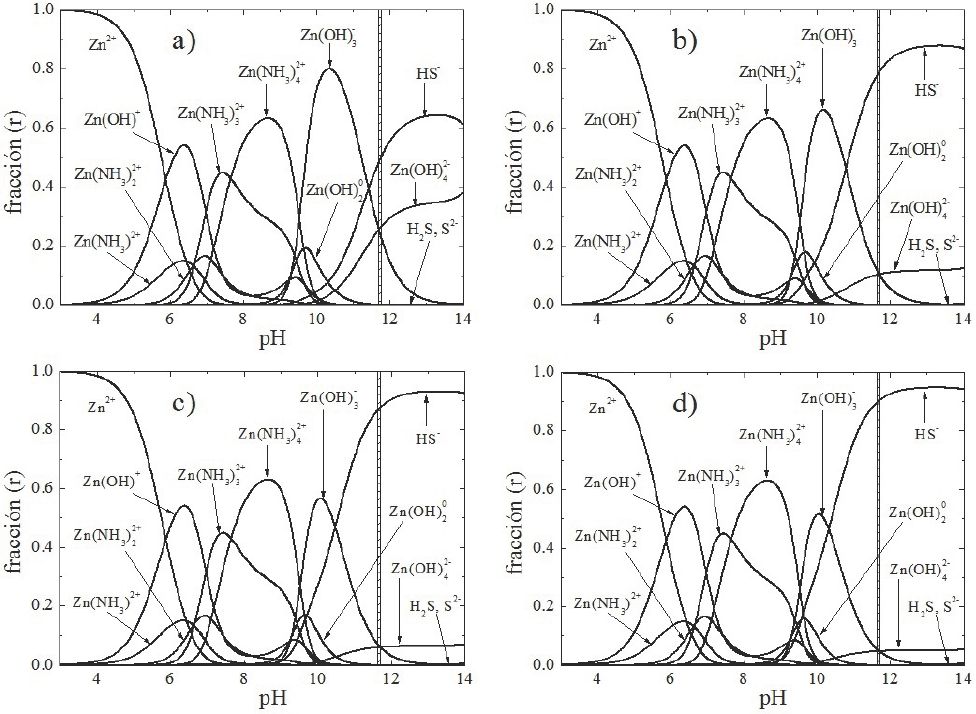
Fig. 3 Diagramas de distribución de especies para la formación del ZnS usando las concentraciones de ZnCl2 (0.0036 M), KOH (0.364 M), NH4NO3 (0.155 M) y concentraciones de tiourea de: a) 0.037 M, b) 0.145 M, c) 0.272 M y d) 0.364 M. La temperatura del baño es de 80 °C.
Se observan efectos muy importantes: i) como es de esperarse, el incremento del ión HS- ; ii) la casi eliminación de los iones
3.4 Diagramas de distribución de especies efecto del complejante
El agente complejante utilizado en el baño químico juega un papel importante, ya sea para la formación de compuestos intermediarios, o para acomplejarse con otros iones y formar complejos que precipiten. El NH4NO3 es el reactivo utilizado en este trabajo y su función es primordial para el depósito del ZnS. La Figura 4 muestra los diagramas de distribución de especies para concentraciones del agente complejante entre 0.091 y 0.272 M y una temperatura del baño de 80 °C. Se puede observar que en el rango de pH de 8 a 10, al aumentar la concentración de NH4NO3, aumenta la concentración relativa del ión
3.5 Diagramas de distribución de especies: efecto del KOH
La concentración del KOH en el depósito de lDBQ-ZnS se utiliza principalmente para fijar el valor del pH de la solución acuosa y determinar así una zona de preparación del ZnS basado en los diagramas de distribución de especies. La Figura 5 muestra una serie de diagramas de distribución de especies para las concentraciones de KOH de 0.227, 0.3636, 0.454 y 0.545 para la temperatura del baño de 80 °C.

Fig. 5 Diagramas de distribución de especies para la formación del ZnS usando las concentraciones de ZnCl2 (0.0036 M), CS(NH2)2 (0.037 M), NH4NO3 (0.155 M), y concentraciones de KOH de: a) 0.227 M, b) 0.364 M, c) 0.454 M, d) 0.545 M. La temperatura del baño es de 80 °C.
De los diagramas de especie se observa que únicamente se produce un desfasamiento hacia la derecha (mayor pH) cuando se incrementa la concentración del KOH, sin cambio en las fracción mol r (%) de las diferentes especies formadas.
3.6 Otras aplicaciones del diagrama de distribución de especies
Diversos autores (Hubert y col. (2007); Lincot y col. (2009)) han reportado que el depósito del ZnS por baño químico, siempre va acompañado de la formación del ZnO y/o del Zn(OH)2 y que resulta difícil depositar únicamente el ZnS. De acuerdo a los resultados de este trabajo, el diagrama de distribución de especies nos permite predecir las condiciones fisicoquímicas para depositar exclusivamente tanto el ZnS, el ZnO o el Zn(OH)2, dependiendo de la zona del pH elegida y del control que se obtenga de la solución acuosa.
En general, es posible depositar compuestos binarios y ternarios en solución acuosa, si se conocen los reactivos a utilizar y si se determinan previamente los diagramas de distribución de especies correspondientes. Aunque es una ardua labor el considerar la mayor cantidad de posibles reacciones químicas que pueden ocurrir al disociarse en una solución acuosa un grupo de tres o cuatro reactivos, sobre todo porque sus constantes de equilibrio a diferentes temperaturas no siempre están disponibles en la literatura, resultan de gran ayuda para determinar las mejores condiciones para depositar los materiales.
4 Resultados
4.1 Depósito de películas semiconductoras
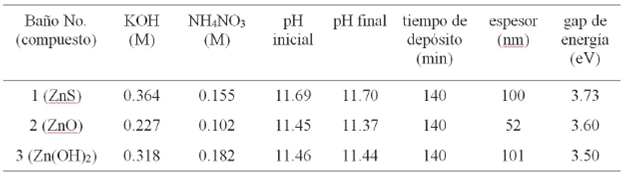
Con el objetivo de hacer uso de los diagramas de distribución de especies para la formación del ZnS, ZnO y Zn(OH)2, se realizaron una serie de depósitos a la temperatura del baño de 80 °C por la técnica de baño químico variando las concentraciones de KOH y de NH4NO3 para conseguir diferentes valores de pH en el baño. Aunque el ZnO no se consideró en los diagramas anteriores, su formación se puede suponer a partir del Zn(OH)2. La Tabla 2 muestra las condiciones utilizadas para preparar estos tres compuestos. Las concentraciones del ZnCl2 (0.0036 M) y del SC(NH2)2 (0.037 M) se mantuvieron constantes al igual que la temperatura del baño.
Tabla 2 Condiciones del baño y propiedades de los compuestos obtenidos (vol. total: 440 ml). Concentraciones: ZnCl2 (0.0036 M) y tiourea (0.0367 M). Temperatura del baño: 80 °C.
La Figura 6 muestra los diagramas de especies de los tres baños propuestos, así como sus correspondientes patrones de difracción de rayos x en haz rasante obtenidos para cada película depositada. En la Figura 6a se observa un patrón policristalino correspondiente a la estructura cúbica tipo blenda con orientación preferencial (111) del ZnS, que involucra las orientaciones complementarias (220) y (311) (muestra 1). En forma similar, las condiciones del baño de la Figura 6b propiciaron la formación preferencial del ZnO con orientaciones cúbicas (100), (002) y (101) dominantes (muestra 2). Para el tercer baño (Figura 6c), las orientaciones cristalinas preferenciales corresponden al ZnS y al Zn(OH)2 (muestra 3).

Fig. 6 Diagramas de distribución de especies y los difractogramas correspondientes de las películas preparadas por baño químico de: a) ZnS, b) ZnO, y c) Zn(OH)2. Las condiciones de preparación se muestran en la Tabla 2.
La Figura 7 muestra las curvas α2 vs hν (absorbancia2 vs energía), a partir del cual se determina el valor del gap de energía (Eg ) de cada material y la transmitancia óptica de las tres muestras depositadas bajo las condiciones mostradas en la Tabla 2. El ZnS es un semiconductor de gap directo cuyo valor del gap de energía puede determinarse mediante la relación α2 = A(hν − Eg). Así, Eg será hallado en la intersección de la recta ajustada en el borde de absorción cuando α2 = 0, como se señala en la Figura 7a.

Fig. 7 a) gap de energía y b) transmitancia óptica de las películas de ZnS, ZnO y Zn(OH)2 preparadas bajo las condiciones de la Tabla 2 y usando los diagramas de distribución de especies.
De acuerdo a la ley de Beer-Lambert (Beer, 1852), una mayor absorbancia α (i.e., menor transmitancia) representa un mayor espesor de la muestra. La muestra 1 de ZnS es la de mayor espesor obtenida y presenta un valor de Eg =3.73 eV, en concordancia con el valor reportado en la literatura de EgZnS =3.72 eV. La muestra 2, con mayor cantidad de Zn(OH)2, presenta el menor valor de Eg =3.5 eV, valor mayor al reportado de 3.06 eV (S.M. Islam y col., 2012). Por otro lado, la muestra 3 de ZnO, de menor espesor y mayor transmitancia óptica, tiene un valor de Eg =3.6 eV, ligeramente arriba del valor reportado en la literatura de EgZnO=3.4 eV. De los difractogramas obtenidos y de los valores del gap de energía reportados, es posible deducir que las películas 2 y 3 son una mezcla de Zn[O, (OH)2] en virtud de la dificultad de prepararlos en forma individual. Sin embargo, se ha demostrado que es posible controlar su formación preferencial mediante el apoyo de los diagramas de distribución de especies discutidos en este trabajo.
Esta metodología para el análisis fisicoquímico es aplicable para la formación acuosa de cualquier material a partir de sus sales solubles, si se consideran el mayor número de reacciones posibles entre los reactivos involucrados, así como las correspondientes constantes de equilibrio como función de la temperatura.
Conclusiones
El diagrama de distribución de especies es una herramienta que proporciona información importante para el depósito de materiales binarios y ternarios cuando se depositan en solución acuosa por la técnica de baño químico. Aunque la técnica es muy sencilla en su aplicación, es necesario tener la certeza de que las condiciones del depósito son propicias para la formación del material deseado.
Se propuso una metodología basada en los diagramas de distribución de especies para preparar películas de ZnS, ZnO y Zn(OH)2 por la técnica de baño químico bajo condiciones controladas. Las muestras depositadas fueron caracterizadas por difracción de rayos x y por espectroscopia óptica para determinar su estructura cristalina, su gap de energía y su transmitancia óptica.
El análisis fisicoquímico del baño, así como la cinética de crecimiento de un material por la técnica de baño químico son temas poco estudiados en la literatura y cuyo conocimiento puede dar mayor confianza en el control, calidad y en la preparación de algunos materiales semiconductores para aplicaciones solares.
Nomenclatura
SC(NH 2 )2(aq) |
tiourea en forma acuosa |
H2 S (aq) |
ácido sulfídrico en forma acuosa |
H2 NCN(aq) |
cianamida en forma acuosa |
|
cianoamino en forma acuosa |
|
ión hidronio en forma acuosa |
|
cianonitreno en forma acuosa |
|
cianonitreno en forma acuosa |
|
ión bisulfuro en forma acuosa |
|
ión Sulfuro en forma acuosa |
NH3(aq) |
ión amonio en forma acuosa amoniaco en forma acuosa |
|
ión zinc en forma acuosa |
|
ión aminocomplejo de zinc en forma acuosa |
|
ión bi-aminocomplejo de zinc en forma acuosa |
|
ión tri-aminocomplejo de zinc en forma acuosa |
|
ión tetra-aminocomplejo de zinc en forma acuosa |
|
ión hidroxilo en forma acuosa |
|
ión hidroxicomplejo de zinc en forma acuosa |
Zn(OH) 2(aq) |
ión bi-hidroxicomplejo de zinc en forma acuosa |
Zn(OH) |
ión tri-hidroxicomplejo de zinc en forma acuosa |
|
ión tetra-hidroxicomplejo de zinc en forma acuosa |
ZnS(s) |
sulfuro de zinc en forma sólida |
Zn(OH)2(s) |
hidróxido de zinc en forma sólida |
H2 O(l) |
fórmula del agua en estado líquido |
M |
concentración molar (mol/L) |











 nueva página del texto (beta)
nueva página del texto (beta)