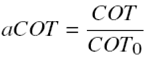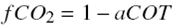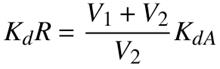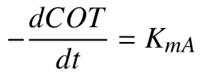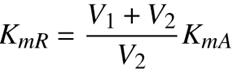1 Introducción
Actualmente, un número significativo de actividades, tales como: agrícolas, médicas e industriales, generan contaminantes que son liberados al medio ambiente a través de las aguas residuales. En la actividad agrícola la contaminación procede de los plaguicidas, que son compuestos utilizados para fumigar los cultivos. La Agencia de Protección Ambiental (2006) define en forma general a un plaguicida como cualquier substancia o mezcla de substancias empleada para prevenir, destruir o mitigar cualquier plaga, como pueden ser: insectos, maleza, roedores, hongos, bacterias u otros organismos no deseados. En México, el empleo de plaguicidas es muy variado debido al gran nu ́mero de plagas y enfermedades que se desarrollan en diferentes climas. Sobresalen entre estos los organofosforados, carbamatos y los derivados del biperidilo, como el paraquat (Lira-Siade y col. 2000). Entre los organofosforados se encuentran los insecticidas diazinón, malatión, metamidofós y metilparatión.
Después de su aplicación, los plaguicidas se disipan al medio ambiente por volatilización, adsorción en el suelo, por transporte y por dilución en los mantos acuíferos (Coats 1993, Happeman- Somich, 1991). Posteriormente los plaguicidas pueden ser degradados por microorganismos presentes en el suelo o por radiación UV de la luz solar, para producir compuestos orgánicos intermediarios y compuestos inorgánicos tales como: CO2, HCl, HNO3, etc. ( Klter y col. 1997).
Otra actividad significativa es la médica, que ha cobrado gran interés debido a la contaminación farmacéutica derivada del uso frecuente de medicamentos. En pequeñas concentraciones, los compuestos farmacéuticos están saturando la tierra y provocando transformaciones ecológicas cuya magnitud va en aumento. Las primeras investigaciones que actualmente se centran en el impacto de la contaminación por medicamentos, no han mostrado buenos resultados. Concentraciones biológicamente activas de medicamentos están penetrando en el medio ambiente a través de la excreción humana, los desechos animales, los fabricantes de medicamentos, los hospitales y lodos contaminados con productos farmacéuticos comu ́nmente utilizados como fertilizantes. Los compuestos farmacéuticos están diseñados para provocar "efectos biológicos" a muy bajas concentraciones en nuestros organismos, por lo tanto, su potencial para afectar el medio ambiente sigue siendo relevante y preocupante. (Redacción Enlace México 2013).
Félix-Cañedo y col. (2013) lograron detectar un total de 17 microcontaminantes orgánicos en efluentes de plantas de tratamiento en México, entre los que se encuentran: ácido clorfíbrico, ibuprofeno, ácido salicílico, ácido 2, 4-diclorofenoxiacético, gemfibrozil, ketoprofeno, naproxeno, diclofenaco, 4- nonilfenol(4-NP), pentaclorofenol (PCP), triclosán, bisfenol A (BPA), ftalato de butil-fenil, di(2- etilhexil)ftalato (DEHP), estrona (E1), 17 β-estradiol (E2) y 17 α-etinilestradiol (EE2).
Los procesos industriales también generan una gran cantidad de compuestos orgánicos que se descargan a los drenajes que van a dar a plantas de tratamiento. Tal es el caso de la manufactura de nylon y otras fibras sintéticas, aceites lubricantes, adhesivos de industria maderera y zapatera, abrasivos revestidos y barnices aislantes de conductores. La fabricación de un gran nu ́mero de estos compuestos tienen como precursor base el fenol. Este compuesto y sus derivados también han sido detectados en efluentes de la ciudad de México (Félix-Cañedo y col. 2013). En la industria química, el fenol es utilizado como bactericida, sanitizante, antiséptico y desinfectante. En la industria farmacéutica se usa en el proceso de fabricación de ácido acetilsalicílico (aspirina) y en preparaciones médicas como enjuagues bucales y medicamentos para aliviar el dolor de garganta.
El fenol es un compuesto químico aromático derivado del benceno, es un sólido blanco o incoloro muy soluble en agua y rápidamente inflamable, de olor fuerte e irritante que se evapora más lentamente que el agua. La legislación mexicana (NOM 1993) señala que la concentración de fenol en las aguas residuales debe ser igual o menor a 0.5 mgL−1.
El fenol es un compuesto difícil de degradar en las plantas de tratamiento convencional, por lo que, se utiliza como compuesto modelo en los procesos avanzados de oxidación particularmente en la fotocatálisis heterogénea (Nickheslat y col. 2013).
A través de los años se ha investigado a fondo la fotocatálisis heterogénea, en particular los estudios se han enfocado con especial interés en los procesos de degradación de compuestos orgánicos y su transformación a CO2, H2O y algunos ácidos orgánicos (Kabra y col. 2004, Fujishima y col. 2000, Ahmed y col. 2011). El proceso fotocatalítico inicia cuando un semiconductor absorbe energía luminosa con igual o mayor energía que la de su banda prohibida para promover un electrón (e-) de la banda de valencia a la banda de conducción generando al mismo tiempo un hueco de carga positiva (h+). Los electrones libres (e-) pueden reducir los iones metálicos, compuestos orgánicos y otros aceptores de electrones presentes en la mezcla de reacción. Al mismo tiempo, los huecos (h+) reaccionan con el agua y forman los radicales hidroxilo que oxidan totalmente las moléculas orgánicas (Zermeño y col. 2011). Desafortunadamente, los electrones y los huecos de carga positiva se recombinan fácilmente, por lo que se necesita añadir oxígeno, ozono, Na2(S2O3) o algu ́n otro aceptor de electrones para incrementar la producción de radicales HO·.
En nuestro grupo de investigación, se ha estudiado la degradación de diversos contaminantes modelo y de un gran nu ́mero de compuestos orgánicos de uso agrícola y farmacéutico en un reactor de laboratorio de 500 mL, con el fin de determinar el efecto de las variables de operación en la cinética y el mecanismo de reacción, (Leyva y col. 1998, Moctezuma y col. 2011, Luna-Sánchez y col. 2013, Moctezuma y col. 2013). Estos estudios sirvieron como base para diseñar y construir un reactor de recirculación a nivel de planta piloto, con capacidad de tratar 20 L de solución acuosa de compuestos orgánicos. En este trabajo se reportan los resultados del estudio de la degradación fotocatalítica de soluciones de fenol de alta concentración en un reactor de flujo, iluminado con lámparas de luz UV de λmax= 365 nm o λmax= 254 nm utilizando TiO2 como catalizador y oxígeno u ozono como aceptor de electrones.
2. Metodología experimental
2.1 Sistema de reacción
Para este trabajo de investigación, se diseñó una planta piloto (Figura 1) para la degradación fotocatalítica de compuestos orgánicos en solución acuosa. El equipo está constituido por un reactor fotocatalítico iluminado con una lámpara de luz UV, una bomba de diafragma, un tanque de acero inoxidable, un compresor y un ozonizador.

Fig 1 Planta piloto :1) Reactor fotocatalítico de flujo, 2) Válvula de aguja, 3) Bomba magnética, 4) depósito de almacenamiento, 5) Tubería de descarga, 6) Tubería de seguridad, 7) Apagadores eléctricos, 8) Descarga, 9) Medidor de flujo de gas, 10) Compresor, 11) Ozonizador.
El reactor fotocatalítico de acero inoxidable con acabado espejo, tiene una capacidad de 9 L, en su interior tiene tres placas con perforaciones de diferente tamaño que distribuyen el flujo de líquido, y soportan un tubo de vidrio pyrex o de cuarzo que alberga la lámpara de luz UV.
Se cuenta con una lámpara de 20 W de λmax=365 nm marca Cole-Palmer modelo 97615-51 y una lámpara de16 W, λmax=254 nm marca Aqua Mass para realizar los experimentos de degradación fotocatalítica bajo diferentes condiciones de iluminación.
La mezcla de reacción se hizo circular por la planta piloto con un bomba rotatoria marca Cole-Palmer modelo U-07085-40 de 1⁄4 HP. El flujo se controló mediante una válvula de aguja. También se cuenta con un tanque de acero inoxidable de 20 L para la solución de fenol.
El compresor de 2.5 HP marca American Master Power tiene la función de inyectar aire para saturar la mezcla con oxígeno. En algunas reacciones es necesario utilizar como gas oxidante el ozono, para esto se utilizó un ozonizador marca Ozotech modelo OZ2PCS. El flujo de aire y ozono se controló mediante un medidor de flujo para gas con capacidad de 500 mL min−1 marca Dwyer.
2.2 Pruebas de degradación fotocatalítica de fenol
Para cada experimento se prepararon 20 L de solución acuosa de fenol con una concentración de 50 ó 100 ppm a partir de un litro de solución concentrada del mismo reactivo. La solución diluida se colocó en el tanque de recirculación y se mezcló con 40 g de TiO2 Degussa P25.
La mezcla de reacción se hizo circular por la planta piloto por al menos 60 min., en este paso se puede ajustar la velocidad de flujo y el tiempo de residencia mediante la válvula de aguja. Enseguida, se encendió la lámpara y se inyectó la cantidad necesaria de agente oxidante, medido por el flujómetro de gas. Se tomaron muestras cada media hora durante las dos primeras horas y posteriormente cada hora para seguir el avance de la reacción mediante análisis por CLAR (Cromatografía de Líquidos de Alta Resolución) y COT (Carbón Orgánico Total). Antes de analizar, cada muestra se centrifugó y filtró con membranas Millipore GV (0.22 μm de diámetro de poro) para eliminar cualquier rastro de catalizador.
La concentración del reactivo orgánico se determinó mediante cromatografía de líquidos en un equipo Waters modelo 600 equipado con un detector UV-Vis y una columna Novapack phenil (60 Å 4 μm, 3.8 x 100mm). Lafasede11mMdeácido cítrico/0.055 mM de EDTA / 40% de metanol se inyectó con una velocidad de elución de 1.0 mL min−1. La longitud de onda del detector de UV se fijó en 280 nm y el sistema se hizo funcionar en modo isocrático (Moctezuma y col. 1998, Medina-Valtierra y col. 2005). Los productos orgánicos derivados de fenol fueron identificados por la técnica de coinyección de estándares, para este fin, se usaron como estándares varias soluciones acuosas de fenol, hidroquinona, benzoquinona y catecol con diferente concentración entre 5 y 80 mgL−1. Una muestra de cada una de las soluciones se inyectó en el cromatógrafo para determinar el tiempo de elución y para medir el área del pico específico en el cromatograma (Zermeño y col. 2011). Los productos de reacción fueron identificados por comparación de los tiempos de retención de cada compuesto y cuantificados con el apoyo de las curvas de calibración de concentración como función del área de respuesta. El contenido de COT se determinó utilizando un analizador de Carbón Orgánico Total marca Shimadzu modelo 5000 A., este equipo tiene un límite de detección inferior de 5 ppm de COT.
3 Discusión de resultados
Antes de realizar los experimentos de degradación fotocatalítica de fenol, se determinó la cantidad de fenol adsorbida por el catalizador. Para ello, se cargaron 20 L de solución de fenol de 100 ppm (1.062 mM) y 40 gramos de catalizador al sistema de reacción. La mezcla se agitó de forma continua durante 24 horas bajo condiciones de obscuridad. Los resultados confirmaron que el TiO2 sólo adsorbe una pequeña cantidad de fenol, en el orden de 2 mg fenol porgramo de catalizador, tal como se había reportado anteriormente (Medina-Valtierra y col. 2005), lo que representa solo el 4 % de la cantidad total de fenol cargado al sistema de reacción.
Los resultados de las pruebas de degradación fotocatalítica de soluciones acuosas de fenol de 50 ppm (0.57mM) en la planta piloto de 20 L iluminada con lámpara de luz UV λmax=365n mutilizando 2 gL−1 de TiO2 Degussa P-25 como catalizador y oxígeno como aceptor de electrones, se muestran en la Figura 2. En la primera línea, se gráfica la concentración de fenol determinada mediante análisis CLAR como función del tiempo de reacción, ésta indica que cuando se inyecta aire al sistema de reacción, la oxidación del reactivo se lleva a cabo lentamente por lo que se requieren más de 50 horas de reacción para transformar todo el fenol a otros compuestos químicos. Además, los resultados del análisis del contenido de carbón orgánico total (COT) en cada una de las muestras de reacción se transformaron a cantidad de fenol mineralizado a CO2; para ello, se calculó la concentración relativa de carbón orgánico total presente en la mezcla de reacción mediante la siguiente ecuación:
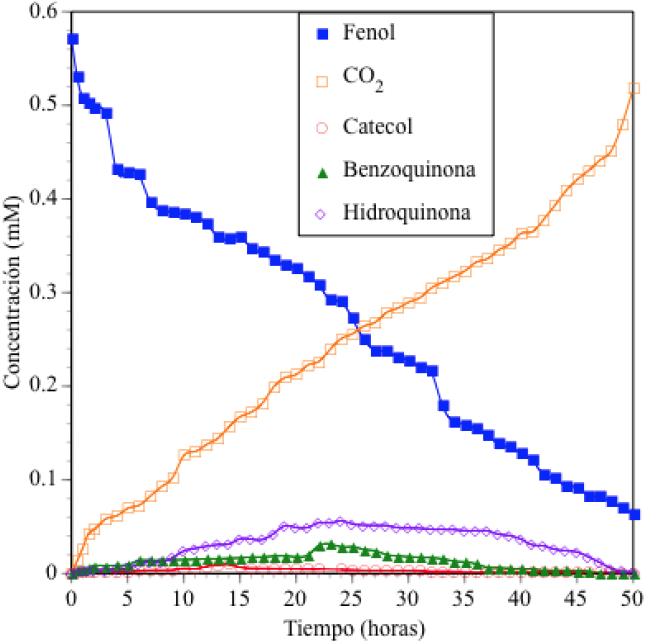
Fig. 2 Concentración de fenol, concentración de productos orgánicos de carácter aromático y fenol convertido a CO2 durante una prueba de degradación fotocatalítica de fenol con TiO2, luz λmax = 365 nm y oxígeno en un reactor de flujo (V 0 = 20 L, C 0 = 50 ppm, TiO2 = 2 g L−1, flujo de gas oxidante = 500 mL min−1). Análisis por COT y CLAR.
Luego, se determinó la cantidad de fenol mineralizado a CO2 con las ecuaciones 2 y 3.
Los resultados indican que la molécula de fenol se mineraliza lentamente siguiendo una cinética de orden cero. Al comparar los perfiles de concentración de fenol y mineralización en la Figura 2 se hace evidente que el reactivo se transforma a otros compuestos orgánicos antes de ser mineralizado a CO2 y agua. Los resultados del análisis de los productos de reacción con carácter aromático mediante CLAR, se presentan en las líneas de la parte inferior de la Figura 2 y muestran claramente que los radicales HO· reaccionan con la molécula de fenol para formar hidroquinona, benzoquinona y catecol. Cabe señalar que los balances de materia a los diferentes tiempos de muestreo, indican que una fracción del fenol se transforma a otros productos orgánicos, probablemente ácidos carboxílicos que no fueron identificados ni cuantificados mediante CLAR.
La Figura 3, muestra los resultados del experimento de degradación de fenol en las mismas condiciones del experimento anterior con inyección de ozono en lugar de oxígeno. La literatura señala que la inyección de ozono favorece la formación de H2O2 que a su vez se transforma a radicales OH· (Doménech y col. 2004, Ahmed y col. 2011) lo que provoca un aumento en la velocidad de las reacciones de degradación y mineralización de fenol alcanzando un 90 % de degradación del reactivo en 33 horas de reacción. La Figura 3 también muestra el perfil de concentración de los compuestos aromáticos producidos durante el transcurso del experimento.

Fig. 3 Concentración de fenol, concentración de productos orgánicos de carácter aromático y fenol convertido a CO2 durante una prueba de degradación fotocatalítica de fenol con TiO2, luz λmax = 365 nm y ozono en un reactor de flujo (V 0 =20L, C 0 =50 ppm, TiO2 = 2 g L−1, flujo de gas oxidante = 500 mL min−1). Análisis por COT y CLAR.
Aunque en ambos experimentos se detectan los mismos productos orgánicos, la velocidad de formación y consumo de cada uno de ellos depende de la cantidad de radicales HO· presentes en la mezcla de reacción. Cuando el experimento se realiza en presencia de oxígeno, se forma hidroquinona como producto mayoritario y cuando se inyecta ozono se forma una mayor cantidad de benzoquinona y catecol.
Los resultados del análisis de las muestras del experimento de oxidación fotocatalítica de una solución acuosa de alta concentración de fenol (100 ppm =1.062 mM) con 2g L−1 de catalizador y flujo de ozono se muestran en la Figura 4. Como era de esperarse, las reacciones de degradación se llevaron a cabo lentamente, por lo cual, sólo se alcanza un 97% de degradación y un 67% de mineralización en 78 horas de reacción.

Fig. 4 Concentración de fenol, concentración de productos orgánicos de carácter aromático y fenol convertido a CO2 durante una prueba de degradación fotocatalítica de fenol con TiO2, luz λmax = 365 nm y ozono en un reactor de flujo (V 0=20L, C 0=100 ppm, TiO2=2 g L−1, flujo de gas oxidante = 500 mL min−1). Análisis por COT y CLAR.
Debido a que los experimentos anteriores requirieron de tiempos de reacción muy largos para alcanzar una conversión de 90 %, se cambió la lámpara de luz UV de λmax= 365 nm por una lámpara germicida de λmax= 254 nm la cual se colocó dentro de un tubo de cuarzo de alta transmitancia.
Dado que la luz UV de λmax= 254 nm puede inducir la transformación del fenol a otros compuestos orgánicos, se llevó a cabo una prueba de oxidación fotoquímica de solución de fenol a una concentración de 100 ppm (1.062 mM) bajo iluminación de la lámpara mencionada. Los resultados indicaron que sólo se logra una conversión del 12% del reactivo inicial después de 48 horas de reacción, cabe señalar que sólo se detectó la formación de hidroquinona y de trazas de benzoquinona después de 9 horas de reacción y ninguno de los compuestos aromáticos presentes en la mezcla de reacción se mineralizó completamente a CO2.
Los resultados de los experimentos de oxidación fotocatalítica de una solución de fenol de 50 ppm (0.531 mM) con inyección de oxígeno y ozono se presentan en las Figuras 5 y 6 respectivamente. En ellas se puede apreciar que al utilizar una lámpara de luz UV de mayor energía (λmax= 254 nm) se reducen los tiempos de reacción para degradar y mineralizar al reactivo. Para el experimento donde se inyectó oxígeno se obtuvo un 88% de mineralización en 46 horas de reacción y cuando se inyectó ozono se alcanzó la misma conversión en 25 h.

Fig. 5 Concentración de fenol, concentración de productos orgánicos de carácter aromático y fenol convertido a CO2 durante una prueba de degradación fotocatalítica de fenol con TiO2, luz λmax = 254 nm y oxígeno en un reactor de flujo (V 0 = 20 L, C 0 = 50 ppm, TiO2 = 2 g L−1, flujo de gas oxidante = 500 mL min−1). Análisis por COT y CLAR.
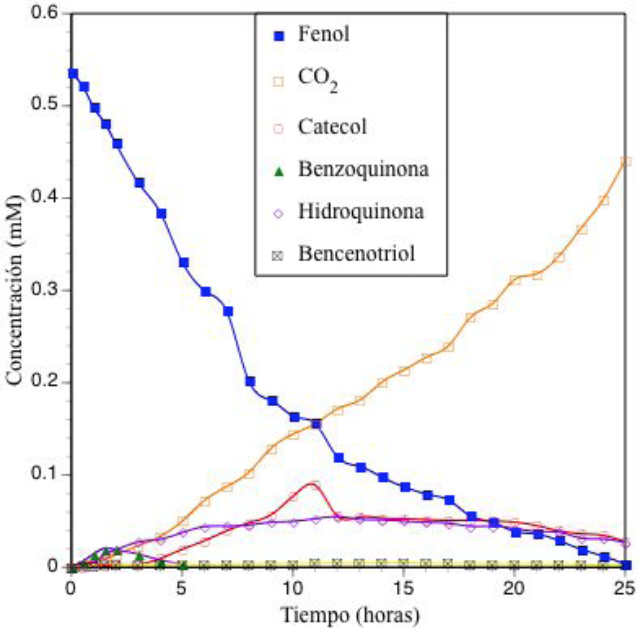
Fig. 6 Concentración de fenol, concentración de productos orgánicos de carácter aromático y CO2 durante una prueba de degradación fotocatalítica de fenol con TiO2, luz λmax = 254 nm y ozono en un reactor de flujo (V 0 =20L, C 0 =50ppm, TiO2=2g L−1, flujo de gas oxidante = 500 mL min−1). Análisis por COT y CLAR.
Cuando se modifican las condiciones de reacción, los perfiles de formación y consumo de los productos orgánicos también se modifican, tal como lo indican las Figuras 5 y 6. Los resultados del análisis de las muestras de los experimentos de degradación fotocatalítica de fenol con inyección de oxígeno (Figura 5) mediante CLAR, muestran que se forma mayoritariamente hidroquinona y en menor proporción benzoquinona y catecol. Además, se detecta la formación de trazas de bencenotriol, lo que indica que existe un aumento en la concentración de radicales HO· que desplazan los hidrógenos de las posiciones 2 y 4 del anillo aromático de fenol. Esto confirma el mecanismo de reacción propuesto anteriormente en la literatura (Moctezuma E, y col. 2011).
Cuando se inyecta ozono al sistema de reacción se favorece la mineralización del fenol vía formación de catecol y bencenotriol (Figura 6), al mismo tiempo que ocurre a menor velocidad la mineralización vía hidroquinona y benzoquinona.
Los perfiles de concentración de fenol como función del tiempo reportados en las figuras anteriores muestran que hay un ligero cambio de pendiente al disminuir la concentración del reactivo, sin embargo, las gráficas muestran una tendencia clara de que las reacciones de degradación fotocatalítica de fenol siguen una cinética de orden cero. Además, las reacciones de degradación fotocatalítica de diferentes compuestos aromáticos siguen una cinética del tipo LH-HW, en estos casos, el orden de reacción cambia desde primer orden hasta orden cero al aumentar la concentración del reactivo orgánico (Moctezuma y col. 2013), por lo que las constantes de velocidad para las reacciones de degradación fotocatalítica de soluciones de fenol de alta concentración, pueden calcularse mediante la Ecuación 4. Los resultados se muestran en la Tabla 1.
Tabla 1 Constantes de velocidad para las reacciones de degradación y mineralización de fenol con TiO2, luz λmax = 365 nm, oxígeno u ozono en el reactor de flujo (KdA = Constante de velocidad de reacción aparente para la degradación de fenol, KdR = Constante de velocidad de reacción real para la degradación de fenol, KmA = Constante de velocidad de reacción aparente para la mineralización de fenol, KmR = Constante de velocidad de reacción real para la mineralización de fenol)
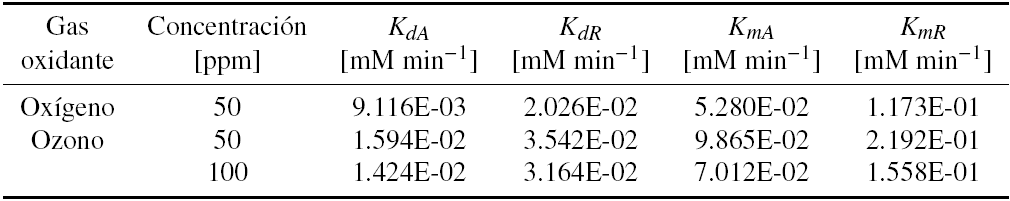
Sin embargo, como los experimentos se llevaron a cabo en un reactor de recirculación se corrigió el valor de la constante de velocidad de reacción mediante la Ecuación 5 de acuerdo al procedimiento recomendado por Davis and Hao (1992). Los resultados también se muestran en la Tabla 1.
Las constantes de velocidad para las reacciones de mineralización (Tabla 2), se calcularon de la misma manera utilizando las Ecuaciones 6 y 7.
Tabla 2 Constantes de velocidad para las reacciones de degradación y mineralización de fenol con TiO2, luz λmáx = 254 nm, oxígeno u ozono en el reactor de flujo (KdA = Constante de velocidad de reacción aparente para la degradación de fenol, KdR = Constante de velocidad de reacción real para la degradación de fenol, KmA = Constante de velocidad de reacción aparente para la mineralización de fenol, KmR = Constante de velocidad de reacción real para la mineralización de fenol)

Conclusiones
Las soluciones acuosas de fenol de alta concentración pueden ser degradadas y mineralizadas en la planta piloto usando TiO2 (Degussa P25) como catalizador y una lámpara de luz UV con λmax=365nmo una lámpara germicida de λmax = 254 nm. El fenol se mineraliza vía formación de hidroquinona, benzoquinona, catecol y bencenotriol que a su vez se transforman a otros productos orgánicos de cadena abierta para finalmente convertirse a CO2. Aunque las reacciones de degradación y mineralización siguen una cinética de orden cero, la inyección de ozono en lugar de oxígeno como aceptor de electrones acelera las reacciones de degradación debido a que favorece la formación de benzoquinona y catecol. El cambio de la lámpara de luz UV de λmax=254 nm por una lámpara germicida favorece la formación de bencenotriol que da por resultado un incremento en las velocidades de degradación y mineralización.











 nueva página del texto (beta)
nueva página del texto (beta)