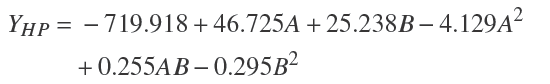1 Introducción
Las proteasas (EC 3.4.21-24) representan cerca del 60 % de la producción mundial de enzimas de uso industrial. Se encuentran distribuidas en la naturaleza y pueden ser obtenidas a partir de fuentes vegetales, animales y microbianas (Sandhya y col. 2005). Las proteasas microbianas juegan un papel importante en procesos biotecnológicos debido a su aplicación en alimentos (bebidas, panificación, ablandamiento de carne, etc.), industria farmacéutica (obtención de péptidos), en la industria de la curtiduría, tratamiento de aguas residuales y en detergentes, entre otros (Singh y col. 2008; Marcial y col. 2011).
El principal productor de proteasas ha sido el género Bacillus sp., sin embargo, en los últimos años se ha incrementado el interés por el uso de hongos filamentosos en la producción de proteasas. Existen reportes del uso de Streptomyces (De Azeredo y col. 2004), Aspergillus (Wu y col. 2006), Penicillium (Agrawal y col. 2004) y Rhizopus (Kumar y col. 2005); así como de Aerobasidium pullulans y Yarrowia lipolytica (Hernández-Martínez y col., 2010b). Se han reportado altos títulos de proteasa extracelular producidos por Y. lipolytica (Madzak y col. 2004), un ascomiceto aeróbico dimórfico obligado considerado no patógeno y aprobado como seguro o GRAS (Hernández-Martínez y col. 2010b).
El cultivo en medio sólido ha sido favorablemente utilizado para la producción de proteasas fúngicas debiéndose principalmente a que los hongos están naturalmente adaptados a crecer sobre superficies con bajo contenido de humedad. Dentro de las aplicaciones del cultivo sólido, se enumeran la producción de enzimas extracelulares con estabilidad en un amplio rango de pH y temperatura (Sumantha y col. 2006; Ruíz-Leza y col. 2007, Flores-Flores y col. 2011). Desde el punto de vista industrial, se estima que el 30-40 % de los costos de producción de enzimas es debido al costo del medio de cultivo (Wang y col. 2005). Los procesos de cultivo sólido permiten emplear residuos sólidos agroindustriales de bajo costo y gran disponibilidad; por ejemplo: residuos de cáscara de camarón en polvo (Wang y col. 2008) y sus residuos (Ghorbel-Bellaaj y col. 2012); sardina en polvo (Sellami-Kamoun y col. 2011), residuos de curtiduría (Ravindran y col. 2011), harina de plumas y licor de máız fermentado (De Azeredo y col. 2006).
En el proceso de cultivo sólido, las diferentes variables del proceso, como temperatura, pH, humedad, actividad de agua, naturaleza, disponibilidad y concentración del sustrato, aireación, tamaño de partícula, tiempo de incubación, entre otros, etc. (Thomas y col. 2013) pueden ser optimizados con apoyo de métodos estadísticos a fin de identificar los factores críticos y sus interacciones sobre la variable de interés. La temperatura y el pH son dos parámetros ambientales que afectan en gran medida los procesos de fermentación y/o la síntesis enzimática (Bhunia y col. 2013). El objetivo del presente trabajo fue evaluar el efecto del pH, la temperatura y la fuente de proteína y carbohidratos en la producción de proteasas por Y. lipolytica en cultivo sólido. Se utilizó como fuente de proteína y carbohidratos harina de pescado (HP) y harina de soya (HS).
2 Materiales y métodos
2.1 Microorganismo
Se utilizó la cepa Y. lipolytica (Laboratorio de Bioprocesos, Universidad Autónoma de Guadalajara). La cepa se conservó a -40 °C en una suspensión de glicerol-leche descremada. La cepa se propagó en agar papa dextrosa (PDA-Bioxon) a 45 °C por siete días. Las esporas se cosecharon con una solución estéril de Tween 80 (0.05 %) y se cuantificaron en cámara de Neubauer.
2.2 Preparación del soporte y sustrato
Para la producción de proteasas se utilizó harina de pescado (HP) y harina de soya (HS) como sustrato y perlita (P) como soporte inerte (Termolita, Nuevo León, México). La HP, HS y P se ajustaron a un tamaño de partícula de 0.42, 0.50 y 0.84 mm respectivamente. La P fue sometida a un pre- tratamiento que consistió en dos lavados secuenciales con agua caliente-fría y posteriormente se secó a 60 °C durante 72 h.
2.3 Medio de cultivo
El medio de cultivo se formuló como se describe a continuación (g/L): KH2PO4 (1.0), MgSO4· 7H2O (0.5), KCl (0.5) y FeSO4 (0.01). La HP presenta una composición elemental (%) como se describe a continuación: Carbono (40.08), Nitrógeno (8.71) e Hidrógeno (6.44). Sin embargo, del 43.25 % de carbono, solo el 1.45 % son carbohidratos asimilables (Fenol-sulfúrico) (García-Gómez, 2008). Por otro lado, la HS está compuesta por: Carbono (42.20), Nitrógeno (7.23) e Hidrógeno (6.83).
Los diferentes valores de pH inicial se ajustaron como sigue: pH 5.0 (Buffer de acetatos 0.1 M), pH 7.0 (Buffer fosfatos 0.1 M) y pH 9.0 (Buffer Tris-HCl 0.1 M).
2.4 Condiciones de cultivo
Se utilizaron columnas de vidrio (3.5x12 cm) empacadas con 1.5 g de una proporción sustrato-soporte de 30/70 (p/p) previamente homogenizados con el medio de cultivo e inóculo (2x107 esp/g sopote seco), la humedad inicial se ajustó al 50 %. El cultivo en medio sólido se realizó a tres diferentes temperaturas (40, 45 y 50 °C) durante 48 h a un flujo de aire de 40 mL/min. Se tomó muestra cada 12 h y el extracto enzimático de cada columna se recuperó adicionando 10 mL de agua destilada a 4 °C por cada g de masa fermentada. La muestra se agitó (30 min) y filtró (Whatman No. 1). El filtrado se centrifugó (14000 g/15 min/4 °C) y se consideró al sobrenadante como el extracto proteolítico.
2.5 Procedimientos analíticos
Determinación de proteína y actividad enzimática
Se determinó el contenido de protéına soluble de acuerdo al método de Bradford (Bio-Rad protein assay). El contenido de protéına se determinó por el método de Kunitz (1947) modificado por Johnsvesly y col. (2002). Se preparó una solución de caséına (Hammerstein) al 1 % en buffer fosfatos 0.1 M pH 7.0. El extracto enzimático (50 μL) se adicionó a 950 μL de solución de caséına previamente atemperada a 35 °C. La mezcla se homogenizó e incubó durante 15 min a 35 °C; la reacción se detuvo por la adición de 1.5 mL de ácido tricloroacético (TCA) al 5 %. Se preparó un blanco en el cual se sustituyó el volumen del extracto enzimático por agua destilada y se le dio el mismo tratamiento que a las muestras. Adicionalmente se puso una alícuota de 950 μL de solución caséına y se incubó a 35°C durante 15 min, se añadió 1.5 mL de TCA (5 %) y 50 μL de extracto enzimático. La muestra se centrifugó (14000g/15 min/4 °C), se filtró el sobrenadante (Whatman No. 1) y se cuantificó la liberación de tirosina a una absorbancia de 280 nm. Se preparó una curva de calibración con tirosina (Sigma- Aldrich®) en un rango de 0 a 156 μg/mL de tirosina en ácido clorhídrico 1 M. Una unidad de actividad proteolítica (U) se definió como la cantidad de enzima capaz de liberar un μg de tirosina por minuto bajo las condiciones de ensayo.
Análisis estadístico
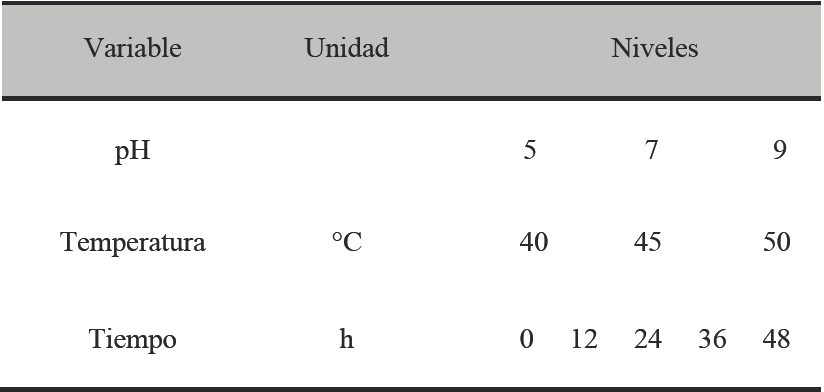
Se realizó un diseño factorial 3x3x5 para determinar el efecto del pH, temperatura y tiempo sobre la actividad proteolítica de Y. lipolytica en cultivo sólido utilizando dos sustratos diferentes (HS y HP). Los niveles empleados para cada factor a evaluar se muestran en la Tabla 1.
Tabla 1 Diseño experimental para evaluar el efecto del pH, Temperatura y tiempo en la producción de protestas por Y. lipolytica en cultivo sólido.
Se obtuvo un total de 90 tratamientos para cada sustrato. Para el análisis de datos se realizó un análisis de varianza (ANOVA) empleando el software PASW Statistics 18. Cuando fue necesario, se realizó una comparación de medias por Tukey (p ≤ 0.05).
3 Resultados y discusión
Se realizaron cultivos en medio sólido para evaluar la producción de proteasas por Y. lipolytica empleando HP y HS como sustrato y perlita como soporte inerte. Se llevó a cabo un análisis de varianza (ANOVA) de tres vías para evaluar el efecto del pH, tiempo y temperatura sobre la producción de proteasas (Tabla 2).
Tabla 2 Análisis de varianza (ANOVA) de la producción de proteasas a partir de harina de pescado (HP) o harina de soya (HS).
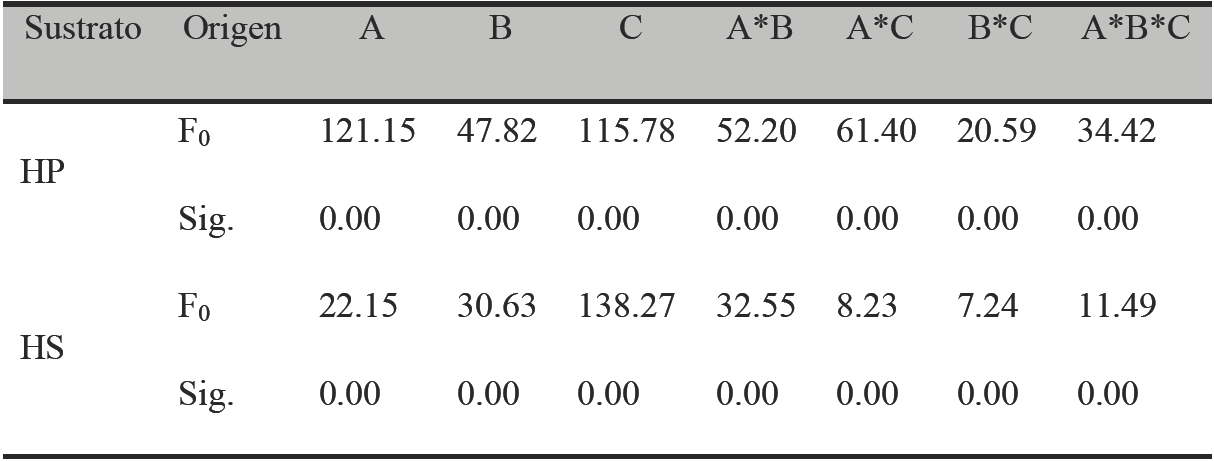
a) R2= 0.98; b) A: pH, B: Temperatura, C: Tiempo
Se observó que todos los factores evaluados; así como sus interacciones mostraron un efecto significativo (p ≤ 0.05) en la producción de proteasas a partir de HP. La Figura 1 y 2 muestra el efecto del pH (a) y temperatura (b) empleando HP y HS como sustrato, respectivamente.
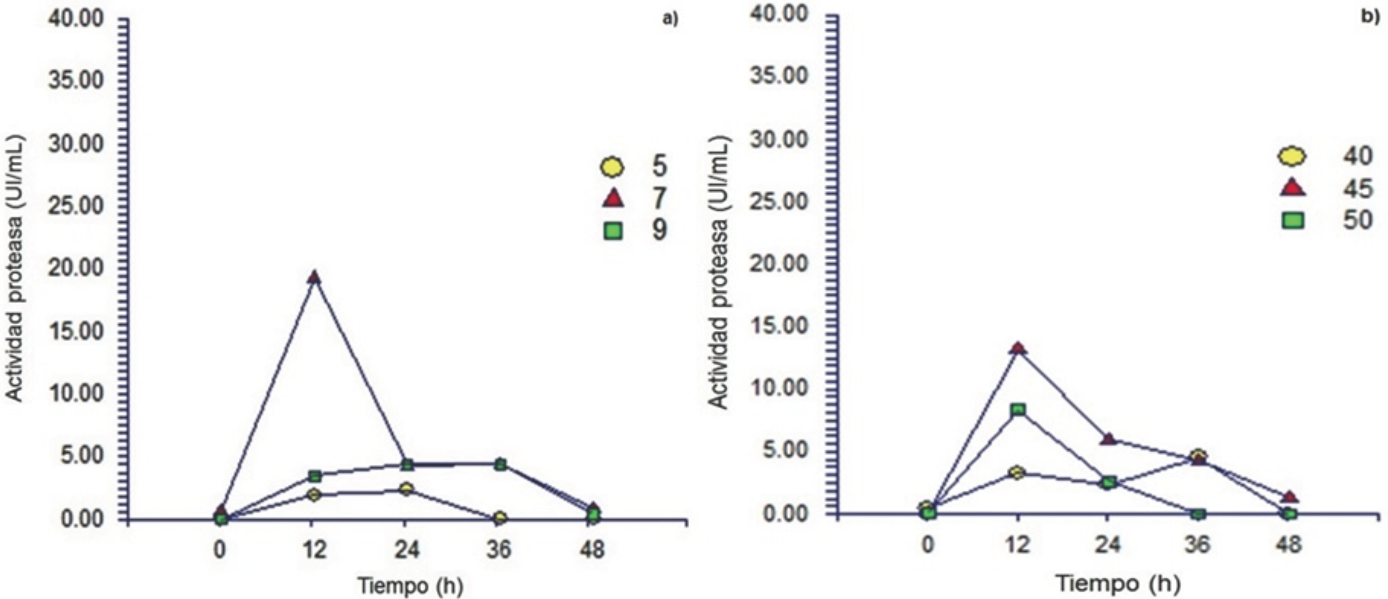
Fig. 1 Efecto del (a) pH 5 (•), 7 (▲) y 9 (∎) y (b) temperatura 40 (•), 45 (▲) y 50 °C (∎) en la producción de proteasas por Y. lipolytica a partir de harina de pescado.
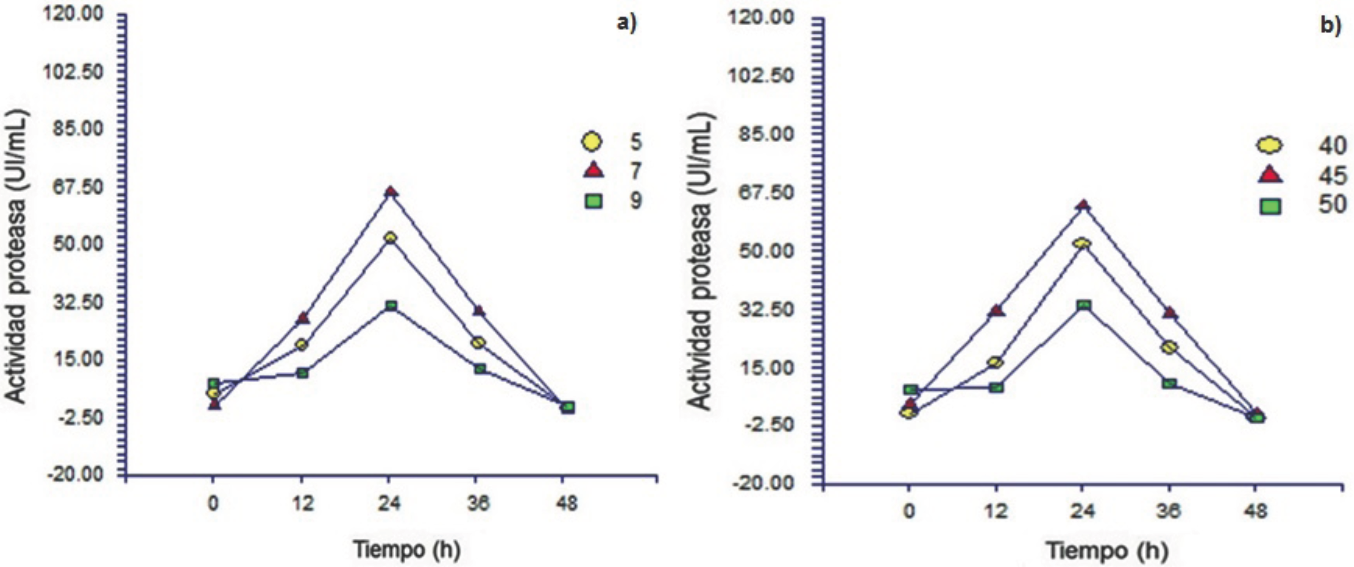
Fig. 2 Efecto del (a) pH 5 (•), 7 (▲) y 9 (∎) y (b) temperatura 40 (•), 45 (▲) y 50 °C (∎) en la producción de proteasas por Y. lipolytica a partir de harina de soya.
Se observó la producción de proteasas por Y. lipolytica a partir de HP (Fig. 1) en el rango de pH de 5 a 9; sin embargo, la máxima producción de proteasas se obtuvo a pH 7 a las 12 de cultivo (20 U/mL), valor 4.5 veces mayor al obtenido a pH 5 y 9 (Fig. 1a). El pH del medio influye en el crecimiento y metabolismo microbiano para producir enzimas, así como en la actividad y estabilidad de las mismas. Al utilizar HS (Fig. 2), la máxima actividad proteolítica (66 U/mL) se obtuvo a pH 7 y la actividad decrece cuando el valor de pH se ajusta por arriba o por abajo de 7 (Fig. 2a). Valores de pH similares han sido reportados como óptimos para la producción de proteasas por A. fumigatus, A. tamarii, A. nidulans HA-10 y Monascus purpureus (Hernández-Martínez y col. 2011a). Se ha reportado que la producción de proteasas fúngicas está influenciado por el pH inicial del medio de cultivo, debido a su participación en los diversos procesos enzimáticos y de transporte necesarios para el crecimiento celular y metabolitos (Ellaiah y col. 2002; Kumar y col. 2008).
Una vez identificado el valor de pH que proporciona la mayor actividad proteolítica, se evaluó el efecto de la temperatura (40 a 50 °C). La máxima producción de actividad enzimática se obtuvo a 45 °C (Fig. 1b y 2b), bajos niveles de actividad se obtuvieron a 40 y 50 °C para ambos sustratos (HP y HS).
El uso de HS como fuente de protéına y carbohidratos proporcionó la mayor actividad proteolítica (67 U/mL) a un pH inicial de 7 a 45 °C, a las 24 h de cultivo (Fig. 2). En contraste, con la HP (Fig. 1) a las mismas condiciones de pH y temperatura proporcionó 14 U/mL como máxima actividad proteolítica a las 12 h de cultivo, valor 4.8 veces menor al obtenido con HS.
Se ha reportado que la máxima producción de proteasa alcalina por A. flavus IM1 327634 fue de 2.72 U/g sustrato obtenida a las 48 h utilizando salvado de trigo como sustrato, con mayor actividad a pH entre 7.5 y 9.5 (Malathi y col. 1991). García-Gómez y col. (2008) reportaron la máxima producción de proteasas a las 44 h de cultivo al utilizar HP. En este trabajo la mayor producción se obtuvo a las 24 h y 12 h utilizando HS y HP respectivamente, la reducción del 50-75 % del tiempo de fermentación representa una disminución significativa del costo total del proceso.
La temperatura óptima de producción encontrada en este estudio (45 °C) es similar a la reportada por Li y col. (2009) para proteasas de Y. lipolytica. Esto se explica debido a que la mayoría de las levaduras tienen una temperatura máxima de crecimiento entre 24-48 °C y una afinidad por medios ligeramente ácidos con un pH entre 4.5 y 6.5 (Déak y Beuchat, 1996). Los tiempos de máxima producción de proteasa observados en este trabajo (12 y 24 h con HP y HS, respectivamente)sonmáscortosquelosreportados para la producción de proteasas por A. oryzae (García-Gómez y col. 2008), Candida humícola (Ray y col, 1992),C.Buinensis (Araujoycol.2010) yY.lipolytica (Hernández-Martínez y col. 2011b), quienes reportan la máxima producción de proteasas a las 44, 96, 48 y 36 h de cultivo respectivamente.
Yarrowia lipolytica presentó la capacidad de utilizar HP y HS como fuente de protéına y carbohidratos para su crecimiento y producción de proteasas, la máxima producción enzimáticas e obtiene a las 12 h empleando HP; en contraste al utilizar HS la máxima producción se alcanza a las 24 h. Sin embargo, los rendimientos son hasta 6.25 veces superiores al emplear HS, comparado con aquellos obtenidos al emplear HP. Sandhya y col. (2005) reportaron el uso de salvado de trigo en la producción de proteasas de A. oryzae, obteniendo la mayor actividad proteasa (31.2 U/mL) a pH 7.5 y una temperatura de 30 °C, a un tiempo de cultivo de 72 h. Empleando la cepa A. fumigatus y harina de coraza de langosta como fuente de carbono, la mayor actividad proteasa obtenida fue de 1.1 U a pH 4, 37 °C y 144 h de cultivo (Wang y col. 2005). En el presente estudio, se observa una reducción del tiempo de máxima producción de proteasas en un 66.7 y 83.44 % comparado con lo reportado por Sandhya y col. (2005) y Wang y col. (2005) respectivamente. Asimismo, García-Gómez y col.(2008) y Hernández-Martínez y col. (2011b) reportaron la máxima producción de proteasas a partir de HP a las 44 y 36h de cultivo respectivamente; en contraste con ese trabajo, el tiempo de máxima producción fue de 12 h a partir del mismo sustrato (HP), logrando una reducción en el tiempo de proceso del 73 y 66 % respectivamente. El notable acortamiento en el tiempo del proceso es de gran interés para la industria enzimática,ya que se disminuyen considerablemente los tiempos de operación, disminuyendo los costos del proceso.
En referencia al efecto de la temperatura (Fig. 4a) se observó un patrón clásico de relación temperatura-actividad, con una temperatura óptima de 45°C, observándose una disminución de actividad a valores mayores o menores de dicha temperatura. La mayoría de las levaduras crecen de manera óptima a temperaturas de 24-48 °C, por encima de esta temperatura se comienza a perder estabilidad en la producción enzimática (Déak y Beuchat, 1996). Adicionalmente, el cultivo en medio sólido limita los fenómenos de transferencia de energía generando problemas para remover el calor generado, ocasionando un sobre calentamiento y, por ende, una mayor pérdida de humedad del medio, limitando la disponibilidad de nutrientes para el crecimiento del microorganismo; motivo por el cual no es conveniente utilizar temperaturas mayores a 45°C durante los procesos en cultivo sólido (Graminha y col.2008).
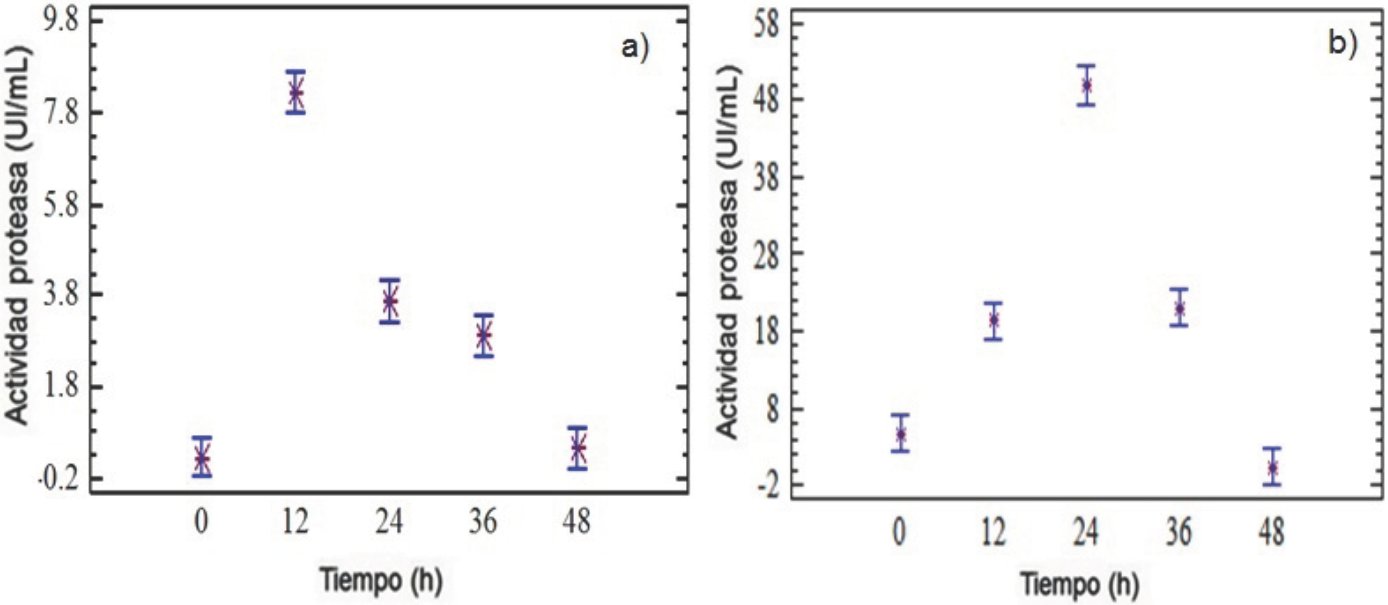
Fig. 3 Efecto del tiempo en la producción de proteasas por Y. lipolytica a partir de harina de pescado (a) y harina de soya (b).

Fig. 4 Efecto del a) temperatura y b) pH en la producción de proteasas por Y. lipolytica a partir de harina de pescado
Debido a la diferencia de unidades en las que se reporta la actividad enzimática entre los diferentes autores, no es factible hacer una comparación directa entre los títulos de actividad producidos. La mayor producción de actividad enzimática se obtuvo a pH inicial de 7 (Fig. 4b), observando que a pH 5 y 9 se presenta una notable reducción en la producción de proteasas, por lo cual se considera la producción de una proteasa neutra. Hernández-Montañez y col. (2007) reportaron que Y. lipolytica posee genes recombinantes que son capaces de generar los tres tipos de proteasas: ácidas, neutras y alcalinas; por lo que es posible considerar que las proteasas producidas por Y. lipolytica bajo las condiciones de cultivo sólido descritas en este trabajo sean mayoritariamente neutras, dependiendo del pH inicial (Niyonzima y More, 2013; Sumantha y col. 2006).
Una vez obtenidos los valores de pH (7) y temperatura (45 °C) que proporcionan la mayor producción de proteasas, se realizó un ANOVA fijando el tiempo a 12h para HP y 24h para HS, los resultados se muestras en las Tablas 3 y 4 para HS y HP respectivamente. El ANOVA resultante para HS (Tabla 3) no presentó términos significativos y la R2 fue de 33.5%. Esto indica que en el tiempo máximo de producción enzimática con HS no se tiene efecto del pH y temperatura, por lo que los niveles de mayor actividad elegidos del ANOVA de tres vías se consideran como los valores que logran las mejores condiciones usando Harina de Soya como sustrato.
Tabla 3 Análisis de varianza de la producción de proteasas por Y. lipolytica a partir de harina de soya.
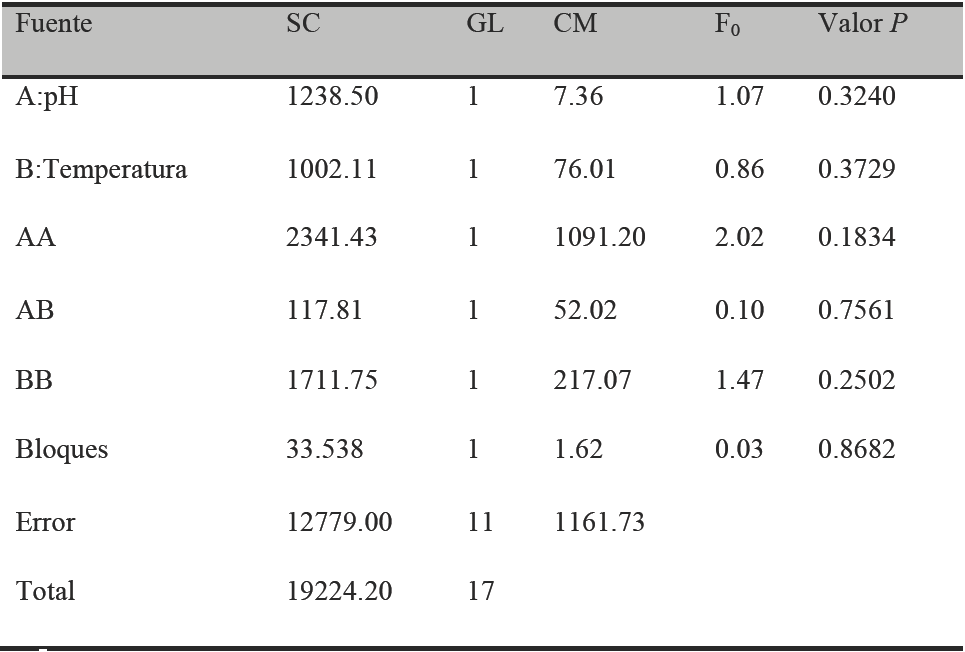
*R2 =33.52%
Tabla 4 Análisis de varianza de la producción de proteasas por Y. lipolytica a partir de harina de pescado.
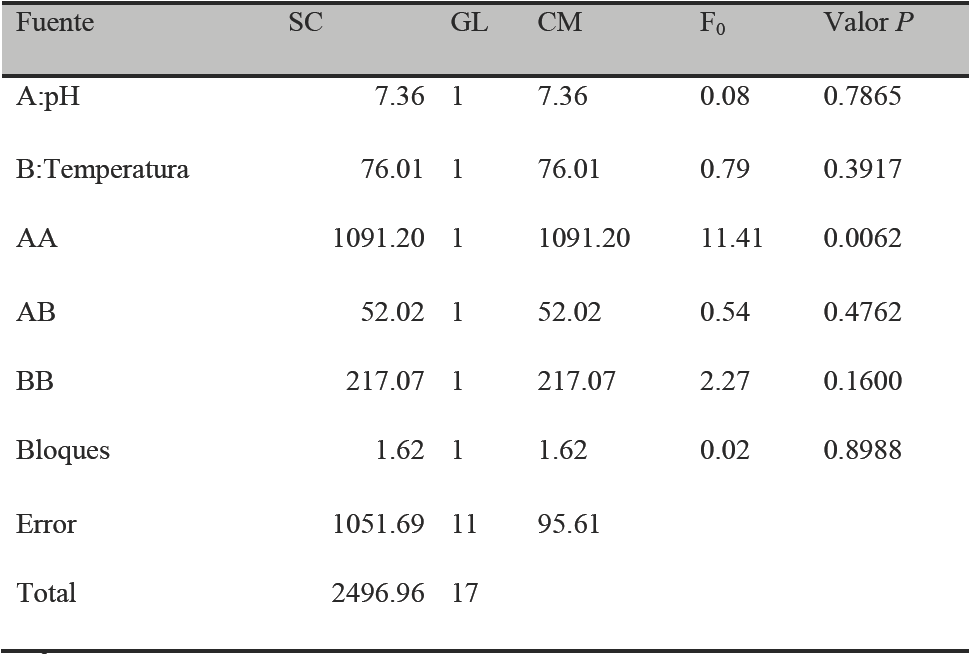
*R2 =57.88%
En contraste, en el ANOVA de Hp (Tabla 4) la variable que más influye en la producción de proteasas por Y. lipolytica en cultivo sólido empleando HP es el pH (p≤0.05). Lo anterior indica que un ligero cambio en el valor de pH puede provocar un aumento o descenso notable en la producción de proteasas. El modelo tiene al menos un efecto significativo, por lo cual se concluye que se presenta un efecto del pH en el término cuadrático para el tiempo de máxima producción enzimática.
Los datos obtenidos del ANOVA para HP permitieron generar una superficie de respuesta estimada. Los datos fueron ajustados mediante regresión múltiple a una ecuación polinomial de segundo orden (HP, Ec.1), originando un modelo que indica la relación empírica entre la variable dependiente (actividad proteasa, Y) y las variables independientes (pH y temperatura) para HP.
Donde: HP= Harina de pescado; A= pH; B= Temperatura
La Fig. 5 muestra la respuesta de la interacción pH-temperatura empleando HP como fuente de carbono a un tiempo de cultivo de 12 h. La máxima producción de proteasa bajo estas condiciones fue predicha en 24.41 U/mL, correspondiendo a pH 7 a 45 °C. La curva además sugiere que ligeros cambios en el pH o temperatura de incubación producen diferencias notables en la variable de respuesta; sin embargo, el ajuste solo explica el 57.88 % del modelo. Lo anterior indica que aún en las condiciones del tiempo de máxima producción, el modelo permite estimar una aproximación del nivel óptimo de temperatura y pH. Bajo condiciones predichas por el modelo, se obtuvo una actividad proteolítica experimental de 38.59±2.48 U/ml.
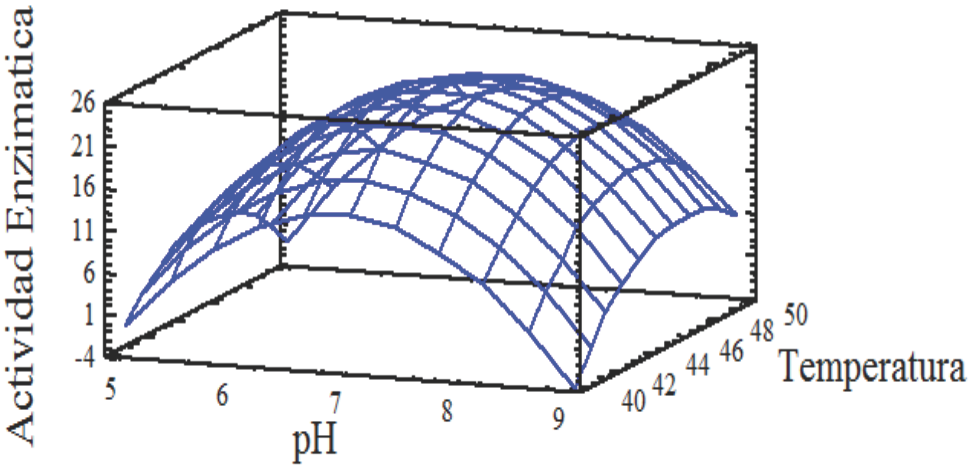
Fig. 5 Superficie de respuesta en la producción de proteasas por Y. lipolytica, se muestra la interacción entre pH-temperatura después de 12 h de cultivo en medio sólido a partir de harina de pescado.
El valor experimental fue superior al predicho por el modelo debido al poco ajuste de los datos al modelo, lo cual puede ser debido a que no se están considerando otros factores que puedan influir en la producción de la proteasa, tales como la diferente composición de minerales, así como la relación C/N.
La síntesis de enzimas fúngicas está fuertemente influenciada por el tipo de cepa, composición del sustrato y la concentración de nitrógeno en el medio de cultivo (Elisashvili y col., 2008; Elisashvili y Kachlishvili, 2009). Entre los parámetros de cultivo, la relación Carbono/Nitrógeno (C/N) es uno de los factores fundamentales en la regulación metabólica entre la producción de biomasa y biomoléculas; dependiendo del metabolito de interés (biomasa o biomolécula) el radio C/N debe ser establecido. El exceso o falta de nitrógeno en el sustrato puede ser una limitante para el crecimiento del hongo; pero no así para la producción de cierto tipo de enzimas fúngicas (Rajarathnam y Bano, 1989). Se reportado que la producción de proteasas extracelulares, no asociadas al crecimiento está modulada por un sistema inductor regulado en función del radio C/N (De Azeredo y col., 2003). La HS usada en este trabajo presentó un C/N de 6.11, mientras que la HP presentó un C/N de 4.6, lo cual indica que a mayor C/N, mayor es la producción de proteasas bajo las condiciones evaluadas en este trabajo. Actualmente se está estudiando el efecto de la relación C/N en la producción de proteasas.
Conclusiones
Los resultados obtenidos muestran que es posible acortar los tiempos de producción de proteasas por Y. lipolytica a partir de HP y HS, proporcionando un proceso económico y rentable en función del costo del sustrato (USD $ 0.8 kg) y tiempo de proceso. La mayor producción de proteasas (105.2 U/mL) se obtiene empleando HS a un pH inicial de 7, temperatura de 45 °C y un tiempo de cultivo de 24 h. El tiempo máximo de producción se redujo hasta un 83.4 % comparado con los reportados en la literatura para sustratos y procesos similares. La reducción del tiempo del proceso de producción de proteasas tiene un impacto directo en el costo total del proceso; a menor tiempo de proceso menor será el costo de producción de la enzima. El modelo obtenido para HS indica que las variables estudiadas no presentan efecto significativo sobre la producción de proteasas por Y. lipolytica. En el caso de HP se observó un efecto significativo del pH. Es recomendable profundizar el estudio tomando en cuenta otras variables (relación C/N, nivel de inóculo, enriquecimiento del medio, etc) que pueden tener un efecto positivo en el aumento de la producción de proteasas por Y. lipolytica.











 nueva página del texto (beta)
nueva página del texto (beta)