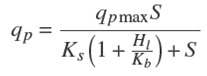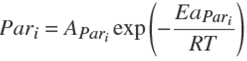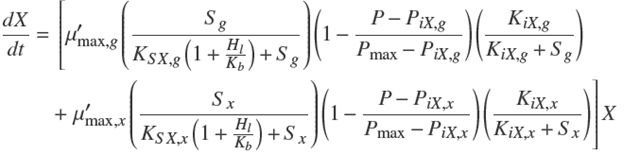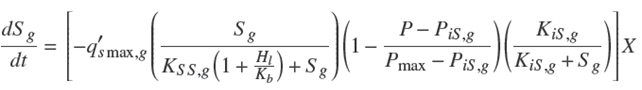1 Introducción
Mucho se ha hablado sobre la problemática de los combustibles fósiles, en parte debido a la contaminación que inevitablemente se deriva por su uso. Las emisiones de CO2 a la atmósfera, consideradas como una de las fuentes que contribuyen mayoritariamente al calentamiento global del planeta, pueden tener consecuencias desastrosas para ciertas regiones produciendo sequías e inundaciones. Una alternativa para reducir el volumen total de CO2 que se emite a la atmósfera, es el uso de biocombustibles. Estos se obtienen de manera renovable a partir de restos orgánicos que absorben CO2 a medida que crecen, emitiendo prácticamente la misma cantidad que los combustibles convencionales cuando se queman, lo que se produce un proceso de ciclo cerrado. Dentro de estos biocombustibles se encuentra el bioetanol, que mezclado con la gasolina produce un biocombustible con características muy similares a la gasolina. Además usado a concentraciones del 5 o el 10% no se requieren modificaciones en los motores actuales.
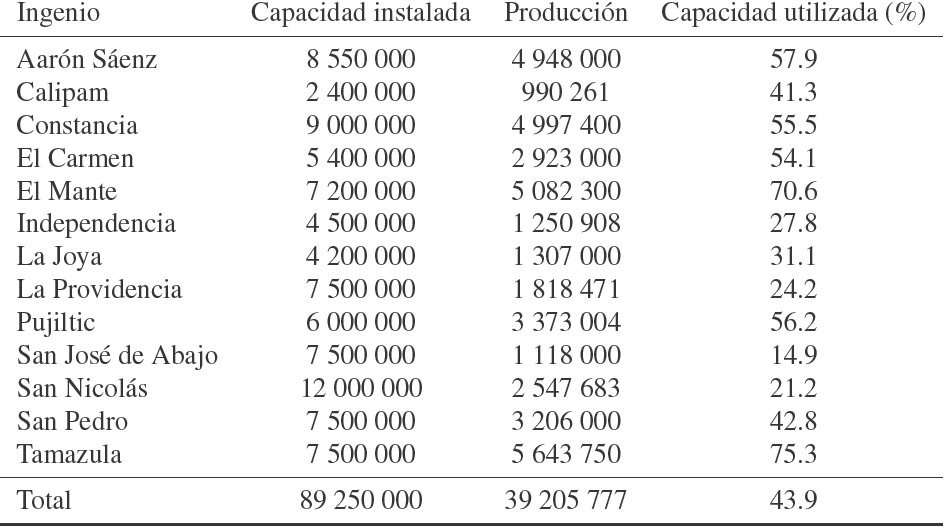
Actualmente en México, la bioenergía representa el 8% del consumo de energía primaria. Los principales bioenergéticos empleados son el bagazo de caña (usado para la generación eléctrica y/o térmica en la industria azucarera) y la leña (fundamentalmente usada para calefacción y cocción de alimentos). Además, se cuenta con un área agrícola significativa, potencialmente apta para la producción de bioetanol y biodiesel (Red Mexicana de Bioenergía, 2005). En México, desde hace varios años, se produce etanol de caña de azúcar en los diferentes ingenios del páıs que cuentan con destilerías, sólo que su uso es para bebidas embriagantes e industriales, no para uso combustible. Se produce, principalmente, de melazas de caña de azúcar y con una tecnología tradicional y bastante conocida. Sin embargo, a pesar de tener la capacidad para producir mayor cantidad, los ingenios del páıs no la utilizan (ver Tabla 1), debido a que la demanda es limitada y que el insumo es cíclico.
Tabla 1 Producción de Etanol en México y capacidad instalada, ciclo 2002 - 2003 expresada en Litros/ciclo agrícola (SENER, 2004).
La Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), a declarado que México forma parte de los páıses de América Latina y el Caribe (ALC) con alta disponibilidad de tierra arable para expansión agrícola (entre 6 y 343 millones de hectáreas). De modo que es posible la expansión de cualquier tipo de agricultura, mediante el esquema de desarrollo sostenible, incluso para proveer alimentos y biocombustibles a otros páıses (Bot y col., 2008). De acuerdo con la Secretaría de Energía (SENER, 2006), la reducción de las importaciones de gasolina y metilterbutiléter (MTBE) en el caso de que todas las gasolinas en México fueran mezclas del 10% de etanol, supondría un ahorro en la balanza de pagos de hasta US$ 2.0 mil millones. La venta de bonos de carbono a través de proyectos del Mecanismo de Desarrollo Limpio (MDL) podría potencialmente añadirse a este beneficio. Para el escenario de mayor penetración de etanol se esperaría una mitigación de 10.6 millones ton CO2 eq/año con base en una producción a partir de caña de azúcar. El impacto del uso de bioetanol en la reducción de gases de efecto invernadero en México, pueden verse en la Tabla 2.
Tabla 2 Impactos esperados en las emisiones de GEI en México con la introducción de 10% de etanol en la gasolina, los valores para el año 2004. *Considerando que las emisiones por gasolina como 2.8 kg CO2 eq. / l, y la equivalencia (en volumen) de los dos combustibles.
Por otra parte, es importante señalar que el bioetanol se consume de un 25% a un 30% más rápido que la gasolina, y que para ser competitivo debe tener un menor precio. Así que para que el bioetanol contribuya perceptiblemente a las necesidades de combustible, debe tener un balance energético neto positivo. De modo que para hacer del bioetanol una alternativa viable, se hace necesaria la optimización del proceso y para ello es indispensable el uso de modelos que ayuden a predecir los niveles de producción de bioetanol.
En la literatura se han reportado varios modelos para la producción de bioetanol, no obstante los modelos existentes tienen el inconveniente de ser poco generalizables, además de emplear parámetros específicos constantes para cada prueba sin posibilidad de tomar en cuenta las condiciones de operación. De modo que estos modelos solo reproducen adecuadamente un conjunto específico de condiciones de operación.
Por esta razón, el objetivo principal de este trabajo es obtener un modelo para la producción de bioetanol a partir de glucosa y xilosa que permita tomar en cuenta los efectos de pH, temperatura y concentración de glucosa y xilosa en el proceso de fermentación, posibilitando la optimización del proceso de fermentación.
2 Modelos previamente reportados
En la literatura se encuentran reportados varios modelos para la producción de etanol a partir de glucosa y xilosa. Meintjes (2011) presenta un resumen cronológico con la evolución que han seguidos los modelos basados en la ecuación cinética de Monod desde 1949 a 1997. Con el paso de los años se han incluido al modelo original, los términos de inhibición y limitación con la consideración generalizada de procesos de fermentación llevados a cabo a condiciones constantes. Una variante al modelo cinético de Monod fue presentada por Escamilla y col. (1997), quienes tomaron como base el modelo de Gompertz tomando como base los postulados de la cinética clásica de evolución poblacional. Este modelo tiene el inconveniente de que pequeñas variaciones en los parámetros pueden generar grandes variaciones en las estimaciones de la biomasa, debido a que la ecuación incluye términos exponenciales elevados a otro exponencial.
Para la producción de bioetanol a partir de glucosa y xilosa se han empleado diferentes levaduras, reportando valores óptimos para diferentes condiciones de operación. Krishnan y col. (1999), emplearon Saccharomyces cerevisiae y encontraron que solamente se transformaba la glucosa de manera eficiente, pues en el consumo de xilosa los efectos de inhibición son más pronunciados. El nivel máximo de rendimiento fue de 0.46 g de etanol/g azúcar.
Por otra parte, Rogers y col. (2000) llevaron a cabo la fermentación de diferentes mezclas glucosa/xilosa a varias condiciones de temperatura y pH con levadura Zymomonas mobilis, notable por su capacidades de producción de bioetanol y que además poseé la característica de ser susceptible de manipulaciones genéticas (Zhang y col.1995),lo que le confiere la habilidad de degradar tanto glucosa como xilosa. A diferencia de los experimentos con Saccharomyces cerevisisae las Zymomonas mobilis modificadas fueron capaces de transformar la mezcla de glucosa y xilosa con rendimientos de 0.48 g de etanol/g azúcar.
Leksawasdi y col. (2001) propusieron un modelo basado en la ecuación de Monod que incluía los términos de limitación e inhibición de sustrato así como la limitación del producto. Además, contenía un factor de optimización que les permitía reducir el error entre experimentos a diferentes condiciones de operación. Este factor fue asociado a la fracción de glucosa y fue fijado en 0.65, lo cual no es físicamente posible ya que la fracción de glucosa cambia desde un valor inicial de 1 si solo se emplea glucosa en las pruebas hasta un valor cercano a cero cuando se ha consumido casi por completo la misma. Este hecho representa una desventaja del modelo presentado por Leksawasdi y col. (2001).
3 Metodología
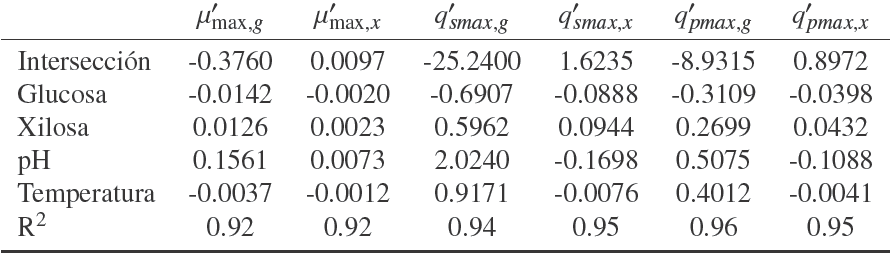
Para desarrollar el modelo que se propone en este trabajo se parte del modelo reportado por Rogers y col. (1999) y Leksawasdi y col. (2001). Este modelo incluye en su cinética tres parámetros que afectan sensiblemente el proceso de fermentación: tasa específica de crecimiento, μ; tasa específica de consumo de sustrato, qs y tasa específica de producción de etanol qp . Para incluir el efecto del pH en el modelo, se modificaron dichos parámetros como se muestra en las ecuaciones (1-3).
Para incluir el efecto de la temperatura, se probó un símil de la ecuación Arrhenius en los parámetros μ, qs y qp . La ecuación (4) muestra la dependencia de cada parámetro (Pari ) con la temperatura.
Donde Pari podía ser μ, qs y qp ; A es el coeficiente pre-exponencial, Ea la energía de activación, R la constante universal de los gases y T la temperatura. Al ser un símil, Ea no representa propiamente una energía de activación sino de una pseudo-energía de activación.
Usando los datos reportados por Rogers y col. (1999), y Leksawasdi y col. (2001) se realizó una regresión no lineal para ajustar los valores de los coeficientes pre-exponencial y la pseudo-energías de activación. Sin embargo se obtuvieron bajos niveles de reproducibilidad, por lo que se descartó esta forma de variación de parámetros con respecto a la temperatura.
Dado que no fue posible introducir los efectos de temperatura con la aproximación anterior, se procedió a modificarlas ecuaciones cinéticas usando pseudo parámetros que contemplaran efectos lineales para pH, temperatura y concentración de azúcares para los parámetros μ',
Las constantes
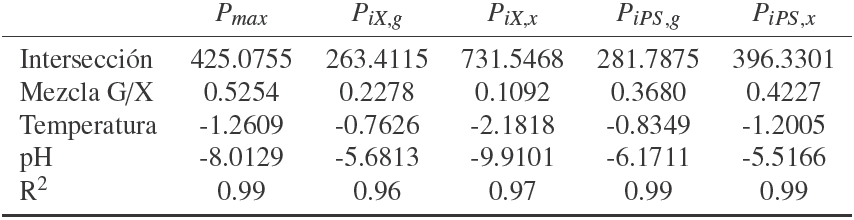
A continuación se presenta el modelo propuesto (Reyes, 2010) formado por cuatro ecuaciones diferenciales que permiten el cálculo de la biomasa formada, X, el bioetanol producido, P, y la concentración de glucosa y xilosa, Sg, Sx en función del tiempo. En la Tablas 3 y 4 se muestran los coeficientes para el cálculo de los pseudo parámetros como función de las variables de operación (Sg ,Sx, pH, y T). Los valores de las constantes Kij son los mismos que los reportados en los trabajos Rogers y col. (1999) y Leksawasdi y col. (2001).
4 Resultados
Las primeras modificaciones al modelo mostraron que el incluir el efecto del pH solamente, no era suficiente para reproducir los datos experimentales en el intervalo considerado; tampoco fue posible reproducir los datos experimentales con variaciones en la temperatura siguiendo un comportamiento del tipo de la ecuación de Arrhenius. Sin embargo, con el uso de los pseudo parámetros sí fue posible reproducir el proceso de fermentación. Para probar el modelo se llevaron a cabo simulaciones a diferentes condiciones de operación. En las Figs. (1-3), se muestran los resultados que permiten la comparación del modelo de Leksawasdi y col., con el modelo propuesto y los datos experimentales reportados en la literatura.

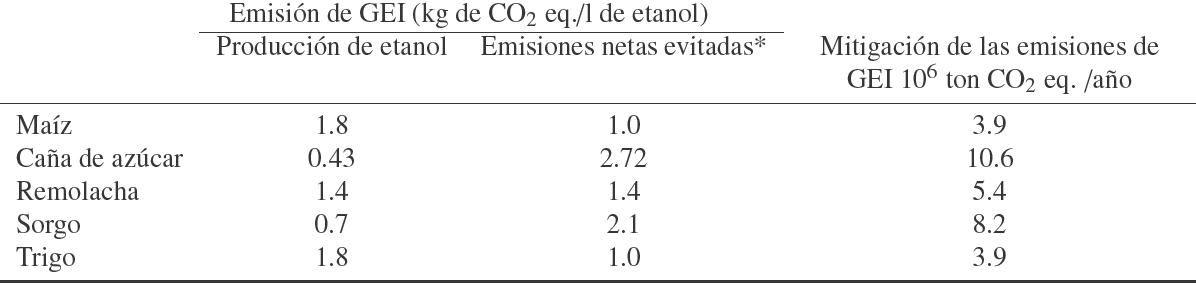
Fig. 1 Comparación de los datos experimentales contra la simulación del modelo propuesto y el modelo de Leksawasdi y col. (2001) a 30°C. Los valores puntuales son datos experimentales ■, Glucosa; ♦, Xilosa; ▲, Etanol; •, Biomasa, las líneas sólidas son los datos generales por el modelo propuesto y las líneas discontinuas son los datos generales por el modelo de Leksawasdi y col. (2001).
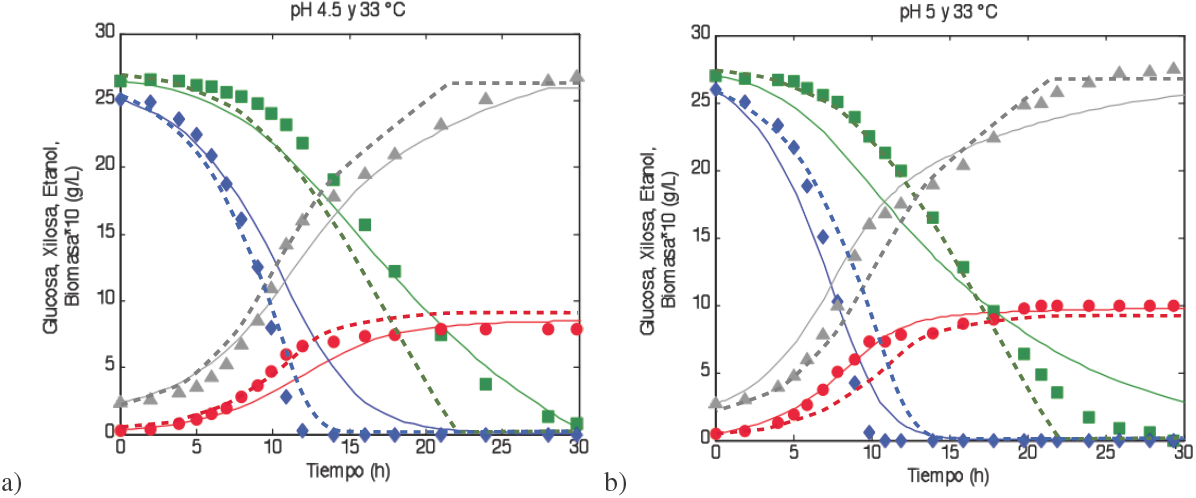
Fig. (2) Comparación de los datos experimentales contra la simulación del modelo (pBro)puesto y el modelo de Leksawasdi y col. (2001) a 33oC. Los valores puntuales son datos experimentales ■, Glucosa; ♦, Xilosa; ▲, Etanol; •, Biomasa, las líneas sólidas son los datos generados por el modelo propuesto y las líneas discontinuas son los datos generados por el modelo de Leksawasdi y col. (2001).
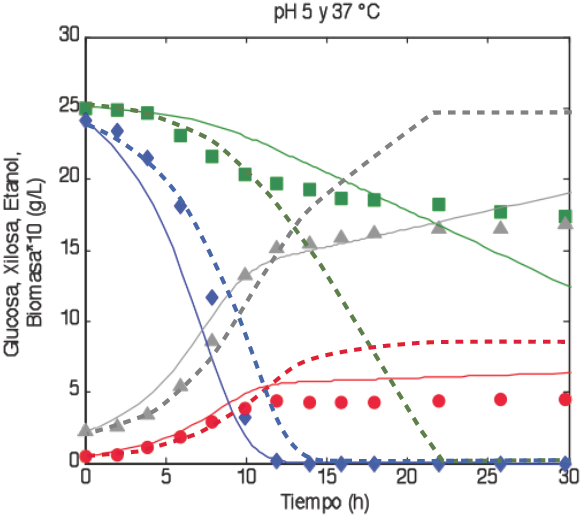
Fig. (3) Comparación de los datos experimentales contra la simulación del modelo propuesto y el modelo de Leksawasdi y col. (2001) a 37°C. Los valores puntuales son datos experimentales ■, Glucosa; ♦, Xilosa; ▲, Etanol; •, Biomasa, las líneas sólidas son los datos generados por el modelo propuesto y las líneas discontinuas son los datos generados por el modelo de Leksawasdi y col. (2001).
En la Fig. (1A) se observa que a pH 4.5 y 30o C, el modelo propuesto se ajusta adecuadamente a los datos experimentales del consumo de glucosa y producción biomasa, de la misma forma que el modelo de Leksawasdi y col. (2001). Sin embargo en la simulación del consumo de xilosa y producción de etanol, se presentan las mayores variaciones. El máximo error obtenido por modelo propuesto fue de 14.8 %, contra 15.8 % del modelo de Leksawasdi y col., ambos porcentajes de error correspondieron a la concentración de xilosa.
En la Fig. (1B) se puede observar que a pH 5 el consumo de xilosa en el modelo propuesto es más rápido en las primeras horas de la fermentación, comparado con los datos experimentales. Por otro lado, también se observa que el modelo de Leksawasdi y col. (2001) ya no es capaz de representar adecuadamente las cinéticas de la fermentación, esto debido a que las condiciones ya no son las mismas a las que fue desarrollado dicho modelo. En este caso los errores máximos para la producción de biomasa y la concentración de xilosa son 33.3% y 20.9% respectivamente con el modelo de Leksawasdi y col. Los errores encontrados con el modelo propuesto para los mismos parámetros fueron de 5.1 % y 14.9%. Los errores encontrados con el modelo propuesto para Los porcentajes de error para las otras variables se encuentran reportados en la Tabla 5.
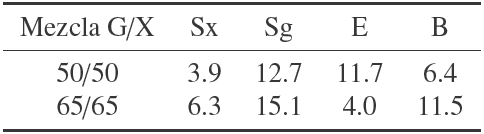
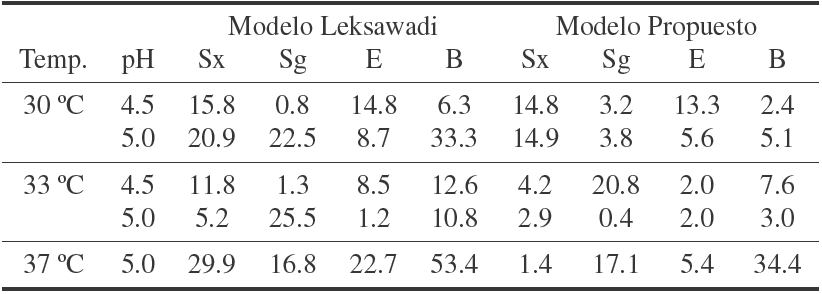
Tabla 5 Errores porcentuales de las simulaciones obtenidas con el modelo propuesto y el Leksawasdi y col. (2001). Donde Sx es la concentración de xilosa, Sg la concentración de glucosa, E la concentración de etanol y B la concentración de biomasa.
En la simulación a pH 4.5 y 33o C, el ajuste para el consumo de la xilosa mejora notablemente (Fig. (2A)). Sin embargo el error máximo aumenta, debido a que en la simulación, el consumo de glucosa se vuelve mas lento de lo que indican los datos experimentales. A 33 °C y pH 5, la simulación para el consumo de xilosa presenta algunas diferencias respecto a los datos experimentales pero exhibe un comportamiento consistente con los mismos (Fig. (2B)). No obstante, el modelo propuesto representa mejor las cinéticas de la producción de biomasa y etanol. Los errores fueron de: 3% en la simulación de la biomasa para el modelo propuesto y de 25.5% en la simulación de glucosa para el modelo de Leksawasdi y col.
En la Fig. (3) se puede observar como el modelo de Leksawasdi y col. falla en predecir el comportamiento de la fermentación a 37 °C, sobre todo en las cinéticas para la producción de biomasa y consumo de xilosa. Mientras que los datos experimentales muestran, que después de 30 horas aún no se a consumido la xilosa. El modelo de Leksawasdi y col. predice que se consume totalmente aproximadamente a las 22 hrs. Por otro lado, el modelo propuesto presenta un buen ajuste para el consumo de glucosa y la producción debio masa y etanol, sin embargo la cinética de la xilosa no puede ser representada en la etapa final de la fermentación. Los errores para el modelo propuesto y el modelo de Leksawasdi y col., son 34.3% y 53.4% respectivamente, ambos en la simulación del consumo de xilosa.
Para corroborar la robustez del modelo, éste se probó con datos de fermentaciones a cantidades iniciales de sustrato de 50g/50g/ y 65g/65g. La Figura 4 muestra los resultados con estas concentraciones iniciales.
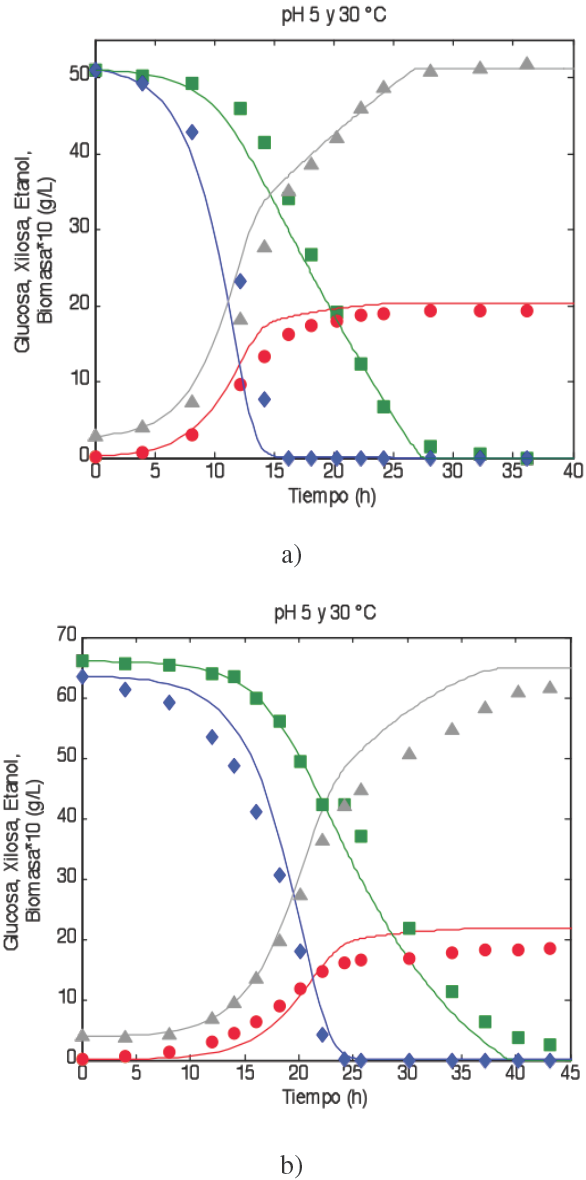
Fig. 4 Comparación de los datos experimentales contra la simulación del modelo propuesto y las nuevas consideraciones a concentraciones glucosa/xilosa de 50/50 g/L (A) y 65/65 g/L (B). L os valores puntuales son datos experimentales ■, Glucosa; ♦, Xilosa; ▲, Etanol; •, Biomasa, las líneas sólidas son los datos generados por el modelo propuesto.
El efecto por el cambio en la cantidad de sustrato alimentado está siendo bien representado por el modelo. Las diferencias más notorias ocurren a 65g/65g (Fig. 4 (B)) en donde se puede ver que el consumo total de xilosa ocurre a las 40 hrs para el modelo propuesto mientras que en los datos experimentales esto ocurre aproximadamente a las 45 hrs. El error máximo para la fermentación con la relación 65g/65g fue de 12.7%, mientras que para la relación 50g/50g fue de 15.1%, ambos en la cinética del consumo de glucosa. Los errores para los otros perfiles aparecen en la Tabla 6.
Conclusiones
El empleo de pseudo-parámetros en el modelo propuesto ha permitido generar un modelo flexible en función de las variables de operación (pH, temperatura y concentración de glucosa y xilosa). La inclusión separada de los efectos de pH y temperatura no son suficientes para reproducir los datos experimentales con los modelos originales. Pero con el uso de los pseudo-parámetros se tiene ahora la posibilidad de variar las condiciones de operación para generar un perfil óptimo de fermentación. Los errores generados con el modelo propuesto resultaron en todos los casos analizados menores a los producidos al usar el modelo de Leksawadi y col. Los parámetros P max, PiX, PiS y PiP presentan una dependencia importante al cambio de temperatura, pH y concentración de sustrato, por lo que es recomendable realizar experimentos a otras condiciones para contar con más datos experimentales y tratar de afinar los pseudo-parámetros que predigan de mejor manera las cinéticas del proceso de fermentación.











 nova página do texto(beta)
nova página do texto(beta)