Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.2 Ciudad de México ago. 2012
Ingeniería ambiental
Efecto de la temperatura en la tasa de crecimiento y decaimiento heterotrófico en el rango de 20-32°C en un proceso de lodos activados
Effect of temperature in the growth rates and decay heterotrophic in the range of 20-32°C in activated sludge process
M. A. Espinosa-Rodríguez1*, N. Flores- Álamo2, M. Esparza-Soto2 y C. Fall2
1 Programa de Ingeniería Química del Área de Ciencias Básicas e Ingenierías, Universidad Autónoma de Nayarit, Ciudad de la Cultura Amado Nervo, C.P 63155, Tepic, Nayarit, México.*Autor para la correspondencia. E-mail: mangelespinosa@hotmail.com Tel/Fax. 311-211-88-00 ext. 8757
2 Centro Interamericano de Recursos del Agua. Facultad de Ingeniería, Universidad Autónoma del Estado de México, Apdo. Postal 367, Toluca, centro, C.P 50091, Estado de México, México.
Recibido 6 de Febrero 2012;
Aceptado 14 de Junio 2012
Resumen
El modelo ASM1 es aceptado como referencia para predecir y comprender los procesos de degradación de materia orgánica, nitrificación y desnitrificación en sistemas de lodos activados. Para calibrar el modelo, se requiere estimar paréticos tales como la tasa máxima de crecimiento (µHMAX) y de decaimiento (bH) heterotróficos. Estos parámetros han sido estudiados para temperaturas menores a 20°C. El objetivo de esta investigación, fue evaluar µHMAX y bH en un rango de temperatura de 20 a 32°C en la planta de tratamiento de aguas residuales "Dulces Nombres" en Monterrey, Nuevo León, México. El trabajo se basó en pruebas respirométricas como parte de la calibración del modelo ASM1. La fracción de sustrato fácilmente biodegradable (SS) fue baja (34 mg/L) dificultándose las pruebas de crecimiento. Para evaluar µHMAX , fue necesario agregar acetato de sodio para obtener un crecimiento duradero de los microorganismos y así poder estimar este parámetro. Las pruebas de respirometría, se realizaron a temperaturas de 20, 24, 28 y 32°C. Los resultados promedio de µHMAX y bH para 20°C fueron de 6.9 y 0.40 d-1 respectivamente. El factor de corrección por cambio de temperatura (θ) de Arrhenius para µHMAX y bH fue de 1.045 y 1.04 respectivamente, los cuales se pueden aplicar para condiciones de clima cálido o tropical.
Palabras clave: modelo ASM1, tasa de crecimiento heterotrófico, tasa de decaimiento heterotrófico, respirometría, factor de corrección por cambio de temperatura.
Abstract
The ASM1 model is accepted as a reference to predict and understand the processes of organic matter degradation, nitrification and denitrification in systems activated sludge. To calibrate the model, requires estimate kinetic parameters such as the maximum grow rate (µHMAX) and decay (bH) heterotrophic. These parameters have been studied for temperatures under 20°C. The objective of this investigation was to evaluate µHMAX and bH in a range of temperature of 20 at 32°C in the wastewater treatment plant "Dulces Nombres" in Monterrey, Nuevo León, México. The work was based on respirometric tests as part of the calibration of the model ASM1. The fraction of substrate readily biodegradable (SS) was low (34 mg/L) diffult tests for growth. For evaluate µHMAX was necessary to add sodium acetate to obtain a durable growth of the microorganisms and thus to estimate this parameter. The tests of respirometry, were made at temperatures of 20, 24, 28 and 32°C. The results average of µHMAX and bH for 20°C were 6.9 and 0.40 d-1 respectively. The correction factor by temperature change (θ) of Arrhenius for µHMAX and bH was 1,045 and 1.04 respectively, which can be applied to conditions of warm climate or tropical.
Keywords: ASM1 model, grow heterotrophic rate, decay heterotrophic rate, respirometry, correction factor for temperature exchange.
1 Introducción
La modelación de plantas de tratamiento de aguas residuales (PTAR) por lodos activados contribuye a mejorar el entendimiento del proceso y representa una herramienta útil para el diseño, diagnóstico y optimización. En la actualidad, el modelo ASM1 (Activated Sludge Model 1, por sus siglas en inglés) propuesto por Henze y col. (2002), es en muchos casos el modelo más utilizado (Roeleveld y van Loosdrecht, 2002; Gernaey y col., 2004), sin embargo, para su calibración, se requiere de la estimación de paramétros cinéticos, entre los cuales destacan la tasa máxima de crecimiento heterotrófico (µHMAX) y el coeficiente de decaimiento de biomasa heterotrófica bH. Al respecto, se tienen datos de estos coeficientes para plantas de tratamiento que operan en Europa, cuyas temperaturas de proceso son menores a 20°C, sin embargo, a la fecha no se tiene conocimiento sobre estos parámetros cinéticos en PTAR de países del continente americano, entre ellos México, cuyas condiciones de operación con respecto a la temperatura, son mayores de los 20°C.
En la presente década, se han propuesto varios protocolos de calibración para el modelo ASM1, entre los que destacan los descritos por, Petersen y col. (2002), Hulsbeek y col. (2002), WERF (2003) y Langergraber y col. (2004).
La calibración se puede definir, como la adaptación de un modelo para describir cierta cantidad de información obtenida de la PTAR bajo estudio, (Petersen y col., 2002). En este sentido, la información necesaria para calibrar el modelo según Siegrist y Tschui, 1992; Dupont y Sinkjaer, 1994, y, Xu y Hultman, 1996, son: a) Datos de diseño: volúmenes de agua; b) Datos de operación: flujos de influente, efluente, recirculación y purgas, pH, OD y temperatura; c) Caracterización del modelo hidráulico; d) Caracterización del modelo de sedimentación, y e) Caracterización para el modelo biológico: caracterización del influente y efluente (también corrientes intermedias dentro de las unidades de proceso de la PTAR); composición del lodo (SST, SSV, DQO, N y P); determinación de parámetros cinéticos (tal como µHMAX y bH ) y estequiométricos (por ejemplo el rendimiento heterotrófico, YH).
Recientemente Hauduc y col. (2010), hicieron un inventario sobre las experiencias en la aplicación de los modelos ASM (ASM1, ASM2, ASM2d, ASM3), y mostraron que existen 9 parámetros de 31, que suelen modificarse durante la calibración para el modelo ASM1. De los 9 que más se modifican, 6 son por factor de temperatura (incluyendo el factor de corrección de Arrhenius Θ para µHMAX y bH ). Esto muestra que los factores de corrección de temperatura son de los menos conocidos, lo que justifica la pertinencia de este trabajo, y sobre ΘbH y ΘµHMAX para temperaturas mayores de 20°C.
La obtención de µHMAX y bH se realiza con base en la respirometría, la cual es la medida e interpretación de velocidad consumo de oxígeno (QO2) en condiciones experimentales bien definidas. La velocidad de respiración es la cantidad de oxígeno por unidad de volumen y tiempo, que es consumido por los microorganismos. Dicha velocidad está relacionada con dos procesos bioquímicos importantes: crecimiento de la biomasa y consumo de sustrato (Spangers y col., 1996).
En teoría, todos los parámetros y componentes involucrados en las relaciones funcionales que están vinculadas directa o indirectamente con el balance de oxígeno, se pueden evaluar mediante la técnica de respirometría. Sin embargo, el desafío en este tipo de prueba es encontrar y crear las condiciones experimentales que permitan determinar con precisión los parámetros del proceso y las concentraciones de los componentes. Por consiguiente, es claro que se requiere de gran creatividad para generar tales condiciones experimentales (Vanrolleghem y col., 1999).
En los modelos clásicos de diseño y operación de procesos biológicos para el tratamiento de aguas residuales, se obvian, generalizan o suponen varios aspectos y valores de parámetros que influyen notoriamente en las predicciones del comportamiento de los sistemas. En este tipo de modelos clásicos, µHMAX se determina a partir de una curva de consumo de sustrato o de producción de biomasa, sin embargo, este enfoque tiene limitaciones debido a que el sustrato total incluye fracciones no biodegradables y biodegradables, y la biomasa total incluye biomasa activa y residuos de biomasa; por consecuencia, los valores de µHMAX y bH para el modelo tradicional y ASM1 son diferentes. En la Tabla 1, se muestran los valores promedio y rangos de µHMAX y bH según el modelo ASM1.

En los datos de la Tabla 1, los valores típicos son valores promedio para un pH neutro y para aguas residuales municipales. Sin embargo, Henze y col. (2002) reconocen cierto riesgo en la utilización generalizada de estos parámetros ya que los valores de éstos llegan a variar en amplios rangos debido a que son influenciados por condiciones específicas del influente, temperatura, pH y compuestos presentes en el agua; por lo tanto, deben ser determinados para cada tipo de agua residual en particular en diferentes países y PTAR. Al respecto es necesario subrayar también, que ningún de Arrhenius por cambio de temperatura (θ) se menciona en el documento original del ASM1.
En este contexto, el objetivo del presente estudio, fue el de evaluar el efecto de la temperatura sobre µHMAX y bH del modelo ASM1, así como proponer factores de corrección de Arrhenius (Θ) para temperaturas entre 20-32°C. El tener valores de µHMAX y bH para temperaturas mayores a 20°C, permitirá aplicar de mejor manera los escenarios de simulación de PTAR, para zonas de clima tropical.
2 Metodología
2.1 Desarrollo de la técnica de respirometría
Las corridas de prueba para la obtención de µHMAX y bH se realizaron en el laboratorio de la PTAR "Dulces Nombres" de Monterrey, Nuevo León (México) con el equipo mostrado en la Fig. 1. Se trata de un montaje desarrollado para servir de respirómetro con una capacidad para ejecutar simultáneamente 4 pruebas.

Las pruebas respirométricas de µHMAX y bH se desarrollaron a temperaturas de 20, 24, 28 y 32°C. Para el caso de µHMAX se realizaron una, dos o tres pruebas por día, mientras que para bH fueron pruebas que se prolongaban hasta por varios días (6 a 7 días).
La medición de la tasa de consumo de oxígeno se desarrolló basada en el principio de fase líquida-gas y líquido estáticos (Spangers y col., 1999). Se construyó el respirómetro a escala de laboratorio operando en batch, que constó principalmente de 4 biorreactores (vasos de precipitado de 1 L) los cuales fueron equipados cada uno con un mezclador magnético, una bomba que inyectaba aire que se utiliza regularmente para las peceras, un equipo de control de temperatura y medidores de oxígeno disuelto (OD) (modelos YSI5739 y YSI57).
Las lecturas de OD se fueron registrando en continuo en un sistema de adquisición de datos y controlados a través de una computadora. Para las necesidades de las diferentes pruebas respirométricas, se colectaron muestras puntuales con las siguientes variantes:
• Tipo de muestra: licor mezclado y/o agua residual (influente).
• Puntos de toma de muestra variable para agua residual: antes del pretratamiento, antes de la sedimentación primaria y/o después de la sedimentación primaria.
• Hora de la toma de muestra: Horas de flujo mínimo (8:00 horas) y horas de flujo máximo (13:00 a 15:00 horas).
• Pruebas con o sin siembra (licor mezclado) para µHMAX .
• Temperaturas de prueba: 20, 24, 28 y 32°C
• Pruebas con o sin acetato para µHMAX.
Para la operación del respirómetro y para la prueba de µHMAX , se adiciono al biorreactor lodo activado y agua residual (prueba con siembra) o sólo agua residual (prueba sin siembra) y se homogeneizó con agitación a la temperatura deseada. El sensor de oxígeno, limpio y calibrado, se colocó dentro del biorreactor para determinar continuamente la concentración de OD durante toda la prueba. Se aireó el contenido del reactor hasta obtener una concentración máxima de OD (4 mg/L); luego cortaba la aireación para determinar el consumo de oxígeno a través de la pendiente del tramo descendente de la gráfica en función de la temperatura. Al llegar a la concentración mínima establecida (3 mg O2/L) se reiniciaba la aireación. Éstos ciclos de aireación-consumo de O2 se repitieron durante el tiempo que duró la prueba para obtener los respirogramas completos [QO2:f(t)]. El control de la aireación y registro de los datos se hicieron vía computadora teniendo como interfase un hardware y software (Microlink 752 y Windmill Ltd, Manchester, UK). El error de interferencia por aireación superficial fue de 1.9 ± 0.4 mg O2/L-h, el cual no es considerable comparado con el orden de magnitud de las mediciones de los respirogramas, sobre todo para las pruebas de µHMAX.
2.2 Determinación de decaimiento heterotrófica (bH).
La determinación de bH o en la metodología de Vanrolleghem y col. (1999). Para esta prueba se utilizaron muestras de licor mezclado. Este licor que tenía inicialmente alrededor de 4000 mg/L de sólidos suspendidos volátiles (SSV), fue diluido con agua tratada de la planta en una relación aproximada de 3:1, con el fin de reducir los problemas de interferencia de los sólidos sobre las membranas de las sondas de oxígeno. Todas las muestras fueron inhibidas, con respecto a la nitrificación, con 10 mg/L de alil thiourea. La muestra de licor mezclado (700 mL) en los biorreactores del respirómetro, se mantuvieron con aireación continua (bien mezclado) durante 6 a 7 días (duración de la prueba), con un pH cercano a 7 y a la temperatura de prueba. Para controlar la temperatura, se utilizó un equipo de calefacción adaptado al respirómetro y con una incubadora, de tal manera de realizar dos pruebas (2 diferentes temperaturas) por día. Al inicio de cada prueba, se observó cada una de las muestras para ver si había sucedido algún problema de mezclado durante la noche anterior, es decir, que se hayan tapado las membranas de la sonda de aireación provocando un mezclado no homogéneo y ciclos distorsionados en el sistema de adquisición de datos; luego se medía la temperatura y la cantidad de muestra, se limpiaban los sensores y reactores sin eliminar lodos, y al mismo tiempo se reponía el agua evaporada. Posterior a ello, se corría la prueba respirométrica y se anotaba la hora de inicio. Estas mediciones se realizaron por triplicado o cuadruplicado para cada una de las temperaturas. Al graficar el logaritmo natural de QO2 contra el tiempo, se obtuvo una recta cuya pendiente corresponde al coeficiente de decaimiento del modelo tradicional (b'H), a partir del cual se obtuvo bH del modelo ASM1. La corrección y transcripción coeficiente b'H en bH se considera por el hecho de que el decaimiento tradicionalmente modelado con el proceso de respiración endógena (tasa de consumo de oxígeno en ausencia de sustrato de origen externo) está ahora representado con un proceso de muerte regeneración en el modelo ASM1.
La obtención de bH se realizó con la Ec. (1), para lo cual es necesario conocer el valor del coeficiente de rendimiento de la biomasa heterotrófica (YH) y considerar el valor sugerido por ASM1 para ƒp (fracción de biomasa que se transforma en productos inertes).

2.3 Determinación de la tasa máxima de crecimiento específico de la biomasa heterotrófica (µHMAX).
La obtención de este parámetro fue determinado según la metodología de Kappeler y Gujer, (1992) que se desarrolla en condiciones de una relación alta de sustrato/biomasa (S/X:4/1). Para estas pruebas, fue necesario optimizar la relación S/X de tal manera de poder obtener buenas curvas de crecimiento. Ya obtenida la relacióptima (S/X:3/1), se tomaron 700 mL de muestra con una proporción de 680 mL de agua residual presedimentada (influente de la planta) y 20 mL de siembra (licor mixto). A cada una de las muestras, se les agregó 10 mg/L de alil thiourea para inhibir la nitrificación. Debido a que en muchas de las pruebas no se observaba suficiente crecimiento de biomasa heterotrófica por falta de sustrato fácilmente biodegradable, se optó añadir acetato de sodio y de esta manera, se obtuvieron crecimientos constantes y con tiempos de duración mayor a 3 horas. No obstante, se continuaron realizando pruebas sin acetato, ya que en algunas ocasiones, se presentaron buenos crecimientos sin la adición de esta sustancia. De igual manera, también se realizaron pruebas sin agregar siembra (sin inocular). Después de calcular los valores promedio de QO2 contra el tiempo y ajustar el respirograma exponencialmente, se pudo obtener la pendiente, (µH-b'H). Se calculó posteriormente µHMAX ya conocido el valor de b'H con la Ec. (2).

2.4 Factor de corrección de temperatura de Arrhenius (θ)
La velocidad o tasa de reacción (r) corresponde a la velocidad con la cual desaparece un reactivo (compuesto) o a la rapidez de formación de un producto. La tasa de on depende de la temperatura la cual influye sobre "r" por medio de la constante "k" como es el caso de µHMAX y bH . Debido a la necesidad de utilizar constantes que han sido determinadas a una temperatura de referencia, en sistemas sometidos a otra temperatura, se requiere de métodos de corrección. El efecto de la temperatura sobre la constante "k" se expresa con la Ec. (3) de Van't Hoff-Arrhenius (Metcalf y Eddy, 2003):
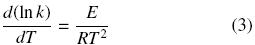
Para los procesos biológicos el término E/RT2 suele tomarse como una constante debido a que el intervalo de temperatura en que funcionan es muy pequeño, por eso la Ec. (3) se simplifica como:

La Ec. (4), se usa normalmente en el campo de la ingeniería sanitaria para corregir el valor de la constante al tener en cuenta el efecto de la temperatura. En este sentido, a fin de estimar el coeficiente por cambio de temperatura (θ) de Arrhenius, se calculó este valor tanto para µHMAX como para bH . Con el valor promedio de θ, los valores de µHMAX y bH se pueden extrapolar a cualquier temperatura entre 20 y 32°C.
3 Resultados y discusiones
3.1 Parámetro bH
Cada prueba realizada para obtener la constante de decaimiento, se prolongó entre 6 y 7 días, en el que se determinó el promedio de la tasa de consumo de oxígeno (QO2) por día. Durante la prueba, por cada hora se registraron de entre 5 a 10 ciclos de aireación, se calcularon las pendientes y se promediaron.
La Fig. 2a, es un ejemplo de un respirograma de bH a 24°C que representa los valores de QO2 calculados en función del tiempo. Graficando estos valores en forma de ln QO2 contra el tiempo se obtiene una pendiente que corresponde al coeficiente de decaimiento b'H (Fig. 2b).
Los resultados individuales de b'H se presentan en la Tabla 2. Las pruebas respirométricas fueron organizadas en tres etapas; cada etapa fue realizada para los cuatro niveles de temperatura. Cada prueba a cada temperatura se repitió 3 o 4 veces (YS1 vs YS2 vs YS3 vs YS4).
Ya obtenido el valor de b'H a cada temperatura, con el valor de YH de 0.67 (valor por default de ASM1) y ƒp igual a 0.08, se calculó bH cuyos resultados promedio son resumidos en la Tabla 3.

En varias de las pruebas, el b'H y bH medidos a 24°C no fueron discernibles con los medidos a 28°C, mientras que los resultados para las temperaturas extremas (20°C y 32°C) si fueron perceptibles. La insensibilidad del bH a los incrementos de temperatura en el rango de 24 a 28°C no era el esperado, ya que no presentó la tendencia exponencial que se da cuando se utiliza el factor de corrección (θ) tal como se observa en la Tabla 3, sin embargo, fue aceptado como tal, ya que ello pudo deberse a la aclimatación de la biomasa en los reactores. Hay que hacer notar que en el momento de las pruebas, la temperatura del licor mezclado en los reactores era de 24°C. El juego de datos de bH en función de la temperatura fue ajustado con la Ec. (4). El factor de corrección por cambio de temperatura (θ) de Arrhenius fue de 1.040.
3.2 Dificultades en las pruebas de µHMAXy solución del problema
Durante las primeras pruebas de µHMAX , y ya calibrado el equipo, no se observó crecimiento, aún y cuando las muestras fueron de agua cruda (influente a pretratamiento), agua de influente a sedimentación primaria (después del pretratamiento) y finalmente agua del influente a reactores.
La Fig. 3, muestra un ejemplo del registro de los datos con 3 sondas YS1, YS2 y YS3.

En la Fig. 4, se presenta el resultado de una de las pruebas utilizando agua del influente a sedimentación primaria y con 20 mL de siembra. La muestra fue tomada a la 1:30 PM, dentro del rango de las horas pico del gasto del influente a la PTAR.

En la Fig. 4, se observa una tasa de consumo de oxígeno máxima (QO2) de 16 mg/L-h en un tiempo de 2 horas y a partir del cual, el crecimiento heterotrófico termina. Algo similar ocurre con las muestras de agua del influente a sedimentación primaria a diferentes temperaturas representadas en la Fig. 5a y Fig. 5b, en las que el tiempo de duración del crecimiento alcanzó solo 1 hora con tasas de consumo de oxígeno máximas de 14mg/L.h y 12 mg/L.h respectivamente.
Para la prueba de 24°C, en la Fig. 5a, se observó un nivel de consumo de oxígeno estable de alrededor de 14 mg/L.h en 1 hora; para este caso la muestra fue tomada a las 8:30 AM. El mismo día, se realizó otra prueba también con agua del influente a sedimentación primaria, pero la muestra se toma las 3:15 PM durante el rango de las horas pico del gasto del influente a la planta, y la temperatura de la prueba fue a 28°C; para este caso, el consumo de oxígeno se estabilizó entre 11 y 12 mg/L.h y el crecimiento terminó en 1 hora según se muestra en la Fig. 5b. De acuerdo a los respirogramas obtenidos, se observó que la fracción de sustrato fácilmente biodegradable (Ss) en el agua residual podría estar presente en concentraciones bajas. El contenido de biomasa fácilmente biodegradable (SS ) podría ser la causa, tal y como lo presenta Dold y col. (2010).
La fig. 6, muestra la evolución de la tasas de consumo de oxígeno de una muestra tomada en el influente a pretratamiento (agua cruda) a las 9:00 AM, a la cual se le alimentó lodo activado (inoculo) en cantidades de 5 mL (Fig. 6a) y 20 mL (Fig. 6b) a 24°C.
Como se observa en la Fig. 6a, el crecimiento fue continuo durante un tiempo de aproximadamente 2 horas con 5 mL de siembra. Para la misma muestra, ocurrió también un crecimiento continuo de alrededor de 1.8 horas tal y como se observa en la Fig. 6b, aunque a este reactor, se le agregaron 20 mL de siembra. Esto indica, que en este día por el resultado obtenido, se deduce que la concentración de Ss en el agua muestreada era alta, o bien que la relación S/X se incrementó. Cabe señalar al respecto, que este incremento no ocurrió periódicamente.
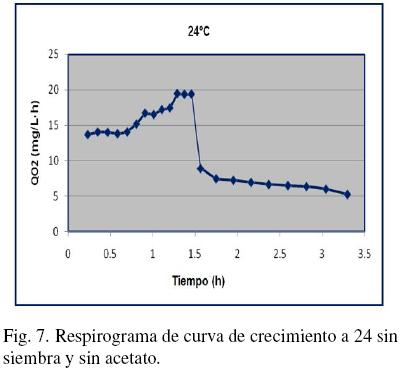
Observando la dificultad de obtener curvas de crecimiento de mayor duración se realizaron pruebas "sin siembra", tal es el caso de la muestra representada en la Fig. 7 cuya prueba se realizó a 24°C y con influente a pretratamiento, en la cual el tiempo de crecimiento de biomasa heterotrófica fue de 1.5 horas.
Aunado a las pruebas de µHMAX, también se estuvieron haciendo pruebas esporádicas de Ss por respirometría, las cuales confirmaron que la razón del poco tiempo de crecimiento en las pruebas µHMAX fue que la Ss era muy baja. Los resultados de Ss obtenidos durante la campañas, intensiva de muestreo de 7 días fueron de 48 mg/L en el influente a clarificadores primarios y de 34 mg/L en el influente a reactores. Fall y col. (2011), presentan una comparación entre los métodos fisicoquímicos y la respirometría para la obtención de Ss como parte del fraccionamiento de la DQO en la PTAR "Dulces Nombres" de Monterrey, Nuevo León, cuyos resultados marcan una gran diferencia (5 a 6 veces más grande por métodos fisicoquímicos) y tienen que ver hipotéticamente con las partículas coloidales, almidón y/o grasa semulsificadas, todo ello por el tipo de agua residual que llega a la planta (municipales, de la industria de alimentos y del proceso de metales). En la Fig. 8,se muestran los resultados obtenidos en algunas de las pruebas de estimación de Ss.
Los resultados obtenidos de SS nos dieron la pauta para entender el poco tiempo de crecimiento en las pruebas de µHMAX , y ello debido a la pequeña cantidad de sustrato rápidamente biodegradable en el agua residual. En este sentido, se optó por agregar acetato de sodio (C2H3O2Na·3H2O) para estimular el crecimiento de los microorganismos y por tanto la velocidad de respiración, ya que este compuesto presenta características similares al SS de las aguas municipales en cuanto a su composición química (Ellis and Eliosov, 2004). Al añadir acetato con una concentración de 21.25 g/L, las pruebas de µHMAX con siembra y sin siembra resultaron aceptables de inmediato, obteniéndose crecimientos de más de 3 horas.
3.3 Estimaciones de µHMAX
En la Fig. 9, se presentan algunos de los resultados obtenidos cuando se adicionó acetato de sodio y su ajuste exponencial para las temperaturas de 20, 24, 28 y 32°C.
En la Tabla 4, se presentan los resultados de las pruebas de crecimiento con siembra, en función de la temperatura. El promedio de (µH-b'H) se obtuvo considerando los valores promedio por día de cuando menos dos resultados por prueba (con 3 o 4 reactores), y considerando una duración de la prueba de cuando menos 2 horas.
A continuación, en la Tabla 5, se presentan los resultados promedio de crecimiento sin siembra.
En la Tabla 6, se presentan los resultados de µHMAX con y sin siembra calculados con base a los promedios de (µH-b'H) y conociendo de antemano el valor de b'H para cada temperatura.

Los valores de µHMAX en la Tabla 6 son muy similares "con siembra" y "sin siembra" a una misma temperatura, lo cual se observa con los resultados de la desviación estándar; esto indica que las pruebas para obtener µHMAX se pueden realizar de una u otra manera.
Aunado a los resultados anteriores, se calculó el factor de corrección por cambio de temperatura (θ) de Arrhenius para µHMAX cuyos valores fueron, con siembra de 1.04 y sin siembra de 1.05. El valor promedio fue de 1.045.
Para observar el comportamiento que se dio en las pruebas de crecimiento a las diferentes temperaturas (20, 24, 28 y 32°C), en la Fig. 10, se presenta un ejemplo de la evolución de la tasa de consumo de oxígeno (QO2) con respecto al tiempo.

La Fig. 10, muestra que la tasa de consumo de oxígeno (QO2) a 32°C fue mayor con respecto a las otras temperaturas conforme transcurrió el tiempo de la prueba, mientras que para 20°C el QO2resulto'mínimo. Para el caso de 24 y 28°C presentaron de inicio un comportamiento similar durante las primeras horas de la prueba, disparándose después para la temperatura de 28°C tal y como se esperaba.
3.4 Comparación de los resultados de µHMAX, bH y θ con la bibliografía
En la Tabla 7 se presentan los resultados obtenidos por algunos autores de los parámetros de µHMAX ,bH y θ a la temperatura de 20°C y se comparan con los resultados obtenidos en esta investigación, Es de mencionar que para la obtención de µHMAX , los autores presentados en la Tabla 7 no utilizaron acetato de sodio en sus pruebas de crecimiento. El uso de esta sustancia durante esta investigación, fue para obtener con mayor exactitud el valor de la pendiente de la curva de crecimiento (µH-bH) para posteriormente calcular el valor de µHMAX.
Los valores mostrados en la Tabla 7 de µHMAX y bH por algunos autores (columnas 2 y 3) son datos observados en plantas de tratamiento de aguas residuales municipales en países de Europa con climas muy fríos. Hauduc y col. (2010) y el software GPSX (columnas 4 y 5) solamente recopilan información específicamente del modelo ASM1 (Henze y col., 2002). Nótese que existe poca información del factor de corrección por cambio de temperatura (θ) de Arrhenius. Precisamente al respecto, la idea de este proyecto de investigación fue encontrar parámetros de µHMAX ,bH y θ que puedan ser utilizados en climas cálidos con temperaturas desde 20 a 32°C, y en plantas de tratamiento de aguas residuales municipales industriales muy diferentes en su caracterización, con respecto a las aguas residuales municipales de Europa.
Los resultados obtenidos de µHMAX y bH obtenidos para la PTAR "Dulces Nombres" difieren de los valores reportados por los otros autores mostrados en la Tabla 7, lo cual puede ser debido a las características del agua (municipal, industrial, potencial de toxicidad, pH, variación en el consumo de oxigeno, etc) tal como lo reportó WERF en 2003. Es necesario aclarar que los valores presentados en la Tabla 7, muestran el percentil del 50% (promedio) de las distribuciones, por lo que hay valores mínimos y máximos. Así por ejemplo, el mismo Cox (2004) presenta resultados de µHMAX en un rango de 3 a 13.2 d1 y de bH en un rango de 0.05 a 1.6 d-1 a la temperatura de 20°C.
Conclusiones
La obtención de bH durante las pruebas respirométricas no representaron problemas en cuanto al control de la aireación, mezclado, pH y temperatura de la muestra para ninguno de los casos. El llevar a cabo paso a paso el procedimiento propuesto haciendo énfasis en tener las muestras a las temperaturas adecuadas para cada prueba (20, 24, 28 y/o 32°C), proporcionó resultados aceptables.
Por otra parte, durante las primeras pruebas para la obtención de µHMAX , se observaron tasas de consumo de oxígeno muy bajas entre 12 y 16 mg/L.h en tiempos de 1 a 2 horas respectivamente, por lo cual se realizaron pruebas respirométricas para observar la concentración de sustrato a través de la obtención de SS. Los resultados de SS de 48 mg/L en el influente a clarificadores primarios y de 34 mg/L en el influente a reactores, mostraron que la relación S/X no era la óptima y por lo tanto el tiempo de duración crecimiento de biomasa heterotrófica en muchas de las pruebas se mantenía entre 1 y 2 horas, por ello se optó por utilizar el acetato de sodio para estimular el crecimiento de los microorganismos, lo cual dio buenos resultados.
Los resultados promedio de µHMAX y bH para 20°C fueron respectivamente de 6.9 d-1 y 0.40 d-1. El factor de corrección por cambio de temperatura (θ) de Arrhenius para µHMAX fue estimado en 1.045 y para bH en 1.04, los cuales se pueden aplicar para condiciones de clima cálido o tropical, es decir, en un rango de temperaturas de 20 a 32°C.
Agradecimientos
Los autores agradecen a Servicios de Agua y Drenaje de Monterrey (SADM) por la prestación de sus instalaciones para la realización de este proyecto de investigación, así como a la UNESCO-IHE y a la UAEM por su financiamiento.

Referencias
Cox, C. D. (2004). Statistical distributions of uncertainty and variability in activated sludge model parameters. Water Environment Research 76, 2672-2685. [ Links ]
Dold, P., Bye, C., Chapman, K., Brischke, K., White, C., Shaw, A., Barnard, J., Latimer, R., Pitt, P., Vale, P. y Brian, K. (2010). Why do we model and how should we model? WWTmod2010. Second Seminary QC Canada. [ Links ]
Dupont R. y Sinkjaer O. (1994). Optimization of wastewater treatment plants by means of computer models. Water Science and Technology 30, 181-190. [ Links ]
Ellis, T. G. y Eliosov, B. (2004). Use of extant kinetic parameters to predict effluent concentrations of specific organic compounds at full-scale facilities. Water Environment Research 76, 444-452. [ Links ]
Fall, C., Flores, A. N., Espinosa, M. A., Vázquez, G., Loaiza, N. J., van Loosdrecht, M. C. M. y Hooijmans, C. M. (2011). Divergence between respirometry and physicochemical methods in the fractionation of the chemical oxygen demand in municipal wastewater. Water Environment Research 83, 162-172. [ Links ]
Gernaey, K. V., Van Loosdrecht, M. C. M., Henze, M., Lind, M. y Jorgensen, S. B. (2004). Activated sludge wastewater treatment plant modelling and simulation: State of the Art. Environmental Modelling & Software 19, 763-783. [ Links ]
Hauduc, H., Rieger, L., Ohtsuki, T., Shaw, A., Tákacs, I., Winkler, S., Héduit, A., Vanrolleghem, P. A. y Gillot, S. (2010). Activated sludge modelling: Development and potential use of a practical applications database. WWTmod2010. Second Seminary QC Canada. [ Links ]
Henze, M., Gujer, W., Mino, T. y van Loosdrecht, M. (2002). Activated sludge models ASM1, ASM2, ASM2d and ASM3. IWA Task Group on Mathematical Modelling for Design and Operation of Biological Wastewater Treatment. IWA Publishing, London UK. [ Links ]
Hulsbeek, J. J. W., Kruit, j., Roeleveld, P. J. y Loosdrecht, M. C. M. (2002). A practical protocol for dynamic modelling of activated sludge systems. Water Science and Technology 45, 127-136. [ Links ]
Kappeler, J. y Gujer, W. (1992). Estimation of kinetic parameters of heterotrophic biomass under aerobic conditions and characterization of wastewater for activated sludge modelling. Water Science and Technology 25, 125-139. [ Links ]
Langergraber, G., Rieger, L., Winkler, S., Alex, J., Wiese, J., Owerdieck, C., Ahnert, M., Simon, J. y Maurer, M. (2004). A guideline for simulation studies of wastewater treatment plants. Water Science and Technology 50, 131-138. [ Links ]
Metcalf y Eddy (2003). Wastewater Engineering, Treatment and Reuse. Fourth Edition, Mc. Graw Hill Companies, Inc. [ Links ]
Petersen, B., Gearney, K., Henze, M. y Vanrolleghem, P. A. (2002). Evaluation of an ASM1 model calibration procedure on a municipal-industrial wastewater treatment plant. Journal of Hydroinformatics 4, 15-38. [ Links ]
Roeleveld, P. J. y van Loosdrecht, M.C M. (2002). Experience with guidelines for wastewater characterization in the Netherlands. Water Science and Technology 45, 77-87. [ Links ]
Siegrist, H. y Tschui, M. (1992). Interpretation of experimental data with regard to the activated sludge model no. 1 and calibration of the model for municipal wastewater treatment plants. Water Science and Technology 25, 167-183. [ Links ]
Spangers, H., Vanrolleghem, P., Olsson, G. y Dold, P. (1996). Respirometry in control of the activated sludge process. Water Science and Technology 34, 117-126. [ Links ]
Spangers, H., Takacs, I. y Brouwer, H. (1999). Direct parameter extraction from respirograms for wastewater and biomass characterization. Water Science and Technology 39, 137-145. [ Links ]
Vanrolleghem, P., Spangers, H., Petersen, B., Ginestet, P. y Takács, I. (1999). Estimating (combination of) activated sludge Model No. 1 parameters and components by respirometry. Water Science and Technology 39, 195-214. [ Links ]
WERF (2003), Methods for wastewater characterization in activated sludge modelling, Water Environment Research Federation (WERF), Alexandria, VA, WERF publication N° 9 WWF3. [ Links ]
Xu S. y Hultman, B. (1996) Experiences in wastewater characterization and model calibration for the activated sludge process. Water Science and Technology 33, 89-98. [ Links ]














