Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.2 Ciudad de México Ago. 2012
Biotecnología
Análisis de células en dispositivos microfluídicos
Cell assessment in microfluidic devices
R.E. Sósol-Fernández1, V.M. Marín-Lizárraga1, E. Rosales-Cruzaley1 y B.H. Lapizco-Encinas1'2*
1 Centro de Investigación y de Estudios Avanzados del IPN Unidad Monterrey, Vía del Conocimiento 201, PIIT, Autopista Monterrey-Aeropuerto km 9.5, Apodaca NL, 66600, México.*Autora para la correspondencia. E-mail: bhlbme@rit.edu Tel. +001- 585-475-2773
2 Department of Chemical and Biomedical Engineering, Rochester Institute of Technology, 160 Lomb MemorialDrive, Rochester, NY14623, USA.
Recibido 10 de Enero 2012;
Aceptado 11 de Abril de 2012
Resumen
En los últimos años se ha tenido un importante crecimiento en el desarrollo de métodos en microescala para el análisis, separación y concentración de células intactas, es decir, sin la realización de lisis. La miniaturización ofrece excelentes ventajas para el manejo y análisis de células, como son rapidez, portabilidad, alta resolución y sensibilidad, bajo requerimiento de cantidad de muestra y reactivos. Diferentes áreas de la ciencia y de la industria, como la industria alimentaria, los análisis clínicos y biomédicos, el monitoreo ambiental, etc., están siendo beneficiadas por el uso de micro-laboratorios o micro-sistemas para análisis. Debido a estas importantes ventajas, significativos esfuerzos de investigación a nivel mundial están siendo dedicados al desarrollo de técnicas aplicables en microescala para el análisis de células.
El presente es un artículo de revisión tutorial que expone los fundamentos y aplicaciones recientes de las técnicas en microescala más importantes para el análisis de células intactas. Se incluye una descripción breve del funcionamiento y ejemplos de aplicaciones de seis técnicas en microescala estratégicamente seleccionadas para proveer al lector un panorama integral sobre los avances en este campo. Las técnicas aquí presentadas cubren los principales mecanismos empleados en los métodos miniaturizados para el manejo de células intactas. Estos mecanismos son campos eléctricos (electroforesis, dielectroforesis, electrorotación e impedancia eléctrica), efectos de flujo (enfocado inercial) y efectos ópticos (citometría de flujo).
Palabras clave: células, microescala, microfluídica, microorganismos.
Abstract
In recent years there has been significant development in microscale methods for the assessment, separation and concentration of intact cells, that is, without carrying out lysis. Miniaturization offers excellent advantages for the handling and analysis of cells, such as short response time, portability, high resolution and sensitivity, and low requirement of sample and reagents. Different science and industry fields, such as food industry, clinical and biomedical analysis, environmental monitoring, etc., have benefited from the use of micro-laboratories or micro analytical systems. Due to these advantages, significant research efforts worldwide are being devoted towards the development of techniques than can be applied on the microscale for cell assessment.
The present article is a tutorial review that depicts the fundamentáis and recent applications of the most important microscale techniques for the analysis of intact cells. A brief description and examples of applications of six strategically selected techniques have been included, with the objective of providing the reader with a comprehensive overview on the advances in this field. The techniques presented here cover the main mechanisms employed in miniaturized methods for handling intact cells. These mechanisms are electric fields (electrophoresis, dielectrophoresis, electrorotation and electric impedance), flow effects (inertial focusing) and optical effects (flow cytometry).
Keywords: cells, microscale, microfluidics, microorganisms.
1 Introducción
La miniaturización y la microfluídica son dos campos de la ciencia que están alcanzando un crecimiento acelerado. Un gran número de aplicaciones para procesos en microescala y microdispositivos surgen continuamente. Grupos importantes de investigación están realizando grandes esfuerzos en este campo debido a las características atractivas que la miniaturización ofrece, como son mayor control y desarrollo de nuevas técnicas (Whitesides, 2006; Pratt y col., 2011). Estos importantes avances han beneficiado en particular procesos de bioseparación en biotecnología y en farmacéutica, así como análisis en la industria alimentaria, en diagnóstico médico y ambiental. A pesar de ser un campo aún naciente, el desarrollo de los microdispositivos microfluídicos es considerable, ya que se han logrado micro-laboratorios, conocidos en inglés como ''lab on a chip'', que son capaces de llevar a cabo todas las funciones de equipos convencionales, con ventajas atractivas como tiempos más cortos, menor requerimiento de muestra y reactivos, portabilidad, mayor resolución y sensibilidad, y bajo costo (Lapizco-Encinas, 2008). Uno de los primeros dispositivos capaces de desarrollar todas las funciones requeridas para un proceso completo fue reportado por Burns y colaboradores en 1998. Este grupo desarrolló un dispositivo para el análisis de muestras de ADN muy pequeñas (nanolitros), donde sin componentes externos y sin intervención humana, el microsistema realizó las funciones de mezclado, amplificado o digestión del ADN, separación y detección (Burns y col., 1998). Este estudio fue una piedra angular para el campo de la microfluídica ya que demostró el potencial de la miniaturización para aplicaciones de análisis biológicos. El desarrollo de este tipo de sistemas en microescala ha seguido avanzando, y una de las áreas con mayor potencial para estos sistemas es en el análisis y manipulación de células intactas. Actualmente, si la detección o separación de células se realiza por métodos de microbiología tradicionales, que en su mayoría dependen de cultivo celular, los resultados de algunos análisis pueden demorarse desde 24 a 72 horas. En aplicaciones como análisis de contaminación de alimentos o cuerpos de agua, control de calidad y análisis clínicos, se requieren métodos y sistemas que proporcionen resultados más rápidamente. Es precisamente en este tipo de situaciones donde la microfluídica puede ser la solución requerida. Existen reportes de separación y concentración de células en menos de dos minutos empleando microcanales y campos eléctricos (Moneada-Hernández y Lapizco-Encinas, 2010). Aplicaciones en análisis clínicos pueden ser también beneficiadas de manera significativa por los métodos en microescala, un área que está teniendo un crecimiento acelerado es en detección de cáncer. Como ejemplo se tiene la rápida detección de células cancerígenas en microdispositivos empleando dielectroforesis, desde la detección de células iniciadoras de tumores prostéticos (Salmanzadeh y coi, 2012), hasta la caracterización de células de tumor circulantes en sangre para el desarrollo de métodos de detección y concentración (Sano y col., 2011; Salmanzadeh y col, 2012). También, existen estudios de la rápida caracterización de glóbulos rojos para diferenciar su tipo y factor Rh (Keshavamurthy-Srivastava y col, 2011; Leonard y Minerick, 2011). Así como sistemas para el cultivo y diferenciación de células madres donde es posible estudiar su metabolismo dentro de micro-cámaras (van Noort y col., 2009). Otra atractiva característica de las técnicas en microescala, es la posibilidad de poder realizar análisis de células completas, sin realizar lisis celular; especialmente las técnicas que utilizan campos eléctricos son adecuadas para el manejo de células intactas (González y Remcho, 2005; Voldman, 2006; Gagnon, 2011).
El presente es un artículo de revisión de tipo tutorial, donde se busca proporcionar información relevante sobre las técnicas en microescala y su aplicación para el análisis y manipulación de células intactas, tanto para el investigador principiante como para el experto en esta área. Se seleccionaron cuidadosamente artículos con el fin de incluir una introducción esencial del tema y además mostrar los avances más significativos en las técnicas en microescala. Al ser el presente manuscrito un artículo de revisión de tipo tutorial, el objetivo es presentar al lector de una manera sucinta el panorama de este campo, con suficiente material en cuanto a los fundamentos y aplicaciones para despertar en el lector el interés en este importante campo de la microfluídica para el análisis de células. La microfluídica es un campo todavía incipiente en México (Lapizco-Encinas, 2008). Se presentan y explican los fundamentos de seis de las técnicas en microescala más empleadas con células, donde el lector podrá apreciar la riqueza y potencial de estos métodos miniaturizados, donde fuerzas eléctricas e inerciales, y efectos ópticos son explotados para realizar la caracterización, separación, concentración y detección de diferentes tipos de células, desde bacterias hasta células de mamíferos.
2 Metodología
Para la preparación de este artículo de revisión se realizaron búsquedas sobre la aplicación de métodos en microescala para el análisis de células en bases de datos como el ISI Web of Knowledge de Thomsom, Pud Med, Scopus, la Red de Revistas Científicas de América Latina y el Caribe, España y Portugal y Google Scholar. Los artículos incluidos se seleccionaron buscando ejemplos representativos del uso de cada técnica y aplicaciones relativamente nuevas, publicadas del año 2000 en adelante.
3 Técnicas en microescala para la manipulación de células
El avance que se ha tenido en el desarrollo de técnicas en microescala y las ventajas que éstas ofrecen sobre los métodos tradicionales, las convierten en una alternativa atractiva para diversos análisis y estudios de células. Se ha reportado un importante número de estudios exitosos donde los tiempos de respuesta son en minutos en lugar de días u horas. La portabilidad, bajo costo y corto tiempo de respuesta abre la posibilidad de efectuar mediciones y análisis en línea en ''tiempo real''. En el campo de los análisis clínicos, los métodos en microescala permiten la realización de estudios empleando métodos no invasivos, como detección de células anormales empleando una muestra de sangre periférica, lo que evitaría el uso de biopsias. En el monitoreo ambiental, un microdispositivo portátil proporcionaría la posibilidad de efectuar análisis rápidos en campo, obteniendo respuestas de inmediato. En la industria alimentaria, permitiría el desarrollo de detectores en línea para ser usados en la detección de patógenos en alimentos. Los ejemplos anteriores muestran como el uso de estas técnicas facilitan y aceleran procesos que suelen ser más largos. La Tabla 1 presenta una comparación de las técnicas en aplicaciones a escala convencional y en microescala. A continuación se describe de manera breve seis técnicas en microescala mencionando un par de ejemplos de cada una.
3.1 Electroforesis
La electroforesis es un fenómeno electrocinético que consiste en el movimiento de partículas cargadas electrostáticamente bajo la influencia de un campo eléctrico uniforme. Cuando a una partícula con carga neta q se le aplica un campo eléctrico E, ésta experimenta una fuerza electrostática

conocida como Fuerza de Coulomb (Griffiths, 1999). Si dicha partícula está inmersa en un fluido, los iones del fluido se reorganizan alrededor de ella, de acuerdo a su carga, dando origen a un potencial conocido como potencial zeta (ζ). La Fig. 1 muestra una representación esquemática de una partícula cargada suspendida en un líquido en presencia de iones y bajo la acción de un campo eléctrico; donde la partícula posee carga negativa y por tanto experimenta una fuerza electroforética (FEP) o movimiento hacia el electrodo positivo.

La velocidad  y movilidad (μep) electroforéticas experimentadas por la partícula están representadas por:
y movilidad (μep) electroforéticas experimentadas por la partícula están representadas por:

donde E es el campo eléctrico, em es la permitividad del medio, η es la viscosidad del líquido y ζ es el potencial zeta. En la mayoría de las células esta movilidad es de ~ 10-4 cm2/Vs, lo que equivale a 1 μm/s en un campo eléctrico de 1 V/cm (Voldman, 2006). Este desplazamiento de partículas es muy empleado para análisis en aplicaciones de biotecnología y bioquímica. El método convencional más común es la electroforesis en gel, que es una técnica de rutina en los laboratorios de biología molecular que permite analizar, separar y cuantificar muestras que contienen proteínas y ADN (Ehlers y col., 1991; Ibeas y Jiménez, 1993) Sin embargo, existen pocos estudios sobre separación y caracterización de células intactas y completas, es decir, sin previa lisis celular (Ainsworth y col., 2005). La técnica principalmente usada para analizar células intactas es la electroforesis capilar (EC), la cual fue introducida en 1979, y ha sido empleada para la identificación de bacterias, virus y células sanguíneas (Wallingford y Ewing, 1987; Kremser y coi, 2004). La técnica consiste en un capilar de sílice con un diámetro interno ≤200 &956;m donde se introduce la muestra previamente tratada con una solución buffer, y posteriormente se aplica campo eléctrico utilizando electrodos en ambos lados del capilar que a su vez tendrá conectado un detector (Fig. 2a) (Amin y col., 2012). Los resultados de la EC son similares a los de una separación cromatográfica, ya que se obtienen electroferogramas graneando la señal del efluente del capilar vs. tiempo. La técnica se basa en las diferencias en la relación carga/masa de cada partícula biológica, ya sea de repulsión o de atracción, generando selectividad en cuanto a tamaño y composición como se representa en la Fig. 2b (Klodzinska y Buszewski, 2009). En la imagen se muestra la vista lateral de un capilar de sílice y como los microorganismos interactúan con la superficie del capilar, esta interacción es única para cada microorganismo y genera un tiempo de retención dentro del capilar distinto.
El grupo de investigación de Daniel W. Armstrong realizó un trabajo pionero en el uso de EC para la separación y análisis de microorganismos reportando avances muy importantes. Este grupo reportó por primera vez que los métodos electroforéticos, usados para separar biomoléculas, podían ser empleados para separar microorganismos intactos (Armstrong y col., 1999). En aplicaciones clínicas demostraron la detección en orina de patógenos responsables de infecciones del tracto urinario (Armstrong y Schneiderheinze, 2000); en estudios analíticos realizaron la medición del contenido de bacterias presentes en suplementos alimenticios prebióticos, lográndose resultados en menos de 10 minutos, demostrando como un método electrocinético, como lo es la EC, puede ser usado como técnica de control de calidad en productos comerciales (Armstrong y col., 2001). Uno de los estudios más importantes realizados por Armstrong y colaboradores fue el uso de la EC para pruebas de viabilidad de bacterias (Armstrong y He, 2001); donde reportaron la separación simultánea y detección de células vivas (fluorescencia verde, gráfica superior) y muertas (fluorescencia roja, gráfica inferior) de B. infantis, L. acidophilus y S. cerevisiae, en un capilar de sílice, obteniendo los electroferogramas mostrados en la Fig. 2c, que presentan ''picos'' definidos por cada microorganismo. Como puede observarse la señal de fluorescencia de células vivas es mayor que las células muertas. En la imagen se tiene un primer pico a un tiempo aproximado de 15 min correspondiente a B. Infantis, seguido de una señal debida a L. acidophilus y un tercer pico que muestra la presencia de S. cerevisiae, logrando resultados en un tiempo de análisis corto. En otros estudios realizados este grupo usó la EC para el análisis de la potencia y comportamiento de células espermatogénicas de jabalí (He y col., 2003); y para detección de células individuales de bacterias, lo que abre la posibilidad del uso de la EC en muestras con muy bajas concentraciones de microorganismos (Lantz y col., 2007). Los ejemplos anteriores demuestran el gran potencial para un amplio rango de aplicaciones de la EC como técnica de análisis y detección de células intactas.
En el 2009, Klodzinska y Buszewski hicieron una importante contribución al modificar químicamente la superficie de un capilar de sílice con la finalidad de reducir o eliminar las interacciones entre la sílice y los microorganismos, recubriendo la superficie del capilar con varios reactivos como acrilamida, trimetilclorosilano y divinilbenceno (DVB), beneficiando con esto, la salida de los microorganismos en tiempos más cortos (Klodzinska y Buszewski, 2009). En una interesante aplicación clínica estos investigadores utilizaron un capilar de sílice con tres capas de acrilamida para analizar muestras extraídas de escaras (úlceras en la piel originadas por presión). Los resultados se muestran en la Figura 2d en un electroferograma, donde se observa la separación exitosa de S. aureus y H. pylori en un tiempo aproximado de 10 minutos. La electroforesis capilar representa una alternativa atractiva en análisis microbiológicos ofreciendo ventajas de rapidez, eficiencia y sensibilidad en comparación a las técnicas de microbiología tradicionales; con aplicaciones potenciales en biotecnología, control de calidad, monitoreo ambiental, entre otros. En otro estudio reciente en el campo de aplicaciones clínicas, Szeliga y col. (2011) reportaron el uso de la electroforesis capilar de zona para análisis microbiológico rápido de muestras tomadas de heridas post-operatorias. El objetivo principal era el de crear un algoritmo para detectar infecciones rápidamente de manera cualitativa y cuantitativa, obteniéndose resultados con muy alta sensibilidad en cuestión de minutos (Szeliga y col., 2011).
3.2 Dielectroforesis
Otra técnica con importantes aplicaciones para el análisis y estudio de células es la dielectroforesis. El término dielectroforesis fue introducido por primera vez por Pohl en 1951, y consiste en el movimiento de partículas en un campo eléctrico no uniforme debido a un desbalance en las fuerzas electrostáticas. Cuando una partícula es suspendida en un medio y se le aplica un campo eléctrico, tanto la partícula como el medio se polarizan, induciendo un dipolo en la partícula (Fig. 3). Si el campo eléctrico es no uniforme, cada polo es expuesto a fuerzas eléctricas de diferente intensidad, resultando en un desbalance que a su vez produce un desplazamiento neto en la partícula (Pohl, 1978). La fuerza dielectroforética FDEP ejercida sobre la partícula esférica se define como (Jones, 1995):


donde εm es la permitividad del medio, rp es el radio de la partícula, ∇E2 expresa el gradiente del cuadrado del campo eléctrico y ƒCM es el factor de polarización conocido como factor de Clausius-Mossotti:

donde ε*p y ε*m son la permitividad compleja, la cual se define como:

donde ε y σ son la permitividad y conductividad reales de la partícula o del medio, respectivamente; 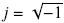 y ω es la frecuencia angular del campo eléctrico. El factor de Clausius-Mossotti determina el sentido de la fuerza dielectroforética (positiva o negativa). Se define como dielectroforesis positiva cuando una partícula es más polarizable que el medio y es atraída hacia la parte más intensa del campo eléctrico. Por el contrario, si la partícula es menos polarizable que el medio, se presenta dielectroforesis negativa y es repelida hacia el campo eléctrico de menor intensidad, como se indica en la Fig. 3a.
y ω es la frecuencia angular del campo eléctrico. El factor de Clausius-Mossotti determina el sentido de la fuerza dielectroforética (positiva o negativa). Se define como dielectroforesis positiva cuando una partícula es más polarizable que el medio y es atraída hacia la parte más intensa del campo eléctrico. Por el contrario, si la partícula es menos polarizable que el medio, se presenta dielectroforesis negativa y es repelida hacia el campo eléctrico de menor intensidad, como se indica en la Fig. 3a.
Esta técnica electrocinética ha tomado importancia en años recientes debido a su potencial en la separación, concentración y manipulación de una amplia variedad de biopartículas como ADN, proteínas, bacterias, virus y células (Lapizco-Encinas y Rito-Palomares, 2007; Voldman, 2007). La dielectroforesis es una técnica con alta flexibilidad, ya que puede aplicarse con campos eléctricos de corriente alterna o corriente directa, y funciona tanto para partículas neutras como para partículas con carga, teniendo así mayor aplicabilidad que la electroforesis. La dielectroforesis es una técnica con aplicación en microescala, solo existen un par de reportes de aplicaciones fuera de microdispositivos (Ivanoff y col., 2011; Shen y col., 2011). En la mayoría de los casos la dielectroforesis se lleva a cabo en microcanales o cámaras cuyas magnitudes oscilan entre μm a mm, y se manejan volúmenes en el rango de nL a μL. Existen dos configuraciones principales para dispositivos dielectroforéticos: arreglos de electrodos y arreglos de estructuras aisladoras (Cummings y Khusid, 2007; Çetin y Li, 2011). En ambos tipos de arreglos, el objetivo es alterar la distribución del campo eléctrico, para crear las zonas de gradiente. Con electrodos generalmente esto se logra seleccionando geometrías adecuadas que al energizarse generen estos gradientes. La Fig. 3b muestra la representación de un arreglo de electrodos de tipo interdigitados y la distribución de campo eléctrico generada. En el caso de sistemas de dielectroforesis con aisladores, la distribución de campo eléctrico se logra mediante la inclusión de obstáculos aisladores entre dos electrodos remotos. Al aplicar el campo eléctrico, estos obstáculos de material dieléctrico alteran la distribución de líneas de campo eléctrico. La Fig. 3c, muestra una imagen de un microcanal con postes aisladores cilíndricos, las líneas rojas representan las líneas de campo eléctrico. En la imagen se observa como en las constricciones entre los postes se tienen las regiones de mayor intensidad de campo eléctrico, mostrado por la concentración de las líneas de campo eléctrico (Ozuna-Chacón y col., 2007).
Utilizando un microdispositivo con arreglo de electrodos, Li y Bashir (2002), reportaron la manipulación de histeria innocua, mediante la aplicación de campos eléctricos de corriente alterna, observando que a una frecuencia de 50 kHz se obtiene una separación del 90% entre células vivas y muertas. En la Fig. 4a, se muestra la respuesta de las células sobre los electrodos al aplicar el campo eléctrico, y se observa que las células vivas (teñidas en verde) experimentan una dielectroforesis positiva lo que provoca que se dirijan hacia los bordes de los electrodos donde el gradiente de E2 es mayor. Por otro lado, las células muertas (teñidas en rojo) presentan dielectroforesis negativa, alejándose de los electrodos y ubicándose en el centro del espacio entre dos electrodos. Este comportamiento se debe a la diferencia en propiedades eléctricas de las membranas de células vivas y muertas. Cuando una célula muere, la membrana pierde integridad y es contaminada con iones del citoplasma celular, lo que aumenta en forma considerable la conductividad eléctrica permitiendo que a las condiciones empleadas en este experimento se obtuviera dielectroforesis positiva y negativa, para las células vivas y muertas, respectivamente (Li y Bashir, 2002).

Por otra parte, Lapizco y col. (2004) reportaron la separación de células vivas y muertas de E. coli aplicando voltajes de corriente directa a través de microcanales con arreglos de postes aisladores cilíndricos de 200 μm de diámetro con separación de 50 μm de centro a centro, similares al canal mostrado en la Fig. 3c, donde la zona de mayor gradiente de campo eléctrico se genera en las constricciones entre los postes cilíndricos. Este grupo demostró que aplicando un potencial de 60 V de corriente directa todas las células de E. coli presentaban dielectroforesis negativa, teniendo las células muertas una respuesta más débil. Las células fueron repelidas de las regiones de constricción entre los postes, como se muestra en la Fig. 4b, las células muertas (teñidas en rojo) están más cerca de la constricción que las células vivas (teñidas en verde). Como ya se mencionó, las células muertas poseen una membrana con mayor conductividad, lo que las hace mas semejantes al medio de suspensión y por tanto disminuye la magnitud de su polarizabilidad (factor de Clausius-Mossotti), disminuyendo así el efecto dielectroforético, que en este caso se trata de un efecto de repulsión, es decir las células muertas son ''menos repelidas''. Este estudio demuestra el potencial de la dielectroforesis para la manipulación y separación de microorganismos en análisis de viabilidad, por ser una técnica no destructiva, rápida y económica (Lapizco-Encinas y col., 2004). Estos estudios demuestran que la dielectroforesis es una técnica que puede utilizarse en estudios de viabilidad, con posibles aplicaciones en la industria de alimentos,
En cuanto a aplicaciones clínicas, existe un gran interés en el desarrollo de métodos rápidos para el análisis de fluidos biológicos (Jones y col., 2011). Recientemente, Srivastava y col. (2011) realizaron un estudio empleando dielectroforesis para clasificar células sanguíneas de manera continua de acuerdo al sistema ABO, utilizando un régimen de dielectroforesis de corrientes. En este régimen la fuerza de dielectroforesis, no es muy alta, de tal forma que no atrapa o detiene las partículas, solo altera la dirección de movimiento, este método es muy empleado para separaciones con flujo continuo (Cummings, 2003; Srivastava y col, 2011). En este estudio se utilizó un microcanal con cuatro salidas, el canal contenía un obstáculo de material dieléctrico. Al aplicar un campo eléctrico a lo largo del canal se tuvo un flujo del líquido y de los eritrocitos, y mediante la acción de fuerza dielectroforética se logró hacer una separación de los glóbulos rojos; observando diferencias entre las respuestas dielectroforéticas de cada tipo de sangre (A+ B+ AB+ O+) (Srivastava y col., 2011). En otro estudio del mismo grupo, se investigó la influencia de los antígenos de grupo sanguíneo y de factor Rh en la polarización eléctrica de glóbulos rojos bajo campos de corriente alterna. Este estudio estableció que los antígenos de grupo sanguíneo (ABO) afectan la conductividad eléctrica membranal y los antígenos de factor Rh afectan la permitividad eléctrica de la membrana. Esta información permitirá desarrollar un método miniaturizado rápido en base a dielectroforesis para la caracterización de glóbulos rojos (Leonard y Minerick, 2011). Estos estudios aportan una opción rápida y portátil para análisis de glóbulos rojos y demuestra la aplicación de la dielectroforesis en el área clínica.
La técnica de dielectroforesis sin contacto es un nuevo método que fue derivado de la dielectroforesis con aisladores. En este método se emplean dispositivos con postes aisladores, pero los campos eléctricos se aplican de manera perpendicular al canal, a través de una delgada barrera conductiva que separa los electrodos del microcanal evitando el contacto directo con las células (Fig. 5a). Fue desarrollado por Rafael V. Davalos y su grupo, reportado por primera vez en el 2009 (Shafiee y coi, 2009). En una reciente aplicación clínica, Salmanzadeh y col. (2012) reportó el aislamiento y separación de células iniciadoras de tumores prostéticos (células PC3) mediante el uso de dielectroforesis sin contacto. La Fig. 5b muestra una vista superior del dispositivo. La Fig. 5c muestra las células PC3 atrapadas con dielectroforesis positiva alrededor de los postes aisladores al aplicar un potencial de 129 V a lo ancho del canal a una frecuencia de 600 kHz. La importancia de este trabajo es que solo las células iniciadoras de tumor fueron atrapadas, células sin esta capacidad fluyeron a lo largo del canal sin ser atrapadas. Este atrapamiento selectivo se debió a que las células iniciadoras de tumor tienen diferentes proteínas en su membrana lo que altera las propiedades dieléctricas de las células y facilita el atrapamiento.
Este método permitió diferenciación sin el uso de etiquetas como tintes fluorescentes, demostrando así la capacidad de la técnica de dielectroforesis como método para análisis clínicos que no requieren etiquetado (Salmanzadeh y col, 2012).
3.3 Electrorrotación
Otra técnica electrocinética importante para la manipulación y caracterización de células en microescala es la electrorrotación. Este fenómeno ocurre cuando una partícula se expone a un campo eléctrico rotacional. Al exponerse la partícula a un campo eléctrico, se forma un dipolo que se alinea con el campo, este dipolo tarda un tiempo corto en formarse, y como el campo esta rotando, al terminarse de formar el dipolo, el campo ya cambió, es decir el dipolo no está alineado con el nuevo campo, y se genera un torque en la partícula que la hace rotar asincrónicamente con el campo. El torque rotacional ejercido en una partícula se define como:

donde Ω es el índice de rotación dado en radianes por segundo, η es la viscosidad del medio e Im (ƒCN) es la parte imaginaria del factor de Clausius-Mossotti. La respuesta de la partícula, en términos de la dirección y velocidad de giro, dependerá tanto de las propiedades del medio y de la partícula como de la frecuencia y magnitud del campo eléctrico aplicado. La Fig. 6 muestra una representación esquemática de electrorrotación en un sistema de cuatro electrodos, donde se observa que la partícula tiene una rotación en la dirección contraria a la del campo eléctrico. En la misma figura también se muestran las gráficas donde se representa la señal sinusoidal que se aplica a cada uno de los cuatro electrodos para generar el campo eléctrico rotante (Cristofanilli y coi, 2002; Hughes, 2002).
La electrorrotación al ser una técnica no invasiva, tiene un gran potencial para la caracterización de células viables en tiempo real; puede además discriminar células individuales y usarse para caracterizar propiedades dieléctricas de sub-poblaciones. La electrorrotación puede operar con una sola célula, lo que la hace ideal en pruebas con bajas concentraciones y como indicador de presencia de patógenos en agua y alimentos. Se han reportado importantes estudios de electrorrotación en diversos tipos de células, a continuación se describen aplicaciones en parásitos (Dalton y col., 2004) y microalgas (Wu y col., 2005b).
En el 2004 Dalton y col. reportaron un estudio de electrorrotación para analizar la viabilidad del parásito Cryptosporidium parvum, utilizando campos eléctricos de corriente alterna a una frecuencia de 800 kHz y se observó que si el parásito era viable, la rotación sucedía de lado derecho, y cuando no lo era giraba del lado izquierdo. La Fig. 7a muestra el perfil completo de la velocidad de rotación de los ooquistes como función de la frecuencia del campo eléctrico aplicado, donde se observa que a la frecuencia de 105 Hz los ooquistes viables alcanzan su máxima velocidad de giro, la cual es mucho mayor que la velocidad de los ooquistes muertos. Estas diferentes respuestas se deben a cambios en las propiedades dieléctricas de la membrana de los ooquistes al perder viabilidad. Es importante mencionar que la velocidad de giro en las células es mucho menor que la velocidad con la que gira el campo, esto permite observar el giro de las células con el ojo humano y en cuestión de segundos conocer el estado de viabilidad. Este es un ejemplo del potencial de éste método en microescala para proveer una rápida respuesta en análisis de viabilidad. En este estudio también se reportó la diferenciación entre huevos de Áscaris fertilizados y sin fertilizar mediante la observación de la dirección del giro, ya que giran en dirección opuesta; esto sucede porque en los huevos fertilizados se van formando varias estructuras que cambian las propiedades dieléctricas y la respuesta de electrorrotación (Dalton y col, 2004). Estos resultados demuestran la flexibilidad del fenómeno de electrorrotación para determinar rápidamente el estado fisiológico de células, desde estudios de viabilidad hasta análisis de fertilización.
En el 2005 Wu y col., desarrollaron un sistema electrocinético usando electrorrotación y dielectroforesis de onda viajera, con la finalidad de estudiar las diferencias dieléctricas existentes entre células de algas. Los autores emplearon células de Chlorella protothecoides, una microalga que tiene la característica de comportarse de manera autótrofa o heterótrofa dependiendo de las condiciones del medio. Se cultivaron células en diferentes medios de cultivo, modificando únicamente la cantidad de glicina y glucosa, con el propósito de obtener los dos tipos de células (autótrofa y heterótrofa). Las células se analizaron con electrorrotación obteniendo la gráfica mostrada en la Fig. 7b, donde se observan distintas respuestas entre las frecuencias 10 kHz a 10 MHz, lo que indica que las células autótrofas (•) tienen una velocidad de rotación mayor a las células heterótrofas  debido a las diferencias en propiedades dieléctricas en su membrana, principalmente en el contenido de proteínas y lípidos. Los autores propusieron a la electrorrotación como técnica para la determinación de componentes bioquímicos en las células, ya que este estudio permitió conocer que células con porcentajes altos de proteínas giran con mayor velocidad que las células con menor cantidad, esto porque las proteínas pueden transportar carga eléctrica más negativa (Wu y col., 2005b). Los resultados que obtuvieron prevén para estudios futuros estimar la cantidad de proteínas, lípidos y otros componentes de la partícula, lo cual proporcionaría una manera más eficaz de determinar las composiciones bioquímicas de la partícula.
debido a las diferencias en propiedades dieléctricas en su membrana, principalmente en el contenido de proteínas y lípidos. Los autores propusieron a la electrorrotación como técnica para la determinación de componentes bioquímicos en las células, ya que este estudio permitió conocer que células con porcentajes altos de proteínas giran con mayor velocidad que las células con menor cantidad, esto porque las proteínas pueden transportar carga eléctrica más negativa (Wu y col., 2005b). Los resultados que obtuvieron prevén para estudios futuros estimar la cantidad de proteínas, lípidos y otros componentes de la partícula, lo cual proporcionaría una manera más eficaz de determinar las composiciones bioquímicas de la partícula.
Otra aplicación importante de la electrorrotación es para la caracterización de propiedades dieléctricas de células y otras partículas complejas. Mediante la realización de experimentos de electrorrotación es posible medir la frecuencia de corte (frecuencia donde el factor de Clausius-Mossotti es cero), y de esta información extraer la conductividad y permitividad de los distintos componentes de una célula: membrana, pared y citoplasma. Las propiedades dieléctricas son indispensables para poder diseñar sistemas de manipulación de células, en especial se requieren para el diseño de sistemas dielectroforéticos. Estos datos usualmente se emplean en simulaciones matemáticas donde se predice el funcionamiento de dispositivos para cierto tipo de partículas y se seleccionan los mejores sistemas para ser construidos y probados. El conocer las propiedades dieléctricas de las partículas a analizar y realizar simulaciones, proporciona una herramienta muy efectiva para la optimización de estos sistemas, ahorrando recursos y tiempo (Leiy col., 2011).
3.4 Impedancia eléctrica
La impedancia eléctrica es una técnica rápida que se ha empleado para cuantificar la concentración de células y detección de presencia de patógenos. La impedancia se define como la oposición a la corriente, es decir, consiste en los efectos resistivos a la corriente que se presentan en un circuito. La técnica consiste en el empleo de dos electrodos para aplicar campos de corriente alterna y medir la impedancia de una suspensión de células a lo largo del tiempo, donde se producen cambios debido a la liberación de metabolitos iónicos de las células. Generalmente se utilizan varias frecuencias con el fin de lograr una caracterización completa de un sistema. Esta técnica tiene más de 100 años de ser usada, pero tiene la desventaja que en equipos convencionales, el tiempo de detección puede ser muy largo cuando se tienen bajas concentraciones de células. Se han reportado aplicaciones de detección rápida de bacterias tanto a nivel laboratorio como industrial. La técnica es especialmente efectiva y rápida cuando se emplea en dispositivos miniaturizados (Gomez-Sjoberg y col, 2005). Estudios importantes demuestran el potencial de la impedancia como método en microescala aplicado con bacterias (Suehiro y col., 2003; Gómez - Sjoberg y col., 2005), esporas (Sabounchi y col., 2008), y con líneas celulares de cáncer (Meighan y col, 2009).
En el 2003 Suehiro y col. reportaron un microdispositivo donde emplearon una combinación de dielectroforesis con mediciones de impedancia. El dispositivo contenía un arreglo de microelectrodos interdigitados que se utilizaron para atrapar células de E. coli mediante dielectroforesis positiva y detectarlas midiendo la impedancia en términos de conductancia en μS. Se utilizaron células viables y no viables, las células no viables se obtuvieron mediante tratamiento térmico y con luz ultravioleta. Los experimentos consistieron en introducir al microdispositivo un flujo 0.9 mL/min de suspensión con células a una concentración de 107 células/mL, y atraparlas en los electrodos mediante la aplicación de un potencial de corriente alterna. Al aplicar el voltaje, las células se atrapaban con dielectroforesis positiva y formaban un ''puente'' entre los electrodos interdigitados como lo muestra la Fig. 8a. Este ''puente'' que une los electrodos aumenta la conductancia de la suspensión y de esta forma permite detectar la presencia de las bacterias. Conforme avanza el experimento, se tiene una mayor acumulación de bacterias atrapadas en estos ''puentes'' uniendo los electrodos y por tanto se observa un aumento de conductancia con el tiempo. La Fig. 8b muestra las mediciones de conductancia llevadas a cabo durante 150 s, cuando se aplicó un potencial de 3 V a una frecuencia de 1 MHz a una muestra de células viables y no viables. En la figura puede apreciarse que la conductancia de las células viables aumenta con el tiempo, lo que indica una efectiva acumulación de células viables atrapadas con dielectroforesis positiva. En cambio, no se ve este aumento en conductancia con las células no viables, ya que éstas tienen diferentes propiedades dieléctricas en su membrana y no se atrapan con dielectroforesis. Estos resultados obtenidos en menos de 3 min permiten evaluar exitosamente la viabilidad de las células. Se demuestra así la capacidad de la impedancia para análisis rápidos de microorganismos cuando se aplica en dispositivos miniaturizados (Suehiro y col., 2003).
En el 2005 Wu y col. desarrollaron un detector para bacterias combinando flujo electroosmótico con mediciones de impedancia. Este grupo construyó un microdispositivo con electrodos planos, localizados en el fondo, los cuales se usaron para generar flujo electroosmótico de corriente alterna para concentrar de forma rápida células bacterianas de E. coli. La Fig. 9a muestra una representación esquemática del dispositivo empleado, donde se incluye la distribución del campo eléctrico de corriente alterna. Como se muestra en la Fig. 9a, al aplicar un potencial de corriente alterna se generan vórtices encima de los electrodos, si el potencial aplicado tiene una magnitud suficiente, las partículas (mostradas en color obscuro) se depositan en áreas de estancamiento. El dispositivo empleado contenía electrodos de oro y titanio, los cuales tenían una longitud de 2 mm, ancho de 80 mm y separación de 40 mm. La Fig. 9b muestra los resultados obtenidos con células de E. coli que se introdujeron en el microdispositivo a una concentración de 4 x 106 UFC/mL (unidades formadoras de colonia). Como se observa en la imagen, las células se encuentran colectadas formando una línea en la región de estancamiento localizada a lo largo del centro del electrodo. El atrapamiento de estas células se logró en 30 segundos aplicando un potencial de 1 V a una frecuencia de 100 Hz. Demostrando la rapidez que se obtiene al emplear métodos en microescala. En cuanto a la detección, la Fig. 9c muestra los resultados de impedancia obtenidos en suspensiones de E. coli en solución fosfato salino, estas mediciones se llevaron a cabo empleando distintas concentraciones de células, aplicando un potencial de 1 V. Como se observa en la figura, altas concentraciones de células 106 UFC/mL son fácilmente detectables con impedancia. En concentraciones celulares mas bajas, no es posible detectar la presencia de las células a bajas frecuencias, observándose que la sensibilidad de la detección aumenta a frecuencias mas altas. Este estudio es un ejemplo mas de una aplicación exitosa de métodos en microescala. La miniaturización facilita integración de varios procesos en un mismo dispositivo; en este caso se logró la detección de bacterias en suspensión por medio de impedancia, empleando electroósmosis de corriente alterna para pre-concentrar las células y mejorar la detección (Wu y col, 2005a).
En una combinación de las técnicas de dielectroforesis con aisladores e impedancia eléctrica, Sabounchi y col. (2008) reportaron la concentración de esporas de B. subtilis seguida de detección con impedancia eléctrica. Primeramente las partículas (esporas y partículas inertes) se concentraron en un microcanal con postes aisladores cilíndricos, para su posterior detección en un canal lateral mediante el monitoreo de cambios de impedancia entre dos electrodos sensores.
Los resultados mostraron como un sistema de este tipo, con acoplamiento entre dielectroforesis y detección con impedancia puede ser usado como un dispositivo de alto flujo para detección de bajas concentraciones de células de interés. Al concentrar las células con dielectroforesis se asegura tener una señal suficiente para ser detectada por impedancia. Se encontró también que al pasar el flujo de esporas por el canal lateral de sensado se genera un descenso en la resistencia entre los dos electrodos, lo que resulta en una corriente más alta y genera un mayor voltaje de salida. Este efecto se intensifica al aumentar la concentración de esporas. Este estudio demuestra la aplicación de la impedancia eléctrica en sensores de partículas biológicas de alto flujo (Sabounchi y col., 2008).
3.5 Enfocado inercial
El uso de fuerzas inerciales es otro mecanismo que se emplea en la manipulación de células en microdispositivos con un alto grado de control y sensibilidad (Di Cario y col, 2007). El enfocado inercial es una técnica en microescala no destructiva, que no requiere el etiquetado de células con tintes o reactivos, y es utilizada con éxito para separar y concentrar micropartículas. Este método consiste en el direccionamiento y enfocado de partículas dentro de un microcanal con ayuda de fuerzas inerciales, que son inducidas mediante la topología del microcanal. Las topologías más empleadas son microcanales rectos y curvos. En la Fig. 10a se aprecia una imagen que muestra como es el ordenamiento de partículas en un canal recto, se muestra la sección transversal; observándose que las partículas se agrupan en cuatro zonas en el centro de cada pared. La Fig. 10b es una representación esquemática de la vista superior de un canal rectangular, observándose que las partículas se enfocan en tres corrientes o líneas, donde la línea central es más gruesa ya que corresponde a dos líneas de enfocado. En los canales curvos el ordenamiento y enfocado de partículas se obtiene en el centro del canal, así como lo muestra la Fig. 10c en la sección transversal de un canal con forma de serpentín.
La Fig. 10d es un esquema de la vista superior del mismo canal en forma de serpentín, donde se aprecia que a la entrada del canal las partículas están en desorden y se van ordenando conforme se acercan a la salida del microcanal. Los microdispositivos que emplean canales con curvaturas, pueden ser de forma de serpentín o espiral, donde se han reportado separaciones eficaces de una variedad de micropartículas (Xuan y col, 2010).
En esta técnica, las partículas fluyen a lo largo del canal con la ayuda de un flujo inducido por una bomba o por electroósmosis. En estos sistemas se tiene una combinación de fuerzas de ascensión (lift forces en inglés) de fuerzas de corte y fuerzas de pared.
Las fuerzas de corte que se generan a números de Reynolds mayores a 5 alejan a las partículas del centro del canal, mientras que las fuerzas de efecto de pared impulsan a las partículas hacia al centro, alejándolas de las paredes. De esta forma, las partículas son enfocadas a un punto donde las fuerzas se equilibran, y permanecen enfocadas, la posición de las partículas es dictada por la magnitud de las fuerzas. En la Fig. 10e se muestra un esquema del movimiento que tendrán tres distintas partículas en la sección transversal de un canal. El balance o equilibrio entre las fuerzas de corte y pared enfocan las partículas (círculos amarillos) a posiciones en el centro de cada una de las cuatro caras del canal, estas posiciones están denotadas con líneas discontinuas.
Los parámetros más importantes que determinan si las partículas serán enfocadas, son el número de Reynolds del canal, la relación entre el diámetro de la partícula (dp) y el diámetro hidráulico del canal (Dh). Se ha demostrado que para lograr enfocado se requiere flujo cuyo número de Reynolds sea moderado y que se cumpla la relación dp/Dh≥0.07.
El grupo de investigación de Di Cario ha sido uno de los pilares en el desarrollo del enfocado inercial de partículas en dispositivos microfluídicos. Este grupo ha publicado desde los principios fundamentales (Di Cario y coi, 2007); hasta importantes aplicaciones clínicas como el desarrollo de un filtro miniaturizado para muestras de sangre con eficiencias mayores del 80% en la remoción de patógenos presentes en sangre (Mach y Di Cario, 2010). Reportes mas recientes han extendido las bases teóricas del enfocado inercial, desarrollando los primeros estudios en partículas no esféricas (Hur y col., 2011a) y partículas deformables (Km y col, 2011b).
Di Cario y col. (2007) estudiaron las fuerzas inerciales generadas en canales curvos variando la geometría del canal, la densidad de las partículas y de las soluciones de suspensión empleadas. En estos experimentos con partículas inertes se encontró que la razón entre las densidades de la partícula y del medio no tenía un efecto significativo en el enfocado. Este grupo reportó estudios con glóbulos rojos donde se obtuvo un enfocado similar al de las partículas inertes, con la excepción de que los glóbulos rojos presentaron un ordenamiento adicional debido a su forma bicóncava, ya que éstos rotaban sobre su propio eje. En la Fig. 11a se tiene una imagen del posicionamiento de los glóbulos rojos en un canal rectangular, mostrando que a números de Reynolds bajo (Re = 0.3) no hay un enfocado de glóbulos rojos y en la Fig. 11b se observa el enfocado exitoso de glóbulos rojos obtenido al aumentar la velocidad del flujo con Re = 60. Cabe mencionar que la curvatura del canal es un parámetro más que puede explotarse para lograr una separación deseada. En canales curvos existe un flujo secundario causado por la inercia del mismo fluido que se ha utilizado para manipular mas efectivamente la posición de partículas en microcanales (Di Cario y col., 2007).
El enfocado inercial también se ha usado para manipular células cancerígenas, como ejemplo se tiene el trabajo de Kuntaegowdanahalli y col. (2009), donde diseñaron un microdispositivo con un canal en espiral para la separación continua de diferentes células empleando la aceleración centrifuga en el canal. En la Fig. 11c se muestra un esquema del dispositivo en espiral, mostrando en la entrada partículas no ordenadas, y conforme avanzan son enfocadas y separadas hacia distintos reservorios o salidas. Este grupo demostró la separación entre células de neuroblastoma (SH-SYS5) de ~ 15 /an de diámetro y células de glioma (C6) de ~ 8 /mi de diámetro. La eficiencia de separación fue superior al 80% para ambos tipos de células, con una viabilidad celular después de la separación mayor al 90% (Kuntaegowdanahalli y col, 2009). Estos resultados demuestran la gran flexibilidad del enfocado inercial para aplicaciones clínicas y biomédicas.
3.6 Citometría de flujo
La citometría de flujo es una importante herramienta que utiliza los principios de dispersión de la luz y excitación de fluorocromos en el estudio y clasificación de poblaciones celulares, ya que permite conocer características como tamaño celular, granularidad de la membrana e intensidad de fluorescencia (en el caso de células marcadas con tintes fluorescentes). En los estudios de citometría en microescala, las células se introducen en un sistema microfluídico para ser alineadas hidrodinámicamente y ser conducidas hacia un rayo láser. Esencialmente, el sistema microfluídico se usa para introducir la muestra, la cual es rodeada por un flujo envolvente externo, y enfocar las células al centro del microcanal. El flujo de células enfocadas se hace pasar, una por una, a través de un rayo láser el cual al incidir sobre las células se desvía obteniendo una señal específica, que es recibida por un sensor que la transforma de luminosa a digital. La señal digital es relacionada con la célula analizada, lográndose de esta manera, la clasificación de las células. La Fig. 12 muestra una representación esquemática del funcionamiento básico de un citómetro de flujo.

Usualmente, los resultados de estudios de citometría de flujo son reportados en gráficas de puntos, donde en los ejes x y y se representan las escalas de fluorescencia de los diferentes tipos de fluorocromos utilizados, y cada punto simboliza a una partícula detectada. En estas gráficas se puede diferenciar a poblaciones con características diferentes u obtener la densidad de una población de partículas marcadas.
Una aportación importante en el campo de citometría de flujo en microescala fue reportada Yamaguchi y col. (2006); este grupo desarrolló una técnica rápida para analizar la presencia de Pseudomonas en leche. En este estudio las células bacterianas fueron marcadas usando la técnica de hibridación fluorescente in situ (FISH en inglés). En esta investigación se preparó una muestra testigo de leche sin Pseudomonas y otra muestra con Pseudomonas, previamente marcadas, ambas muestras fueron analizadas con citometría de flujo. La Fig. 13a muestra la gráfica obtenida cuando se analizó una muestra de leche sin bacterias, observando ausencia de señal en la región 1 (dentro del rectángulo). La Fig. 13b contiene los resultados obtenidos con la muestra inoculada con Pseudomonas, mostrando una alta densidad celular relativa a la presencia bacterias en la región 1. El tiempo de análisis de seis muestras en este sistema microfluídico fue de solo 30 min. Este estudio comprueba que la citometría de flujo en microescala puede representar una alternativa a las técnicas tradicionales en la detección de bacterias y otros microorganismos en alimentos; con ventajas atractivas como reducción en la cantidad de muestra requerida, rapidez y portabilidad (Yamaguchi y col, 2006).
Otras importantes aplicaciones de los citómetros de flujo fueron presentadas por Palková y col. (2004) mediante el empleo de un sistema hidrodinámico miniaturizado para el análisis de viabilidad en levaduras, detección del silenciamiento de un gen y caracterización de infecciones fúngales. Estos resultados demuestran el gran campo de aplicación y flexibilidad de la citometría en microescala (Palkova y col., 2004). En la actualidad los citómetros de flujo son una poderosa herramienta en el análisis celular, como por ejemplo en el estudio de los distintos estados fisiológicos, la viabilidad celular o la caracterización dinámica de secreción de algún metabolito secundario. Sin embargo los equipos convencionales de laboratorio (escala normal) resultan ser demasiado costosos y de grandes dimensiones (Bhagat y col, 2010; David y col, 2011; Want y col, 2011). Por tanto existe un creciente interés en el desarrollo de citómetros de flujo para microfluídica, de menor costo, portátiles y de bajo requerimiento de muestra (Meade y col, 2011).
Conclusiones
El desarrollo de las técnicas en microescala para el análisis de células está avanzando rápidamente. Aplicaciones como detección de patógenos en alimentos y cuerpos de agua, control de calidad, análisis clínicos como detección oportuna de cáncer, son áreas donde es esencial la obtención de resultados rápidamente. El miniaturizar estos procesos permite explotar diferentes fenómenos y características que impulsan el desarrollo de nuevas técnicas. Las ventajas que ofrecen las técnicas en microescala, como respuesta rápidas, portabilidad y alta resolución, ofrecen una alternativa a los métodos tradicionales, que en su mayoría requieren cultivo y por tanto no son capaces de proporcionar respuestas oportunas.
El presente artículo de revisión muestra un panorama de los avances en el manejo de células intactas a microescala, donde se incluye una breve descripción de los fundamentos de seis de las técnicas más empleadas y ejemplos representativos de cada una de ellas. En las aplicaciones se muestran como fuerzas eléctricas, inerciales y efectos ópticos han sido empleados exitosamente para el análisis de una amplia variedad de células. El potencial de los métodos miniaturizados es muy amplio, desde simples mediciones de crecimiento celular y pruebas de viabilidad, hasta análisis clínicos que se espera puedan ser empleados para la oportuna detección de cáncer. Las técnicas electrocinéticas en particular tendrán un desarrollo acelerado; debido a su alta flexibilidad y bajo costo, ya que ofrecen la posibilidad de explotar diferentes características, como los son las propiedades dieléctricas de las células, para lograr la detección, separación y concentración de células. Existe aún mucho trabajo por hacer para lograr que estos métodos novedosos sean aceptados como práctica estándar en los laboratorios y en la industria, sin embargo, se espera seguir teniendo en los años venideros un gran avance en el desarrollo de las técnicas en microescala para el análisis y manipulación de células.
Agradecimientos
Los autores agradecen el apoyo económico proporcionado por CINVESTAV Unidad Monterrey y por el Consejo Nacional de Ciencia y Tecnología (CONACYT) por becas de posgrado.
Referencias
Ainsworth, C, Nixon, B. y Aitken, RJ. (2005). Development of a novel electrophoretic system for the isolation of human spermatozoa. Human Reproduction 20, 2261-2270. [ Links ]
Amin, N.C., Blanchin, M.D., Ake, M. y Fabre, H. (2012). Capillary zone electrophoresis as a potential technique for the simultaneous determination of sulfadoxine and pyrimethamine in tablet formulations. Journal of Pharmaceutical and Biomedical Analysis 58, 168-171. [ Links ]
Armstrong, D.W. y He, L.F. (2001). Determination of cell viability in single or mixed samples using capillary electrophoresis laser-induced fluorescence microfluidic systems. Analytical Chemistry 73, 4551-4557. [ Links ]
Armstrong, D.W. y Schneiderheinze, J.M. (2000). Rapid Identification of the Bacterial Pathogens Responsible for Urinary Tract Infections Using Direct Injection CE. Analytical Chemistry 72, 4474.4476. [ Links ]
Armstrong, D.W., Schneiderheinze, J.M., Kullman, J.P. y He, L.F. (2001). Rapid CE microbial assays for consumer producís that contain active bacteria. FEMS Microbiology Letters 194, 33-37. [ Links ]
Armstrong, D.W., Schulte, G., Schneiderheinze, J.M. y Westenberg, D.J. (1999). Separating microbes in the manner of molecules. 1. Capillary electrokinetic approaches. Analytical Chemistry 71, 5465-5469. [ Links ]
Bhagat, A.A.S., Kuntaegowdanahalli, S.S., Kaval, N., Seliskar, CJ. y Papautsky, I. (2010). Inertial microfluidics for sheath-less high-throughput flow cytometry. Biomedical Microdevices 12, 187-195. [ Links ]
Burns, M.A., Johnson, B.N., Brahmasandra, S.N., Handique, K., Webster, J.R., Krishnan, M., Sammarco, T.S., Man, P.M., Jones, D., Heldsinger, D., Mastrangelo, C.H. y Burke, D.T. (1998). An integrated nanoliter DNA analysis device. Science 282, 484-487. [ Links ]
Çetin, B. y Li, D. (2011). Dielectrophoresis in microfluidics technology. Electrophoresis 32, 2410-2427. [ Links ]
Cristofanilli, M., De Gasperis, G., Zhang, L., Hung, M.-C, Gascoyne, P.R.C. y Hortobagyi, G.N. (2002). Automated electrorotation to reveal dielectric variations related to HER-2/neu overexpression in MCF-7 sublines. Clinical Cáncer Research 8, 615-619. [ Links ]
Cummings, E. y Khusid, B. (2007). Dielectrophoretic microfluidics. En Microfluidic Technologies for Miniaturized Analysis Systems. (S. Hardt and F. Schonfeld, eds.), Pp. 315-355, Springer, New York. [ Links ]
Cummings, E.B. (2003). Streaming dielectrophoresis for continuous-flow microfluidic devices. IEEE Engineering in Medicine and Biology Magazine 22, 75-84. [ Links ]
Dalton, C, Goater, A.D., Burt, J.P.H. y Smith, H.V. (2004). Analysis of parasites by electrorotation. Journal of Applied Microbiology 96, 24-32. [ Links ]
David, F., Steinwand, M., Hust, M., Bohle, K., Ross, A., Dubel, S. y Franco-Lara, E. (2011). Antibody production in Bacillus megaterium: Strategies and physiological implications of scaling from microtiter plates to industrial bioreactors. Biotechnology Journal 6, 1516-1531. [ Links ]
Di Cario, D., Irimia, D., Tompkins, R.G. y Toner, M. (2007). Continuous inertial focusing, ordering, and separation of particles in microchannels. Proceedings of the National Academy of Sciences of the United States of América 104, 18892-18897. [ Links ]
Ehlers, J., Tosch, M., AlBaz, I. y Lochmann, E.-R. (1991). Rapid estimation of chromosomal damage in yeast due to the effects of environmental chemicals using pulsed fleld gel electrophoresis. Ecotoxicology and Environmental Safety 22, 133-138. [ Links ]
Gagnon, Z.R. (2011). Cellular dielectrophoresis: Applications to the characterization, manipulation, separation and patterning of cells. Electrophoresis 32, 2466-2487. [ Links ]
Gomez-Sjoberg, R., Morisette, D.T. y Bashir, R. (2005). Impedance microbiology-on-a-chip: Microfluidic bioprocessor for rapid detection of bacterial metabolism. Journal of Microelectromechanical Systems 14, 829-838. [ Links ]
González, C.F. y Remcho, V.T. (2005). Harnessing dielectric forces for separation of cells, fine particles and macromolecules. Journal of Chromatography A 1079, 59-68. [ Links ]
Griffiths, D.J. (1999). Introduction to Electrodynamics. Upper Saddle River, Prentice Hall. [ Links ]
He, L.F., Jepsen, R.J., Evans, L.E. y Armstrong, D.W. (2003). Electrophoretic behavior and potency assessment of boar sperm using a capillary electrophoresis & láser induced fluorescence system. Analytical Chemistry 75, 825-834. [ Links ]
Hughes, M.P. (2002). Nanoelectromechanics in Engineering and Biology. Boca Ratón, FL, CRC Press. [ Links ]
Hur, S.C., Choi, S.-E., Kwon, S. y Di Cario, D. (2011a). Inertial focusing of non-spherical microparticles. Applied Physics Letters 99, 044101-3. [ Links ]
Hur, S.C., Henderson-MacLennan, N.K., McCabe, E.R.B. y Di Cario, D. (2011b). Deformability-based cell classification and enrichment using inertial microfluidics. Lab on a Chip 11, 912-920. [ Links ]
Ibeas, J.I. y Jiménez, J. (1993). Electrophoretic karyotype of budding yeasts with intact cell-wall. Nucleic Acids Research 21, 3902-3902. [ Links ]
Ivanoff, C.S., Hottel, T.L., Tantbirojn, D.V., Versluis, A. y Garcia-Godoy, F. (2011). Dielectrophoretic transport of fluoride into enamel. American Journal of Dentistry 24, 341-345. [ Links ]
Jones, P., Staton, S. y Hayes, M. (2011). Blood cell capture in a sawtooth dielectrophoretic microchannel. Analytical and Bioanalytical Chemistry 401, 2103-2111. [ Links ]
Jones, T.B. (1995). Electromechanics of Particles. Cambridge University Press, E.U.A. [ Links ]
Klodzinska, E. y Buszewski, B. (2009). Electrokinetic detection and characterization of intact microorganisms. Analytical Chemistry 81, 8-15. [ Links ]
Kremser, L., Blaas, D. y Kenndler, E. (2004). Capillary electrophoresis of biological particles: Virases, bacteria, and eukaryotic cells. Electrophoresis 25, 2282-2291. [ Links ]
Kuntaegowdanahalli, S.S., Bhagat, A.A.S., Kumar, G. y Papautsky, I. (2009). Inertial microfluidics for continuous particle separation in spiral microchannels. Lab on a Chip 9, 2973-2980. [ Links ]
Lantz, A.W., Bao, Y. y Armstrong, D.W. (2007). Single-cell detection: Test of microbial contamination using capillary electrophoresis. Analytical Chemistry 79, 1720-1724. [ Links ]
Lapizco-Encinas, B.H. (2008). Aplicaciones de microfluídica en bioseparaciones. Revista Mexicana de Ingeniería Química 7, 205-214. [ Links ]
Lapizco-Encinas, B.H. y Rito-Palomares, M. (2007). Dielectrophoresis for the manipulation of nanobioparticles. Electrophoresis 28, 4521-4538. [ Links ]
Lapizco-Encinas, B.H., Simmons, B.A., Cummings, E.B. y Fintschenko, Y. (2004). Dielectrophoretic concentration and separation of live and dead bacteria in an array of insulators. Analytical Chemistry 76,1571-1579. [ Links ]
Lei, U., Sun, P.-H. y Pethig, R. (2011). Refinement of the theory for extracting cell dielectric properties from dielectrophoresis and electrorotation experiments. Biomicrofluidics 5, 044109-16. [ Links ]
Leonard, K.M. y Minerick, A.R. (2011). Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis 32, 2512-2522. [ Links ]
Li, H. y Bashir, R. (2002). Dielectrophoretic separation and manipulation of live and heat-treated cells of Listeria on microfabricated devices with interdigitated electrodes. Sensors and Actuators B-Chemical 86, 215-221. [ Links ]
Mach, AJ. y Di Cario, D. (2010). Continuous scalable blood filtration device using inertial microfluidics. Biotechnology and Bioengineering 107, 302-311. [ Links ]
Meade, S.O., Godin, J., Chen, C.-H., Cho, S.H., Tsai, F.S., Qiao, W. y Lo, Y.-H. (2011). Microfluidic flow cytometry: Advancements toward compact, integrated systems. En Advanced Optical Flow Cytometry, Pp. 273-310, Wiley-VCH Verlag GmbH & Co. KGaA. [ Links ]
Meighan, M.M., Staton, S.J.R. y Hayes, M.A. (2009). Bioanalytical separations using electric field gradient techniques. Electrophoresis 30, 852-865. [ Links ]
Moncada-Hernández, H. y Lapizco-Encinas, B.H. (2010). Simultaneous concentration and separation of microorganisms: insulator-based dielectrophoretic approach. Analytical and Bioanalytical Chemistry 396, 1805-1816. [ Links ]
Ozuna-Chacón, S., Lapizco-Encinas, B.H., Rito-Palomares, M., Collado-Arredondo, E. y Martínez Chapa, S.O. (2007). Dielectroforesis con estructuras aisladoras. Revista Mexicana de Ingeniería Química 6, 329-335. [ Links ]
Palkova, Z., Vachova, L., Valer, M. y Preckel, T. (2004). Single-cell analysis of yeast, mammalian cells, and fungal spores with a microfluidic pressure-driven chip-based system. Cytometry Part A59A, 246-253. [ Links ]
Pohl, H.A. (1978). Dielectrophoresis. Cambridge, Cambridge University Press. [ Links ]
Pratt, E.D., Huang, C, Hawkins, B.G., Gleghorn, J.P. y Kirby, BJ. (2011). Rare cell capture in microfluidic devices. Chemical Engineering Science 66, 1508-1522. [ Links ]
Sabounchi, P, Morales, A.M., Ponce, P, Lee, L.P., Simmons, B.A. y Davalos, R. (2008). Sample concentration and impedance detection on a microfluidic polymer chip. Biomedical Microdevices 10, 661-670. [ Links ]
Salmanzadeh, A., Romero, L., Shaflee, H., Gallo-Villanueva, R.C., Stremler, M.A., Cramer, S.D. y Davalos, R.V. (2012). Isolation of prostate tumor initiating cells (TICs) through their dielectrophoretic signature. Lab on a Chip 12, 182-189. [ Links ]
Sano, M.B., Henslee, E.A., Schmelz, E. y Davalos, R.V. (2011). Contactless dielectrophoretic spectroscopy: Examination of the dielectric properties of cells found in blood. Electrophoresis 32, 3164-3171. [ Links ]
Shaflee, H., Caldwell, J., Sano, M. y Davalos, R. (2009). Contactless dielectrophoresis: a new technique for cell manipulation. Biomedical Microdevices 11, 997-1006. [ Links ]
Shen, Y., Elele, E. y Khusid, B. (2011). A novel concept of dielectrophoretic engine oil filter. Electrophoresis 32, 2559-2568. [ Links ]
Srivastava, S.K., Artemiou, A. y Minerick, A.R. (2011). Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis 32, 2530-2540. [ Links ]
Srivastava, S.K., Baylon-Cardiel, J.L., Lapizco-Encinas, B.H. y Minerick, A.R. (2011). A continuous DC-insulator dielectrophoretic sorter of microparticles. Journal of Chromatography A 1218, 1780-1789. [ Links ]
Suehiro, J., Hamada, R., Noutomi, D., Shutou, M. y Hará, M. (2003). Selective detection of viable bacteria using dielectrophoretic impedance measurement method. Journal of Electrostatics 57, 157-168. [ Links ]
Szeliga, J., Jackowski, M., Klodzinska, E., Buszewski, B. y Kupczyk, W. (2011). Clinical application of a rapid microbiological test based on capillary zone electrophoresis to assess local skin infection. BMC Research Notes 4, 467. [ Links ]
van Noort, D., Ong, S.M., Zhang, C, Zhang, S., Arooz, T. y Yu, H. (2009). Stem cells in microfluidics. Biotechnology Progress 25, 52-60. [ Links ]
Voldman, J. (2006). Electrical forces for microscale cell manipulation. Annual Review of Biomedical Engineering 8, 425-454. [ Links ]
Voldman, J. (2007). Dielectrophoretic Traps for Cell Manipulation. En Bio MEMS and Biomedical Nanotechnology. (M. Ferrari, R. Bashir and S. Wereley, eds.), Pp. 159-186, Springer US, [ Links ]
Wallingford, R.A. y Ewing, A.G. (1987). Capillary zone electrophoresis with electrochemical detection. Analytical Chemistry 59, 1762-1766. [ Links ]
Want, A., Hancocks, H., Thomas, C.R., Stocks, S.M., Nebe-Von-Caron, G. y Hewitt, CJ. (2011). Multi-parameter flow cytometry and cell sorting reveal extensive physiological heterogeneity in Bacillus cereus batch cultures. Biotechnology Letters 33, 1395-1405. [ Links ]
Whitesides, G.M. (2006). The origins and the future of microfluidics. Nature 442, 368-373. [ Links ]
Wu, J., Ben, Y, Battigelli, D. y Chang, H.-C. (2005). Long-Range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research 44, 2815- 2822. [ Links ]
Wu, Y.F., Huang, C.J., Wang, L., Miao, X.L., Xing, W.L. y Cheng, J. (2005c). Electrokinetic system to determine differences of electrorotation and traveling-wave electrophoresis between autotrophic and heterotrophic algal cells. Colloids and Surfaces A-Physicochemical and Engineering Aspects 262, 57-64. [ Links ]
Xuan, X., Zhu, J. y Church, C. (2010). Particle focusing in microfluidic devices. Microfluidics and Nanofluidics 9, 1-16. [ Links ]
Yamaguchi, N., Ohba, H. y Nasu, M. (2006). Simple detection of small amounts of Pseudomonas cells in milk by using a microfluidic device. Letters in Applied Microbiology 43, 631-636. [ Links ]














