Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.1 Ciudad de México Abr. 2012
Ingeniería de procesos
Optimización del proceso de fermentación para la producción de tequila, utilizando la metodología de superficie de respuesta (msr)
Optimization of fermentation process for tequila production using response surface methodology (rsm)
P. Téllez-Mora1,2*, F. A. Peraza-Luna2, A. Feria-Velasco3 e I. Andrade-González1
1 Instituto Tecnológico de Tlajomulco, Jalisco, km 10 Carr. San Miguel Cuyutlán; Tlajomulco de Zuñiga, Jal. CP 45640. México.*Autora para la correspondencia. E-mail: patyte16@yahoo.com.mx Tel. y Fax 52 (33)3772 4426
2 Instituto Tecnológico de Tizimín, km3.5 Carr. final aeropuerto Cupul a Tizimin s/n CP 97900. Yucatán México.
3 Universidad de Guadalajara, Zapopan Jalisco. México.
Recibido 9 de Septiembre 2011
Aceptado 23 de Enero 2012
Resumen
El objetivo del trabajo fue optimizar las concentraciones de azúcar, nitrógeno y fósforo del medio, para incrementar la eficiencia en la producción y establecer la influencia de esos macronutrientes en los compuestos sensoriales indicados en la normatividad Mexicana (NOM -006-SCFI-2005). Se utilizaron dos cepas de levaduras Saccharomyces y dos tipos de mosto: 100% Agave y Mixto (Agave más sacarosa). En un principio se utilizó un diseño factorial (24-1). Variables a controlar: concentración de azúcar; nitrógeno y fósforo; y la temperatura. Variables de respuesta: Eficiencia de fermentación y las concentraciones de los compuestos indicados en la NOM. Por mínimos cuadrados se determinó la función objetivo para cada variable de respuesta con sus restricciones. Para una eficiencia de 94.58% (con una función deseable de 0.891312), el programa sugirio: mosto mixto (Agave y sacarosa), Saccharomyces THL 110; 8°Bx; 0.797979 g/l N; 0.376875 g/l P, y 40 °C.
Palabras clave: optimization, Saccharomyces, Agave (tequilana), fermentación, macronutrientes, tequila.
Abstract
The objective of this work was to optimize sugar concentrations, nitrogen and phosphorus in the medium, in order to increase the efficiency production, establishing the influence of these macronutrients in the flavor compounds listed in the Mexican legislation (NOM-006-SCFI-2005). It was used two strains of Saccharomyces yeasts and two types oO must: 100% Agave and mixeO Agave (.Agave plus sucrose). At first it was used a factorial design (24-1). Control variables: sugar concentration, nitrogen and phosphorus, and temperature. Response variables: fermentation efficiency and concentrations of the compounds listed in the NOM. The objective function was determined by minimum squarer for each response variable with its restrictions. For the efficiency of 94.58% (with a desirable function of 0.891312), the program suggested, mixed Agave (Agave and sucroee), Saccharomyces THL 110; 8°Bx; 0.797979 g /1 N; 0.376875 g / 1 P, and at 40 °C.
Keywords: optimization, Saccharomyces, Agave (tequilana), fermentation, macronutrients, tequila.
1 Introducción
En la industria del tequila, el proceso de fermentación es muy importante debido a que involucra biotransformación de azúcares en diversos alcoholes y compuestos aromáticos, que colaboran para dar a cada bebida su identidad distintiva en olor y sabor; por lo que el papel que desempeñan las levaduras es fundamental. Sin embargo la biosíntesis de alcoholes es influenciada por el tipo de cepas participantes, composición y concentración del medio y las condiciones de fermentación (Bohlscheid y col., 2007; Bely y col., 2003; Arrizon y Gschaedler, 2002; Pinal y col., 1997, Melero, 1992). Respecto a los microorganismos participantes, existen estudios sobre la sucesión de levaduras y bacterias durante la fermentación de mostos no estériles (Lachance, 1995; Rainieri y Pretorius, 2000). En el caso de la industria del tequila, el uso de mostos estériles incrementaría el costo, y una solución sería incrementar el volumen de inoculación con la levadura de interés. La principal ventaja de las fermentaciones con levaduras seleccionadas e inoculadas es que son fermentaciones más rápidas dando bebidas con una calidad más consistente (Shuang y Yan, 2010; Mills y col., 2002; Melero, 1992; Torrea y Azpilicueta, 2002; Bely y col., 2003).
En cuanto a la composición del medio y su concentración, particularmente en la producción de tequila, la cantidad de nitrógeno asimilable juega un papel importante en la duración y desarrollo del proceso, ya que además de influir en la velocidad de la fermentación el nitrógeno es precursor de algunos compuestos volátiles (Molina y col. 2007; Arrizón y Gschaedler, 2007; Bely y col., 2003; Torrea y Azpilicueta, 2002; Pinal y col., 1997; Albers y col., 1996). Su deficiencia causa aletargamiento o detención de la fermentación. Se ha reportado que cuando se trabaja con concentraciones elevadas de azúcar (mayor o igual a 180 g/L), el crecimiento y la viabilidad de la levadura decrece debido al stress osmótico y a la presencia de algunos inhibidores, tales como el etanol, CO2, ácidos grasos saturados de 6, 8 y 10 átomos de carbono y algunos pesticidas implicados en el cultivo agrícola, los cuales inhiben el transporte de azúcar (Muñoz e Ingledew, 1989). Esta inactivación suele presentarse en las levaduras carentes de amonio (Salmon, 1989, Wang y col. 2003; Bohlscheid y col., 2007). Para evitar estos problemas tecnológicos además de la adición de factores de supervivencia como el oxígeno, esterol y ácidos grasos insaturados, la utilización de nitrógeno asimilable en forma de sales de amonio o aminoácidos (ya sean solos o combinados) ha ofrecido buenos resultados durante la fermentación de mostos con nitrógeno limitado, ya que ayudan exitosamente a evitar este problema, que se ha reportado ser eficaz solo durante la fase temprana de crecimiento (Salmon, 1989, Muñoz e Ingledew, 1989; Arrizón y Gschaedler, 2002).
Dentro de las condiciones de cultivo, la temperatura es otro factor importante ya que afecta el metabolismo de la levadura y como resultado se obtiene la formación de metabolitos secundarios (como glicerol, ácido acético, acido succínico, alcoholes superiores) (Torija, M.J et al.,2003, Pinal y col., 1997); temperaturas altas (por arriba de los 20°C en el caso de los vinos y/ó producción de cerveza) favorecen la producción de alcoholes superiores, esteres y ácidos grasos, mientras que temperaturas entre los 5°C y los 15°C favorecen particularmente la producción de acetaldehído y diacetilo (Nevdovic V.A., 2006).
Una práctica común en la industria es la adición de una fuente de nitrógeno como medida previsora para favorecer el metabolismo de la levadura, en mostos donde se desconoce tanto la composición de los nutrientes como los requerimientos de la levadura, lo que causa u ocasiona un desequilibrio en el mosto y una generación de cambios en la composición final del producto, afectando con ello el rendimiento (baja producción de alcohol, con mayor cantidad utilizada de Agave) y la calidad (alterando la producción de compuestos sensoriales, generando compuestos no deseados) (Arellano y col., 2008). Según el Consejo Regulador del Tequila (CRT) (2005), las principales fuentes de nitrógeno que industrialmente se utilizan son sulfato de amonio, fosfato de amonio y urea, donde las concentraciones varían desde 0.1 hasta 1.0 g/L. El objetivo del presente trabajo fue optimizar las concentraciones de azúcar, nitrógeno y fósforo, en un mosto tequilero, para incrementar la eficiencia en la etapa de fermentación durante la producción de tequila, evaluando la biosíntesis de los compuestos indicados en la norma oficial que lo regula (NOM-006-SCFI-2005).
2 Materiales y métodos
2.1 Selección de cepa de levadura
Una etapa preliminar del trabajo fue la selección de las cepas, con este fin se trabajaron cuatro levaduras aisladas de mostos tequileros, caracterizadas en trabajos previos y propiedad de la empresa. Las cepas de Saccharomyces sp se identificaron como THL 013, THL 014, THL 018 y THL 110.
El criterio de selección se hizo considerando tres de los aspectos primordiales en esta industria: (1) eficiencia de la fermentación (respecto a la ecuación teórica del rendimiento máximo 0.511); (2) cumplimiento de los compuestos indicados en la normatividad mexicana (NOM 006 SCFI 2005) y (3) la generación de compuestos sensoriales de olor y sabor, evaluado mediante el panel de jueces de la empresa.
2.2 Cinéticas de fermentación
El medio utilizado en la selección se preparó con un lote de jugo de Agave y sacarosa (mosto mixto) a 10 °Brix, adicionado con 0.1 g/L de sulfato de amonio, Se utilizaron matraces erlenmeyer de 1L de capacidad con 750 ml del medio y se esterilizaron durante 10 min a 110°C. Cada matraz fue inoculado con 50 mL de la levadura correspondiente, crecida previamente durante 12 horas en un agitador orbital a 30 °C y 250 rpm. Los matraces se incubaron a 35°C por 72 h. Las determinaciones realizadas al inicio y final de la fermentación fueron: ARD, ART, población por cuenta directa al microscopio y riqueza alcohólica.
2.3 Análisis de concentración de alcohol y compuestos de NOM
Para la determinación de la riqueza alcohólica del mosto, en un microdestilador con recirculación de agua fría, se destilaron 5 mL del mosto a analizar, ajustado a 20°C se le adicionaron 3 mL de agua destilada y se recuperaron 5 mL del destilado a la misma temperatura de entrada, se le determinó la concentración de alcohol en el densímetro digital (DMA) (de acuerdo a la norma mexicana NMX -V - 013-Normex-2005) y de este destilado 2 mL se llevaron al cromatógrafo de gases para analizar los compuestos indicados en la norma mexicana NOM 006 SCFI 2005, de acuerdo al procedimiento indicado en NMX-V- 005-Normex-2005 y además, se determinó furfural mediante la técnica indicada en la norma NMX-V- 004-Normex-2005.
2.4 Evaluación sensorial
La evaluación sensorial, se realizó con una destilación simple, para obtener una muestra conocida como ordinario del medio final de la fermentación. Todo el ordinario se ajustó a una concentración de alcohol del 15% (v/v), mediante un calculo en la concentración final del grado alcoholico de cada uno de los mostos, empleando la formula V1C1=V2C2, donde V1 es el volumen del medio final de la fermentación; C1 grado alcoholico final de la muestra y C2, la concentración deseada de 15%, el V2, volumen a obtener para la muestra de ordinario. Posteriormente las muestras fueron analizadas por siete jueces entrenados en análisis de materia prima, mostos muertos (medio de fermentación al tiempo final), ordinarios y producto final (tequila). Mediante una prueba hedonica se asignaron valores desde 1 (desagrado total) hasta 7 (máximo agrado) dependiendo de la aceptación de cada persona. Los resultados de las calificaciones otorgadas se sometieron a un análisis de varianza bloqueando el efecto del juez.
Todos los ensayos realizados fueron por duplicado y los resultados se analizaron utilizando el paquete estadístico Statgrpahics plus.
2.5 Análisis de la etapa de fermentación
En esta etapa se utilizo un diseño estadístico factorial fraccionado 24-1, completamente al azar, manteniendo como bloque la levadura y el mosto por ser variables no continuas.
Las cepas de Saccharomyces sp utilizadas en la siguiente etapa fueron las identificadas como THL-018 y THL-110, en dos tipos de mostos de Agave: mixto y 100%, con la siguiente combinación:
a). THL 110 y mosto 100%
b). THL 110 y mosto mixto
c). Levadura THL 018 y mosto 100%
d). THL 018 y mosto mixto
Las variables independientes fueron la concentración de azúcar (azúcar) de 8 y 15 ºBrix; concentración de nitrógeno de acuerdo a la adición extra al mosto (N) de 0 y 0.5 g/L de nitrógeno; concentración de fósforo de acuerdo a la adición extra al mosto (P) de 0 y 0.3 g/L de fósforo y la temperatura (T) de 20°C y 40°C. Las variables de respuesta (dependientes) fueron: eficiencia de fermentación (%E) (respecto a la ecuación teórica de rendimiento maximo 0.511) y concentración de los compuestos indicados en la norma oficial del tequila (NOM-006-SCFI-2005).
Para evitar tener la influencia de la composición del medio en cada una de las cinéticas de fermentación del diseño estadístico, se realizó un lote con el medio basal preparado bajo las mismas condiciones tanto para los medios con mostos mixtos como para los de 100% Agave. Se trabajó con un lote de 55 L de jugo de Agave alto en °Brix (obtenido del primer molino), se separó una parte de este jugo a 20 °Brix, se llenaron 47 botellas de 1L con 750 ml de este medio (100% Agave).
Para las muestras de mosto mixto se tomó la otra parte del jugo a 20 ºBrix se hicieron los cálculos para tener una relación de 51% de los azúcares provenientes de Agave y el 49% de otros azúcares (sacarosa en este caso) considerando tener al final el ºBrix también de 20. Los frascos se esterilizaron 10 min a 110 ºC. Después que se enfriaron se llevaron a congelar hasta su uso. La formulación se realizó hasta su uso de acuerdo a la hoja de diseño.
Para la adición de las fuentes se prepararon soluciones concentradas y se esterilizaron por ultrafiltración. En la preparación de la solución concentrada de nitrógeno, se utilizó sulfato de amonio ((NH4)2SO4), se pesaron 118g de (NH4)2SO4 y se aforaron a 500ml con agua destilada. De esta solución se agregaron bajo condiciones estériles, en el momento de la formulación de los mostos a los frascos correspondientes, 28 ml de la solución, ofreciendo a cada medio enriquecido con éste compuesto, 2.36 g/L de (NH4)2SO4, correspondiendo a un concentración de 0.5 g/L de nitrógeno.
Como fuente de fósforo se utilizó el fosfato de potasio monobasico (KH2PO4). El nivel considerado para las muestras que incluían esta fuente fue de 0.3 g/L de P (es decir 1.32 g de (KH2PO4/ cada litro de medio). Para la solución concentrada, se pesaron 66g de fosfato de potasio monobásico y se aforaron a 500 ml. En cada frasco que llevara adición de fósforo se agregaron 28 ml de la solución concentrada estéril. Ambas soluciones se mantuvieron en refrigeración.
El volumen de trabajo para cada una de las corridas del diseño, fue de 2.8 L, ajustado con agua destilada estéril. Los ensayos se realizaron en frascos de vidrio con capacidad de 3L cada frasco, se inocularon con 20 ml de una suspensión de la respectiva levadura, ajustada a una población de 400 x 106 cel /ml. El tiempo de fermentación fue de 72 h tomando muestras cada 4 horas, para análisis de ARD, pH; riqueza alcoholica y compuestos de NOM 006 SCFI 2005. El volumen final de la fermentación que fue de 2.1L se utilizó para la obtención de muestras de tequila a nivel laboratorio.
2.6 Destilación de las muestras de fermentación
Al volumen final obtenido en la etapa de fermentación se le realizó una doble destilación para tener muestra de tequila.
Para este fin se utilizaron matraces de destilación de 1L, cada carga se realizó con 700 ml del medio final de la fermentación (conocido en la industria con el término de mosto muerto) se destiló a una temperatura de 90ºC y se retiraron los primeros 3.0 ml del condensado (fracción referida como "cabezas"). Por cada 700 ml de mosto muerto, se recuperaron 200 ml de ordinario (primera destilación), al ordinario se le determinó la riqueza alcohólica para establecer el volumen a recuperar en la segunda destilación. Los 600 ml de ordinario que se obtuvieron, se destilaron nuevamente a 90ºC, retirándose 3.0 ml y se recuperó el volumen de tequila que resultó después de determinar la riqueza alcohólica en los mostos ordinarios, dependiendo de las combinaciones y la concentración de alcohol en el mosto final, se realizaron los cálculos necesarios para tener una riqueza alcohólica no menor de 35% de alcohol en volumen (que es la mínima riqueza permitida en la NOM 006SCFI 2005).
A las muestras de tequila así obtenidas, se analizaron los compuestos de la norma oficial del tequila.
2.7 Optimización
La optimización del proceso se realizó utilizando la metodología de superficie de respuesta, empleando mínimos cuadrados con el paquete estadístico Statgraphics plus 4.0. La función objetivo general que se utilizó fue una de segundo orden, Ec. (1).

donde
Y= Variable de respuesta.
Xi y Xj = Variables independientes.
β0 = Coeficiente de intersección.
βi = Coeficiente lineal.
βii = Coeficiente cuadrático.
βij = Coeficiente de los productos cruzados.
ε = Error experimental aleatorio.
Se determinó la función objetivo para cada variable de respuesta (Eficiencia, metanol, alcoholes superiores, aldehídos, ésteres y furfural) y se realizó una optimización de respuesta múltiple tomando en cuenta la función objetivo, maximizando eficiencia con restricciones en metanol y alcoholes superiores principalmente, considerando los niveles máximos de cada uno de éstos parámetros indicados en la normatividad mexicana (NOM 006 SCFI 2005).
Por último se realizó una corrida confirmatoria con las condiciones sugeridas por el modelo, empleando del mismo lote de jugo de Agave.
El paquete estadístico utilizado fue el Statgraphics plus 4.0. Los análisis de varianza (ANOVA) realizados en todos los tratamientos se hicieron con un nivel de significancia del 0.05.
2.8 Técnicas analíticas
1 Determinación de etanol por densidad DMA (NMX - V - 013-Normex-2005).
2 Determinación de azúcares reductores directos (ARD) y totales (ART), método de Fehling, y cromatografía líquida de alta resolución (HPLC) NMX-V- 006-Normex-2005.
3 Determinación de compuestos de Norma: Aldehídos, Esteres, Metanol; Alcoholes Superiores: Norma Mexicana, NMX-V- 005- Normex-2005 y Furfural: NMX-V- 004-Normex-2005.
4 Determinación de fósforo en mostos de Agave (AOAC, 1990).
5 Determinación de nitrógeno amoniacal en mostos fermentados (método de Nessler. 2800 Spectrophotometer Procedure Manual Hach. 8038 EPA).
3 Resultados y discusión
3.1 Selección de cepas
Los resultados de la selección de las cepas, tanto de la eficiencia de la fermentación alcoholica como de la producción de los compuestos sensoriales de Norma, se presentan en la Tabla 1. La primera columna corresponde a los resultados de la eficiencia (%E), la cepa THL 110 fue la que presentó los valores más bajos, con un valor promedio de 78 %E (±4). Las otras tres cepas mostraron valores muy semejantes, con promedio 88 %E (±4.0), por lo tanto daría lo mismo utilizar la THL 013, 014 o 018. Sobre los compuestos volátiles regulados en la normatividad mexicana (NOM 006-SCFI-2005), en la misma tabla 1, se puede observar que la cepa THL 018 presentó los valores más bajos respecto a la concentración de metanol (96.46 mg/100ml de alcohol anhidro) y alcoholes superiores (216.09 mg/100ml de alcohol anhidro); sin embargo el análisis de varianza realizado entre las cepas indicó que solamente la biosíntesis de alcoholes superiores fue estadísticamente significativa ( p < 0. 05). Como se ha visto en otros trabajos realizados con vinos las cepas aún proviniendo de la misma especie han presentado diferencias respecto a su metabolismo (Shuang y Yan, 2010; Gschaedler y col., 2004; Vilanova y Massneuf-Pomarede, 2005; Rainieri y Pretorius 2000). Otro punto muy importante que se debe considerar en la industria de bebidas alcoholicas es el aspecto sensorial de la bebida, ya que sera un factor determinante en la aceptación o rechazo por parte del consumidor.
Respecto a la evaluación sensorial de la bebida, es importante hacer notar que las calificaciones otorgadas por los jueces al producto evaluado fueron más bajas que cuando se trabaja con el tequila (que es el ordinario rectificado), ya que el ordinario difiere del tequila en la concentración de los componentes mayoritarios que son los compuestos de norma; acetaldehído, acetato de etilo, lactato de etilo, los alcoholes superiores como el isoamílico, isobutílico, n-propanol y el fenetílico, entre otros más y los minoritarios como el eugenol, tymol, hexanoato de etilo, metil furfural, etc. (Escalona y col., 2004; Prado Ramírez, 2004). La concentración de estos productos variará dependiendo si se habla de un ordinario ó un rectificado (tequila).
En la Fig. 1 se presentan los resultados del ANOVA realizado a la preferencia del panel de jueces, por los productos fermentados con las cuatro cepas de levaduras. El unico producto que fue estadísticamente diferente (con valor p < 0.05), fue el de la cepa THL 014 respecto al proveniente de la cepa THL 018. Entre los productos provenientes de las cepas THL 110; 013y018nose encontraron diferencias significativas. El producto proveniente de la cepa THL 018 fue el que presento el valor maximo de aceptación (el valor asignado por los jueces fue de 4.8) y el que menos gustó fue el proveniente de la cepa THL 014 (con un valor mínimo de 2.1).

Con los resultados obtenidos hasta este momento, se decidió trabajar con las cepas THL 018 y la THL 110. La cepa THL 018 porque fue una de las que presento los resultados mas elevados en eficiencia de la fermentación alcohólica (87% E); la única que presentó los valores más bajos de alcoholes superiores (216.09 mg/100 ml de alcohol anhidro) y el producto (ordinario) obtenido con esta levadura fue el que tuvo la aceptación más alta con los jueces (4.8).
La cepa THL 110 se eligió por presentar los valores de eficiencia mas bajos (81.4%); su producción de alcoholes superiores junto con la THL 013 y 014 estuvo dentro de norma (319.61 mg/100 ml de alcohol anhidro) y el producto proveniente de esta cepa también tuvo buena aceptación por el panel de jueces (el valor asignado fue de 4.0).
Con los resultados se ratifica la importancia de seleccionar levaduras locales (Arellano y col., 2008; Vilanova y Massneuf-Pomarede, 2005; Morata y col., 2003); y una vez seleccionadas es importante conocer las necesidades de cada cepa para poderlas manipular de forma favorable en la industria.
3.2 Evaluación de la fermentación
Después de la selección de las cepas de levadura, se trabajaron con dos tipos de mostos para las cepas seleccionadas, dando 4 bloques, como se describieron en la sección de materiales y métodos.
La primer observación realizada en los cuatro bloques fue que tanto el tipo de mosto (mixto y 100% Agave) como la levadura empleada, influyeron sobre la eficiencia de la fermentación. Los resultados de los valores-P para cada uno de los bloques se presentan en la Tabla 2. La principal diferencia en la composición de los mostos fueron las fuentes de azúcares. La composición en el 100% Agave, estuvo constituida básicamente de: inulina (7.93%) y fructosa (82.65%); mientras que los mostos mixtos estuvieron constituidos de: sacarosa (42.42%); y fructosa (50.12%). Siendo la concentración de fructosa, el carbohidrato predominante en ambos mostos.

En aquellos donde se trabajo con mosto mixto se presentaron las eficiencias mas altas, obteniendose valores entre el 90 y 94%, mientras que en los medios con 100% Agave los mas altos estuvieron entre 80 y 82%, como se ha reportado en otros trabajos realizados con la elaboración de vinos, el medio de fermentación y las cepas de levaduras, especialmente Saccharomyces presentaron diferencias en la composición de los constituyentes de los vinos y eficiencias variadas (Shuang y Yan, 2010; Inei y col., 2009; Morata y col., 2003).
En cuanto a la influencia de las interacciones posibles y de los factores sobre la variable de respuesta (%E), la cepa THL 018 presento mucha similitud en ambos mostos: 100% Agave y mixto (Tabla 2), excepto la concentración de fósforo (P) que influyo en el mosto 100% y no en el mixto. La Temperatura (T) mostro influencia en el mosto mixto y no en el 100% Agave.
Respecto a la cepa THL 110, no hubo similitud con ninguín factor en ambos mostos, sólo fueron estadísticamente significativos en el medio 100% Agave, el contenido de nitrógeno (N) y la interacción azúcar-fósforo (AC); mientras que en el mosto mixto el unico factor que influyo fue la Temperatura (T) (Tabla 2).
En los medios 100% Agave, los factores que influyeron sobre la eficiencia en ambas cepas fueron N y las interacciones azúcar (A) - Concentración de fósforo (P), que fueron los únicos factores para la cepa THL 110; mientras que para la cepa THL 018 además de los ya mencionados influyeron azúcar(A), Concentración de fósforo (P) y las interacciones Azúcar-N y Azúcar-T. En mosto mixto el único factor común en ambas cepas fue T, que fue el único en la cepa THL 110 y para la cepa THL 018 además los factores Azúcar y N las interacciones Azúcar-P, Azúcar-N, Azúcar-T, estos resultados se resumen en la Tabla 2.
La influencia del nitrógeno sobre el medio de fermentación ha sido reportada en varios aspectos del metabolismo de la levadura (Inei y col., 2009; Bohscheid y col., 2007; Arrizón y col., 2006; Wang y col., 2003; Moreira y col., 2002; Albers y col., 1996; Kolothumannil y col., 1990) Así como la relación fuente de Carbono-Nitrógeno que ha sido reportada como influyente en cepas evaluadas sobre la producción de alcoholes superiores (Bely y col., 2003; Pinal y col., 1997), todos los resultados aquí obtenidos. Así como las interacciones del nitrógeno con otros factores demuestran su importancia en el medio de fermentación.
La adición de Fósforo (P) al medio de fermentación, mostró influencia estadísticamente significativa sobre la respuesta (%E), en la levadura THL 018 en el mosto 100% Agave, (Tabla 2). Sin embargo las interacciones de los otros factores con el fósforo fue determinante y afecto la eficiencia de la fermentación, a excepción de la interacción Nitrógeno-Fosforo en la cepa THL 110 en mosto mixto donde no mostró ser influyente estadísticamente sobre la respuesta evaluada (%E). Esto indica que la adición del fósforo no es necesaria en la formulación de los mostos, ya que éstos tienen una concentración inicial de 0.1 g/L de fósforo como fosfato sugiriendo que esta concentración es suficiente para que la levadura realice el metabolismo. El efecto de la Temperatura (T) no mostró ser importante con la levadura THL 018 en mosto 100% Agave, sin embargo la mayoría de las interacciones con este factor influyo en la respuesta (%E). Como lo ha reportado Flores y col. (2005), en estudios sobre vinos, el valor óptimo dependerá de la cepa, algunas a temperaturas muy elevadas pueden romper las enzimas de membrana ocasionando una interrupción de la fermentación. Otros autores reportan la resistencia que presentan algunas cepas a temperaturas de 42ºC a 45 ºC (Ballesteros y col., 1991, Kar y col., 1985; Kelsall, 2003). Esta resistencia a temperaturas más altas por parte de las dos cepas en el medio 100% Agave, puede ser debido a la presencia componentes encontrados en este medio que provienen del Agave, como ácidos grasos.
La tolerancia a temperaturas elevadas sea de crecimiento ó fermentación, dependerá de la cepa y de la concentración de alcohol intracelular ya que se produce más rápidamente de lo que puede ser transportado hacia el exterior (Jones y col., 1981); así mismo se habla sobre la alteración de la síntesis de esterol y de ácidos grasos, sobre todo en la etapa de crecimiento, ya que las células de levaduras pueden presentar gran número de mutantes "petit", que son celulas que han perdido su capacidad respiratoria, y que presentan un reducido rendimiento del producto, debido a un requerimiento elevado de mantenimiento (Jones y col., 1981). En el presente trabajo las levaduras se crecieron a 30 ºC, que ha sido reportada en trabajos con medio de Agave (Arrizón and Gschaedler 2002 y 2007).
3.3 Optimización
Dentro de los compuestos que están regulados por la normatividad mexicana (NOM - 006 - SFCI - 2005), los que generalmente suelen representar un problema para los productores de tequila son la presencia de Metanol (sobre todo para quienes formulan 100% Agave) y Alcoholes Superiores. Por tal razón para la etapa de optimización además de estos dos grupos, también se consideró la concentración de ésteres. La presencia de aldehídos y furfural no representaron ningun problema debido a que sus concentraciones en todos los tratamientos cumplieron perfectamente con la normatividad.
Con los resultados previos al estudio, se procedió a optimizar las condiciones de operación para cada uno de los bloques evaluados. Los coeficientes de las funciones objetivo obtenidos para cada bloque se presentan en la Tabla 3. El procedimiento para la optimización multi-respuesta fue siempre considerando la normatividad del tequila como restricciones, buscando el valor más alto en la eficiencia de la fermentación alcoholica y minimizando la concentración de ésteres; metanol y alcoholes superiores; a excepción del bloque correspondiente a la levadura THL 110 en mosto 100% Agave, donde el nivel de metanol se mantuvo en 200 mg/100 ml de alcohol anhidro; se consideró éste valor porque suele ser un valor promedio para el tequila 100% Agave y que además cumple perfectamente con la normatividad. La eficiencia se realizó maximizando la función "deseabilidad", cuyo valor maximo es 1.0, cuando la función de deseabilidad tiene un valor de 0.0, indica que no hay conformidad con el objetivo deseado y cuando la deseabilidad alcanza el valor de 1.0, indica que tiene conformidad total en los cuatro factores optimizados.
También se determinó que la cepa THL 018 presentó los valores más altos de ésteres, debido a la influencia de cada cepa de levadura sobre la biosíntesis de este compuesto (Arellano y col., 2008; Fraile y col., 2000). Además se determinó que el tipo de mosto también influyo, ya que las concentraciones de ésteres más altas, se reportaron en mostos mixtos, como lo reportado por Da Porto (2002), donde sus trabajos también relacionan los mostos de vino, con la variación en el contenido en ésteres dependiendo del tipo de uva empleada.
En la Fig. 2 se presentan las graficas de superficie de respuesta, con la interacción azúcar-nitrógeno. En cada una de ellas se mantiene el fósforo y la temperatura en sus niveles óptimos. Se puede observar la importancia de la presencia de la fuente de nitrógeno, así como el factor temperatura, en todos los casos para obtener los mejores resultados se sugirió trabajarla en los niveles altos. Respecto a la concentración de azuícar, también se sugiere trabajar niveles altos en el medio, a excepción de la cepa THL 110 en mosto mixto, donde se obtienen las mejores respuestas con el nivel bajo (8°Bx).
En la Tabla 4 se presentan los resultados de la optimización multi-respuesta, así como los valores óptimos para cada uno de los factores a controlar y los valores estimados de cada respuesta en cada uno de los bloques de estudio. Las unidades para los parámetros de metanol; alcoholes superiores y ésteres están dadas en mg/100 ml de alcohol anhidro. Se puede también observar que la cepa que presenta los mejores resultados en cuanto a eficiencia de la fermentación, es la cepa THL 110.
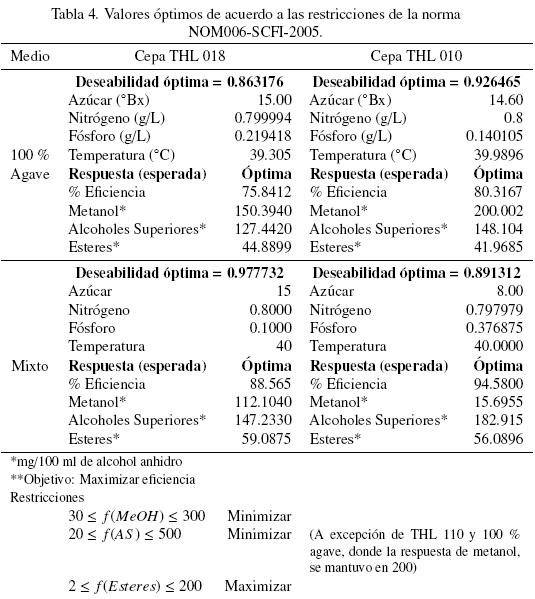
En el caso de la cepa THL 110 y mosto 100% Agave, el programa sugirió trabajar con una concentración de azúcar de 14.6 ºBrix; nitrógeno 0.8 g/L; fósforo 0.140105 g/L y a una Temperatura de 39.9896 ºC para tener la respuesta máxima en eficiencia de fermentación de 80.3167% respecto a la ecuación teórica máxima.
En el caso de la cepa THL 110 y mosto mixto, que corresponde a la eficiencia mas alta bajo las condiciones evaluadas (94.58%), el programa sugirió trabajar con una concentración de azúcar de 8.0 ºBrix; nitrógeno 0. 797979 g/L; fósforo 0.376875 g/L y a una temperatura de 40 ºC (Tabla 4).
Con las condiciones sugeridas por el programa, se realizó una corrida de validación para las eficiencias más altas, tanto para trabajar con mosto mixto (en la producción de tequila) como para cuando se trabaje con mosto 100% Agave. La levadura que se utilizó en ambos casos fue la cepa THL 110. Los resultados de las cineticas de fermentación, para la validación de los resultados se presentan en la Fig. 3.
Respecto a la producción de los compuestos sensoriales de norma, se puede observar una diferencia significativa del metanol en los mostos 100% Agave respecto a ios mostos mixtos, una de las principales razones de la presencia de este compuesto en el tequila, radica principalmente en la concentración de Agave que se utiliza en la elaboración de la bebida. Como se puede observar las variaciones entre lo predicho y lo validado en forma experimental fueron muy semejantes (Tabla 5).

Conclusión
Las cepas THL 013. THL 014 y THL018, no mostraron una diferencia estadística cuyos valores de eficiencia fueron muy semejantes, con un valor promedio de 88%. Mientras que la cepa THL 110, fue la que presento el valor mas bajo (77.9%) y fue diferente estadísticamente al resto de las cepas.
Las condiciones óptimas para la cepa THL 018 en medio 100% Agave: 15°Brix; nitrógeno, 0.799994 g/L; Fosforo, 0.219418 g/L y una temperatura de 39.305°C. Para mosto mixto: 15°Brix; nitrógeno, 0.8 g/L Fosforo, 0.1 g/L y una temperatura de 40°C. Para la cepa THL 110 en mosto 100% Agave: 14.6°Brix; nitrógeno, 0.8 g/L Fosforo, 0.140105 g/L y una temperatura de 39.9896°C y finalmente para mosto mixto: 8°Brix; Nitrógeno, 0.797979 g/L Fósforo, 0.376875 g/L y una temperatura de 40°C.
Respecto a la validación del programa los resultados estimados y los obtenidos experimentalmente, no presentaron diferencias estadísticamente significativas, indicando que hay una igualdad entre ellos y por consiguiente validando las ecuaciones y valores de optimización.
La cepa THL 110 en la etapa de selección de levaduras fue la que presentó los valores en fermentación mas bajos (78% E), sin embargo después de la etapa de optimización fue la cepa de levadura que presentó los valores más altos en ambos medios, en mixto la eficiencia fue de 94.5 (91) % y en 100% Agave fue 80.3 (80.6)%. La cepa THL 018, mantuvo su eficiencia con un promedio de 87%. Se logro incrementar la eficiencia con la cepa THL 110 en un 4% en mosto 100% Agave y un 17% en mosto mixto.
Agradecimientos
Los autores agradecen todas las facilidades y apoyo técnico del M.C. Miguel Cedeño Cruz y la Dra. Aideé Orozco, a través de Casa Herradura. De la misma forma se agradece el apoyo económico de CoSDAC.
Nomenclatura
x variables independientes
Y variable de respuesta
Símbolos griegos
β coeficientes de las funciones objetivo
ε error
Referencias
Albers, E., Larsson, C., Liden, G., Niklasson, C. y Gustafsson, L. (1996). Influence of the nitrogen source on Saccharomyces cerevisiae. Anaerobic growth and product formation. Applied and Environmental Microbiology 62, 3187 - 3195. [ Links ]
Arellano, M., Pelayo, C., Ramírez, J. y Rodríguez, I. (2008). Characterization of kinetic parameters and the formation of volatile compounds during the tequila fermentation by wild yeast isolated from Agave juice. Journal of Industrial Microbiology Biotechnology 35, 835-841. [ Links ]
Arrizón, J., Fiorce, C., Acosta, G., Romano, P. y Gschaedler, A. (2006). Fermentation behaviour and volatile compound production by Agave and grape must yeasts in high sugar Agave tequilana and grape must fermentations. Antonie Van Leeuwenhoek 89, 181-189. [ Links ]
Arrizón, J. y Gschaedler, A. (2002). Increasing fermentation efficiency at high sugar concentrations by supplementing an additional source of nitrogen during the exponential phase of the tequila fermentation process. Canadian Journal of Microbiology 48, 965-970. [ Links ]
Arrizón, J. y Gschaedler, A. (2007). Effects of the addition of different nitrogen sources in the tequila fermentation process at high sugar concentration. Journal ofApplied Microbiology 102, 1123-1131. [ Links ]
Ballesteros, I., Ballesteros, M., Cabanas, A., Carrasco, J., Martín, M., Negro, J., Saez, F. y Saez, R. (1991). Selection of thermotolerant yeasts for simultaneous saccharification and fermentation (SSF) of cellulose to ethanol. Applied Biochemistry and Biotechnology 28, 307-332. [ Links ]
Bely, M., Rinaldi, A. y Doubourdieu, D. (2003). Influence on assimilable nitrogen on volatile acidity production by Saccharomyces cerevisiae during high sugar fermentation. Journal of Bioscience and Bioengineering 96, 507-512. [ Links ]
Blateyron, L. y Sablayrolles J.M. (2001). Stuck and slow fermentations in enology: statistical study of causes and effectiveness of combined additions of oxygen and diammonium phosphate. Journal of Bioscience and Bioengineering 91, 184-189. [ Links ]
Bohlscheid, J.C., Fellman, J.K., Wang, X.D., Ansen, D. y Edwards, C.G. (2007). The influence of nitrogen and biotin interactions in the performance of Saccharomyces in alcoholic fermentations. Journal of Applied Microbiology 102, 390-400. [ Links ]
Da Porto, C. (2002). Volatile composition of "grappa low wines" using different methods and conditions of storage on an industrial scale. International Journal of Food Science and Technology 37, 395-402. [ Links ]
Escalona, H.B., Villanueva, S.J., Lopez, J.E., González, R.M., Martín del Campo, T., Estarrón, M., Cosío, R. y Cantor, E. (2004). Calidad del tequila como producto terminado: normatividad. Composición volátil y la imagen sensorial. En: Ciencia y Tecnología del Tequila, avances y perspectivas (CIATEJ ed.) Pp. 174-256. [ Links ]
Flores, N., Martínez, R.A., Fernández, E., Gallegos, J.L., Díaz, M.I. y Vázquez S.R. (2005). Características fisicoquímicas en vinos tintos: Método tradicional y maceración carbónica empleando dos cepas de levadura Saccharomyces cerevisiae. Revista Mexicana de Ingeniería Química 4, 289-297. [ Links ]
Fraile, P., Garrido, J. y Ancín, C. (2000). Influence of a Saccharomyces cerevisiae selected strain in the volatile composition of rosé wines. Evolution during fermentation. Journal of Agricultural of Food Chemistry 48, 1789-1798. [ Links ]
Gschaedler, A., Ramírez, J., Díaz, D.M., Herrera, J.E., Arellano, M., Arrizon, J. y Pinal, L. (2004). Fermentación, etapa clave en la elaboración del tequila, En Ciencia y Tecnología del Tequila, avances y perspectivas (CIATEJ ed.) Pp. 631-20. [ Links ]
Inei, G., Velasco, H.A., Gutiérrez, G.F. y Hernández, H. (2009). Statistical aproach to optimization of etanol fermentation by Saccharomyces cerevisiae in the presence of VALFOR® 100 zeolite NAA. Revista Mexicana de Ingeniería Química 8, 265-270. [ Links ]
Jones, R.P., Pamment, N. y Greenfield, P.F. (1981). Alcohol fermentation by yeast - the effect of environmental and other variables. Process Biochemistry 16, 42-49. [ Links ]
Kar, R. y Laxmikanthrao, V. (1985). Ethanolic fermentation by thermotolerant yeast. Journal of Chemical Technology and Biotechnology 35B, 235-239. [ Links ]
Kelsall, D.R. y Lyons, P.T. (2003). Practical management of yeast: conversion of sugars to ethanol. En: The Alcohol Textbook 4th Edition. (Jackes, K.A., Lyons, P.T. y Kelsall, D.R ed.). Pp. 121-133. [ Links ]
Kolothumannil, C.T. e Ingledew, M. (1990). Fuel alcohol production: Effect of free amino nitrogen on fermentation of very-high-gravity wheat mashes. Applied and Environmental Microbiology 5, 2046-2050. [ Links ]
Lachance, M.A. (1995). Yeast communities in a natural tequila fermentation. Antonie van Leeuwenhoek 68, 151-160. [ Links ]
Melero, R. (1992). Fermentación controlada y selección de levaduras vínicas. Revista Española de Ciencia y Tecnología de Alimentos 32, 371 - 379. [ Links ]
Mills, D.A., Johannsen, E.A. y Cocolin, L. (2002). Yeast diversity and persistence in botrytis affected wine fermentations. Applied and Environmental Microbiology 68, 4884-4893. [ Links ]
Molina, J.A., Botello, J.E., Estrada, A., Navarrete, J.L, Jiménez, H., Cárdenas, M. y Rico, R. (2007). Compuestos volátiles en el mezcal. Revista Mexicana de Ingeniería Química 6, 41-50. [ Links ]
Morata, A., Gómez, M.C., Colombo, B. y Suárez J. A. (2003). Piruvic acid and acetaldehyde production by different strains of Saccharomyces cerevisiae: relationship with Vitisin A and B, formation in red wines. Journal of Agricultural and Food Chemistry 51, 7402-7409. [ Links ]
Moreira, N., Mendes, F., Pereira, O., De Pinho, P.G., Hogg, T. y Vasconcelos, I. (2002). Volatile sulphur compounds in wines related to yeast metabolism and nitrogen composition of grape musts. Analytica Chimica Acta 458, 157-167. [ Links ]
Munoz, E. e Ingledew, W. M. (1989). Effect of yeast hulls on stuck and sluggish wine fermentations: Importance of the lipid component. Applied and Environmental Microbiology 55, 1560-1564. [ Links ]
Norma Mexicana, NMX-V-013-NORMEX - 2005. Bebidas alcohólicas. Determinación del contenido alcoholico (% alcohol en volumen a 293 K, 20°C). Metodo de ensayo (prueba), 2005. [ Links ]
Norma Mexicana, NMX-V-005 NORMEX-2005. Bebidas alcohólicas. Determinación de aldehídos, ésteres, metanol y alcoholes superiores. Método de ensayo (prueba), 2005. [ Links ]
Norma Mexicana. NMX-V-006 NORMEX- 2005. Determinación de azúcares reductores directos y totales (Inulina, glucosa, fructosa y sacarosa) método por cromatografía de líquidos de alta resolución. En: Bebidas alcohólicas. Determinación de Azúcares Reductores Directos y Totales. Método de ensayo (prueba), 2005. [ Links ]
Norma Oficial Mexicana, (NOM) 006-SCFI-2005. Bebidas Alcoholicas-Tequila especificaciones. Secofi. Diario Oficial de la Federación 6 de enero de 2006. [ Links ]
Pinal, L., Cedeño, M., Gutiérrez, H. y Álvarez, J. (1997). Fermentation parameters influencing higher alcohol production in the tequila process. Biotechnology Letters 19, 45-47. [ Links ]
Prado, R.R. (2004). Destilación. En Ciencia y Tecnología del Tequila, avances y perspectivas (CIATEJ Ed.), 123-169. [ Links ]
Rainieri, S. y Pretorius I.S. (2000). Selection and improvement of wine yeasts. Annals of Microbiology 50, 15-31. [ Links ]
Salmon, J. M. (1989). Effect of sugar transport inactivation in Saccharomyces cerevisiae on sluggish and stuck enological fermentations. Applied and Environmental Microbiology 5, 953-958. [ Links ]
Shuang, C. y Yan, X. (2010). The influence of yeast strain on the volatile flavour compounds of Chinese rice wine. Journal of the Institute ofBrewing 116, 190-196. [ Links ]
Torija, M.J., Beltrán, G, Novo, M., Poblet, M., Rozes, N., Guillamon J.M. y Mas A. (2003). Effect of the nitrogen source on the fatty acid composition of Saccharomyces cerevisiae, Food Microbiology 20, 255-258. [ Links ]
Torrea, G.D. y Ancín, A. C. (2002). Nitrogen metabolism in Chardonnay musts inoculated with killer strains of Saccharomyces cerevisiae. Journal of Bioscience and Bioengineering 94, 15-22. [ Links ]
Walker, G.M. (2000). Yeast cytology. En: Yeast Physiology and Biotechnology. (John Wiley & Sons) Cap. 2, pp. 11-42. [ Links ]
Wang, X. D., Bohlscheid, J.C. y Edwards, C.G. (2003). Fermentative activity and production of volatile compounds by Saccharomyces grown in synthetic grape juice media deficient in assimilable nitrogen and/or pantothenic acid. Journal of Applied Microbiology 94, 349-359. [ Links ]














