Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.1 Ciudad de México Abr. 2012
Biotecnología
Revisión: Aplicaciones ambientales de microorganismos inmovilizados
Review article: Environmental applications of immobilized microorganisms
M.A. Martínez-Trujillo y M. García-Rivero*
Tecnológico de Estudios Superiores de Ecatepec, Laboratorio de Catálisis Enzimática, División de Ciencias Químicas y Bioquímicas, Av. Tecnológico s/n, Col. Valle de Anáhuac, C.P. 55210, Ecatepec de Morelos, Edo. de México, México.*Autora para la correspondencia. E-mail: mgarcia@tese.edu.mx Tel. 50-00-23-00, Fax 50-00-23-00 ext. 2304
Recibido 30 de Agosto 2011
Aceptado 16 de Diciembre 2011
Resumen
El uso de células inmovilizadas en el área ambiental ha sido poco explotado, a pesar de que se reconoce su potencial en la biodegradación de contaminantes debido al incremento en la estabilidad de las células y la tolerancia ante ciertos compuestos tóxicos. Los ensayos de biodegradación de contaminantes orgánicos se han realizado principalmente en medio líquido, y son escasos los ensayos de biodegradación de contaminantes en suelos, es por esto que el interés del presente trabajo se centro en revisar el estado del arte de la uso de microorganismos inmovilizados para la degradación de contaminantes orgánicos en suelos. Se hace una revisión de los soportes comúnmente usados en la inmovilización de microorganismos para fines ambientales, así como de los diferentes enfoques que se han trabajado, para así identificar posibles áreas de oportunidad para futuras investigaciones.
Palabras clave: contaminantes orgánicos, suelos, soportes, degradación, bacteria, hongos.
Abstract
The use of immobilized cells in the environmental field has been slight explored despite recognizing its potential in contaminant biodegradation due to increased tolerance to toxic compounds and the stability of the cells. The biodegradation assays of organic contaminants have been carried out mainly in liquid medium and there are few assays in soil, therefore the interest of this work focuses on reviewing the state of the art of using immobilized cells for degradation of organic pollutants in soils. Some advantages of support used in the immobilization of microorganisms for environmental purposes as well as the different approaches that have worked to identify potential areas of opportunity are also discussed.
Keywords: organic contaminants, soils, supports, degradation, bacteria, fungi.
1 Introducción
En los últimos años la biotecnología ha tenido importantes avances en su aplicación en procesos industriales para la obtención de productos químicos, alimentarios y farmacéuticos, así como en el área ambiental. Una gran variedad de procesos industriales son llevados a cabo mediante el uso de células inmovilizadas, en los cuales se han producido compuestos tales como aminoacidos, ácidos orgánicos, antibióticos, esteroides y enzimas (Najafpom\ 2007; Linhardt y col., 1987). Entre las técnicas de inmovilización de ceiulas que se conocen, la adsorción y el atrapamiento en la matriz de un soporte polimérico sin duda son las más utilizadas. En la inmovilización por adsorción los microorganismos se unen al soporte por interacciones iónicas, que preferentemente deben ser materiales con grandes superficies, tales como el carbon activado (Ehrdardt y Rehm, 1985) o resinas de intercambio ionico (Jack y Zajic, 1977). La técnica de atrapamiento es aplicable a diversos microorganismos y en esta se utiliza gelatina, agar, gel de poliacrilamida, alginato de calcio, carragenina, quitosano, alcohol polivinilico o sol-gel como materiales para la formación de la matriz (Najafpour, 2007). Otros materiales comúnmente usados como soporte para la inmovilización son los residuos lignocelulósicos, cuya ventaja adicional radica en la producción de azúcares durante su hidrólisis, lo que a su vez minimiza la generación de desechos (Zhang y col., 2009).
Aunque actualmente los estudios respecto a la inmovilización se están enfocando en superar algunas limitaciones técnicas observadas durante el proceso de inmovilización y en la búsqueda de soportes de bajo costo, se tienen logros importantes en el incremento de la producción de metabolitos y en la vida media de las células. Así, el interés sobre los sistemas inmovilizados ha sido creciente debido a las numerosas ventajas que estos ofrecen, ya que permiten acortar el tiempo del proceso de fermentación, incrementar la productividad, facilitar los procesos de separación de productos y minimizar los costos de producción (Najafpour, 2007). Una descripción detallada de los aspectos fundamentales de la inmovilización de células se puede encontrar dentro del texto de "Biochemical Engineerig and Biotechnology" publicado por Najafpour (2007).
Por otra parte, las aplicaciones de la biotecnología para resolver problemas ambientales han permitido el desarrollo de diversas técnicas de biorremediación para suelos y aguas contaminadas, que se han basado de forma tradicional en el uso de microorganismos libres. Sin embargo la incorporación de microorganismos libres en los sistemas de tratamiento tiene ciertas limitaciones debidas a la toxicidad inherente de los contaminantes, así como a la competencia entre las poblaciones nativas y las exógenas (Fantroussi y Agathos, 2005). Una forma de salvar estas limitantes es a través del uso de microorganismos inmovilizados, ya que la inmovilización brinda a las células una protección contra el efecto tóxico de las sustancias presentes en el medio y a la depredación por parte de otras poblaciones (Mishra y col., 2001). Cuando se usan células inmovilizadas en procesos de remoción de contaminantes se logra incrementar la tasa global de biodegradación, debido a las altas densidades celulares que se alcanzan, además de incrementar la estabilidad y tolerancia de los microorganismos a los compuestos tóxicos (Godjevargova y col., 2003; Hanaki y col., 1994). Las células inmovilizadas como una alternativa tecnológica para aplicación ambiental se han usado en agricultura, biocontrol, aplicación de pesticidas, biodegradación de contaminantes en aguas subterráneas (Cassidy y col., 1996) y en aguas residuales de origen industrial (Nair y col., 2007), y en menor proporción en suelos. Sin embargo, la mayoría de las aplicaciones se han realizado a nivel de laboratorio.
El objetivo del presente artículo es revisar las aplicaciones de la inmovilización de diversas especies microbianas durante la biodegradación de contaminantes, con énfasis en la aplicación de esta tecnología para la biorremediación de suelos contaminados con compuestos orgánicos.
La información que aquí se presenta se ha organizado en cuatro secciones. En la primera, relacionada con el uso de microorganismos en la recuperación del ambiente, se analiza el uso de los sistemas inmovilizados a través de la tecnología de bioaumentación. El análisis de publicaciones relacionadas con el tema, permitio identificar a la supervivencia de la población microbiana introducida al suelo como una de las principales limitantes en el éxito de esta tecnología. Es así como el uso de microorganismos inmovilizados se convierte en una herramienta para incrementar la probabilidad de su establecimiento en el suelo. Una vez identificada la necesidad de incorporar microorganismos al suelo en forma inmovilizada se hace necesario conocer los tipos de soportes más usados (alginato de calcio, agar, poliuretano y el sol gel) y las cualidades que estos poseen, temas que se tratan en la segunda sección.
En la tercera sección se discute la aplicación de microorganismos inmovilizados en la degradación de contaminantes en sistemas líquidos. Se demuestra cómo el reconocido incremento en la resistencia a la toxicidad y concentración de los compuestos en la fase líquida cobra especial importancia en la degradación de contaminantes. Se revisan los aspectos cinéticos de la degradación de contaminantes, encontrándose que los modelos clásicos usados en cultivo líquido son adecuados para explicar el consumo de contaminantes, los efectos tóxicos e incluso el crecimiento que presentan los sistemas inmovilizados. Lo anterior se hace sin perder de vista que la actividad de las células inmovilizadas depende de las características de los sistemas microbianos y su interacción con el soporte.
En la última sección se hace una revisión del estado del arte de la aplicación de los microorganismos inmovilizados en el tratamiento de suelos contaminados. En general los reportes se refieren a trabajos realizados a nivel de laboratorio, en los que se han empleado preferentemente soportes convencionales en forma de mezclas que permiten lograr una mayor resistencia del soporte. Estos estudios han reiterado el incremento de la eficiencia de las células inmovilizadas en la remoción de contaminantes.
2 Los microorganismos en la recuperación del ambiente
La biodegradación de compuestos orgánicos, tales como hidrocarburos, insecticidas y plaguicidas, compuestos clorados y compuestos aromáticos, ha sido ampliamente estudiada a nivel de laboratorio y en estudios de campo. Dichos estudios han demostrado que la degradación microbiana de contaminantes en el ambiente es un proceso complejo, cuyos resultados cuantitativos y cualitativos dependen de factores abióticos y bióticos. Entre los primeros se deben enumerar a las condiciones ambientales locales como pH, temperatura y humedad, principalmente, además de la concentración y la disponibilidad del contaminante. Entre los factores bióticos son fundamentales la composición, la adaptabilidad y capacidad fisiológica de las poblaciones microbianas. En suma, esos resultados han permitido el desarrollo de las llamadas tecnologías de biorremediación (Boopathy, 2000).
En los últimos años, se ha desarrollado una amplia variedad de tecnologías de biorremediación, tanto in situ como ex situ. Esas tecnologías han sido diseñadas para lograr condiciones adecuadas de cultivo e incrementar la disponibilidad de los contaminantes y las poblaciones microbianas con reconocida capacidad de biodegradación. A ese respecto destaca la técnica de bioaumentación, que se refiere a la adición de microorganismos exógenos a un sistema para incrementar la tasa y alcance de la biodegradación. El éxito de la estrategia de bioaumentación está determinado por la interrelación del microorganismo inoculado con su nuevo ambiente biótico y los factores ambientales, en términos de su supervivencia y actividad de migración (Mrozik y Piotrowska-Seget, 2010). En un ambiente natural, la depredación por protozoarios o bacteriófagos, competencia con microorganismos autóctonos por nutrientes o aceptores de electrones y la presencia de raíces que liberan compuestos orgánicos, son elementos que afectan adversamente a la bioaumentación (Fantroussi y Agathos, 2005). Varias técnicas han sido empleadas para incrementar la probabilidad del establecimiento, eficacia y actividad de un inoculo introducido en un ambiente natural. Esas técnicas incluyen la inmovilización de microorganismos, el desarrollo de nichos que favorezcan el crecimiento del inóculo (inoculación en la rizosfera de una planta que es introducida en el sitio) y el uso de suelos activados (Mrozik y Piotrouska-Seget, 2010; Gentry y col. 2004a). Esta última se refiere a partículas de suelo que han sido expuestas al contaminante de interés y que actúan como soporte para el desarrollo de una población microbiana que puede eliminar un contaminante en particular (Barbeau y col., 1997). Cuando se opta por la inmovilización de microorganismos, los resultados obtenidos han demostrado que el soporte de inmovilización proporciona una efectiva protección al inóculo ante los microorganismos nativos. Adicionalmente, con la introducción de microorganismos inmovilizados se logra establecer micrositios con una población microbiana única que trabaja de forma interactiva en la remoción del compuesto de interés.
En relación al uso de suelos activados como ventajas potenciales se puede mencionar el uso de una población naturalmente desarrollada, que podría ser más efectiva que una población aislada, ya que al no haber sido cultivada fuera del suelo no pierde su habilidad para competir en el ambiente. Finalmente bajo las condiciones en las que se desarrolla la población microbiana durante los procesos de bioaumentación con suelos activados, sería posible incluir microorganismos degradadores no cultivables, que se pierden cuando se pretende aislar microorganismos de un sitio para llevarlos a otro (Gentry y col., 2004a). Una revisión más amplia de las técnicas que pueden incrementar la supervivencia de los microorganismos exógenos se presenta en el trabajo publicado por Gentry y col. (2004b). A partir de lo anterior, la siguiente sección se enfoca en la revisión de los diferentes soportes utilizados para la inmovilización de microorganismos con aplicación en el área ambiental, mencionando casos de aplicación, así como sus ventajas y desventajas.
3 Soportes usados para inmovilización de microorganismos útiles en el área ambiental
Un soporte adecuado para la inmovilización de microorganismos con aplicación en el área ambiental debe proporcionar condiciones apropiadas para la supervivencia de las células y su funcionamiento como inóculo, lo cual da como resultado una vida media suficientemente larga así como el mejoramiento de la supervivencia y de la actividad en el suelo. Se requiere que el soporte no sea tóxico, ni contaminante y que tenga una calidad constante, para permitir una liberación precisa de los microorganismos en el sitio de interés y eventualmente se evite la dispersión de los microorganismos (van Veen y col., 1997; Cassidy y col., 1996; Gentry y col., 2004b). Es importante aclarar que en la bioremediación de suelos contaminados una lenta liberación de los microorganismos inmovilizados puede ser ventajosa (Cassidy y col., 1996); en contraparte en los sistemas de tratamiento de aguas subterráneas o residuales contaminadas es importante mantener la estabilidad del soporte para evitar el incremento en la formación de lodos cuya disposición y tratamiento puede incidir en los costos del proceso de tratamiento del agua (Juárez-Ramírez y col., 2011).
Son diversos los materiales que se han usado como soporte para la inmovilización de microorganismos con fines ambientales, entre ellos se incluye biosólidos, suelos enmendados con carbón, arcilla, estiércol o turba. Debido a que dichos materiales presentan una gran variabilidad en su calidad y composición, se ha preferido el uso de polímeros naturales que forman matrices porosas tales como el alginato, la k-carragenina y el agar (van Veen y col., 1997) . Aunque los dos primeros son considerados como los más seguros y efectivos, el alginato de calcio y el agar son los que se han utilizado de manera más amplia. Entre los polímeros sintéticos que han sido usados como matrices para inmovilización con el objetivo de emplearlos en procesos de bioremediación se puede mencionar el poliuretano (Oh y col., 2000), el sol gel (Pannier y col., 2010; Rietti-Shati y col., 1996), poliacrilonitrilo (Yordanova, y col., 2009), poliacrilamida (Manohar y Karegoudar, 1998) y alcohol polivinilico (Chitiva y Dussan, 2003; Cunningham y col., 2004; Zhang y col., 2007).
Antes de analizar con detalle ejemplos específicos de la aplicación de sistemas biológicos inmovilizados en diversos procesos del área ambiental, es necesario revisar algunas características generales de los soportes que se utilizan con mayor frecuencia, lo que se hace en la siguiente sección.
3.1 Alginato de calcio
El alginato es un componente de la pared celular de las algas pardas, está formado por dos tipos de unidades monomericas: el acido β(1-4) D-manuronico y el acido α(1,4)-L-guluronico. Cuando el alginato es expuesto a la presencia de iones calcio se forma una red de entrecruzamiento con los polímeros del ácido gulurónico, que permite la inmovilización de células (Smidsrød y Skjak-Brka, 1990).
La inmovilización de microorganismos en alginato de calcio es el método más usado, debido a que en su preparación no se requieren condiciones de reacción extremas, es de bajo costo y de baja toxicidad (Sanjay y col., 2008; de-Bashan y Bashan, 2010). Ha sido considerado como un método promisorio para incrementar la degradación de compuestos tóxicos debido a que las células atrapadas en el interior de la matriz están protegidas contra ambientes adversos, lo cual no sucede cuando las células son retenidas en la superficie de un soporte. Adicionalmente, las células inmovilizadas son fácilmente liberadas al medio por la disolución del gel en presencia de agentes quelantes del calcio, tales como citrato de sodio y fosfato de potasio (Mohammad y Bustard, 2008), lo cual permite cuantificar la biomasa formada.
A pesar de sus características el uso del alginato de calcio se ha considerado adecuado solo para pruebas de laboratorio pero no para la aplicación en campo, debido a su baja resistencia mecánica, incompatibilidad con ciertos iones y su susceptibilidad a la biodegradación (de-Bashan y Bashan, 2010). No obstante, recientes investigaciones han sugerido que la resistencia mecánica de las perlas de alginato de calcio puede incrementarse mediante la adición de silica, logrando la inmovilización de células e incluso de biomoléculas (Coradin y col., 2003); Otra alternativa para el uso exitoso de perlas de alginato se ha logrado usando 4.9% de alginato y 4% de solución de estronio en sistemas marinos (Moreira y col., 2006).
En la práctica el alginato de calcio ha sido ampliablemente utilizado para el atrapamiento de enzimas y células usadas para la remoción de iones metálicos por absorción en la biomasa de algas (de-Bashan y Bashan, 2010) u hongos (Xiangliang y col., 2005); remoción de colorantes (Chen y Lin, 2007) y compuestos fenolicos (Dursun y Tepea, 2005), entre otros compuestos.
3.2 Agar
El agar es una mezcla de polisacaridos extraída a partir de diferentes especies de algas rojas, principalmente del genero Gracilaria. El polisacarido fundamental es la agarosa que posee propiedades gelificantes y tiene una estructura alternante de 3,6 anhidro-L-galactosa (3,6-AG) y D-galactosa.
El agar es ampliamente usado como aditivo alimenticio y en numerosas aplicaciones medicas, farmacéuticas y biotecnologicas (Pulz y Gross, 2004). Aunque típicamente se ha utilizado como agente gelificante en cultivos microbianos, su uso como soporte para inmovilización de células se ha extendido debido a su nula toxicidad y a las condiciones de reacción suaves que se requieren llevar a cabo la matriz de inmovilización. Entre otras ventajas, se puede mencionar la diversidad en la formación y licuefacción del gel, su estabilidad química y térmica, y su capacidad para el entrecruzamiento (Guiseley, 1989).
El agar se ha empleado exitosamente como soporte para preparar biosensores basados en microorganismos para detectar bifenilos, tiosulfunato y SDS en aguas contaminadas, y para la inmovilización de microorganismos usados en ensayos de biodegradación de nafatleno (Manohar y Karegoudar, 1998), fenol (Juárez-Ramírez y col., 2001) y 2,4-Dinitrofenol (Kitova y col., 2004), entre otros compuestos.
3.3 Poliuretano
El poliuretano es un polímero derivado de la condensación de poli-isocianatos y polialcoholes. Es químicamente inerte, completamente elástico y mecanicamente resistente a la abrasión. Una de las ventajas del poliuretano es su alta porosidad, que permite retener a las células sin limitaciones difusionales para el sustrato, el producto e incluso para el oxígeno (Manohar y col., 2001; Kadakol y col., 2010). Los compuestos contaminantes se pueden adsorber de forma reversible al poliuretano. En consecuencia en la fase líquida se establecen concentraciones por debajo del nivel de toxicidad, mientras que el compuesto se mantiene disponible para los microorganismos, y por tanto es posible el uso de una concentración inicial más alta a la que podría fijarse para un cultivo de células libres (O'Reilly y Crawford 1989b).
Entre otras cualidades el poliuretano es de fácil disponibilidad y manejo para la inmovilización de microorganismos, extremadamente versátil y de bajo costo, altamente estable y permite una mayor viabilidad de las células inmovilizadas durante varios usos, y dadas sus características se considera aplicable en la destoxificación de efluentes que contienen contaminantes orgánicos (Sharanagouda y Karegoudar, 2002; Tallur y col., 2009).
Los primeros trabajos de inmovilización en poliuretano emplearon prepolímeros a partir de los cuales se generó el poliuretano que contenía a las células inmovilizadas. Sin embargo, se tienen evidencias de que los grupos isocianato, producidos durante la polimerización de este soporte, pueden tener un efecto toxico sobre las células (Branyik y col., 2000), por lo que una práctica común ha sido el uso de polímeros prefabricados.
Algunas de las aplicaciones de microorganismos inmovilizados en espuma de poliuretano ha sido en la degradación de compuestos fenolicos (O'Reilly y Crawford, 1989b), 2-metilnaftaleno (Sharanagouda y Karegoudar, 2002) y carburan fenol (Kadakol y col., 2010), por citar algunos compuestos.
3.4 Matrices de silica gel
Las matrices de silica se forman por reacciones de hidrólisis y policondensación que ocurren en soluciones acuosas a temperatura ambiente, que generan una estructura porosa inorgánica cuando las células son adicionadas a una solución de silica prehidrolizada de tetraetoxisilicato o metoxisilicato (Bhatia y col., 2000).
La química sol-gel, basada en reacciones inorgánicas de polimerización, ha sido empleada en diferentes áreas de investigación, y debido a las condiciones en las cuales ocurre la reacción puede aplicarse para el atrapamiento de diferentes sistemas biológicos. La principales características de los materiales usados en los métodos sol-gel, y que los hacen adecuados para aplicaciones en biotecnología ambiental, son su bajo costo, su carácter hidrofílico y su resistencia al ataque microbiano (Bhatia y col., 2000); adicionalmente son químicamente inertes, presentan una alta estabilidad mecánica, térmica y no se disuelven en solventes orgánicos como ocurre con la mayoría de los polímeros orgánicos (Conroy y col., 2000; Nassif y col., 2003).
A pesar de sus características, una desventaja de las matrices de silica gel es que durante su formación por procesos convencionales, se generan matrices con una porosidad promedio menor al tamaño de las células comunes. A lo que se debe sumar la toxicidad de los alcoholes que se liberan (metanol o etanol) durante las reacciones de hidrólisis y condensación de alcoxidos de silicio Si(OCH3)4. Con la finalidad de proteger a las células de la toxicidad de los compuestos que se forman durante el proceso de inmovilización, se ha probado el uso de compuestos químicos que, entre otras características deseables, deben ser solubles en agua, biocompatibles y mantener la cohesión del gel (Nassif y col., 2003). El compuesto que mejores resultados ha proporcionado es el glicerol, que incluso puede tener un efecto en el tamaño del poro y en el área superficial del gel (Álvarez y col., 2009). Sin embargo, existen pocos estudios sobre el efecto de estos solutos compatibles sobre la estructura del gel y respecto a su función como una fuente de nutrientes para los microorganismos inmovilizados.
Recientemente el uso del sol-gel se ha orientado a la inmovilización de microorganismos para la elaboración de biosensores de contaminantes como el fenol (Branyik y Kuncova, 2000); la inmovilización de enzimas o péptidos para la detección de metales pesados (Bahrami y col., 2007) o compuestos organofosforados (Dosoretz y col., 1996); y la inmovilización de enzimas para la conversión oxidativa de compuestos en medios orgánicos (Li y Takahashi, 2000), que puede ser de especial interés en el desarrollo de biocatalizadores en el campo de la química verde. Otra aplicación ambiental del solgel, aunque no mediante el uso de microorganismos, fue la formación de películas con la incorporación de oxido de titanio, que fueron aplicadas en la remoción fotocatalítica de fenol en solución acuosa (Mediana-Valtierra y col., 2005).
En nuestro grupo de trabajo se han realizado varias pruebas para la inmovilización de hongos con algunos de los soportes mencionados. Al respecto, inmovilizamos en sol-gel pellets de Phanerochaetechrysosporium y Asperguillis niger que mantuvieron su actividad biológica y su capacidad para producir xilanasas; además de haber empezado los procesos de inmovilización de P. chrysosporium en alginato de calcio con miras para su empleo en la degradación de fenol, y tenemos un buen avance en los estudios de inmovilización de Trametes versicolor en poliuretano, con lo que se ha logrado la remoción de colorantes textiles. En la Fig. 1 se muestran algunas fotografías de los microorganismos con los que se ha trabajado.
En la siguiente sección se hace una revisión de procesos específicos donde se aplican los microorganismos inmovilizados en los diferentes soportes. A partir de lo anterior se analizan aspectos referentes a la resistencia que éstos ofrecen a los microorganismos con respecto a la toxicidad de los contaminantes, para concluir la revisión con el análisis de las cuestiones cinéticas y difusionales que se presentan en estos sistemas.
4 Los microorganismos inmovilizados en la degradación de contaminantes
Las aplicaciones de microorganismos inmovilizados en la degradación de contaminantes se han enfocado principalmente a estudios desarrollados en medios acuosos, que han demostrado que el material usado como soporte puede crear microhábitats de protección (en la superficie o poros del soporte), y funcionar como una fuente temporal de sustratos específicos para los microorganismos introducidos (Van Veen y col., 1997). Otra ventaja que puede listarse es la facilidad del manejo de las células inmovilizadas, que permite minimizar los riesgos de contaminación durante el transporte, aplicación y almacenamiento (Park y Chang, 2000).
En la década de los 80 s se dio inició a los estudios de aplicación de células inmovilizadas para la degradación de contaminantes. En la Tabla 1 puede observarse que los soportes de uso común son el alginato, el poliuretano y el agar, y en menor proporción el sol-gel. Es importante destacar que las bacterias son los microorganismos comúnmente empleados en los estudios realizados para degradación de compuestos tóxicos con microorganismos inmovilizados, al igual que sucede en los ensayos de biodegradación de contaminantes con células libres. Esto se explica debido a que el interés se ha centrado en el papel que juegan las bacterias del suelo en la degradación de los compuestos, y en consecuencia se tiene un amplio conocimiento sobre sus rutas metabólicas y las condiciones en las que éstas llevan a cabo el proceso. En contraparte, a pesar de que los hongos poseen también un alto potencial para la degradación de contaminantes poco se sabe sobre las enzimas y los mecanismos implicados en el proceso de biodegradación que llevan a cabo. Debido a lo anterior los estudios de biodegradación de contaminantes con hongos filamentosos inmovilizados son poco numerosos, a pesar de que el uso de estos microorganismos en la producción de enzimas de interés industrial ha sido exitoso. Por ende, podrían representar un área de oportunidad para futuras investigaciones.
4.1 Resistencia a la toxicidad
Una característica fundamental de los microorganismos inmovilizados es su mayor tolerancia a altas concentraciones de sustrato. Esta cualidad es de especial interés cuando se emplean compuestos contaminantes tóxicos. En este sentido, los primeros trabajos de aplicación de microorganismos inmovilizados en el área ambiental para degradar compuestos fenólicos, demostraron que la inmovilización confiere una mayor resistencia a los microorganismos, incluso a altas concentraciones del contaminante, que resultan tóxicas cuando el microorganismo está libre en la fase líquida. Sin embargo, la respuesta difiere en función del microorganismo usado. Por ejemplo Pseudomonas putida inmovilizada en alginato de calcio toleró hasta 3 g L-1 de fenol sin inhibición aparente, el doble de lo que las células libres pudieron soportar (Bettmann y Rehm, 1984). Sin embargo, una cepa de colección del mismo microorganismo fue capaz de tolerar solo 1.2 g L-1 de fenol cuando se inmovilizó en alginato de calcio (Hannaford y Kuek, 1999), comportamiento similar al demostrado por Escherichia coli inmovilizada, que se inhibio en concentraciones de fenol superiores a 1 g L-1 de fenol (Keweloh y col., 1989). En contraparte, en pruebas de remoción de 4-nitrofenol (50 mg L-1) por Corynebacterium sp, la protección por el soporte fue evidente a partir del segundo ciclo de reutilización, incluso las células mantuvieron su actividad biológica hasta por 10 ciclos (Kotoucková y col., 1997).
Si bien, la protección de las células inmovilizadas por el soporte es un hecho comprobado, una elevada porosidad del soporte puede permitir que el compuesto contaminante ejerza un efecto toxico similar al observado en un cultivo de células libres, como se reportó para la degradación de tricloroetileno por Bacillus sp inmovilizado en agar (Dey y Roy, 2009), o bien en el caso en el que el alginato de calcio cuando pierde estabilidad debido a la presencia de sales de fosfato en el medio (Mohammad y Bustard, 2008; Keweloh y col., 1989). Aunque esta limitante puede superarse usando una mayor concentración del soporte durante el proceso de inmovilización, se deben tener en cuenta las consecuentes limitaciones difusionales.
Por otra parte, se ha demostrado que la adsorción de los compuestos tóxicos en la matriz de inmovilización juega un papel importante en la reducción de la toxicidad de estos sobre el microorganismo. Se puede citar por ejemplo, la adsorción reversible del pentaclorofenol en poliuretano (O'reilly y Crawford, 1989b) o de fenol en quitosano (Annadurai y col., 2000), en los cuales fue posible mantener en la fase líquida concentraciones del compuesto menores al nivel tóxico. En el caso de los hidrocarburos del petróleo, se ha sugerido que el uso del poliuretano, que tiene una gran capacidad de absorción, presenta un alto potencial en la biorremediación de hidrocarburos en aguas superficiales. El poliuretano puede prevenir la migración de los productos que flotan en la superficie y la biodegradación por los microorganismos inmovilizados se puede llevar a cabo in situ o ex situ (Oh y col., 2000; Quek y col., 2006).
4.2 Estudios cinéticos y de difusión
La cinética de biodegradación de contaminantes por células inmovilizadas, tal como sucede en los cultivos desarrollados con células libres, es afectada por el pH, la temperatura y la concentración inicial de contaminante, pero los límites de tolerancia son mayores cuando los microorganismos están inmovilizados (Chung y col., 2003; Dursun y Tepea, 2005). Una alta concentración de sustrato inclusive puede tener un efecto positivo en la tasa de biodegradación. Por ejemplo, ensayos de biodegradación de fenol en un cultivo semicontinuo en un lecho fluidizado con C. tropicalis (Juárez-Ramírez y col., 2001) demostraron que en concentraciones superiores a 1000 mg L-1, la tasa de biodegradación de fenol por los microorganismos inmovilizados fue mayor a la de las células libres.
En la Tabla 2 se muestra una comparación de la tasa de degradación de diferentes contaminantes por sistemas microbianos diversos, tanto libres como inmovilizados en soportes como el agar, alginato y el poliuretano. En general, cuando se compara la tasa de degradación de fenol con células libres e inmovilizadas, se observa que a bajas concentraciones de contaminante sucede una cinética de primer orden, de manera tal que la tasa de degradación resulta mayor con las células libres que con las inmovilizadas. Sin embargo, a mayores concentraciones de contaminante este efecto es inverso, y las células inmovilizadas resultan mejores para la remoción. A ese respecto, como se señaló antes, los soportes usados para inmovilizar a las células pueden ejercer una cierta protección ante la toxicidad que les provoca el fenol, debido a que favorecen la formación de microcolonias dentro de los poros de los soportes, las cuales dificultan la difusión del contaminante dentro de los mismos (Cassidy y col., 1996); o bien puede suceder que la dificultad que encuentran los contaminantes para difundirse en el soporte modifique la concentración real de este a la que se enfrenta el microorganismo, disminuyendola, por lo que alcanzan de manera tardía la condición de saturación (Dwyer y col., 1986). Ambas hipótesis se refuerzan al analizar los casos donde se utilizan contaminantes mas tóxicos, como el carbofurano, el p-cresol o el 2-metilnaftaleno, en los que la tasa de degradación del contaminante por las células libres nunca fue mayor que la de las inmovilizadas, debido probablemente al efecto tóxico que ejercen estos compuestos per se. De hecho, cuando en estos casos se emplearon las mayores concentraciones del contaminante, se observó una considerable disminución de la velocidad de remoción por las células libres, en tanto que la de las células inmovilizadas se incrementó.
A partir de lo anterior, se esquematizó el mecanismo mediante el cual los contaminantes se difunden hasta llegar a las células inmovilizadas, para ser degradados mismo que se muestra en la Fig. 2. Este esquema parte del hecho de que generalmente los tratamientos para la degradación de un contaminante que se encuentra en fase líquida se efectúan en reactores mezclados, en consecuencia el mecanismo de transporte predominante es convectivo (paso 1) y por tanto no limitante. Debido a lo anterior, la biodegradación del contaminante estará solo limitada por la difusión del contaminante y del oxígeno dentro de la matriz del soporte (paso 2). Esto explica que en bajas concentraciones de contaminante dentro de la matriz del soporte exista en consecuencia una baja concentración y por tanto una baja tasa de degradación. Cuando la concentración en la fase líquida se incrementa de forma significativa entonces en el interior del soporte se alcanzaran también concentraciones mayores, pero sin llegar al nivel de toxicidad a la que se enfrentan las células libres.

En relación al análisis cinético de degradation de contaminantes por células inmovilizadas, se acostumbra tomar como base los modelos cinéticos que describen este proceso en cultivos con células libres. Por ejemplo, el consumo de oxígeno durante la oxidación de metano por Hansenula polymorpha fue explicado basándose en un modelo desarrollado para describir la cinética de difusión de oxígeno en un pellet fungico (Hiemstra y col., 1983). Así, se encontró que el coeficiente de difusión en la matriz de alginato de bario fue un 25% del valor reportado en agua, y que un incremento de la densidad celular en la matriz polimerica limita la difusión de oxígeno desde la fase líquida hacia el interior del gel, lo que finalmente influye en la velocidad de oxidación del metano por las células inmovilizadas. En un estudio similar, la oxidación de propeno por Mycobacterium inmovilizada en alginato de calcio fue explicada a partir del modelo de Michaelis-Menten suponiendo una cinética de pseudo-primer orden (dado que las concentraciones iniciales de sustrato fueron menores a las de la constante de saturación) y despreciando la inhibición por producto (Brink y Tramper, 1986). En ambos casos, se encontró que los datos predichos por el modelo se ajustan de forma adecuada a los datos experimentales, y que la principal resistencia a la transferencia de masa ocurre en los poros.
Cuando el sustrato tiene un fuerte efecto inhibitorio sobre el crecimiento microbiano se puede emplear el modelo de Haldane (Dwyer y col., 1986; Pallerla y Chambers, 1998; Dursun y Tepea, 2005). Sin embargo, la aplicabilidad de los modelos depende de las características particulares del sistema. En la biodegradación de fenol por P. putida inmovilizada en alginato de calcio, en una concentración de fenol superior a 750 ppm, se observo que el comportamiento de la reacción se desvía del modelo de MichaelisMenten, probablemente por efecto de la difusión intrapartícula (Bandhyopadhyay y col., 2001). Si bien el proceso global de biodegradación en un sistema inmovilizado está gobernado por la difusión intrapartícula y la reacción química (Chung y col., 2003), se ha identificado a la difusión intrapartícula como el paso limitante (Annadurai y col., 2000). De ahí que los modelos más acertados para describir las cinéticas de biodegradación deban considerar tanto el termino de reacción como el de la difusión, como es el modelo de reacción-difusión propuesto por Xiaoqiang y col. (2006) para describir la biodegradación de fenol por Alcaligenes faecalis inmovilizadas en poliuretano. Para una revisión detallada sobre los principios fundamentales de transferencia de masa en sistemas de células inmovilizadas se pueden consultar los trabajos relacionados con microorganismos de interés en la industria alimentaria (Raytchinova, 2011).
4.3 Comparación de soportes
Aunque el tipo de soporte utilizado para la inmovilización puede tener efecto sobre la degradación de los contaminantes orgánicos, debido principalmente a su porosidad, son escasos los estudios de comparación de la eficiencia de degradación con diferentes matrices y no permiten establecer una relación entre el tipo de soporte y la eficiencia lograda en la biodegradación.
En la biodegradación de fenol con una concentración inicial de 2 gL-1, en un reactor "airlift" con Pseudomonas sp inmovilizada en alginato o poliacrilamida, se encontró que la bacteria inmovilizada fue capaz de degradar el fenol en menos de dos días, mostrando una mayor eficiencia en poliacrilamida, en tanto que las células libres no fueron capaces de crecer en esa concentración de fenol (Bettmann y Rehm, 1984). Posteriormente se demostró que la degradación de fenol ocurrio de forma efectiva en un reactor de lecho empacado, aunque se presentaron limitaciones en la difusión del sustrato hacia el interior del gel, debido al tamaño del poro (1 a 10 nm) de la silica gel, por lo que la degradación fue menos eficiente en comparación a la obtenida cuando el consorcio fue inmovilizado en poliuretano (Brányik y col., 2000).
Karigar y col. (2006) compararon la eficiencia de degradación de fenol (22mM) por Arthrobacter citreus inmovilizado en alginato y en agar, encontrando una respuesta similar en la remoción de fenol y una actividad de degradación continua hasta por una semana con ambos soportes. Sin embargo, en los resultados reportados en la degradación de TCE por Bacillus sp, se demostró que el alginato de calcio fue una mejor matriz que el agar para la inmovilización del microorganismo, debido a que la actividad de degradación se preservó por un mayor número de ciclos (Dey y Roy, 2009).
Los resultados obtenidos en la degradación de naftaleno demostraron que la inmovilización de Pseudomonas sp en poliuretano fue mas eficiente comparada con la obtenida usando como soporte alginato de calcio, agar y poliacrilamida (Manohar y col., 2001). Como se señalo anteriormente, debido a su resistencia mecánica y su porosidad el poliuretano facilita la transferencia de oxígeno, la difusión de los compuestos y posee una mayor resistencia mecánica que impide que las células se han liberadas del soporte durante el cultivo.
En otro estudio comparativo de matrices para la degradación de 2-metilnaftaleno por Pseudomonas sp se demostró que el mejor soporte es el poliuretano, comparado contra agar, alginato y alcohol polivinílico (Sharanagouda y Karegoudar, 2002). En ese trabajo se reportó que el microorganismo inmovilizado fue capaz de degradar de 25 a 50 mM de 2-metilnaftaleno y que en esas condiciones las células son reusables hasta por 30 ciclos sin pérdida de actividad. Resultados similares se reportaron en la biodegradación de p-cresol por Bacillus sp en un cultivo usando como soportes alginato de calcio, agar, poliacrilamida y poliuretano (Tallur y col., 2009). Las células inmovilizadas en poliuretano fueron reutilizadas por mas de 35 ciclos sin perdidas de actividad, y mostraron mayor tolerancia a cambios de pH, temperatura e incluso a altas concentraciones de p-cresol. En la biodegradación de carburan fenol por Klebsiella pneumoniae en un cultivo batch, Kadakol y col. (2010) reportaron el agotamiento casi total del compuesto, que fue explicado en términos de la porosidad, resistencia mecánica e hidrofobicidad del poliuretano.
En lo que respecta a la comparación del comportamiento de degradación del contaminante por las células inmovilizadas en los distintos soportes, los resultados indican que el poliuretano es la mejor opción para ser utilizado como soporte para la inmovilización, independientemente del contaminante utilizado. Esto puede deberse a las diferencias en la estabilidad mecánica de los diferentes soportes (Sharanagouda y col., 2002), lo que indica el potencial de estos materiales en la inmovilización de células para empleo en el área ambiental.
De acuerdo a lo anteriormente expuesto es evidente que los modelos cinéticos clásicos son aplicables cuando en el sistema el efecto de la difusión intrapartícula no es el paso limitante, condición que puede lograrse variando el tamaño de poro sin que ello comprometa la estabilidad y resistencia mecánica del soporte.
Dentro del área ambiental, un aspecto que continua siendo importante es el tratamiento de suelos contaminados. A ese respecto, el uso de sistemas inmovilizados sigue siendo un tema poco explorado, como se muestra en la siguiente sección, donde además se discute lo que sucede con respecto a los problemas de difusión en dichos sistemas.
5 Degradación de contaminantes orgánicos en suelo por microorganismos inmovilizados
Como se señaló anteriormente los trabajos de biodegradación de contaminantes por células inmovilizadas se han realizado en medios acuosos, ya que estos se aplican comúnmente en el tratamiento de efluentes. En lo referente a los sistemas de degradación de contaminantes en suelos, pese a que se reconocen las ventajas de aplicar microorganismos inmovilizados, se tienen pocos reportes.
Con respecto al uso de soportes convencionales para la inmovilización de microorganismos la lista es poco numerosa, y en general se trata de trabajos realizados a nivel de laboratorio. Los enfoques han sido variados, por ejemplo se ha sugerido el uso de soportes multicapa, conformados por agar, alginato o k-carragenina cubiertos de una capa protectora de poliuretano, que permiten el establecimiento de condiciones adecuadas para alcanzar una alta densidad celular en el interior del soporte, donde los microorganismos pueden llevar a cabo su actividad de degradación conforme el sustrato difunda hacia el soporte (Middeldorp y col., 1990).
En otros trabajos se han usado las técnicas convencionales para la inmovilización de los microorganismos. Briglia y col. (1990) inmovilizaron Rhodococcus chlorophenolicus y Flavobacterium sp en poliuretano para estudiar la degradación de pentaclorofenol en un suelo natural; los resultados obtenidos demostraron la mineralización del pentaclorofenol en el suelo y la presencia de células similares a R. chlorophenolicus en el poliuretano después de un año de la inoculación. Su y col. (2006) inmovilizaron Bacillus sp. SB02 y Mucor sp. SF06 en vermiculita por adsorción física, logrando una degradación del 95.3% de benzo(a)pireno en 42 d, resultados considerablemente mejores a los logrados con las células libres. Karabika y col. (2009) realizaron pruebas en matraces Erlenmeyer de 250 mL que contenían 50 g de suelo, adicionado con 100 ppm de pireno y 106 células g-1 de suelo, inmovilizadas en una mezcla de alginato de calcio y almidon de máz. Aunque las células libres mostraron una mayor biodegradación de pireno que las células inmovilizadas, estas últimas mostraron una mayor tolerancia al contaminante y mantuvieron su capacidad de biodegradación y su viabilidad hasta por un año de almacenamiento a 4°C.
El uso de alcohol polivinílico como soporte para inmovilización de microorganismos en el área ambiental se ha usado básicamente en sistemas de tratamientos de agua aplicados a la inmovilización de bacterias metanogenicas (Hanaki y col., 1994) e inmovilización de lodos activados (Takizawa y col., 1996), en este último caso se han encontrado diversas limitaciones que han sido superadas mediante el uso de mezclas con otros agentes gelificantes. Por ejemplo, la capacidad del alcohol polivinílico para retener suficiente humedad pudo superarse al generar hidrogeles complejos de alcohol polivinílico y alginato de calcio. (Doria-Serrano y col., 2002). Posteriormente este hidrogel complejo (fue aplicado para desarrollar un sistema de degradación de fenol con operación en la modalidad de cultivo continuo, aunque se reportó como una desventaja a considerar para investigaciones futuras el hecho de que la matriz puede ser inestable estructuralmente hablando (Hernández-Esparza y col., 2006). Zhang y col., (2007) mediante la adición de ortofosfato lograron resolver la aglomeración de las perlas de alcohol polivinílico y la toxicidad que se presentan cuando este se usa mezclado con acido borico. Partiendo de las primeras aplicaciones ambientales del alcohol polivinilico, Cunningham y col., (2004) demostraron su uso exitoso en la remoción de diesel en una biopila a escala de laboratorio al incorporar un material hidrofobico durante la formación de la matriz del soporte. En este trabajo los autores sugieren que una ventaja de este soporte es su baja degradabilidad, que puede garantizar que aunque sera eventualmente degradado, esto no sucedera durante la fase activa de bioremediación, cuando el metabolismo microbiano debe ser encauzado a la degradación del diesel. Si bien la resistencia mecánica del soporte fue adecuada para las biolpilas a escala de laboratorio (con un mezclado manual) no es posible predecir si dicha estabilidad puede mantenerse en una escala mayor.
El uso de células inmovilizadas también se ha extendido a sistemas de tratamiento de dos fases, como es el reactor de suelo en suspensión a nivel de laboratorio. Li y col. (2005) estudiaron la remoción de fenantreno y pireno por la bacteria Zoogloea sp inmovilizada en un soporte compuesto por alcohol polivinilico, alginato de sodio y carbon activado. Se demostró que al introducir las células inmovilizadas en el reactor con un suelo no esterilizado, la biodegradación de los compuestos era el doble de la obtenida con las células libres, y ligeramente menor a la obtenida cuando se uso un suelo esterilizado. Wang y col. (2008) inmovilizaron Trichoderma sp., A.niger y Fusarium sp. en un soporte compuesto por alcohol polivinilico, alginato de sodio y carbon activado, para probarlos en la degradación de pireno y benzo(a)pireno como pares o tríadas. En un cultivo de suelo en suspensión con una concentración de 100 mg kg-1 la mejor degradación (81% de pireno y 43% de benzo(a)pireno después de 240 h) se logro con la mezcla de A. niger y Fusarium sp. Esos resultados demostraron que los hongos inmovilizados fueron mas eficientes que las células libres suspendidas para la biodegradación de los compuestos.
Otras alternativas han sido el uso de arcillas para la inmovilización de Alcaligenes sp A 7-2 aplicado en la biodegradación de 4-clorofenol en un suelo arenoso, usando un percolador (Balfanz y Rehm, 1991) o en un reactor de lecho empacado (Westmeier y Rehm, 1987). Este último sistema también fue aplicado en la degradación de 2-cloroetanol por P. putida US2 (Overmeyer y Rehm, 1995) y acido dicloroacetico por Xanthobacter autotrophicus (Meusel y Rehm, 1993).
Se puede mencionar también el trabajo de Rubilar y col., (2011), en el que emplearon P. chrysospoiurm y Anthracophyllum discolor inmovilizados en granos de trigo para remover pentaclorofenol de un suelo con una concentración inicial de 350 mg Kg de suelo-1. Los investigadores reportaron un incremento de la biodegradación en ensayos realizados en matraces con suelo contaminado, y señalaron que en el caso particular de los hongos de la pudrición blanca, los materiales lignocelulósicos usados como soporte para inmovilización también pueden funcionar como fuente de nutrientes, y por ende promover la producción de enzimas asociadas a la degradación de contaminantes, además de dar protección a la célula ante diferentes condiciones de estrés.
A través del análisis de los trabajos citados es evidente que existe una falta de información sobre el transporte de contaminantes en sistemas inmovilizados cuando se realizan estudios de biodegradación en suelos. Sobre todo el panorama podría tornarse más complejo cuando en el sistema se usan soportes de tipo hidrofílico y los contaminantes son hidrofóbicos. Considerando esta incompatibilidad Cunningham y col., (2004) incorporaron un material oleofílico en la preparación del soporte de inmovilización, que favoreció el consumo del diesel, sin embargo los autores reconocen que hay muchos cuestionamientos no resueltos acerca de la difusividad de los n-alcanos dentro de la matriz del soporte.
En la Fig. 3 se muestra una representación esquemática en la transferencia de masa de un contaminante hidrofóbico que está sorbido en un suelo y que debe difundir hacia el soporte donde se encuentran los microorganismos. En sistemas sólidos convencionales cuando el contaminante está sorbido en los microporos del suelo se sabe (Medina-Moreno y col., 2009) que el paso limitante es la difusión en los poros de la matriz del suelo (paso 1), pero en los sistemas inmovilizados como se describe a continuación puede presentarse otro paso limitante. Una vez que el contaminante ha sido transportado hacia la fase líquida circundante a la partícula de suelo, la presencia de agentes de tensión superficial producidos por los microorganismos, puede favorecer su disolución y difusión en la fase liquida (paso 2) para alcanzar el soporte. En este punto surge una resistencia adicional en los sistemas inmovilizados. El compuesto es transportado sólo por difusión través de los poros del soporte (paso 3). En la matriz del soporte los contaminantes pueden quedar sorbidos en la pared del poro a través de sus componentes polares, dejando los extremos no polares en el espacio poroso. Aquí, la presencia de tensoactivos puede incrementar la transferencia de masa favoreciendo el consumo y transporte difusivo de contaminantes a través de la matriz del soporte para llegar a los microorganismos.
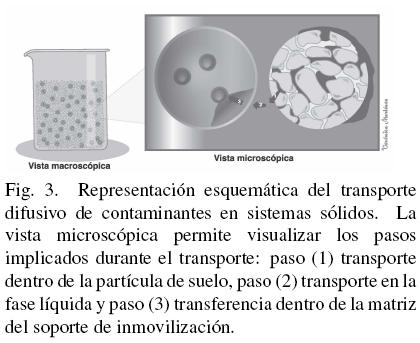
El esquema antes propuesto puede ser válido para cualquier sustrato insoluble, incluyendo el oxígeno. Los problemas difusionales que se mencionan pueden minimizarse a través del control del tamaño del poro del soporte optimizando los procesos de inmovilización.
Conclusión
El uso de microorganismos inmovilizados ha sido ampliamente explorado, tanto a nivel industrial como de investigación, pero en el campo de la biotecnología ambiental aún queda mucho por hacer. En lo que respecta a los soportes que se han utilizado para este fin, el poliuretano podría considerarse como el mas eficiente, debido a su alta resistencia y porosidad. Sin embargo, también se han probado diversos soportes de tipo natural, por considerarse mas adecuados debido a su biodegradabilidad. Aunque dichos soportes han mostrado su factibilidad para inmovilizar microorganismos y usarlos en distintos procesos ambientales, todavía existe la necesidad de profundizar en los estudios que permitan mejorar su resistencia mecánica, o bien en la búsqueda de microorganismos que eventualmente puedan degradar el poliuretano, y que al ser incorporados en el sistema de inmovilización garanticen la desaparición del soporte del sitio a tratar una vez que se ha concluido la fase de degradación del contaminante.
En lo referente a los aspectos cinéticos, aún cuando ya se ha trabajo en el tema, se requiere el desarrollo de estudios minuciosos de los fenómenos de transferencia y de los aspectos cinéticos que rigen el consumo de contaminantes en sistemas inmovilizados, para la generación de expresiones y modelos matematicos que expliquen la degradación de contaminantes en sistemas de tratamiento de aguas y suelos contaminados.
Por último, aunque se han aprovechado las bondades del uso microorganismos inmovilizados en algunos procesos ambientales, son pocos los estudios de aplicación de estos en suelo, debido probablemente a las complicaciones que podrían encontrarse al llevar los procesos a un tratamiento a gran escala. Mas aun, es necesario realizar pruebas en campo que permitan establecer la factibilidad técnica y económica del uso de microorganismos inmovilizados para remover del suelo compuestos contaminantes de forma segura y factible, con lo que sera posible el desarrollo de las tecnologías adecuadas para tal fin.
Referencias
Ahamad, P.Y.A. y Kunhi, A.A.M. (2011). Enhanced degradation of phenol by Pseudomonas sp. CP4 entrapped in agar and calcium alginate beads in batch and continuous processes. Biodegradation 22, 253-265. [ Links ]
Álvarez, G.S., Foglia, M.L., Copello, G.J., Desimone, MF. y Diaz, LE. (2009). Effect of various parameters on viability and growth of bacteria immobilized in sol-gel-derived silica matrices. Applied Microbiology and Biotechnology 82, 639-646. [ Links ]
Annadurai, G., Rajesh B.S., Mahesh, K.P.O. y Murugesan, T. 2000. Adsorption and biodegradation of phenol by chitosan-immobilized Pseudomonas putida (NICM 2174). Bioprocess and Biosystems Engineering 22, 493-501. [ Links ]
Anselmo, A.M., Mateus, M. y Cabral, J.M.S. 1985. Degradation of phenol by immobilized cells of Fusarium flocciferum. Biotechnology Letters 7, 889-894. [ Links ]
Bahrami, S., Bassi, A. y Yanful, E. (2007). Investigation of sol-gel matrices containing crude metallothionein from Scchizosaccharomyces pombe for water treatment applications. The Journal of Sol-Gel Science and Technology 42,119-126. [ Links ]
Balfanz, J. y Rehm, H.J. (1991). Biodegradation of 4-chlorophenol by adsorptive immobilized Alcaligenes sp A 7-2 in soil. Applied Microbiology and Biotechnology 35, 662-668. [ Links ]
Bandhyopadhyay, K., Das, D., Bhattacharyya, P. y Maiti, B.R. (2001). Reaction engineering studies on biodegradation of phenol by Pseudomonas putida MTCC 1194 immobilized on calcium alginate. Biochemical Engineering Journal 8, 179-186. [ Links ]
Barbeau, L. Deschenes, D. Karamanev, Y. Comeau y Samson, R. 1997. Bioremediation of pentachlorophenol-contaminated soil by bioaugmentation using activated soil. Applied Microbiology and Biotechnology 48, 745-752. [ Links ]
Baumgarten W. F., Frommer, T. Mann, I. Pascik, H. Rast, y Schapel, D. January 1987 U.S. patent no. 4,634,672. [ Links ]
Bettmann, H. y Rehm, H.J. (1984). Degradation of phenol by polymer entrapped microorganisms. Applied Microbiology and Biotechnology 20, 285-290. [ Links ]
Beunink, J. y Rehm, H.J. (1990). Coupled reductive and oxidative degradation of 4-chloro-2-nitrophenol by a co-immobilized mixed culture system. Applied Microbiology and Biotechnology 34, 108-115. [ Links ]
Bhatia, R.B., Brinker, C.J., Gupta, A.K. y Singh, A.K. (2000). Aqueous sol-gel process for protein encapsulation. Chemical Material 12, 2434-2441. [ Links ]
Bleve, G., Lezzi, C., Chiriatti, M.A., D'Ostuni, I., Tristezza, M., Venere, D.D., Mita, S., Sergio, L. y Grieco, F. 2011. Selection of non-conventional yeasts and their use in immobilized form for the bioremediation of olive oil mill wastewaters. Bioresource Technology 102, 982-989. [ Links ]
Boopathy, R. (2000). Factors limiting bioremediation technologies. Bioresource Technology 74, 63-67. [ Links ]
Brányik, T. y Kuncová, G. (2000). Changes in phenol oxidation rate of a mixed microbial culture caused by sol-gel immobilization. Biotechnology Letters 22, 555-560. [ Links ]
Brányik, T., Kuncová G. y Paca J. (2000). The use of silica gel prepared by sol-gel method and polyurethane foam as microbial carriers in the continuous degradation of phenol. Applied Microbiology and Biotechnology 54, 168-172. [ Links ]
Brányik, T., Kuncová G., Páca, J. y Demnerová J. (1998). Encapsulation of microbial cells into silica-gel. Journal of Sol-Gel Science and Technology 13, 283-287. [ Links ]
Briglia, M., Nurmiaho-Lassila, E.L., Vallini, G., y Salkinoja-Salonen, M. (1990). The survival of the pentachlorophenol-degrading Rhodococcus chlorophenolicus PCP-1 and Flavobacterium sp. in natural soil. Biodegradation 1, 273-281. [ Links ]
Brink, L.E.S y Tramper, J. (1986). Modelling the effects of mass transfer on kinetics of propene epoxidation of immobilized Mycobacterium cells, 1. Pseudo-one-substrate conditions and negligible product inhibition. Enzyme andMicrobial Technology 8, 281-288. [ Links ]
Cassidy, M.B., Lee, H. y Trevors, J.T. (1996). Environmental applications of immobilized microbial cells, a review. Journal of Industrial Microbiology 16, 79-100. [ Links ]
Chen, J-P. y Lin, Y-S. (2007). Decolorization of azo dye by immobilized Pseudomonas luteola entrapped in alginate-silicate sol-gel beads. Process Biochemistry 42, 934-942. [ Links ]
Chitiva, L.U. y Dussan, J. (2003). Evaluación de matrices para la inmovilización de Pseudomonas sp. en biorremediación de fenol. Revista Colombiana de Biotecnología 2, 5-10. [ Links ]
Chung, T-P., Tseng, H-Y. y Juang, R-S. 2003. Mass transfer effect and intermediate detection for phenol degradation in immobilized Pseudomonas putida systems. Process Biochemistry 38, 1497-1507. [ Links ]
Conroy, J.F.T., Power, M.E, Martin, J., Earp, B., Hosticka, B., Daitch, CH.E. y Norris P.M. (2000). Cells in sol-gels I: a cytocompatible route for the production of macroporous silica gels. Journal of Sol-Gel Science and Technology18, 269-283. [ Links ]
Coradin, T., Nassif, N. y Livage, J. (2003). Silicaalginate composites for microencapsulation. Applied Microbiology and Biotechnology 61, 429-434. [ Links ]
Cunningham, C.J., Ivshina, I.B., Lozinsky, V.I., Kuyukina, M.S. y Philp, J.C. (2004). Bioremediation of diesel-contaminated soil by microorganisms immobilized in polyvinyl alcohol. International Biodeterioration and Biodegradation 54,167-174. [ Links ]
de-Bashan, L.E. y Bashan, Y. (2010). Immobilized microalgae for removing pollutants, Review of practical aspects. Bioresource Technology 101, 1611-1627. [ Links ]
Dey, K. y Roy, P. (2009). Degradation of Trichloroethylene by Bacillus sp., Isolation strategy, strain characteristics, and cell immobilization. Current Microbiology 59, 256-260. [ Links ]
Doria-Serrano, M. C., Riva-Palacio, G., Ruiz-Treviño, F. A. y Hernández-Esparza, M. (2002). Poly(N-vinyl pyrrolidone)-Calcium Alginate (PVP-Ca-alg) composite hydrogels: physical properties and activated sludge immobilization for wastewater treatment. Industrial Engineering Chemistry Research 41, 3163-3168. [ Links ]
Dosoretz, C., Armon, R., Staroswtzky, J. y Rothschild, N. (1996). Entrapment of parathion hydrolase from Pseudomonas spp. in solgel glass. Journal of Sol-Gel Science and Technology 7, 7-1 1. [ Links ]
Dursun, A.Y. y Tepea, O. (2005). Internal mass transfer effect on biodegradation of phenol by Ca-alginate immobilized Ralstonia eutropha. Journal of Hazardous Materials 126, 105-111. [ Links ]
Dwyer, D.F., Krumme, M.L., Boyd, S.A. y Tiedje, J.M. (1986). Kinetics of phenol biodegradation by an immobilized methanogenic consortium. Applied Environmental Microbiology 52, 345-351. [ Links ]
Ehrdardt, H.M. y Rehm, H.J. (1985). Phenol degradation by microorganisms adsorbed on activated carbon. Applied Microbiology and Biotechnology 21, 32-36. [ Links ]
Fantroussi, S.E. y Agathos, S.N. (2005). Is bioaugmentation a feasible strategy forpollutant removal and site remediation? Current Opinion in Microbiology 8, 268-275. [ Links ]
Gentry, T.J., Josephson, K.L., y Pepper, I.L. (2004a). Functional establishment of introduced chlorobenzoate degraders following bioaugmentation with newly activated soil. Biodegradation 15, 67. [ Links ]
Gentry, T.J., Rensing, Ch. y Pepper, I.L. (2004b). New approaches for bioaugmentation as a Remediation Technology. Critical Reviews in Environmental Science and Technology 34, 447-494. [ Links ]
Godjevargova, T., Ivanova, D., Alexieva, Z. y Dimov, N. (2003). Biodegradation of toxic organic components from industrial phenol production waste waters by free and immobilized Trichosporon cutaneum R57. Process Biochemistry 38, 915-920. [ Links ]
Guiseley, K.B. 1989. Chemical and physical properties of algal polysaccharides used for cell immobilization. Enzyme and Microbial Technology 11, 706-716. [ Links ]
Hackel, U., Klein, J., Megnet, R. y Wagner, F. (1975). Immobilization of microbial cells in polymeric matrices. Applied Microbiology Biotechnology 1, 291 293. [ Links ]
Hanaki, K., Hirunmasuwana, S., y Matsuo, T. (1994). Protection of methanogenic bacteria from low pH and toxic materials by immobilization using polyvinyl alcohol. Water Research 28, 877-885. [ Links ]
Hannaford, A.M. y Kuek, C. (1999). Aerobic batch degradation of phenol using immobilized Pseudomonas putida. Journal of Industrial Microbiology and Biotechnology 22, 121-126. [ Links ]
Hernández-Esparza, M., Doria-Serrano, M.C., Acero-Salinas, G. y Ruiz-Trevino, F.A. (2006). Removal of high phenol concentrations with adapted activated sludge in suspended form and entrapped in calcium alginate/cross-linked poly(N-vinyl pyrrolidone) hydrogels. Biotechnology Progress 22, 1552-1559. [ Links ]
Hiemstra, H., Dijkhuizen, L. y Harder, W. (1983). Diffusion of oxygen in alginate gels related to the kinetics of methanol oxidation by immobilized Hansenula polymorpha cells. European Journal of Applied Microbiology Biotechnology 18,189-196. [ Links ]
Jack, T.R. y Zajic, J.E. (1977). The immobilization of whole cells. Advances in Biochemical Engineering/Biotechnology 5,125-145. [ Links ]
Jianlong, W., Liping, H., Hanchang, S. y Yi, Q. (2001). Biodegradation of quinoline by gel immobilized Burkholderia sp. Chemosphere 44, 1041-1046. [ Links ]
Juárez-Ramírez, C, Ruiz-Ordaz, N., Cristiani-Urbina, E. y Galindez-Mayer, J. (2001). Degradation kinetics of phenol by immobilized cells of Candida tropicalis in a fluidized bed bioreactor. World Journal of Microbiology and Biotechnology 17,697-705. [ Links ]
Kadakol, J.C., Kamanavalli, Ch.M. y Shouche, Y. (2010). Biodegradation of carbofuran phenol by free and immobilized cells of Klebsiella pneumonia ATCC13883T. World Journal of Microbiology Biotechnology 27, 25-29. [ Links ]
Karabika, E., Kallimanis, A., Dados, A., Pilidis, G., Drainas, C. y Koukkou, A.I. (2009). Taxonomic identification and use of free and entrapped cells of a new Mycobacterium sp., strain spyr1 for degradation of polycyclic aromatic hydrocarbons (PAHs). Applied Biochemistry and Biotechnology 159,155-167. [ Links ]
Karigar, Ch., Mahesh, A., Nagenahalli, M. y Yun, D.J. (2006). Phenol degradation by immobilized cells of Arthrobacter citreus. Biodegradation 17, 47-55. [ Links ]
Keweloh, H., Heipieper, H.J. y Rehm, H.J. (1989). Protection of bacteria against the toxicity of phenol by immobilization in calcium alginate. Applied Microbiology and Biotechnology 31, 383-389. [ Links ]
Kitova, A.E., Kuvichkina, T.N, Arinbasarova A.Y y. Reshetilov, A.N. (2004). Degradation of 2,4-dinitrophenol by free and immobilized cells of Rhodococcus erythropolis HL PM-1. Applied Biochemistry and Microbiology 40, 258-261. [ Links ]
Kotoucková, L., Vavrik, J., Nemec, M., Plocek, J. y Zdrahal Z. (1997). Use of immobilized cells of the strain Corynebacterium sp. for 4-nitrophenol degradation. Folia Microbiology 42, 509-512. [ Links ]
Lee, C.M., Lu, C.J. y Chuang, M.S. (1994). Effects of immobilized cells on the biodegradation of chlorinated phenols. Water Science Technology 30, 87-90. [ Links ]
Li, B. y Takahashi, H. (2000). New immobilization method for enzyme stabilization involving a mesoporous material and an organic/inorganic hybrid gel. Biotechnology Letters 22, 1953-1958. [ Links ]
Li, P., Wang, X., Stagnitti, F., Li, L., Gong, Z., Zhang, H., Xiong, X. y Austin Ch. (2005). Degradation of phenanthrene and pyrene in soil slurry reactors with immobilized bacteria Zoogloea sp. Environmental Engineering Science 22, 390-399. [ Links ]
Lin J-E., Wang, H.J. y Hickey, R.F. (1991). Use of coimmobilized biological systems to degrade toxic organic compounds. Biotechnology and Bioengineering 38, 273-279. [ Links ]
Linhardt, R.J., Amotz, S., Rugh, S., Markussen, E.K., Thomsen, K., Bigwood, M.P., Naples, J.O., Blattler, W.A., Lambert, J. M. y Senter, P.D. (1987). Patents and literature immobilized biocatalysts. Applied Biochemistry and Biotechnology 14, 121-145. [ Links ]
Manohar, S. y Karegoudar, T.B. (1998). Degradation of naphthalene by cells of Pseudomonas sp. strain NGK 1 immobilized in alginate, agar and polyacrylamide. Applied Microbiology and Biotechnology 49, 785-792. [ Links ]
Manohar, S., Kim, S.K. y Karegoudar, T.B. (2001). Enhanced degradation of naphthalene by immobilization of Pseudomonas sp. strain NGK1 in polyurethane foam. Applied Microbiology Biotechnology 55, 311-316. [ Links ]
Medina-Moreno, S.A., Huerta-Ochoa, S., Lucho-Constantino, C.A., Aguilera-Vázquez, L., Jiménez-González, A. y Gutiérrez-Rojas, M. (2009). Modelado de la biodegradación en biorreactores de lodos de hidrocarburos totales del petróleo intemperizados en suelos y sedimentos. Revista Mexicana de Ingeniería Química 8, 245-258. [ Links ]
Mediana-Valtierra, J., García-Servin, J., Frausto-Reyes, C. y Calixto, S. (2005). Encapsulamiento de anatasa comercial en películas delgadas de TiO2 depositadas sobre micro-rodillos de vidrio para la fotodegradación del fenol. Revista Mexicana de Ingeniería Química 4, 191-201 [ Links ]
Meusel, M. y Rehm, H.J. (1993). Biodegradation of dichloroacetic acid by freely suspended and adsorptive immobilized Xanthobacter autotrophicus GJ10 in soil. Applied Microbiology and Biotechnology 40, 165-171. [ Links ]
Middeldorp, P.J.M., Briglia, M., y Salkinoja-Salonen, M.S. (1990). Biodegradation of pentachlorophenol in natural polluted soil by inoculated Rhodococcus chlorophenolicus. Microbiology Ecology 20,123-139. [ Links ]
Mishra, S., Jyot, J., Kuhad, R. y Lal, B. (2001). Evaluation of inoculum addition to stimulate it in situ bioremediation of oily-sludge-contaminated soil. Applied and Environmental Microbiology 67, 1675-1681. [ Links ]
Mohammad, B.T. y Bustard, M.T. (2008). Fed batch bioconversion of 2-propanol by a solvent tolerant strain of Alcaligenes faecalis entrapped in Ca-alginate gel. Journal of Industrial Microbiology and Biotechnology 35, 677-684. [ Links ]
Moreira, S.M., Moreira-Santos, M., Guilhermino, L., Ribeiro, R., 2006. Immobilization of the marine microalga Phaeodactylum tricornutum in alginate for in situ experiments: bead stability and suitability. Enzyme Microbiology Technology 38, 135-141. [ Links ]
Mrozik, A. y Piotrowska-Seget, Z. (2010). Bioaugmentation as a strategy for cleaning up of soils contaminated with aromatic compounds. Microbiological Research 165, 363-375. [ Links ]
Nair, I.C., Jayachandran, K., Shashidhar, S. (2007). Treatment of paper factory effluent using a phenol degrading Alcaligenes sp. under free and immobilized conditions. Bioresource Technology 98, 714-716. [ Links ]
Najafpour, R.G. (2007). Biochemical Engineering and Biotechnology. Elsevier, Holanda. [ Links ]
Nassif, N., Roux, C., Coradin, T., Rage, M.N., Bouvet, O.M.M., Livage, J. (2003). A sol-gel matrix to preserve the viability of encapsulated bacteria. Journal Material Chemistry 13, 203-208. [ Links ]
Nawaz, M.S, Franklin, W. y Cerniglia, C.E. (1992). Degradation of acrylamide by immobilized cells of a Pseudomonas sp and Xanthomonas maltophilia. Canadian Journal of Microbiology 39, 207-212. [ Links ]
Oh, Y-S., Maeng, J. y Kim, S-J. (2000). Use of microorganisms-immobilized polyurethane foams to adsorb and degrade oil on water surface. Applied Microbiology and Biotechnology 54, 418-423. [ Links ]
O'Reilly, K.T. y Crawford, R.L. (1989a). Kinetics of p-cresol degradation by an immobilized Pseudomonas sp. Applied EnvironmentalMicrobiology 55, 866-870. [ Links ]
O'Reilly, K.T. y Crawford, R.L. (1989b). Degradation of pentachlorophenol by polyurethane-immobilized Flavobacterium cells. Applied and Environmental Microbiology 55, 2113-2118. [ Links ]
Overmeyer, C. y Rehm, H.J. (1995). Biodegradation of 2-chloroethanol by freely suspended and adsorbed immobilized Pseudomonas putida US2 in soil. Applied Microbiology and Biotechnology 43, 143-149. [ Links ]
Pallerla, S. y Chambers, R.P. (1998). Reactor development for biodegradation of pentachlorophenol. Catalysis Today 40, 103-111. [ Links ]
Pannier, A., Oehm, C., Fischer, A.R., Werner, P., Soltmann. U. y Böttcher, H. (2010). Biodegradation of fuel oxygenates by sol-gel immobilized bacteria Aquincola tertiaricarbonis L108. Enzyme and MicrobialTechnology 47, 291-296. [ Links ]
Park, J.K. y Chang, H.N. (2000). Microencapsulation of microbial cells. Biotechnology Advances 18, 303-319. [ Links ]
Pulz, O. y Gross, W. (2004). Valuable products from biotechnology of microalgae. Applied Microbiology and Biotechnology 65, 635-648. [ Links ]
Quek, E., Ting, Y-P., Tan, H.M. (2006). Rhodococcus sp. F92 immobilized on polyurethane foam shows ability to degrade various petroleum products. Bioresource Technology 97, 32-38. [ Links ]
Raytchinova K.M. 2011. Immobilization microbial cells in food process fermentation. Food Bioprocess Technology 4, 1089-1118. [ Links ]
Rietti-Shati, M., Ronen, D. y Mandelbaum, R.T. (1996). Atrazine degradation by Pseudomonas strain ADP entrapped in sol-gel glass. Journal of Sol-Gel Science Technology 7, 77-79. [ Links ]
Rubilar, O., Bustamante, M., Tortella, G., Cea, M., Gianfreda, L., Acevedo, F. y Diez, M.C. (2011). Bioremediation of a Chilean Andisol contaminated with pentachlorophenol (PCP) by solid substrate cultures of white-rot fungi. Biodegradation 22, 31-41. [ Links ]
Sanjay, K., Asish, M., Pradeep, K., Saptadip, S., Bikash, R. Keshab, C. (2008). Production of xylanase by immobilized Trichoderma reesi SAF3 in Ca-alginate beds. Journal ofIndustrial Microbiology Biotechnology 35, 2445-249. [ Links ]
Sharanagouda, U. y Karegoudar, T.B. (2002). Degradation of 2-methylnaphthalene by free and immobilized cells of Pseudomonas sp. strain NGK1. World Journal of Microbiology and Biotechnology 18, 225-230. [ Links ]
Smidsrød O, y Skjak-Brka. G. (1990). Alginate as immobilization matrix for cells. Trends Biotechnology 8, 71-78. [ Links ]
Su, D. LIa,P., Frank, S. y Xiong, Z. (2006). Biodegradation of benzo[a]pyrene in soil by Mucor sp. SF06 and Bacillus sp. SB02 co-immobilized on vermiculite. Journal of Environmental Sciences 18, 1204-1209. [ Links ]
Takizawa, S., Aravinthan, V., y Fujita, K., (1996). Nitrogen removal from domestic waste water using immobilized bacteria. Water Science and Technology 34, 431-440. [ Links ]
Tallur, P.N., Megadi, V.B. y Ninnekar, H. Z. 2009. Biodegradation of p-cresol by immobilizedcells of Bacillus sp. strain PHN 1. Biodegradation 20, 79-83. [ Links ]
Valo, R.J, Haggblom, M.H. and Salkinoja-Salonen, M. (1990). Bioremediation of chlorophenol containing simulated groundwater by immobilized bacteria. Water Research 24, 253-258. [ Links ]
van Veen J.D, van Overbeek L.S. y van Elsas J.D. (1997). Fate and activity of microorganisms introduced into soil. Microbiology end Molecular Biology Reviews 61, 121-135. [ Links ]
Wang, X., Gong, Z., Li, P., Zhang L. y Hu, X. (2008). Degradation of pyrene and benzo(a)pyrene in contaminated soil by immobilized fungi. Environmental Engineering Science 25, 677-684. [ Links ]
Westmeier F. y Rehm H.J. (1987). Degradation of 4-chlorophenol in municipal wastewater by adsorptive immobilized Alcaligenes sp. A 72. Applied Microbiology and Biotechnology 26, 78-83. [ Links ]
Westmeier F. y Rehm, H.J. (1985). Biodegradation of 4-chlorophenol by entrapped Alcaligenes sp A 7-2. Applied Microbiology Biotechnology 22, 301-305. [ Links ]
Xiangliang, P., Jianlong, W., y Daoyong, Z. (2005). Biosorption of Pb(II) by Pleurotus ostreatus immobilized in calcium alginate gel. Process Biochemistry 40, 2799-2803. [ Links ]
Xiaoqiang, J., Jianping, W., Yan, J., Bai, J. Xianrui, Ch. y Ying, Z. (2006). Modeling for batch phenol biodegradation with immobilized Alcaligenes faecalis. AlChE Journal 52, 1294-1303. [ Links ]
Yordanova, G., Ivanova, D., Godjevargova, G. y Krastanov, A. (2009). Biodegradation of phenol by Aspergillus awamori NRRL 3112 on modified polyacrylonitrile membrane. Biodegradation 20, 717-726. [ Links ]
Zhang, Y., Ma, Y., Yang, F. Zhang, Ch, (2009). Continuous acetone-butanol-ethanol production by corn stalk immobilized cells. Journal of Industrial Microbiology and Biotechnology 36, 1117-1121. [ Links ]
Zhang L-S, Wu, W-Z, Wang, J-L. (2007). Immobilization of activated sludge using improved polyvinyl alcohol (PVA) gel. Journal of Environmental Sciences 1, 1293-1297. [ Links ]














