Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.1 Ciudad de México abr. 2012
Ingeniería de alimentos
El gel de Aloe vera: estructura, composición química, procesamiento, actividad biológica e importancia en la industria farmacéutica y alimentaria
Aloe vera gel: structure, chemical composition, processing, biological activity and importance in pharmaceutical and food industry
R.N. Domínguez-Fernández1, I. Arzate-Vázquez2, J. J. Chanona-Pérez1*, J. S. Welti-Chanes3, J. S. Alvarado-González1, G. Calderón-Domínguez1, V. Garibay-Febles4 y G. F. Gutiérrez-López1
1 Departamento de Ingeniería Bioquímica, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Plan de Ayala y Carpio s/n, Col. Santo Tomás, CP. 113440, México, D.F. *Autor para la correspondencia. E-mail: jorge_chanona@hotmail.com Tel. +52 01 57296000 Ext. 62458, Fax +52 01 5729 62463
2 Centro de Nanociencias y Micro y Nanotecnologías, Instituto Politécnico Nacional, Luis Enrique Erro s/n, Unidad Profesional Adolfo López Mateos, Col. Zacatenco, C.P. 07738, México, D.F.
3 División de Biotecnología y Alimentos, Instituto Tecnológico y de Estudios Superiores de Monterrey, Av. Eugenio Garza Sada 2501 Sur, Col. Tecnológico, Monterrey, NL 64849, México.
4 Laboratorio de Microscopía de Ultra Alta Resolución, Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas 1522, Col. San Bartolo Atepehuacan, CP. 07730, México.
Recibido 22 de Noviembre 2011
Aceptado 2 de Marzo 2012
Resumen
El Aloe vera tiene amplios usos en la industria alimentaria, farmacéutica y cosmética; así mismo, la parte que más se usa de esta planta es el gel, debido a sus propiedades funcionales, antioxidantes y terapéuticas. Un adecuado aprovechamiento de la planta, está asociado al contenido de sus componentes bioactivos, microestructura y los métodos para preservar y estabilizar los productos obtenidos a partir del gel. En este trabajo se realizó una compilación relativa al origen de la planta, su estructura, la composición química y microestructural del gel, métodos de procesamiento tradicionales y tecnologías emergentes empleadas en la conservación y estabilización del mismo; así como la importancia de los diversos estudios relacionados con su actividad biológica y efectos farmacológicos. La información presentada puede ser una guía útil para conocer la estructura y microestructura de la planta, así como para la selección de métodos para el procesamiento del gel y la preservación de los componentes bioactivos presentes en el Aloe vera los cuales son responsables de su actividad biológica.
Palabras clave: gel de Aloe vera, composición química, microestructura, procesamiento, actividad biológica.
Abstract
Aloe vera has wide application in both the pharmaceutical and food industries. Furthermore, the gel obtained from this plant is the component more often employed due to their antioxidant, therapeutic and functional properties. A suitable utilization of the plant is associated to the content of their bioactive components, microstructure and methods for preservation and stabilization of the products obtained from gel of others parts of the plant. In this work a compilation regarding to Aloe vera origin, plant structure, chemical and microstructural composition of the gel, traditional processing methods and the emerging technologies used on the conservation and stabilization of their chemical components are presented. Additionally, some studies remarking the biological activity and pharmacological effect of the gel are shown. This information can be a useful guide to know the structure and microstructure of the plant, as well as to select the gel processing and the conservation methods required to obtain the bioactive components of Aloe vera plant which are responsible of its biological activity.
Keywords: Aloe vera gel, chemical composition, microstructure, processing, biological activity.
1 Introducción
1.1 Origen e importancia de la planta de Aloe vera
El Aloe vera, es una planta con alrededor de 360 especies diferentes, pertenece a la familia de las asfodeláceas o liláceas, con hojas perennes en forma de roseta; su tamaño puede alcanzar desde unos cuantos centímetros hasta los 50 cm (Reynolds y Dweck, 1999; Choi y Chung, 2003; Ramachandra y Srinivasa, 2008). Las primeras referencias del Aloe vera se encuentran en los Papiros de Ebers y existen numerosos documentos históricos de los egipcios, griegos, romanos, algerianos, árabes, tunecinos, indios y chinos, entre otros, que hablan de su empleo para uso medicinal y cosmético. Su nombre viene del griego "aloê"; y en árabe se llama "alloeh", que significa: "la sustancia amarga brillante"; la palabra vera viene del latín y significa: "verdad", así como en sanscrito Aloe vera su significado se refiere a diosa (Boudreau y Beland, 2006; Surjushe y col., 2008). La primera clasificación de los Aloes de la isla de Barbados fue hecha por el botánico Miller (Grindlay y Reynolds, 1986), quien reporta que el Aloe barbadensis Miller es originario de la isla de Barbados y fue introducido al mundo como producto del comercio marítimo en el Caribe. Las primeras plantaciones de importancia datan de 1870, pero no fue sino hasta 1920 cuando se cultivo a mayor escala. Desde entonces se explotó de manera artesanal para la extracción del acíbar (exudado de la hoja). El nombre correcto aceptado actualmente es Aloe vera (L.) Burm. f. (Vinson y col., 2005); sin embargo, la planta se ha conocido bajo diversos nombres como sábila, Aloe vera, Aloe Curacao, Aloe barbadensis Miller o coloquialmente como sábila (Reynolds, 2004). Algunas de las especies más conocidas son el Aloe Arborescens, el Aloe Chinensis, el Aloe Socotrino y el Aloe ferox, aunque las más utilizadas son la especie Aloe barbadensis Miller de la que se obtiene acíbar y gel (pulpa) y el Aloe ferox del que básicamente se obtiene el acíbar (Reynolds, 2004). De las plantas adultas (3-5 años), se recolectan las hojas más externas de la base para obtener un acíbar o pulpa de aloe de buena calidad para posteriormente procesarlo y fabricar productos aptos para la industria farmacéutica, cosmética y alimentaria (Reynolds y Dweck, 1999; Choi y Chung, 2003; He y col., 2005; Bozzi y col., 2007). En la actualidad, diversas industrias se han orientado hacia la obtención del gel en diferentes presentaciones; este mercado ha ido evolucionando significativamente durante los últimos años y mantiene una proyección de crecimiento no menor a 12% interanual, estimándose un mercado global de 65 millones de dólares en productos primarios (plántulas, hojas y gel) y más de 200 mil millones de dólares en productos como champús, lociones, bebidas y medicamentos (Reynolds, 1985; Kim y col., 1998; Eshun y He, 2004, Ramachandra y Srinivasa, 2008).
2 Estructura y composición química de la planta de Aloe vera
La planta de Aloe vera se compone de raíz, tallo, hojas y flores en época de floración. Las hojas crecen alrededor del tallo a nivel del suelo en forma de roseta, desde el centro hacia arriba crece el tallo que al florecer forma densos racimos de flores tubulares amarillas o rojas (Reynolds y Dweck, 1999). Las hojas tienen formas lanceoladas y dentadas con pinchos que le sirven de protección a la planta. La estructura de las hojas (Fig. 1) está formada por el exocarpio o corteza, la cual está cubierta de una cutícula delgada. La corteza representa aproximadamente del 20 al 30% del peso de toda la planta y dicha estructura es de color verde o verde azulado, dependiendo de diversos factores tales como: el lugar, clima o nutrición de la planta. El parénquima, conocido comúnmente como pulpa o gel se localiza en la parte central de la hoja y representa del 65 al 80 % del peso total de la planta.

Como se menciono anteriormente, entre la corteza y la pulpa, ocupando toda la superficie interna de la hoja, se encuentran los conductos de aloína (Fig. 1) que son una serie de canales longitudinales de pocos milímetros de diámetro por donde circula la savia de la planta, conocida como acíbar. El acíbar se puede obtener dejando fluir el líquido de los conductos de aloína; dicha sustancia tiene usos farmacéuticos como laxante (Ramachandra y Srinivasa, 2008). Esta sustancia presenta un alto contenido de aloína (>28% en base húmeda), la cual es una antraquinona derivada del aloe-emodina y la glucosa (Reynolds, 2004).
Por otra parte, con respecto a la composición química se ha reportado que la planta de Aloe vera está constituida por una mezcla compleja de compuestos como se muestra en la Tabla 1 y que más de 20 de estas sustancias poseen actividades benéficas para la salud (Reynolds y Dweck, 1999; Pritam y col., 2007; Jia y col., 2008).

Químicamente el Aloe vera se caracteriza por la presencia de constituyentes fenólicos que son generalmente clasificados en dos principales grupos: las cromonas, como la aloensina y las antraquinonas (libres y glicosiladas) como la barbaloína, isobarbaloína y la aloemodina; estos compuestos se encuentran en la capa interna de las células epidermales. La aloína es el principal componente del acíbar, que la planta secreta como defensa para alejar a posibles depredadores por su olor y sabor desagradable. También interviene en el proceso de control de la transpiración en condiciones de elevada insolación. La aloína es un glicósido antraquinónico que le confiere propiedades laxantes al acíbar y se utiliza en preparados farmacéuticos produciendo en ocasiones alergias a personas sensibles (Okamura y col., 1996). En la fabricación de productos alimenticios a base de Aloe vera, éstos no deben contener aloína dado sus propiedades laxantes y alergénicas.
Diferentes antraquinonas naturales y compuestos similares contenidos en la aloína, han mostrado efectos antivirales para algunas infecciones tales como en el herpes simplex tipos 1 y 2, varicela e influenza H1V-1. También se ha encontrado que la aloemodina presenta actividad contra una gran variedad de virus. Diversos estudios reconocen que las antraquinonas son los principales compuestos químicos que actúan directamente sobre los virus, impidiendo la adsorción del virus y su consecuente replicación (Okamura y col., 1996; Reynolds y Dweck, 1999; Rivero y col., 2002; Reynolds, 2004).
Por otra parte, el gel o pulpa es una masa gelatinosa e incolora formada por células parenquimáticas (Fig. 1e), estructuradas en colénquima y células pétreas delgadas. El gel está constituido principalmente de agua, mucílagos y otros carbohidratos, ácidos y sales orgánicas, enzimas, saponinas, taninos, heteróxidos antracénicos, esteroles, triacilglicéridos, aminoácidos, ARN, trazas de alcaloides, vitaminas y diversos minerales (Reynolds, 2004). La aplicación tópica del gel de sábila estimula la actividad de fibroblastos y la proliferación n de colágeno, favoreciendo la cicatrización y la angiogénesis (Chithra y col., 1998). Todas estas sustancias aportan al organismo muchos nutrientes necesarios para su función, y aunque de origen vegetal, son reconocidas por el organismo como propias, siendo perfectamente asimiladas sin producir ningún efecto colateral indeseable (Reynolds y Dweck, 1999). También hay evidencia que sugiere que el gel de la sábila contiene diversas sustancias que aisladas o en conjunto presentan efectos terapéuticos, por lo que una mejor comprensión de estos componentes y de sus efectos es esencial para desarrollar productos a partir de gel de Aloe vera con fines terapéuticos (Choi y Chung, 2003). Otros efectos farmacológicos y biológicos son revisados posteriormente en este trabajo.
2.1 Microestructura de biomateriales
El procesamiento térmico de materiales biológicos es usado para conservar, transformar, crear o destruir una estructura nativa o modificada previamente (Aguilera y Stanley, 1999). Las nuevas mejoras en la calidad de los materiales biológicos y la creación de nuevos productos para satisfacer las amplias demandas de los consumidores, se basan en gran medida en las intervenciones a nivel microestructural de los biomateriales. Hoy existe una amplia gama de técnicas de microscopía para investigar la estructura de los biomateriales y así tener un control del proceso para mejorar la calidad de los productos finales (Aguilera, 2005). Algunas de las técnicas de microscopía permiten observar muestras biológicas en su estado nativo con el mínimo procedimiento de preparación, tales como la microscopía de luz, microscopía confocal de barrido laser, microscopía electrónica de barrido ambiental y microscopía de fuerza atómica. Por otra parte, el uso de técnicas de procesamiento de imágenes puede proveer información cuantitativa acerca de la microestructura y morfología de materiales biológicos a partir de las micrografías obtenidas. Entre las características que pueden ser medidas con el procesamiento de imágenes se encuentran: características de tamaño y forma, color y propiedades texturales (Du y Sun, 2004; Du y Sun 2006; Costa y col., 2011; Cubero y col., 2011; Quintanilla-Carbajal y col., 2011; Vergara-Fernández y col., 2011). La microestructura de los biomateriales está relacionada con diversos aspectos tales como nutrición, textura, propiedades físicas, propiedades de transporte y estabilidad química y microbiológica (Aguilera, 2005). Con base en lo anterior, resultaría interesante el evaluar la microestructura del Aloe vera mediante técnicas de microscopía y de análisis de imágenes y establecer alguna relación en cuanto a su composición química, actividad biológica y el método de procesamiento al cual es sometido.
2.1.1 Estudios microestructurales en gel de Aloe vera
La microestructura del gel de Aloe vera ha sido objeto de diversos estudios con la finalidad de conocer su estructura celular y asociarla a los compuestos químicos que contiene. Ni y col. (2004), examinaron la microestructura de la pulpa mediante el uso de microscopía de luz y microscopía electrónica, además aislaron componentes estructurales y determinaron la composición de carbohidratos. Ellos describen que el gel está constituido por grandes células mesofílicas, con una forma hexagonal o alongada, estas células llegaron a tener un diámetro de más de 1000 ?m y aparentemente no hay diferencia notoria entre el corte longitudinal y el corte transversal. En el estudio de microscopía electrónica de transmisión de las células del parénquima, lograron identificar la pared, membrana celular y algunos organelos celulares, núcleos, cloroplastos y mitocondrias, esto solo se observo en el exocarpio y haces vasculares. Los autores mencionan que la principal función de las células del mesófilo en la pulpa es el almacenamiento de agua (Ni y col. 2004). Estos resultados coinciden con observaciones realizadas por los autores del presente trabajo mediante microscopía de luz (ML), microscopía confocal de barrido laser (MCBL) y microscopía electrónica de barrido ambiental (MEBA).
En la Fig. 2a-b se muestran imágenes de células del mesófilo del gel obtenidas con un microscopio óptico con el modo de luz reflejada (Olympus, BX51, Japón) el cual tiene acoplado una cámara digital con una resolución de 5 Mpx (Infinity 1, Lumenera, Canadá). En base a las imágenes obtenidas se confirmo su geometría hexagonal e isodiamétrica, así como los tamaños celulares los cuales fueron determinados mediante análisis de imágenes siguiendo una metodología previamente reportada por Chanona y col. (2008) y Santacruz-Vázquez y col. (2008), estos correspondieron a un valor promedio de 422 ± 34 μm de diámetro. En la Fig. 2b se pueden observar claramente las células turgentes que constituyen el gel.

Los estudios realizados para este trabajo con MCBL (LSM 710, Carl Zeiss, Alemania) permitieron observar las diferentes estructuras que componen la hoja de sábila (Fig. 3). Para obtener las imágenes se procedió de dos maneras, la primera consistió en realizar un marcaje con rodamina (cromóforo que tifie carbohidratos presentes en las células vegetales), y se excito la muestra a 514 nm, esto permitió observar un corte transversal de la hoja, en donde se localizaron las células del exocarpio (ce), los conductos de aloína (ca) y las células del parénquima (cp) (Fig. 3a). En la Fig. 3b se muestra un acercamiento de las células del parénquima, en donde se logran apreciar las células turgentes del pareínquima las cuales se tifien en su totalidad en color verde debido a la alta concentración de carbohidratos, principalmente polimananos acetilados (Talmadge y col., 2004; Pugh y col., 2001).

La segunda técnica que se desarrolló consistió en excitar las muestras simultáneamente a 405 nm, 488 nm y 561 nm; y detectar la señal de autofluorescencia mediante la herramienta de canales espectrales del Software ZEN del MCBL. Se observaron los picos de intensidad de autofluorescencia a longitudes de onda de 519 nm para el caso de compuestos lignocelulósicos, 610 nm para posibles compuestos fenólicos y 685 nm para el caso de la clorofila (Ma y col., 2011). Las paredes celulares son estructuras compuestas por una gran variedad de moléculas, que cuando son excitadas en longitudes de onda entre el ultravioleta y el verde presentan autofluorescencia (Aguilera y Stanley, 1999). Este fenómeno se puede observar en la Fig. 3c y 3d. La Fig. 3c muestra los conductos de aloína que se observan con una coloración intensa y oscura (en negro) que puede estar asociada a los compuestos fenólicos que contiene la aloína (Davis y col., 1991; Reynolds, 2004; Ramachandra y Srinivasa, 2008). Las células que cubren estos conductos, son células diferenciadas del exocarpio y estas se observan teñidas en dos tonos diferentes, el más abundante se asocia a la florescencia de la clorofila (en rojo) y los puntos más brillantes (en verde) a la lignina de las células (Ma y col., 2011). Las células del exocarpio y la cutícula se observan en la Fig. 3d, donde los tonos oscuros (en verde) corresponden a regiones con alto contenido de clorofilas y los tonos claros (en rojo) a zonas lignificadas como se aprecia en la película exterior que corresponde a la cutícula protectora de la hoja de sábila (Vázquez y col., 1996; Reynolds y Dweck, 1999; Boudreau y Beland, 2006).
Adicionalmente se observaron muestras del gel de Aloe vera con MEBA (XL 30, Philips, USA) y se pudieron observar las paredes de las células y la forma de las células del parénquima (Fig. 4a y 4b). En las micrografías se pueden notar las uniones entre las células isodiamétricas y es posible que estas zonas de unión, sean componentes de la pared celular altamente lignificadas y que pueden contener compuestos fenólicos con posible capacidad antioxidante. La descripción mencionada anteriormente concuerda con los resultados encontrados por otros autores para esta variedad de sábila (Ni y col., 2004; Femenia y col., 1999). Un mayor detalle de las células de parénquima de Aloe vera se puede observar en la Fig. 4b, donde se aprecia la morfología de la pared celular, la cual presenta una estructura rugosa y un gran número de pliegues, así como las uniones que existen entre las células; lo cual concuerda con el reporte de Ni y col. (2004) en donde por medio de microscopía electrónica de transmisión pudieron observar la pared y la membrana celular.

En otro estudio, Femenia y col. (1999) realizaron una caracterización química de la planta de sábila en donde se llevó a cabo la disección de las hojas de la planta entera, en filetes y el gel. El polisacárido detectado en el filete y en las fracciones de gel correspondía a un polisacárido de almacenamiento situado en el protoplasto de las células parenquimatosas. Por sus características estructurales y de composición corresponde a la de un polisacárido activo conocido como acemanosa.
3 Procesamiento del gel de Aloe vera
3.1 Industrialización del gel de Aloe vera
El cultivo comercial de Aloe vera para obtener el gel, inicio en el año 1920 en Florida, caracterizada por ser una planta subtropical con hojas lanceoladas y cuenta con espinas en los bordes, se considera una planta xerofítica (Albornoz e Imery, 2003). A lo largo de la historia se ha usado terapéuticamente en el uso de la medicina popular, como heridas en la piel y otros trastornos, que se remontan desde hace miles de años; hoy en día el procesamiento del gel de sábila para uso medicinal, cosmético y como alimento funcional, se ha convertido en una gran industria en todo el mundo (Vogler y Ernst, 1999; Eshun y He, 2004). En la industria alimentaria, la sábila se ha utilizado en productos como, leche, helados, yogurts y confitería sin embargo, el jugo de sábila ha sido utilizado como alimento funcional especialmente para la preparación de bebidas que no tengan efectos laxantes (Ramachandra y Srinivasa, 2008). En cuanto a la industria farmacéutica el uso comercial del gel de sábila es muy importante en cuanto a la fabricación de ungüentos tópicos, tabletas y capsulas. En la industria cosmética, el gel de sábila ha sido empleado como material de base para la preparación de cremas, lociones, jabones, champús, cremas faciales y una amplia variedad de productos de tocador.
El uso potencial de los productos de sábila con frecuencia, implica algún tipo de tratamiento, por ejemplo, calefacción, deshidratación o molienda. Desafortunadamente y debido a los procesamientos inadecuados que se llevan a cabo durante la preparación y estabilización del gel, se causan modificaciones irreversibles en componentes bioactivos como polisacáridos y compuestos antioxidantes, afectando su estructura original y promoviendo cambios importantes en las propiedades bioquímicas, haciendo que muchos de los productos contengan muy poco o casi ningún ingrediente activo (Kim y col., 1998). Es por ello que en las últimas décadas diversos estudios se han enfocado a investigar los principales compuestos químicos activos responsables de los efectos terapéuticos reportados, de igual manera se han interesado en desarrollar un método eficaz para mantener y preservar de manera natural dichos compuestos contenidos en el gel de Aloe vera con la finalidad de mejorar la calidad del producto (Moore y McAnalley, 1995; Cerqueira y col., 1999; He y col., 2005; Bozzi y col., 2007; Ramachandra y Srinivasa, 2008).
Cuando el gel de Aloe vera se expone al aire, este se oxida rápidamente y se descompone, perdiendo gran parte de su actividad biológica. Se han descrito diferentes técnicas de procesamiento del gel con respecto a su estabilización y esterilización, es decir, el procesamiento en frío o el tratamiento térmico. Sin embargo, el principio fundamental de estas técnicas de procesamiento sigue siendo aun prácticamente el mismo. Independientemente de la calidad de la planta por sí misma, los mejores resultados se obtienen cuando las hojas se procesan inmediatamente después de la cosecha, esto es debido a que el gel sufre una descomposición provocada por reacciones enzimáticas, así como el crecimiento de bacterias, debido a la presencia de oxígeno, elevada actividad de agua y alto contenido de azúcares. Todo el proceso consiste en lavar las hojas de sábila recién cosechadas con un bactericida adecuado, seguido por el procesamiento de separar mecánicamente el parénquima del exocarpio, una vez obtenido el gel éste se trata con carbón activado para decoloración y la expulsión de aloína y antraquinonas. El líquido resultante se somete a diversas etapas de filtración, esterilización y estabilización. El líquido estabilizado obtenido es entonces concentrado para reducir la cantidad de agua o alternativamente, casi toda el agua es removida para obtener un polvo (Ramachandra y Srinivasa, 2008; He y col., 2005). Se ha reportado que el uso de enzimas como la glucosa oxidasa y la catalasa inhiben el crecimiento de organismos aerobios del gel. Otras medidas de esterilización en frío son la exposición del gel a la luz ultravioleta, seguido de una microfiltración.
En la técnica de procesado con calor, el líquido de la sábila obtenido del tratamiento con carbón activado es esterilizado por medio de una pasteurización a alta temperatura con tiempos de exposición cortos. Se ha reportado que la actividad biológica del gel permanece esencialmente intacta cuando el gel es calentado a 65 °C por periodos menores a 15 minutos. Periodos extendidos o altas temperaturas han resultado en alta reducción de los niveles de actividad biológica. Sin embargo, se sugiere que el mejor método de pasteurización es el HTST (High Temperatura Short Time por sus siglas en inglés), seguido de un enfriado súbito a 5 °C o menor. En estas técnicas, la estabilización puede alcanzarse por la adición de conservadores y otros aditivos. Asimismo, se ha investigado el uso de benzoato de sodio, sorbato de potasio, ácido cítrico y vitamina E en forma sinérgica y se ha demostrado que el uso de estas sustancias en conjunto mantienen la bioactividad de la sábila de manera eficaz (Ramachandra y Srinivasa, 2008). Las etapas más importantes del procesamiento de Aloe se detallan en la siguiente sección.
3.2 Etapas del procesamiento del gel de Aloe vera
El procesamiento del gel de Aloe vera (Fig. 5) inicia con la cosecha de la sábila; esta consiste en cortar las hojas a mano desde la base de la planta; las hojas se transportan a la planta procesadora, para ello se emplean hieleras portátiles o camiones con refrigeración integrada. El proceso de corte puede generar cierto oscurecimiento en las zonas de los cortes debido a la oxidación enzimática (Beppu y col., 2006; Sierra y col., 2000).
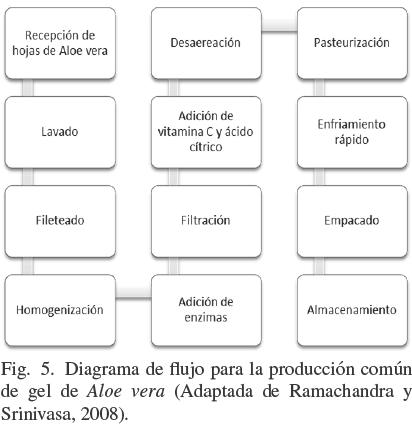
El proceso en la planta procesadora involucra un lavado de las hojas frescas con agua y soluciones bactericidas. Generalmente, el gel puede ser removido mecánicamente de las capas exteriores por medio de una operación conocida como fileteado, pero existen otros métodos para la obtención del gel, tales como:
• Escurrimiento simple: con este procedimiento se obtiene un gel de excelente calidad, se realizan cortes en la planta y por gravedad se recoge el gel liberado. La desventaja de este método radica en que el tiempo de obtención es muy lento y posee muy bajo rendimiento.
• Escurrimiento con adición de calor: el rendimiento es mayor que con el escurrimiento en frió o simple, ya que al calentar la viscosidad del gel disminuye y se facilita el escurrimiento, pero existe un mayor daño en los componentes bioactivos y un incremento en las reacciones de oxidación debidas al tratamiento térmico.
• Separación mecánica por prensado: con este método se obtienen geles con restos de paredes vegetales de la planta; se ha encontrado que estos restos catalizan una coloración roja en el gel.
• Separación mecánica manual y frotación de las hojas: En este método las hojas de Aloe son cortadas por sus orillas y se separa en forma manual una de las caras, así la hoja con el gel se raspa con una malla de acero para extraerlo. Este procedimiento es de bajo rendimiento y complicado. La separación provoca que en ocasiones, material vegetal de las paredes de las hojas se pasen al gel disminuyendo la calidad del producto.
• Separación manual por fileteado: cortes manuales a la hoja se realizan fileteando el gel con un cuchillo a partir de aproximadamente 2.5 cm desde la base de la hoja abarcando su extremo superior y las partes laterales, el gel obtenido se licúa con aspas de acero. Este es el método más utilizado y que provee mejores rendimientos y una mejor calidad del gel, pero se requiere una mayor mano de obra para realizar esta operación (Conti y col., 2006; Reynolds, 2004).
El siguiente paso es la molienda, los filetes del gel se homogenizan en un triturador comercial de alta velocidad a temperatura ambiente (25 °C). Mientras más largo sea el tiempo de molienda, mayor será el índice de oscurecimiento en el jugo del gel de Aloe vera, debido a las reacciones de pardeamiento enzimático. Por lo tanto, al triturar o moler se recomienda emplear alrededor de 10 a 20 minutos para evitar este oscurecimiento. El gel licuado es de alto rendimiento y apto para su uso en la industria alimentaria, farmacéutica y cosmética (Liu, 2001).
Posteriormente, se lleva a cabo una estabilización del gel mediante la adición de enzimas pectolíticas; ésta se lleva a cabo para mantener los compuestos biológicamente activos, como los polisacáridos, ya que son los componentes más abundantes e importantes en el gel de sábila. Se ha reportado que la adición de enzimas a 50 °C y por periodos de 20 minutos no inducen la pérdida de la actividad biológica de los polisacáridos en el gel (Ramachandra y Srinivasa, 2008). Una vez adicionadas las enzimas se hace una filtración; esta operación influye en la estabilidad del jugo de gel de sábila y se lleva a cabo la sedimentación de partículas en el producto.
En seguida se hace una adición de vitamina C y ácido cítrico. El jugo de sábila sin pasteurizar se fortifica con vitamina C y acido cítrico para evitar reacciones de pardeamiento, para mejorar el sabor del jugo y para lograr una mejor estabilización. El pH del jugo se ajusta entre 3.0 y 3.5 mediante la adición de ácido cítrico.
Otro paso, es realizar una desaeración que generalmente se realiza haciendo vacío en el gel líquido para eliminar el oxígeno atrapado en forma de burbujas durante el proceso de homogenización. El objetivo de este proceso es evitar la oxidación del acido ascórbico, lo cual mejora la vida útil del jugo del gel de Aloe vera.
El proceso de pasteurización es similar al procesamiento de jugos de vegetales; este proceso puede afectar el sabor, la apariencia y el contenido de la actividad biológica del producto de gel de Aloe vera. El proceso de HTST a 85-95 °C durante 1 o 2 min, es un método eficaz para evitar el mal sabor y la pérdida de actividad biológica del gel (Eshun y He, 2004).
Después de la pasteurización, el jugo se enfría súbitamente hasta 5 °C durante 10-15 segundos. Este es un paso crucial para preservar la actividad biológica del gel.
Finalmente el jugo del gel de Aloe vera se puede envasar en frascos de vidrio o plástico para su distribución. Es necesario para su conservación controlar la humedad relativa y la temperatura, el control de ambos parámetros ambientales son muy importantes, pues variaciones drásticas de temperatura y humedad pueden afectar las sustancias volátiles del jugo y que pueden ser absorbidas por el material de embalaje y en consecuencia, afectar la calidad y la vida util del producto (Hernández y Giacin, 1998).
3.3 Otras técnicas para el procesamiento del gel de Aloe vera
El procesamiento del Aloe vera, se ha convertido en un gran comercio en todo el mundo debido a las diversas aplicaciones que se le ha dado. De manera artesanal el gel se seca al sol como método económico y alternativo (O?Brien, 2005; Paez y col., 2000). El secado convectivo del gel bajo condiciones controladas, el secado por aspersión y la liofilización son los principales métodos empleados para la conservación de la sábila y a trabéis de estos procesos obtener diferentes productos. El secado por convección en sus diferentes modalidades ha sido investigado en los últimos años y se ha enfocado en estudiar los efectos que tiene este tratamiento térmico en los componentes activos del gel, principalmente la disminución de su capacidad antioxidante y en caracterizar las cinéticas de secado del gel de sábila; por ejemplo Vega y col. (2007) y Miranda y col. (2009) han estudiado la influencia de la temperatura en los parámetros cinéticos del secado convectivo del gel, mostrando que el incremento de la temperatura en un rango de 50 a 90 °C, reduce el tiempo de secado desde 800 hasta 200 min para alcanzar una humedad de equilibrio específica, así como la reducción de la capacidad antioxidante del gel con el incremento de la temperatura del aire de secado.
En otro estudio hecho por Nindo y col. (2007), han obtenido polvo de la sábila por tres diferentes métodos de secado (liofilización, aspersión y ventana reflectante) y se ha cuantificado la influencia del método de secado en parámetros tales como la temperatura de transición vítrea, viscosidad y color; demostrando que el método de secado por aspersión junto con la adición de maltodextrina provocan un desplazamiento en la temperatura de transición vítrea del polvo de Aloe y que su color fue más blanco y brillante en comparación a los otros dos métodos de secado empleados y no se observó una tendencia clara en los valores de viscosidad.
La sábila también se ha secado por medio de secadores de tambor, horno y secado convectivo forzado; estas técnicas se han usado sobre todo en productos textiles recubiertos con sábila, como en guantes de uso domestico o industrial (Bae y Kim, 1998; Cheng y Chen, 2009; Chou, 2002; Xu y Zhao, 2003). El secado por aspersión es un método ampliamente utilizado para concentrar y preservar los extractos de la sábila proporcionado un menor daño en la actividad biológica de los productos obtenidos, en comparación con el secado convectivo con aire forzado. Lo anterior se debe a los cortos tiempos de residencia del producto en los secadores por aspersión, aunque en algunos casos la adición de maltodextrinas y otros materiales de pared provoca que los productos de Aloe vera disminuyan su actividad biológica en comparación con la bioactividad que posee el gel natural o fresco (Reynolds, 2004). Por otro lado, la liofilización es un proceso donde se aplican bajas temperaturas para la remoción del agua del gel lo que permite conservar adecuadamente la actividad biológica de la sábila y en consecuencia obtener productos finales de alta calidad.
Como ya se mencionó anteriormente, durante el procesamiento terrífico del gel, se producen daños en las membranas celulares que desempeñan un papel clave en los cambios que se producen en la estructura de los tejidos del gel. Los cambios en las membranas celulares puede variar entre permeabilización parcial o total, dependiendo del tratamiento; esto promueve cambios importantes en los efectos fisiológicos y farmacológicos de los ingredientes activos de los productos de Aloe vera (Kim y col., 1998; Choi y Chung, 2003; Xiu y col., 2006; Yao y col., 2009). Por lo tanto, con el fin de preservar y mantener de forma natural los componentes bioactivos de materiales biológicos, la aplicación de nuevas tecnologías han sido investigadas para sustituir, mejorar, modificar o complementar las alternativas convencionales empleadas en el procesamiento de materiales biológicos incluido el gel de sábila. Estas tecnologías incluyen las Altas Presiones Hidrostáticas (APH), calentamiento óhmico, pulsos eléctricos, microondas, radiación gamma y ultrasonido; con el uso de estas nuevas tecnologías se ha logrado garantizar la inocuidad alimentaria de estos productos, así como la preservación de las características sensoriales y nutricionales, con la finalidad de obtener productos similares a los alimentos frescos (Hoover y Farkas, 1989; Mackey y col., 1994; Fernández y col., 2001; Deliza y col., 2005; McInerney y col., 2007).
De estas nuevas tecnologías, la aplicación de APH es la más estudiada actualmente, aunque la idea de aplicar presión para la preservación de alimentos y materiales biológicos ya se había planteado desde finales del siglo XVIII (Butz y col., 2003), pero debido al desarrollo tecnológico actual, el procesamiento de materiales biológicos con APH se ha usado como una alternativa no térmica para la conservación de biomateriales tan eficaz como el tratamiento térmico convencional. Adicionalmente, las APH también reducen el tiempo de procesamiento y reduce a un mínimo los daños por calor y los daños por la formación de cristales de hielo (tal como puede suceder en la liofilización), así como la retención de frescura, sabor, textura y color de los productos.
La conservación de la calidad y frescura de los materiales biológicos tratados por presión se debe a que las condiciones de presión-temperatura-tiempo que se usan ocasionan sólo ligeros cambios químicos, por lo que no afectan sus propiedades sensoriales y nutricionales (Torres y Velázquez, 2005). También el uso de APH permite la inactivación de patógenos y componentes moleculares que contribuyen al deterioro en la calidad de los productos. La técnica de conservación con APH consiste en aplicar presiones en un rango de 100-600 MPa por intervalos de tiempo relativamente cortos (0-30 min). En algunas ocasiones se puede combinar con tratamiento a temperaturas moderadas (aprox. 45°C) para mejores resultados. El proceso resulta letal en los microorganismos al provocar cambios morfológicos en sus membranas y para la inactivación enzimática, pero no llegan a romper los enlaces covalentes presentes en los compuestos bioactivos y materiales biológicos, permitiendo que la calidad de los productos se mantenga sin mayores modificaciones. El proceso de las altas presiones hidrostáticas ofrece varias ventajas tales como:
• Evita la deformación de los alimentos debido a que la presión que se transmite es uniforme e instantánea, es decir, no hay gradientes de presión (cumple la denominada regla isostática) (Cheftel, 1995; Pothakamury y col., 1995).
• No produce deterioros de nutrientes termolábiles como las vitaminas (no destruye la vitamina C en los zumos, frente a los métodos tradicionales de pasterización) (Kimura y col., 1994), ni altera otros compuestos de bajo peso molecular principalmente aquellos responsables del aroma y sabor (Eshtiaghi y Knorr, 1993).
• No altera el sabor natural, ni la coloración del alimento, pues las altas presiones no favorecen las reacciones de Maillard o de pardeamiento no enzimático y además evita la oxidación lipídica en ciertos productos (Hayashi, 1989; Tamaokay col., 1999; Gross y Jaenicke, 1994).
• No produce residuos, se trata de una energía limpia, no precisa de la incorporación de aditivos al alimento, mejora o provoca la incorporación de propiedades funcionales en los materiales biológicos (Kimura y col., 1994).
• Inactivación/activación de enzimas para retardar/acelerar procesos de maduración, fermentación u otro tipo de transformaciones enzimáticas deseables en los biomateriales (Pothakamury y col., 1995).
Así, la aplicación de métodos de procesamiento no térmico como las APH surgen de la necesidad de obtener productos que conserven su frescura y naturalidad, y sobre todo, que tengan un alto valor nutrimental o nutracéutico. Los productos vegetales frescos incluido el gel de Aloe, son fuentes ricas de una amplia gama de micronutrientes esenciales y fitoquímicos biológicamente activos, como los carotenoides y polifenoles, muchos de los cuales han supuesto beneficios para la salud. Recientemente, está surgiendo evidencia en estudios en animales que los fitoquímicos podrían ofrecer una mayor protección contra las enfermedades crónicas cuando actúan en combinación, en lugar de hacerlo individualmente. El procesamiento con APH es una innovadora tecnología emergente con potencial para la optimización de la ingesta de nutrientes y los fitoquímicos en la alimentación humana (Kris-Etherton y col., 2002; McInerney y col., 2007; Tamimi y col., 2005). La retención de las propiedades organolépticas, el incremento de la actividad de los fitoquímicos, conservación de la frescura y prolongación de la vida útil, sin duda ha aumentado el atractivo de procesar materiales biológicos mediante APH (Deliza y col., 2005), por estas razones ha surgido la inquietud de desarrollar tecnologías de procesamiento no térmicas como las APH, que permitan extender la vida útil de los productos, pero modificando la integridad del producto lo menos posible.
En el caso del tratamiento del gel de sábila con APH, investigaciones recientes han mostrado la bondad de esta tecnología en la conservación de diversas propiedades del gel. Vega y col. (2011a) estudiaron el efecto de las APH a 300, 400 y 500MPa sobre las propiedades funcionales y en las características de calidad (contenido de vitaminas A y E, aloína, minerales, compuestos fenólicos y actividad antioxidante) del gel. Ellos encontraron que durante el almacenamiento por 35 días de los productos tratados con APH, el contenido de minerales como K, Na, Ca y Mg disminuyen con respecto a la muestra fresca (0 días de almacenamiento) y sin tratamiento pero almacenada, con excepción del P que mostró un mayor contenido al ser tratado con APH. También los contenidos de compuestos fenólicos totales, vitamina C y E se ven disminuidos con el tratamiento APH principalmente a 500 MPa con respecto a las muestras sin tratamiento, pero con una disminución menor en vitamina C. Mientras que todos los tratamientos con APH mostraron un alto contenido de actividad antioxidante y aloína con respecto a las muestras sin tratar, los máximos valores fueron alcanzados a 400 MPa.
En otro estudio del mismo grupo de investigación (Vega y col. 2011b), evaluaron el pretratamiento con APH a 300 MPa por 30s y su efecto en las cinéticas de secado convectivo, capacidad antioxidante, firmeza y microestructura en el gel de sábila. En este estudio se concluye que el pretratamiento con APH incremento los coeficientes de difusión de agua, las velocidades de secado, provocó cambios importantes en la microestructura, y proporciónó productos más suaves y con una mayor capacidad antioxidante con respecto a las muestras sin tratamiento; lo que indica que el efecto combinado de las APH y el secado permiten obtener productos deshidratados con alta capacidad antioxidante.
También la inactivación microbiana con APH en el gel de sábila fue investigada por Vega y col. (2011c), quienes encontraron que las muestras tratadas a 400 y 500 MPa por 1, 3 y 5 min presentaron niveles indetectables de los microorganismos monitoreados. Estos estudios muestran las ventajas que tiene el tratamiento con APH para mejorar las propiedades funcionales, nutricionales, estructurales, de transferencia de masa, de estabilidad y microbiológicas del gel de Aloe vera.
4 Actividad biológica del Aloe vera y su relación con diferentes patologías
Finalmente, como se ha mencionado anteriormente el gel de Aloe vera es una fuente amplia de micronutrientes esenciales (Na 3660 mg/100 g, Ca 3319 mg/100 g, Mg 1536 mg/100 g, K 4060 mg/100 g) y de fitoquímicos activos, como acido ascórbico (127.6 mg/100g), tocoferoles o vitamina E (0.217 mg/100 g) y compuestos fenólicos totales (79.2 mg equivalentes de acido gálico/100 g), que son capaces de reducir los radicales libres que causan las reacciones de oxidación asociados con diversos padecimientos y enfermedades, tales como el envejecimiento, las enfermedades cardiovasculares y carcinogénesis, entre otras (Loots y col., 2007; McInerney y col., 2007; Miranda y col., 2009). La cantidad de micronutientes y de fitoquímicos activos del Aloe vera es similar y algunas veces superior al contenido reportado para otras fuente naturales ricas en estos compuestos; por ejemplo la naranja (sodio 1 mg/100 g, calcio 46 mg/100 g, 11 mg/100 g, potasio 200 mg/100 g, acido ascórbico 31 mg/100 g), la nuez que es reportada como una fuente rica de vitamina E (Na 2 mg/100 g, Ca 92 mg/100 g, Mg 131 mg/100 g, K 450 mg/100 g, vitamina E 25 mg/100 g), también se ha reportado que el vino tinto es una fuente rica de compuestos fenólicos (65-165 mg acido gálico/L), (De Chávez y col., 1992; Ojeda, 2007). También, debido a la amplia actividad biológica que posee la planta de Aloe vera y sus múltiples y diferentes usos, ha sido esencial establecer las relaciones entre los componentes de la planta y sus efectos biológicos, y como se ha mencionado anteriormente también es importante el desarrollo de métodos eficaces de procesamiento que permitan preservar y mantener las entidades químicas bioactivas presentes de forma natural (Choi y Chung, 2003). La mayoría de los estudios científicos publicados de sábila se refieren a la clasificación de la planta misma o de sus componentes. Asimismo, mientras que muchos estudios se han realizado en los componentes de la sábila, son más escasos las investigaciones acerca de cuáles de estos componentes químicos poseen actividad biológica. Por ello, en los últimos años se han realizado algunas investigaciones con respecto a la actividad biológica de la sábila y su efecto con diferentes patologías. A continuación se describen algunos trabajos que muestran las diferentes actividades biológicas que posee la planta.
4.1 Actividad en el sistema nervioso central
Kosif y col. (2008) investigaron el efecto del gel de Aloe vera en el sistema nervioso central de ratas Albino Wistar, estas fueron alimentadas diariamente durante 3 semanas por medio de sonda con una dosis de gel de sábila fresco de 25 mg/kg. Muestras de tejido de cerebro, cerebelo, hipocampo y zona ventricular fueron analizados por medio de cortes histológicos y tinciones con hematoxilina, eosina y violeta de cresilo y observados con microscopía de luz. Los resultados indicaron que el gel de sábila no tiene ningún efecto toxico en las neuronas ni en las células gliales del sistema nervioso central de cada tejido estudiado. Se observó que no hubo cambios en los cuerpos de Nissl, en los axones ni en los núcleos de las neuronas, ya que las caracteríísticas citoplasmáticas de éstas fueron las mismas después del tratamiento. Sin embargo, la relación entre las células de Purkinje y el tejido circundante del cerebelo se redujo considerablemente en el grupo tratado. Otro hallazgo importante fue el cambio de las células ependimarias en la zona ventricular, el número y el tamaño de estas células se incrementaron notablemente. Algunas aéreas del tejido simple cambiaron a tejido estratificado. También se pudo observar que las microvellosidades y los cilios en la zona apical de estas células y los capilares en la región del plexo coroideo fueron aumentados considerablemente. Aunque se encontraron importantes cambios morfológicos, los autores concluyeron que se requieren más estudios para poder comprender el o los mecanismos de acción del gel de sábila y su efecto sobre el sistema nervioso central.
4.2 Actividad angiogénica
Es bastante conocido que el gel de Aloe vera mejora la cicatrización de heridas en forma dosis-dependiente y reduce el edema y dolor (Davis y col., 1986; Davis y col., 1987). En la cicatrización de heridas, la angiogénesis es un proceso esencial (Thompson y col., 1991). La angiogénesis es el crecimiento de nuevos capilares a partir de capilares preexistentes y posteriores a las vénulas capilares (Bischoff, 1995; Folkman y Klagsbrun 1987). Cuando se altera la angiogénesis, como en los ancianos o en los tejidos irradiados, la curación de heridas se retrasa o no tiene éxito, por lo tanto, suponen que el gel de sábila puede contener un componente angiogénico pues mejora la cicatrización de heridas (Phillips y col., 1991; Lee y col., 1995). Lee y col. (1998) investigaron la actividad angiogeínica del gel de sábila y la proliferación de las células de la arteria pulmonar endotelial in vitro. Se ensayaron con extractos orgánico-acuosos del gel de Aloe vera observándose un aumento en la proliferación de las células de la arteria pulmonar endotelial, el estudio sugiere que la actividad angiogenica de los extractos del gel de sábila puede ser debido a un incremento en la estimulación de las células endoteliales y a una mayor expresión de enzimas proteolíticas, ya que estas juegan un rol importante en la degradación de la matriz extracelular.
4.3 Actividad inmunomoduladora
Existen estudios en donde algunos de los componentes de la sábila tienen un efecto inmunoestimulador e inmunosupresor, aunque la mayoría de los estudios se centran en los efectos inmunomoduladores del acemanano presente en el gel. Aunque se sabe que la fracción de polisacaíridos en el gel tiene actividades inmunomoduladoras, la identidad, el tamaño y composición de los principales polisacáridos inmunomoduladores aun no se conocen (Broudreau y Beland, 2006). Otros estudios indican que los polisacáridos en el gel contienen una actividad inmunomoduladora y explican que este efecto puede ocurrir por la activación de los macrofagos para generar oxido nítrico, secretar citoquinas (por ejemplo, factor-alfa de necrosis tumoral oí TNF-α, interleucina-1 ó IL-1, interleuquina-6 ó IL-6 y el interferón y ó INF-γ) y presentar marcadores celulares de superficie (Zhang y Tizard, 1996; Im y col., 2005). Algunas de las reacciones inmunitarias parecen ser específicas del acemanano en comparación con otros polisacáridos que incluyen la estimulación de la respuesta antigénica de los linfocitos, así como la formación de leucocitos, estudiados tanto en el bazo y la medula ósea de ratones que fueron sometidos a irradiaciones. Se cree que los efectos de inmunomodulacioín están vinculados a las glicoproteínas, es decir, las lectinas, que se encuentran en el gel de Aloe vera (Reynolds y Dweck, 1999).
En un estudio sobre las propiedades inmunomoduladoras del gel de sábila, se demostró que se requieren concentraciones relativamente altas de acemanano para lograr la activación de los macrófagos, lo que sugiere que hay otro componente inmerso en el gel que es el responsable de la activación de los macrófagos, a pesar de que sólo está presente en pequeñas cantidades, se postula que estos componentes no identificados del gel de Aloe vera tiene una gran potencia en términos de estimulación de macrófagos (Pugh y col., 2001).
Strickland y col., (2001) mencionan que el gel de sábila puede evitar la supresión de la inmunidad local y retardar las respuestas de hipersensibilidad debidas a la exposición a radiación UV. El mecanismo de este efecto de protección inmunológica de los polisacáridos del gel difiere de las descritas para los anti-oxidantes, anti-inflamatorios y las enzimas de reparación del ADN, asimismo encontraron que los polisacáridos del Aloe vera son efectivos incluso cuando se aplica un máximo de 24 horas después de la exposición a los rayos UV.
4.4 Actividad gastro-protectora
Enfermedades gastrointestinales como la ulcera gástrica, enfermedad de Crohn, gastritis, Síndrome del Intestino Irritable e incluso infecciones debido a bacterias como Helicobácter pylori se consideran un factor en el desarrollo de lesiones crónicas agudas de la mucosa gastrica (James y col., 1992). En un estudio Suvitayavat y col. (2004) evaluaron el efecto de una preparación del gel de Aloe vera en un modelo de fístula gástrica en ratas. La preparación de sábila inhibió la producción de ácido gástrico, estimuló pepsina y secreciones mucosas en las ratas tratadas.
En otro estudio para el tratamiento de colitis ulcerosa de moderada a leve, la sábila ingerida durante 4 semanas, produjo una respuesta clínica en los pacientes humanos con colitis más intensa en comparación con los pacientes que ingirieron solo el placebo, también se observo que redujo la actividad de la enfermedad y los resultados histológicos mostraron que la colitis ulcerativa disminuyo significativamente durante el tratamiento con sábila (Langmead y col., 2004a). En otro estudio Langmead y col. (2004b) evaluaron los efectos del Aloe vera in vitro en la producción de metanolitos reactivos a oxígeno, eicosanoides y la interleuquina-8, los cuales pueden ser asociados a la enfermedad inflamatoria intestinal. La actividad antioxidante de la sábila fue evaluada a través de dos métodos: uno fue la generación de radicales libres y el otro quimiluminiscencia con células incubadas provenientes de la mucosa colorrectal. El gel de Aloe vera tuvo un efecto inhibidor dependiente de la dosis sobre la producción de metabolitos reactivos a oxígeno, con este estudio los autores concluyeron que la actividad antiinflamatoria del gel in vitro puede tener un efecto terapéutico en la enfermedad inflamatoria intestinal.
En otro trabajo, se estudió el efecto de un extracto etanólico al 70 % de la hoja completa de sábila en lesiones agudas de la mucosa gástrica inducida por la producción de HCL 0.6M en el píloro de ratas Wistar y el extracto presento una fuerte actividad como agente gastro-protector contra las lesiones inducidas en la mucosa; en este estudio se concluye que la sábila está dotada de acciones contra la actividad secretora de ácido gástrico y puede proteger la mucosa gástrica en bajas concentraciones de agentes nocivos y que es posible usar el extracto en el tratamiento de la ulcera péptica (Yusuf y col., 2004).
Davis y col. (2006) realizaron estudios en humanos que muestran los efectos benéficos de la sábila en el tratamiento de síndrome de intestino irritable (SII) y en la colitis ulcerativa. Los resultados de este estudio mostraron que la ingestión de sábila es segura y que podría beneficiar a los pacientes con diarrea predominante o con estreñimiento en el SII.
Pogribna y col. (2008) investigaron el efecto del extracto de sábila en cultivos de bacterias puras y mixtas del intestino humano, mediante la evaluación del crecimiento bacteriano y los cambios en la producción de ácidos grasos de cadena corta. Los resultados indicaron que el Aloe vera posee actividad bacteriogénica in vitro y que altera la producción de los ácidos acético, propionico y butírico de los microorganismos seleccionados para el estudio. Estos resultados sugieren que el consumo de un suplemento dietético a base de sábila, pueden alterar la producción de ácidos grasos de cadena corta por la microflora intestinal humana.
4.5 Actividad hipoglucémica e hipolipidémica
Kim y col. (2009) utilizaron ratones con 4 semanas de edad que fueron alimentados con una dieta alta en grasas y baja en carbohidratos y se les administro el gel de sábila durante 8 semanas. La administración del gel de Aloe disminuyó los niveles de glucosa en sangre de los ratones y disminuyo el tamaño de los adipocitos. Con este estudio se demostró que la administración oral del gel de Aloe vera a un modelo in vivo puede ser usado en el tratamiento de diabetes Mellitus tipo II.
En otra investigación, se obtuvieron diferentes extractos del gel de sábila con éter de petróleo, cloroformo, metanol y agua destilada; todos los extractos fueron estudiados para evaluar la actividad hepatoprotectora en un modelo in vivo (ratones Swiss albino), a los cuales se les indujo un daño hepático. En este estudio se demostró que el extracto acuoso, tiene un potencial hepatoprotector y se confirmo con estudios histopatológicos en el tejido del hígado de los ratones (Chandan y col., 2007).
Yongchaiyudha y col. (1996) realizaron un estudio con 72 mujeres diabéticas que se les proporciónó una dosis de una cucharada de gel de Aloe vera y al grupo control un placebo durante 42 días. Los resultados obtenidos revelaron que los niveles de glucosa en la sangre se redujeron de 250 mg a 141 mg en el porcentaje de grupo experimental, mientras que los controles no mostraron importantes cambios. Además, el colesterol, los triglicéridos séricos, el peso y el apetito también fueron monitoreados. Con la excepción de los niveles de triglicéridos que se redujeron significativamente en el grupo del tratamiento activo, ningún cambio se detectó en el grupo control y las otras variables se mantuvieron inalteradas en ambos grupos.
Por otro lado, se ha observado que el Aloe vera puede tener un papel muy importante en la disminución de los niveles de colesterol LDL (lipoproteína de baja densidad) y de TG (triacilglicéridos), puesto que puede aumentar de manera significativa el colesterol HDL (lipoproteína de alta densidad), debido a los esteroles de origen vegetal (esterol, citoesterol), germanio orgánico, cromo, acemanano, vitaminas, aminoácidos y enzimas (Dixit y Joshi, 1983). El colesterol es una grasa muy importante para el organismo, puesto que se encuentra en todas y cada una de sus células. Esta sustancia grasa es fabricada por el hígado y utilizada por el organismo en la construcción de membranas celulares, constitución de ácidos biliares y producción de hormonas. Los niveles altos de colesterol LDL están relacionados con los problemas cardiovasculares, puesto que si hay un exceso de esta grasa en la sangre, se acumula en las paredes de las arterias formando una placa que va estrechando la luz del vaso. Esta estrechez es conocida como aterosclerosis. El colesterol conocido como HDL tiene una acción contraria, es decir actúa como un limpiador, puesto que libera las paredes de los vasos de la acumulación de la placa esclerosa (Glylling y col., 1995; Ntanios y col., 2003). Dixit y Joshi (1983) realizaron un estudio con monos donde observaron que el gel de sábila administrado por vía oral redujo el colesterol total en un 61% y un incremento en el contenido de lipoproteínas de alta densidad (HDL), los investigadores postulan que la acción de la sábila sobre el colesterol no es debida a uno sólo de sus componentes, sino a un efecto colectivo de todas las sustancias que forman parte de su compleja composición química. En otro estudio, se examino la eficacia del Aloe vera en pacientes con hiperlipidemia (Vogler y Ernest, 1999). Nasiff y col. (1993) realizaron un ensayo clínico controlado en 60 pacientes con hiperlipidémia que previamente no habían respondido a las intervenciones dietéticas. Los pacientes recibieron 10 ml o 20 ml de Aloe vera o placebo diariamente durante un período de 12 semanas. Los niveles de lípidos en sangre se midieron antes del tratamiento y después de cuatro, ocho y doce semanas. El colesterol total disminuyó en un 15.4% y 15.5%, los triglicéridos en un 25.2% y 31.9%, lipoproteínas de baja densidad (LDL) en un 18.9% y 18.2%, respectivamente en los grupos que recibieron sábila.
4.6 Efecto antioxidante del Aloe vera
Se ha encontrado que algunos polisacáridos del gel de sábila poseen propiedades antioxidantes y efectos protectores en células de origen animal (Wu y col., 2006). Chun-Hui y col., (2007) reportan que las propiedades antioxidantes dependen del grado de acetilación, el peso molecular, el tipo de azucares y el enlace glucosídico de los polisacáridos presentes en la sábila; ellos realizaron estudios en la planta de sábila entera así como de sus componentes estructurales (gel y piel) y caracterizaron los componentes químicos y evaluaron las actividades antioxidantes de los polisacáridos extraídos del gel y del exocarpio de hojas de la sábila. Encontraron que polisacáridos aislados denominados GAPS-1 (gel) y SAPS-1 (exocarpio) están compuestos de manosa: glucosa: galactosa en proporciones de 120:2:3 y 296:36:1 y con pesos moleculares de 1.74 x 105 y 3.97 x 104 Da, respectivamente. Una fuerte actividad de eliminación del radical superóxido fue encontrada para los dos polisacáridos extraídos, por otra parte, actividades moderadas de eliminación del radical hidroxilo y de inhibición de peroxidación lipídica fueron encontradas. Por último, concluyeron que el polisacárido extraído del gel tiene una mayor actividad antioxidante que el aislado del exocarpio, y esto puede ser debido a que tiene una mayor concentración de grupos acetilo.
En otro estudio, Lee y col. (2000) aislaron y caracterizaron un potente compuesto fenólico a partir de un extracto metanolico de sábila. El compuesto demostró tener una actividad antioxidante igual al α-tocoferol en un ensayo in vitro usando el cerebro de rata. Otro estudio reveló que extractos etanólicos de jugo de sábila poseen una fuerte actividad de eliminación de radicales libres y que esta actividad es mayor que la sábila en polvo y mencionan que el efecto antioxidante está relacionado con la madurez de la planta (Zheng y Wang, 2001). Hu y col., (2003) evaluaron la actividad antioxidante de extractos de sábila de diferentes etapas de madurez. Determinaron las concentraciones de polisacáridos y flavonoides de hojas de 2, 3 y 4 años de madurez, y su actividad antioxidante fue evaluada comparándolas con α-tocoferol y BHT (butil hidroxitolueno). Los resultados obtenidos señalan que todos los extractos de sábila tuvieron una considerable actividad antioxidante. El extracto de sábila de hojas de tres años de edad demostró que tenía una alta actividad de eliminación de radicales (72.19%), la cual es significativamente mayor que la del BHT (70.52%) y el α-tocoferol (65.20%). Los datos obtenidos sugieren que la etapa de madurez tiene un papel importante en la composición y en la actividad antioxidante de la sábila. Además de utilizar solventes orgánicos para la extracción de compuestos antioxidantes, se han propuesto otros métodos extractivos como la extracción supercrítica con dióxido de carbono.
En otro estudio Hu y col. (2005), también evaluaron y compararon la actividad de eliminación de radicales libres de extractos de Aloe vera obtenidos por extracción con dióxido de carbono en condiciones supercríticas y disolventes orgánicos, así como de antioxidantes de referencia. En cuanto a los resultados obtenidos encontraron que el porcentaje de inhibición de los extractos y los antioxidantes de referencia mostró el siguiente orden de bioactividad: Trolox (76.8%) > extracto de etanol del exocarpio de sábila (39.7%) > BHT (35.9%) > extracto de CO2 supercrítico (33.5%) > α-tocoferol (25.6%) > extractos etanólicos del gel de sábila (14.2%).
Conclusiones
En este trabajo se revisaron aspectos relativos al origen y estructura de la planta de Aloe vera, composición química y micro estructural, así como métodos tradicionales de procesamiento térmico y tecnologías emergentes para la conservación de componentes bioactivos del gel de sábila, al igual que sus aplicaciones, usos en la industria farmacéutica, cosmética y alimentaria y la actividad biológica de los compuestos activos del gel. Los datos compilados de la composición química y microestructural de la planta pueden ser de utilidad para ubicar que secciones de la planta o del gel puede tener un mayor efecto terapéutico. Mientras que los métodos de procesamiento revisados permiten visualizar cuales de los tratamientos pueden mejorar la conservación y estabilización del gel sábila y de sus componentes químicos bioactivos, mostrando además que el uso de las APH puede ser una tecnología emergente con alto potencial de aplicación para la obtención de productos derivados del gel con alta capacidad antioxidante. En general, esta revisión bibliográfica puede ser una fuente de consulta útil para conocer los aspectos generales más relevantes de la planta y sus aplicaciones en la ingeniería de alimentos y las ciencias farmacéuticas.
Agradecimientos
El primer autor agradece el apoyo al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca otorgada para cursar el doctorado en Alimentos de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional, incluido en el padrón de Postgrados de Excelencia, así como también a la Comisión de Operación y Fomento de Actividades Académicas (COFAA) del IPN por la beca PIFI otorgada como apoyo a los estudios de postgrado. Se agradece también el soporte financiero del proyecto SIP-IPN 20110627 y de los fondos financieros de la cátedra Coca-Cola para jóvenes investigadores 2011 otorgada por la Industria Mexicana de Coca Cola (IMCC) y el CONACYT.
Referencias
Aguilera, J. M. y Stanley, D. W. (1999). Microstructural principles of food processing and engineering. 2ed. Gaitherburg, M. D: Aspen Publishers, Inc. [ Links ]
Aguilera, J. M. (2005). Why food microstructure? Journal of Food Engineering 67(1-2), 3-11. [ Links ]
Albornoz, A. y Imery, J. (2003). Evaluación citogenética de ocho poblaciones de Aloe vera L. de la Península de Araya-Venezuela. Ciencia 11(1), 5-13. [ Links ]
Bae, J-H y Kim, O-Y. (1998) Skin-adhesive cosmetics for removing wrinkles, containing vitamins and Aloe extract. Patent: US005723138A. United States Patent. [ Links ]
Beppu, H., Shimpo, K., Chihara, T., Kaneko, T., Tamai, I., Yamaji, S., Ozaki, S., Kuzuya, H. y Sonoda, S. (2006). Antidiabetic effects of dietary administration of Aloe arborescens Miller components on multiple low-dose streptozotocin-induced diabetes in mice: Investigation on hypoglycemic action and systemic absorption dynamics of aloe components. Journal of Ethnopharmacology 103, 468-477. [ Links ]
Bischoff J. (1995). Approaches to studying cell adhesion molecules in angiogenesis. Trends Cell Biology 5, 69-74. [ Links ]
Boudreau, M. y Beland, F. (2006). An evaluation of the biological and toxicological properties of Aloe barbadensis (Miller) Aloe vera. Journal of Environmental Science and Health, Part C 24, 103-154. [ Links ]
Bozzi, A., Perrin, C., Austin, S. y Arce Vera, F. (2007). Quality and autenticity of commercial Aloe vera gel powders. Food Chemistry 103,22-30. [ Links ]
Butz, P., Fernández, A., Lindauer, R., S. Dieterich, A. Bognar, A. y Tauscher, B. (2003). Influence of ultra-high pressure processing on fruit and vegetable products. Journal of Food Engineering 56, 233-236. [ Links ]
Cerqueira, L., McKnight, L.S, Rodriguez, S. y Turner, C.E. (1999). Bifurcated method to process Aloe whole leaf. US Patent 5, 925, 357. [ Links ]
Chanona-Pérez, J., Quevedo, R., Jiménez- Aparicio, Gumeta-Chávez, A. R. C., Mendoza-Pérez, J. A., Calderon-Dominguez, G., Alamilla Bletran, L. y Gutiérrez-Lopez, G. F. (2008). Image processing methods and analysis for quantitative evaluation of size, shape, structure and microstruscture in food materials. In: Food Engineering: Integrated Approaches. Gutiérrez-Lopez, G. F., Barbosa-Canovas, G. V., Welti-Chanes, J. and Parada-Arias, E. (Eds). Springer Science, New York, USA. [ Links ]
Cheng, Yc. y Chen, Fb. (2009). Aloe vera glove and its manufacturing method. Patent: Us007579028b1. United States Patent. [ Links ]
Chithra, P., Sajithlal G.B. y Chandrakasan G. (1998). Influence of Aloe vera on collagen turnover in healing of dermal wounds in rats. Indian Journal of Experimental Biology 36, 896-901. [ Links ]
Cheftel, J. C. (1995). Review: High-pressure, microbial inactivation and food preservation. Food Science Technology International 1,75-90. [ Links ]
Choi, S. y Chung, M. (2003). A review on the relationship between Aloe vera components and their biologic effects. Seminars in Integrative Medicine 1, 53-62. [ Links ]
Chou, B. (2002). Aloe vera glove and manufacturing method. Patent Intellectual Property Law Group LLP, California, EUA, 103, 22-30. [ Links ]
Chun-hui, L., Chang-hai, W., Zhi-liang, X. y Yi, W. (2007). Isolation, chemical characterization and antioxidant activities of two polysaccharides from the gel and the skin of Aloe barbadensis Miller irrigated with sea water. Process Biochemistry 42, 961-970. [ Links ]
Conti, P., Simonetti, R., Lozano, E. y Figueroa, L. (2006). El poder curativo del Aloe vera. Pluma Y Papel Ediciones.1era Edición. Buenos Aires, Argentina, Pg: 26-56. [ Links ]
Costa, C., Antonucci, F., Pallotino F., Aguzzi, J., Sun, D.-W y Menesatti, P. (2011). Shape analysis of agricultural products: A review of recent research advances and potential application to computer vision. Food Bioprocess Technology 4, 673-692. [ Links ]
Cubero, S., Aleixos, N., Moltó, E., Goimez-Sanchis, J. y Blasco, J. (2011). Advances in machine vision applications for automatic inspection and quality evaluation of fruits and vegetables. Food Bioprocess Technology 4, 487-504. [ Links ]
Dagne, E., Bisrat, D., Viljoen, A. y Van Wyk, BE. (2000). Chemistry of aloe species. Current Organic Chemistry 4, 1055-1078. [ Links ]
Davis, J., Dibner, D. y Battey, J. F. (1986). End labeling of synthetic probes: Basic method in molecular biology. Elsevier Press Inc., New York, pp. 72-74. [ Links ]
Davis, R. H., Kabbani, J. M. y Maro, N. P. (1987). Aloe vera and wound healing. Journal of the American Podiatric Medical Association 77, 165-169. [ Links ]
Davis, R., Parker, W. y Samson, R. (1991). The isolation of an active inhibitory system from an extract of Aloe vera. Journal American Pediatric Medical Association 81, 258-261. [ Links ]
Davis, K., Philpott, S., Kumar, D. y Mendall, M. (2006). Randomised double-blind placebo-controlled trial of Aloe vera for irritable bowel syndrome. International Journal of Clinical Practice 60, 1080-1086. [ Links ]
De Chávez, M. M., Hernández, M. y Roldan, J. A. (1992). Tablas de uso practico del valor nutritivo de los alimentos de mayor consumo en México. Segunda Edición. Instituto Nacional de la Nutrition Salvador Zubiran. Comisión Nacional de Alimentación. [ Links ]
Deliza, R., Rosenthal, A., Abadio, F.B., Silva, C. y Castillo, C. (2005). Application of high pressure technology in the fruit juice processing: benefits perceived by consumers. Journal of Food Engineering 67, 241-246. [ Links ]
Dixit, V. y Joshi, S. (1983). Effect of Aloe barbadensis and clofibrate on serum lipids in triton induced hyperlipidaemia in Presbytis monkeys. Indian Journal of Medical Research 78, 417-421. [ Links ]
Du, C. y Sun, D. (2004). Recent developments in the applications of image processing techniques for food quality evaluation. Trends in Food Science and Technology 15, 230-249 [ Links ]
Du, C. y Sun, D. (2006). Learning techniques used in computer vision for food quality evaluation: a review. Journal of Food Engineering 72, 39-55. [ Links ]
Eshtiaghi, M. N. y Knorr, D. (1993). Potato cubes response to water blanching and high hydrostatic pressure. Journal Food Science 58(6), 1371-1373. [ Links ]
Eshun, K. y He, Q. (2004). Aloe vera: A valuable ingredient for the food, pharmaceutical and cosmetic industries-A review. Critical Reviews in Food Science and Nutrition 44, 91-96. [ Links ]
Femenia, A., Sánchez, E., Simal, S. y Rossello, C. (1999). Compositional features of polysaccharides from Aloe vera (Aloe barbadensis Miller) plant tissues. Carbohydrate Polymers 39, 109-117. [ Links ]
Fernández, A., Butz, P. y Tauscher, B. (2001). Effects of high-pressure processing on carotenoid extractability, antioxidant activity, glucose diffusion and water binding of tomato puree (Lycopersicom esculentum Mill). Journal of Food Science 66, 1033-1038. [ Links ]
Folkman, J. y Klagsbrun, M. (1987). Angiogenic factor. Science 235, 442-447. [ Links ]
Grindlay, D y Reynolds, T. (1986). The Aloe vera phenomenon: A review of the properties and modern uses of the leaf parenchyma gel. Journal of Ethnopharmacology 16, 117-151. [ Links ]
Gross, M. y Jaenickeí, R. (1994). Proteins under pressure. European Journal of Biochemistry 221, 617-630. [ Links ]
Gylling, H., Siimes, M. A. y Miettinen, T. A. (1995). Sitostanol ester margarine in dietary treament of children with familial hypercholesterolemia. Journal of Lipid Research 36, 1807-1812. [ Links ]
Hamman, J.H. y Viljoen, A.M. (2008). Use of Aloe vera for increasing the bioavailability of poorly absorbable drugs. SA patent application 2008/01542. [ Links ]
Hayashi, R. (1989). Application of high pressure to food processing and preservation: Philosophy and development. Engineering and food 2,815826. Spiess, W and Schubert, H. (ed.). Elsevier Applied Science, London. [ Links ]
He, Q., Liu, C., Eshun, K. y Zhang, T. (2005). Quality and safety assurance in the processing ofAloe vera gel juice. Food Control 16, 95-104. [ Links ]
Hernádez, R.J. y Giacin, J. R. (1998). Factors affecting permeation, sorption and migration processes in package-product systems. In: Food storage stability, Boca Raton, CRC Press, pp: 269-329. [ Links ]
Hoover, D. G., Metrick, C., Papineau, A. M., Farkas, D. F. y Knorr, D. (1989). Biological effects on high hydrostatic pressure en food microorganisms. Food Technology 43(3), 99-107. [ Links ]
Hu, Q., Xu, J., y Hu, Y. (2003). Evaluation of antioxidant potential Aloe vera (Aloe barbadensis Miller) extract. Journal of Agricultural and Food Chemistry 51(26), 7788-7791. [ Links ]
Hu, Q., Hu, Y., Xu, J. (2005). Free radical-scavening activity of Aloe vera (Aloe barbadensis Miller) extracts by supercritical carbon dioxide extraction. Food Chemistry 91, 85-90. [ Links ]
Im, S.-A., Oh, S.-T., Song, S., Kim, M.-R., Woo, S.S., Jo, T.-H., Park, Y.-I. y Lee, C.-K. (2005). Identification of optimal molecular size of modified Aloe polysaccharides with maximum immunomodulatory activity. International Immunopharmacology 5, 271-279. [ Links ]
James, F., Balch, M.D. y Balch, P.A. (1992). Prescription for natural healing. Academic Press, New York, p. 575. [ Links ]
Jia, Y., Zhao, G. y Jia, J. (2008). Preliminary evaluation: The effects of Aloe feroxMiller and Aloe arborescens Miller on wound healing. Journal of Ethnopharmacology 120, 181-189. [ Links ]
Kim, K. H., Lee, J. G., Kim, D. G., Kim, M. K., Park, J. H. y Shin, Y. G. (1998). The development of a new method to detect the adulteration of commercial Aloe gel powders. Archives of Pharmacal Research 21, 514-520. [ Links ]
Kim, K., Kim, H., Kwon, J., Lee, S., Kong, H., Im, S. A., Lee, Y. H., Lee, Y. R., Oh, S. T., Jo, T. H., Park Y. I., Lee, C. K. y Kim K. (2009). Hypoglycemic and hypolipidemic effects of processed Aloe vera gel in a mouse model of non-insulin-dependent diabetes mellitus. Phytomedicine 16, 856-863. [ Links ]
Kimura, K., Ida, M., Yosida, Y., Ohki, K., Fukumoto, T. y Sakui, N. (1994). Comparison of keeping quality between pressure-processed jam and heat-processed jam: changes in flavor components, hue, and nutriments during storage. Bioscience, Biotechnology, and Biochemistry 58, 1386-1391. [ Links ]
Kosif, R., Aktas, R. G. y Oztekin, A. (2008). The effects of oral administration of Aloe vera (barbadensis) on rat central nervous system: An experimental preliminary study. Neuroanatomy 7, 22-27. [ Links ]
Kris-Etherton, P. M., Hecker, K. D., Bonanome, A., Coval, S.M., Binkoski, A. E. y Hilpert, K. F. (2002). Bioactive compounds in foods: Their role in the prevention of cardiovascular disease and cancer. American Journal of Medicine 113, 71-88. [ Links ]
Langmead, L., Feakins, R. M., Goldthorpe, S., Holt, H., Tsironi, E., De Silva, A., Jewell, D.P. y Rampton, DS. (2004a). Randomized, doubleblind, placebo-controlled trial of oral Aloe vera gel for active ulcerative colitis. Alimentary Pharmacology and Therapeutics 19, 739-747. [ Links ]
Langmead, L, Makins, R.J. y Rampton, D.S. (2004b). Anti-inflammatory effects of Aloe vera gel in human colorectal mucosa in vitro. Alimentary Pharmacology and Therapeutics 19, 521-527. [ Links ]
Lee, M. J., Yoon, S. H. y Lee, S. K. (1995). In vivo angiog enic activity of dichloromethane extracts of Aloe vera gel. Archives of Pharmacal Research 18, 332-335. [ Links ]
Lee, M., Lee, O. y Yoon, S. (1998). In vitro angiogenic activity of Aloe vera gel on calf pulmonary artery endothelial (CAPE) cells. Archives Pharmacal Research 21, 260-265. [ Links ]
Lee, K. Y., Weintraub, S. T., y Yu, B. P. (2000). Isolation and identification of a phenolic antioxidant from Aloe barbadensis. Free Radical Biology and Medicine 28(2), 261-265. [ Links ]
Liu, C., (2001). Study on preservatives in the Aloe gel juice system. J. Wuxi University Light Ind. (Chenses), 20(5), 480-484. [ Links ]
Loots D. T., van der Westhuizen F. H. y Botes L. (2007). Aloe ferox leaf gel phytochemical content, antioxidant capacity, and possible health benefits. Journal of Agricultural and Food Chemistry 55, 6896. [ Links ]
Ma, J. F., Yangb, G. H., Maoa, J. Z. y Xu, F. (2011). Characterization of anatomy, ultrastructure and lignin microdistribution in Forsythia suspense. Industrial Crops and Products 33, 358-363. [ Links ]
Mackey, B. M., Forestiére, K., Isaacs, N. S., Stenning, R. y Brooker, B. (1994). The effect of high hydrostatic pressure on Salmonella Thompson and Listeria monocytogenes examined by electron microscopy. Letters in Applied Microbiology 19, 429-432. [ Links ]
McInerney, J. K., Seccafien. C. A., Stewart, C. M. y Bird, A. R. (2007). Effects of high pressure processing on antioxidantactivity, and total carotenoid content and availability, in vegetables. Innovative Food Science and Emerging Technologies 8, 543-548. [ Links ]
Miranda, M., Maureira, H., Rodriguez, K. y Vega, A. (2009). Influence of temperature on the drying kinetics, physicochemical properties, and antioxidant capacity of Aloe vera (Aloe barbadensis Miller) gel. Journal of Food Engineering 91, 297-304. [ Links ]
Moore, E.D. y McAnalley, B.H. (1995). A drink containing mucilaginous polysaccharide and its preparation. US Patent 5, 443, 830. [ Links ]
Nassiff, A., Fajardo, F. y Velez, F. (1993). Efecto del Aloe sobre la hiperlipidemia en pacientes refractarios a la dieta. Revista Cuba de Medicina General Integral 9, 43-51. [ Links ]
Ni, Y., Turner, D., Yates, K. y Tizard, I. (2004). Isolation and characterization of structural components of Aloe vera L. leaf pulp. International Immunopharmacology 4, 1745-1755. [ Links ]
Nindo, C., Powers, R. y Tang, J. (2007). Glass transition and rheological properties of Aloe vera (Aloe barbadensis, L.). Dried by Different Methods. An ASABE Meeting 23, 2261-2276. [ Links ]
Ntanios, F. Y., van de Kooij, A. J., de Deckere, E. A. M., Duchateau, G. S. M. J. E. y Trautwein, E. A. (2003). Effects of various amounts of dietary plant sterol esters on plasma and hepatic sterol concentration and aortic foam cell formation of cholesterol-fed hamsters. Atherosclerosis 169, 41-50. [ Links ]
O'Brien. (2005). Physical and chemical characteristics of Aloe gels. Disponible en: http://hdl.handle.net/10210/245. Accesado: 8 Septiembre de 2010. [ Links ]
Okamura, M., Asaia, M., Hine, N. y Yagi, A. (1996). High performance liquid chromatographic determination of phenolic compounds in Aloe species. Journal Chromatographic A 747, 225-231. [ Links ]
Ojeda, H. (2007). Los compuestos fenólicos de la uva. Enología 4,1-11 [ Links ]
Paez, A., Gebre, G., González, M. y Tschaplinski, T. (2000). Growth, soluble carbohydrates, and aloin concentration of Aloe vera plants exposed to three irradiance levels. Enviromental and Experimental Botany 44, 133-139. [ Links ]
Phillips, D., Whitehead, A. y Kighton, R. (1991). Initiation and pattern of angiogenesis in wound healing in the rat. American Journal of Anatomy 192, 257-262. [ Links ]
Pogribna, M., Freeman, J.P., Paine, D. y Boudreau M.D. (2008). Effect of Aloe vera whole leaf extract on short chain fatty acids production by Bacteroides fragilis, Bifidobacterium infantis and Eubacterium limosum. Letters in Applied Microbiology 46, 575-580. [ Links ]
Pothakamury, U. R., Barbosa-Canovas, G. V. y Swanson, B. G. (1995). The pressure builds for better food processing. Chemical Engineering Progress 91, 45-53. [ Links ]
Pritam, A. y Kale, P. G. (2007). Alteration in the antioxidant potential of Aloe vera due to fungal infection. Plant Pathology Journal 6, 169-173. [ Links ]
Pugh, N., Ross, S. A., ElSohly, M. A. y Pasco, D. S. (2001). Characterization of aloride, a new high molecular weight polysaccharide from Aloe vera with potent immunostimulatory activity. Journal of Agricultural and Food Chemistry 49, 1030-1034. [ Links ]
Ramachandra, C. y Srinivasa P. (2008). Processing of Aloe vera leaf gel: A review. American Journal of Agricultural and Biological Sciences 3, 502-510. [ Links ]
Reynolds, T. (1985). The compounds in Aloe leaf exudates: A review. Botanical Journal of the Linnean Society 90, 157-177. [ Links ]
Reynolds, T. y Dweck A. C. (1999). Aloe vera leaf gel: a review update. Journal Ethnopharmacology 68, 3-37. [ Links ]
Reynolds, T. (2004). Aloes: The Genus Aloe. Medicinal and aromatic plants-industrial profiles Editorial CPR Press LLC, Boca Raton, Florida. [ Links ]
Quintanilla-Carvajal, M.X., Meraz-Torres L.S., Alamilla-Beltran, L., Chanona-Pérez, J.J., Terres-Rojas, E., Hernández-Sanchez, H., Jiménez-Aparicio, A.R. y Gutiérrez-Lopez, G.F. (2011) Morphometric characterization of spray-dried microcapsules before and after a-tocopherol extraction. Revista Mexicana de Ingeniería Química 10, 301-312. [ Links ]
Rivero, R., Rodriguez, E., Menéndez, R., Fernández, J., Del Barrio, G. y González, M. (2002). Obtención y caracterización preliminar de un extracto de Aloe vera L. con actividad antiviral. Revista Cubana de Plantas Medicinales 7, 32-38. [ Links ]
Santacruz-Vázquez, V., Santacruz-Vázquez, C, Welti-Chanes, J., Farrera-Rebollo R. R., Alamilla-Beltraín, L., Chanona-Pérez, J. y Gutiérrez-Lopez, G. F. (2008). Effects of air-drying on the shrinkage, surface temperatures and structural features of apples slabs by means of fractal analysis. Revista Mexicana de Ingeniería Química 7, 55-63. [ Links ]
Sierra, C., Pezoa, C., Urqueta, R., Sierralta, R. y Alfaro, P. (2000). Adaptacioín, frecuencia de riego y fertilización de plantas de Aloe vera Cv. Barbadensis medidos en altura de Plantas, número de hojas, materia prima para gel y acíbar. Seminario Aloe vera: Corpadeco, Fia, Inia Intihuasi, 86 P. [ Links ]
Strickland, F. M. (2001). Immune regulation by polysaccharides: implications for skin cancer. Journal of Photochemistry and Photobiology B 63, 132-140. [ Links ]
Surjushe, A., Vasani, R. y Saple, D. G. (2008). Aloe vera: a short review. Indian Journal Dermatology 53, 163-166. [ Links ]
Suvitayavat, W. C., Sumrongkit C., Thirawarapan, S. y Bunyapraphatsara, N., (2004). Effects of Aloe preparation on the histamine-induced gastric secretion in rats. Journal of Ethnopharmacology 90, 239-247. [ Links ]
Talmadge, J., Chávez, J., Jacobs, L., Munger, C., Chinnah, T., Chow, J., Williamson, D., Yates, Kenneth. (2004). Fractionation of Aloe vera L. inner gel, purification and molecular profiling of activity. International Inmunopharmacology 4, 1757-1773. [ Links ]
Tamaoka, T., Itoh, N. y Hayashi, R. (1999). High pressure effect on Mailard reaction. Agricultural and Biological Chemistry 55, 2071-2074. [ Links ]
Tamimi, R. M., Hankinson, S. E., Campos, H., Spiegelman, D., Zhang, S. y colditz, G. A. (2005). Plasma carotenoids, retinol, and tocopherols and risk of breast cancer. American Journal of Epidemiology 161, 153-160. [ Links ]
Thompson, D., Harvey, A., Kazmi, M. y Stout, J. (1991). Fibrinolysis and angiogenesis in wound healing. Journal of Pathology 165, 311-318. [ Links ]
Torres, J. A. y Velazquez, G. (2005). Comercial opportunities and research challenges in the high presure processing of food. Journal of Food Engineering 67, 95-112. [ Links ]
Vázquez, B., Avila, G. y Segura, D. (1996). Antiinflammatory activity of extracts from Aloe vera gel. Journal of Ethnopharmacology 55,69-75. [ Links ]
Vega, G.A., Miranda, M., Aranda, M., Henriquez, K., Vergara, J., Tabilo-Munizaga, G. y Pérez-Won, M. (2011a). Effect of high hydrostatic pressure on functional properties and quality characteristics of Aloe vera gel (Aloe barbadensis Miller). Food Chemistry 129, 1060-1065. [ Links ]
Vega, G.A., Uribe, E., Pérez, M., Tabilo-Munizaga G., Vergara, J., Garcia-Segovia, P., Lara E. y Di Scala, K. (2011b). Effect of high hydrostatic pressure pretreatment on drying kinetics, antioxidant activity, firmness and microstructure of Aloe vera (Aloe barbadensis Miller) gel. LWT Food Science and Technology 44, 384-391. [ Links ]
Vega, G. A., Giovagnoli, C., Pérez-Won, M., Tabilo-Munizaga, G., Vergara, J., Miranda, M., Uribe, E. y Di Scala, K. (2011c). Application of high hydrostatic pressure to Aloe vera (Aloe barbadensis Miller) gel: Microbial inactivation and evaluation of quality parameters. Innovative Food Science and Emerging Technologies 13, 57-63. [ Links ]
Vergara-Fernández, A., Hernández, S., San Martín-Davison, J. y Revah, S. (2011). Morphological characterization of aerial hyphae and simulation growth of fusarium solani under different carbon source for application in the hydrophobic vocs biofiltration. Revista Mexicana de Ingeniería Química 10, 225-233. [ Links ]
Vinson, J. A., Al Kharh y Adreoli, L. (2005). Effect of Aloe vera preparations on the human bioavailability of vitamins C and E. Phytomedicine 12, 760-765. [ Links ]
Vogler, K., y Ernest, E. (1999). Aloe vera: a systematic review of its clinical effectiveness. British Journal of General Practice 49, 823-828. [ Links ]
Wu, J. H., Xu, C., Shan, C. Y., Tan, R. X. (2006). Antioxidant properties and PC12 cell protective effects of APS-1, a polysaccharide from Aloe vera var. chinensis. Life Sciences 78, 622-630. [ Links ]
Xiu, L.C., W. Changhai, F. Yongmei y L. Zhaopu. (2006). Effect of heat treatment and dehydration on bioactive polysaccharide acemannan and cell wall polymers from Aloe barbadensis Miller. Journal of Food Engineering 75, 245-251. [ Links ]
Xu, Y. y Zhao, B. (2003) The main origin of endogenous no in higher non-leguminous plants. Plant Physiology and Biochemistry 41, 833-838. [ Links ]
Yao, H., Chen, Y., Li, S., Huang, L., Chen, W. y Lin, X. (2009). Promotion proliferation effect of a polysaccharide from Aloe barbadensis Miller on human fibroblasts in vitro. International Journal of Biological Macromolecules 45, 152-156. [ Links ]
Yongchaiyudha, S., Rungpitarangsi, V., Bunyapraphatsara, N. y Chokechaijaroenporn, O. (1996). Antidiabetic activity of Aloe vera L. juice. I. Clinical trial in new cases of diabetes mellitus. Phytomedicine 3, 241-243. [ Links ]
Yusuf, S., Agunu, A. y Diana, M. (2004). The effect of Aloe vera A. Berger (Liliaceae) on gastric acid secretion and acute gastric mucosa injury in rats. Journal of Ethnopharmacology 93, 33-37. [ Links ]
Zhang, L. y Tizard, I.R. (1996). Activation of a mouse macrophage cell line by acemannan: the major carbohydrate fraction from Aloe vera gel. Immunopharmacology 35,119-128. [ Links ]
Zheng, W. y Wang, S. Y. (2001). Antioxidant activity and phenolic compounds in selected herbs. Journal of Agricultural and Food Chemistry 49, 5165-5170. [ Links ]














