Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.3 Ciudad de México dic. 2011
Termodinámica
Presiones de vapor y equilibrio líquido–vapor de acetato de propilo/metanol o 1–propanol a 0.15MPa. Sistemas binarios
Vapor pressures and vapor–liquid equilibrium of propyl acetate + methanol or + 1–propanol at 0.15MPa. Binary systems
P. Susial*, J.J. Rodríguez–Henríquez, J.C. Apolinario, V.D. Castillo y E.J. Estupiñan
Laboratorio de Tecnología Química General. Escuela de Ingenierías Industriales y Civiles. Universidad de Las Palmas de Gran Canaria. 35017 Las Palmas de Gran Canaria. Islas Canarias. España. * Autor para la correspondencia. E–mail: psusial@dip.ulpgc.es Tel. 34–28–45–14–89, Fax 34–28–45–86–58.
Recibido 24 de Mayo 2011.
Aceptado 30 de Julio 2011.
Resumen
Las presiones de vapor de metanol y 1–propanol en el intervalo de 0 a 1.6 MPa así como los datos del ELV para los sistemas binarios acetato de propilo + metanol y acetato de propilo + 1–propanol a 0.15 MPa han sido obtenidos. Los datos experimentales del ELV se verificaron con el test punto a punto de Van Ness. Diferentes modelos termodinámicos fueron utilizados para correlacionar la función GE/RT, obteniéndose valores inferiores a 0.03 para la desviación estándar. Ambos sistemas forman azeótropo a 0.15 MPa. Los modelos de predicción por contribución de grupos ASOG y diferentes versiones de UNIFAC han sido utilizados.
Palabras clave: presiones de vapor, datos isobáricos del ELV, acetato de propilo, metanol, 1–propanol.
Abstract
Vapor pressures of methanol and 1 –propanol from 0 to 1.6 MPa range and VLE data tor the binary systems of propyl acetate + methanol and propyl acetate + 1–propanol at 0.15 MPa have been determined. The experimental VLE data were verified with the point–to–point test of van Ness. Several thermodynamic models were used to correlate GE/RT function and the results of correlations showed values below 0.03 for the standard deviations. These systems have azeotropic point at 0.15 MPa. The different versions of UNIFAC and ASOG prediction models were applied.
Keywords: vapor pressures, VLE isobaric data, propyl acetate, methanol, 1–propanol.
1 Introducción
El acetato de propilo es un disolvente, ampliamente utilizado en las industrias de plásticos, pinturas y productos farmacéuticos. También se emplea como materia prima para adhesivos así como en la industria flexográfica en las formulaciones de las tintas. Esta sustancia produce mezclas azeotrópicas con algunos alcoholes.
La separación de las mezcla azeotrópicas, y por tanto, la obtención de las sustancias puras, se puede conseguir, entre otros procedimientos, modificando la presión del proceso. Es por lo que se hace necesario conocer las condiciones operatorias adecuada. Para tal finalidad, los datos de laboratorio son imprescindibles, en consecuencia, los ebullómetros y los equipos auxiliares utilizados para realizar las determinaciones experimentales han de ser verificados.
En trabajos anteriores (Susial y col., 2010a; Susial y col., 2010b) ha sido informada la construcción de un ebullómetro metálico con el que es posible realizar las determinaciones experimentales del equilibrio–líquido vapor (ELV) en condiciones moderadas de presión. No obstante, la necesidad de datos precisos hace conveniente realizar diferentes modificaciones en las instalaciones que deben ser verificadas. Es el motivo por el que se han obtenido los datos del ELV de los sistemas binarios constituidos por acetato de propilo (1) + metanol (2) y acetato de propilo (1) + 1–propanol (2) a 0.15 MPa.
Resa y col., (2001) han investigado a 101.3 kPa el ELV del sistema acetato de propilo (1) + metanol (2), mientras que el ELV del sistema acetato de propilo (1) + 1–propanol (2) ha sido estudiado en distintas condiciones operatorias (Gmehling y Onken, 1986; Ortega y col., 2000). Para ambos sistemas binarios ha sido descrito el punto azeotrópico (Gmehling y col., 2004; Ortega y col., 2000; Resa y col., 2001). En consecuencia, estos sistemas pueden ser utilizados como referencia y para la validación de las modificaciones introducidas en la instalación anteriormente informada (Susial y col., 2010a; Susial y col., 2010b).
Por otra parte, la validación termodinámica de los datos del ELV es función de las presiones de vapor de las sustancias. Motivo por el que para este trabajo se han determinado las presiones de vapor del metanol y del 1–propanol en un amplio intervalo de trabajo, y han sido utilizadas al aplicar a los sistemas binarios de este estudio el test punto–a–punto (Van Ness y col., 1973). Los datos obtenidos a 0.15 MPa del ELV de los sistemas binarios acetato de propilo + metanol y acetato de propilo + 1–propanol, presentan concordancia con el criterio de consistencia establecido en la literatura (Fredenslund y col., 1977). Con posterioridad a la consistencia termodinámicamente, se procedio a la verificación de los modelos de contribución por grupos UNIFAC (Gmehling y col., 1993; Hansen y col., 1991; Larsen y col., 1987) y ASOG (Kojima y Tochigi, 1979).
2 Parte experimental
2.1 Materiales y aparatos
Propiedades físicas como la temperatura de ebullición en condiciones normales, densidad a 298.15 K, y el índice de refracción a 298.15 K, determinadas para el acetato de propilo (Alfa Aesar GmbH & Co. con una pureza del 99% masa/masa), metanol y 1–propanol (respectivamente de 99.9 y el 99.8% masa/masa de pureza, ambos de Panreac Química SA), y su comparación con los valores encontrados en la literatura se muestran en la Tabla 1. Estos productos químicos se utilizaron tal y como se recibieron del proveedor. Para determinar la densidad y el índice de refracción de las sustancias a 298.15 K se utilizaron un densímetro de tubo vibrante (Kyoto Electronics DA–300) el cual tiene ± 0.1 kg–m de precisión y un refractómetro Zusi modelo 315RS Abbe con incertidumbre igual a ± 0.0002 unidades, respectivamente.
2.2 Equipos y procedimiento
El trabajo experimental de este estudio se realizó con un ebullómetro dinámico, en el que se verifica la recirculación de ambas fases, equipado con una bomba Cottrell, y que ha sido descrito anteriormente (Susial y col., 2010a; Susial y col., 2010b). Sin embargo, para este trabajo se utilizaron sondas Pt100 de Dostmann Electronic GmbH a las que se les incluyó una pieza con rosca y realizó la soldadura de un anillo a su vaina. Posteriormente, fue ensamblada la parte eléctrica dentro de la vaina, posibilitando roscar la sonda al ebullómetro de acero inoxidable. Al utilizar las sondas indicadas con un lector digital modelo p655 de Dostmann Electronic GmbH, la temperatura se determino con una incertidumbre de ± 0.02 K. La soldadura del anillo a la vaina de la sonda, así como el calibrado del conjunto sonda–lector fue realizado por Dostmann Electronic GmbH. Las normas de NPL (National Physical Laboratory) y NIST (National Institute of Standards & Technology) fueron aplicadas durante la calibración del dispositivo. Después de montar las sondas en el ebullómetro, se verificó su correcto funcionamiento por la medida del punto de ebullición del agua destilada.
La presión de trabajo se midió utilizando un transductor con lector digital modelo 8311 de Burket Fluid Control Systems aplicable para un intervalo de operación comprendido entre 0.0 y 4.0 MPa (incertidumbre de ± 0.002 MPa). Una válvula de control (Binks MFG Co.) se incluyó en la instalación con el fin de regular el flujo de nitrógeno seco al equipo durante la operación en continuo y para la determinación de los datos experimentales del ELV. Sin embargo, para determinar las presiones de vapor se utilizó una válvula de control con intervalo de aplicación comprendido entre 0.6 y 2.4 MPa de Truflo Internacional y un regulador de presión por descarga con un intervalo de trabajo de 0.035 hasta 2.8 MPa de Fairchild Ind. Prod. Co. Además, la instalación dispone de una bomba de vacío Busch modelo R5 que puede generar una presión absoluta de 0.05 kPa y un manómetro Bourdon con intervalo de trabajo comprendido entre –0.1 y 0.15 MPa y con ± 0.001 MPa de incertidumbre, utilizado para la determinación del ELV a 0.15 MPa.
Para asegurar el estado estable, durante el proceso de obtención en continuo de los datos del ELV, el sistema se mantuvo en condiciones de ebullición durante 90 minutos. Después del periodo de recirculación de las fases, muestras de líquido y vapor condensado fueron extraídas en recipientes herméticos externos al ebullómetro. Realizada la toma de muestras, el equipo fue recargado con una pequeña cantidad de uno de los compuestos, para modificar la composición de la mezcla en el interior del equipo, sin detener su funcionamiento. La composición de la fase líquida y de la fase vapor de las muestras contenidas en los recipientes herméticos se determinó al medir sus densidades a 298.15 K. Previamente se determinó una curva de calibración que relaciona la composición con la densidad. Para el sistema acetato de propilo (1) + metanol (2) se obtuvo la relación ρ = 787.0+263.8· x1–364.7· x12 + 294.2· x13–98.0· x14 siendo s(ρ) = 0.2 kg·m–3. Los datos de la bibliografía (Resa y col., 2001) para el citado sistema, se correlacionaron en la misma forma y se obtuvo la regresión ρ = 786.9 + 259.4 · x1 – 351.9 x12 + 280.1 x13 – 92.7 x14 con s(ρ) = 0.2 kg·m–3. En igual manera se procedió con el sistema acetato de propilo (1) + 1–propanol (2) resultando la relación ρ = 799.5 + 119.2 · x1 – 51.0 · x12 + 14.7 · x13 con s(ρ) = 0.05 kg·m–3. También se realizó un idéntico tratamiento matemático a los datos de la literatura (Ortega y col., 2000) para el sistema acetato de propilo (1) + 1–propanol (2) y se obtuvo la relación ρ = 799.5 + 120.2 · x1 – 52.8 · x12 + 15.5 · x13 siendo s(ρ) = 0.05 kg·m–3. La precisión al determinar la composición se estima mejor que 0.002 unidades de fracción molar.
3 Resultados y discusión
Utilizando el ebullómetro de acero inoxidable (Susial y col., 2010a; Susial y col., 2010b) fueron obtenidas, para este trabajo, las presiones de vapor del metanol y del 1–propanol. Los datos piº vs. x1 (Tabla 2) se correlacionaron a la ecuación de Antoine,
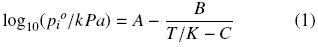
y el procedimiento de Nelder y Mead (1965) fue utilizado. Las constantes obtenidas se presentan en la Tabla 1 junto con los valores de la literatura.
Los datos T–x1–y1 del ELV para los sistemas acetato de propilo (1) + metanol (2) y acetato de propilo (1) + 1–propanol (2) a 0.15 MPa se muestran en la Tabla 3. La consistencia termodinámica de estos datos ha sido verificada al aplicar el test de Van Ness y col. (1973). Los datos de ambos sistemas binarios presentan consistencia positiva global al emplear las propiedades de la bibliografía (Fredenslund y col., 1977; Susial y col., 2011) y las constantes de Antoine informadas en la Tabla 1, ya que la desviación entre los datos experimentales y los valores calculados resultó ser inferior a 0.01 unidades de fracción molar en la fase de vapor (Fredenslund y col., 1977).
3.1 Tratamiento de los datos
Los coeficientes de actividad de la fase líquida en cada sistema, se determinaron utilizando la siguiente ecuación:

Los coeficientes de fugacidad fueron calculados aplicando la ecuación de estado de virial truncada al segundo término, utilizando la expresión:
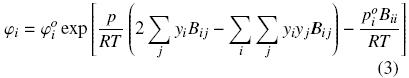
Los segundos coeficientes de virial fueron obtenidos al emplear el método de Hayden y O'Connell (1975). El volumen molar del líquido saturado fue estimado para cada temperatura utilizando la ecuación de Yen y Woods (1966).
Los coeficientes de actividad de la fase líquida, calculados a partir de los datos experimentales del ELV (Tabla 3) como anteriormente se ha indicado y utilizando las propiedades de la literatura (Fredenslund y col., 1977; Susial y col., 2011) junto con las constantes de Antoine de la Tabla 1, muestran una desviación positiva respecto del comportamiento ideal, probablemente como consecuencia de las asociaciones moleculares.
Realizada la comprobación termodinámica de los datos experimentales, los coeficientes de actividad calculados, fueron correlacionados utilizando la energía libre de exceso de Gibbs. De tal modo que, los modelos termodinámicos–matemáticos de Redlich–Kister, Van Laar, Margules, Wilson, NRTL y UNIQUAC, fueron aplicados y las constantes de los modelos, al relacionar GE/RT vs. x1, obtenidas. El método simplex (Nelder y Mead, 1965) fue utilizado, teniendo en cuenta la minimización de la función objetivo (FO) de la siguiente manera (Holmes y Vanwinkle, 1970):

Se han obtenido buenas correlaciones al aplicar los modelos termodinámicos (ver Tabla 4). Las desviaciones resultantes al predecir, con los modelos termodinámicos, la composición de la fase vapor, se pueden considerar suficientemente buenas.
3.2 Correlaciones y predicciones
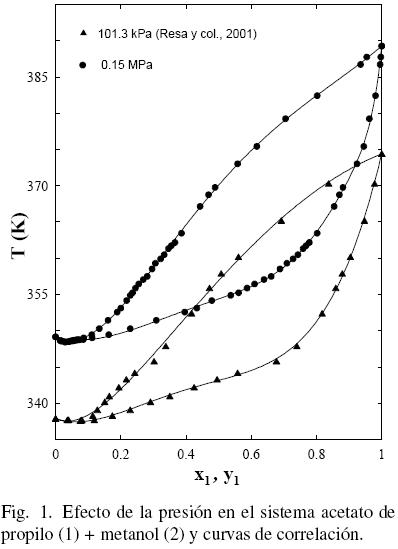
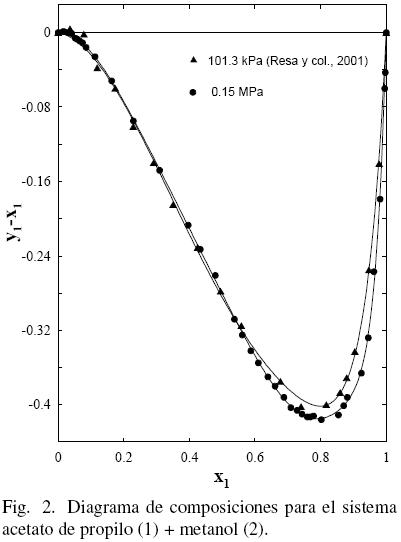
El procedimiento de Nelder y Mead (1965) fue utilizado para realizar el tratamiento de los datos empleando las ecuaciones polinómicas (FF) como en anteriores trabajos (Ortega y col., 000; Susial y col., 2010a; Susial y col., 2010b) y los resultados obtenidos se muestran en la Tabla 5. El mismo proceso fue aplicado a los datos de la literatura (Gmehling y col., 2004; Ortega y col., 2000; Resa y col., 2001) (ver figs. 1–(2–3–4–5)–6). Se puede observar que los datos de este trabajo a 0.15 MPa, para el sistema acetato de propilo (1) + metanol (2), presentan una buena correlación con los datos de Resa y col. (2001) (ver Fig. 1). Sin embargo, aunque el desarrollo de los datos en la Fig. 2 evoluciona de forma similar, no aparecen significativas diferencias, al considerar el efecto de la presión sobre el sistema, en el intervalo 0.1–0.5; tal circunstancia pudiera ser consecuencia de las diferentes incertidumbres en los trabajos experimentales.
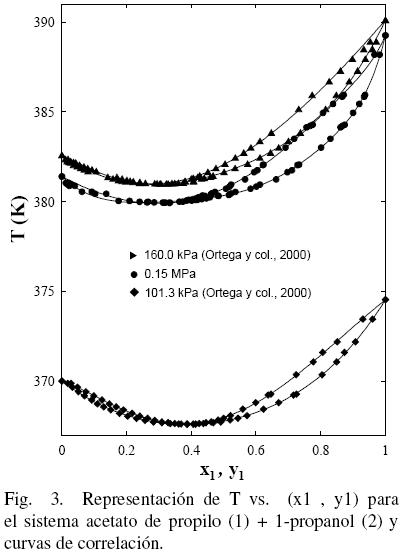
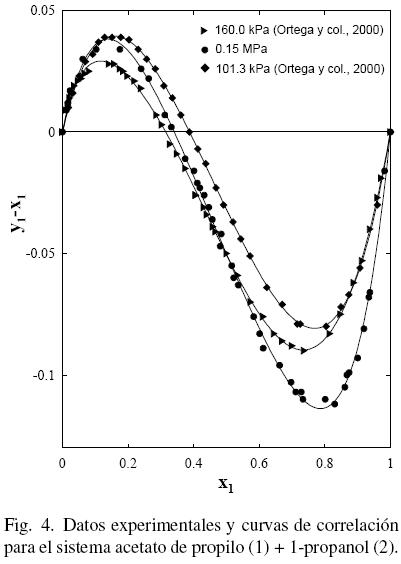
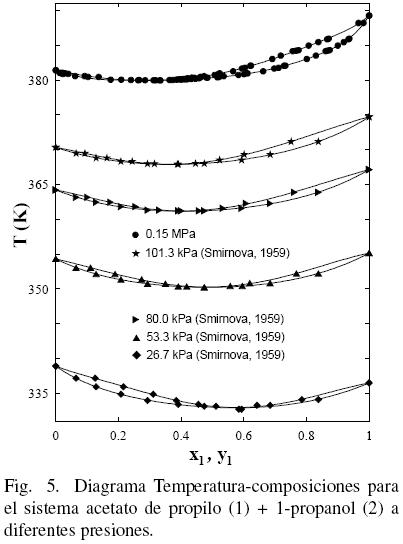
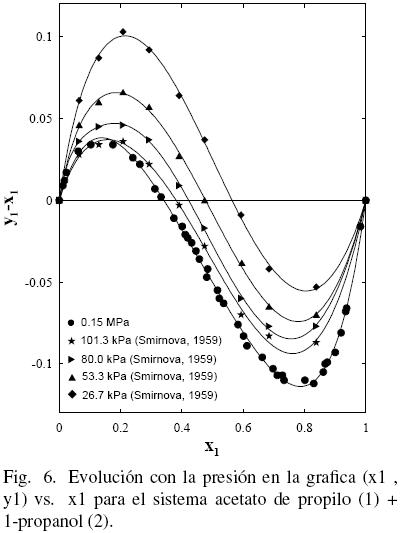
Al considerar los datos del sistema acetato de propilo (1) + 1–propanol (2) de este trabajo junto con los datos de la literatura (Gmehling y Onken, 1986; Ortega y col., 2000), se observa que existe un aparente similar desarrollo entre los datos de este estudio a 0.15 MPa y los bibliográficos (Ortega y col., 2000) (ver Fig. 3); sin embargo, la Fig. 4 muestra que tal evolución no tiene correspondencia. Es el motivo por el cual en grafica diferente, se han representado (figs. 5 y 6) los datos de este trabajo junto con los de N.A. Smirnova (1959) tomados de la bibliografía (Gmehling y Onken, 1986). Se observa la buena correspondencia en el desarrollo del sistema y su simétrica evolución con la presión (Figura 6). Además, la Fig. 5 muestra que al aumentar la presión, a bajas composiciones del acetato de propilo, disminuye la diferencia y1–x1, mientras que el comportamiento se invierte en el lado de altas composiciones del acetato de propilo. Tal comportamiento, similar al presentado en anteriores trabajos (Susial y col., 2010a; Susial y col., 2010b), no se visualiza en la Fig. 3. Consiguientemente la baja pureza, del acetato de propilo utilizado en este trabajo y en la literatura (Ortega y col., 2000; Resa y col., 2001), en todos los casos 99%, pudiera ser el motivo del comportamiento asimétrico y de las notables diferencias que se observan en las figs. 3 y 4.
Los modelos de contribución por grupos UNIFAC (Gmehling y col., 1993; Hansen y col., 1991; Larsen y col., 1987) y ASOG (Kojima y Tochigi, 1979) pueden ser utilizados para el estudio y desarrollo de los procesos de separación de las sustancias, es el motivo por el que los datos experimentales de este trabajo han sido utilizados para verificar la capacidad de predicción de tales modelos. Los resultados globales de las predicciones obtenidos se indican en la Tabla 6. Se observa que UNIFAC–1991 (Hansen y col., 1991) en el sistema acetato de propilo/metanol y ASOG (Kojima y Tochigi, 1979) en el sistema acetato de propilo/1–propanol son los modelos que mejor predicen los coeficientes de actividad de la fase líquida, lo que se evidencia en la desviación media de la composición, expresada como fracción molar del acetato de propilo.
3.3 Resultados azeotrópicos
En este trabajo se han obtenido los puntos azeotrópicos de los sistemas acetato de propilo (1) + metanol (2) a 0.15 MPa y acetato de propilo (1) + 1–propanol a 0.15 MPa. En la Tabla 4 se muestran y comparan con los resultados que predicen los modelos termodinámicos. Se observa que todos los modelos correlacionan y predicen bien el punto singular en ambos sistemas. En similar manera se ha procedido respecto de los modelos de contribución por grupos (ver Tabla 6). Al considerar simultáneamente la composición y temperatura del azeótropo, se evidencia que los modelos UNIFAC–1991 (Hansen y col., 1991) y ASOG (Kojima y Tochigi, 1979) realizan la mejor predicción en ambos sistemas.
Por otro lado, se han utilizado las propiedades reducidas temperatura (Tr) y presión (pr) del acetato de propilo junto con la composición, para graficar los datos azeotrópicos de la bibliografía (Gmehling y col., 2004; Ortega y col., 2000) así como los de este trabajo para el sistema acetato de propilo (1) + 1–propanol (2) (ver Figura 7). Todos los datos antes indicados se han correlacionado como se ha indicado previamente (Susial y col., 2010a; Susial y col., 2010b) resultando simultáneamente, x1 = –1.426 + 1.216 · Tr–1 – 0.003 · log10(pr)2 junto con Tr–1 = 1.085 –0.268 · log10(pr). En la Fig. 7 se han graficado todos los puntos azeotrópicos y sus correlaciones. Se puede observar que el resultado del azeótropo en este trabajo está adecuadamente posicionado con los datos bibliográficos. También en la Fig. 7 se han representado los resultados azeotrópicos del sistema acetato de propilo (1) + metanol (2) de este trabajo y de la literatura (Resa y col., 2001) para verificación de la evolución de los azeótropos del acetato de propilo con la presión y la cadena del alcohol. Parece adivinarse que no serán necesarios importantes incrementos en la presión del sistema para conseguir que desaparezca el azeótropo de la mezcla acetato de propilo (1) + metanol (2); mientras que las curvas de correlación mostradas en la Fig. 7, evidencian que presiones significativamente mayores a la utilizada en este estudio, deberán aplicarse al sistema acetato de propilo (1) + 1–propanol (2) para alcanzar tal finalidad, es decir la desaparición del punto singular de la mezcla.

Conclusiones
Los datos isobáricos del ELV a 0.15 MPa se han medido, para los sistemas binarios de acetato de propilo/metanol y acetato de propilo/1–propanol, utilizando un ebullómetro de acero inoxidable. La consistencia termodinámica de los datos se ha comprobado con el test de punto a punto y los resultados obtenidos muestran concordancia con el criterio de validación de Fredenslund y col. Además, los datos experimentales de este trabajo han sido evaluados respecto de los datos de la bibliografía. Considerando los resultados obtenidos, se puede indicar que los nuevos equipos utilizados en la instalación empleada para la determinación del ELV son fiables.
Por otro lado, varios modelos termodinámicos–matemáticos, así como los modelos de contribución por grupos UNIFAC y ASOG, han sido aplicados sobre los datos experimentales y las predicciones han sido analizadas y discutidas. También se determinó el punto azeotrópico a 0.15 MPa para los sistemas acetato de propilo/metanol y acetato de propilo/1–propanol, y procedió en igual forma estudiando el comportamiento azeotrópico de los sistemas.

Referencias
Fredenslund, A., Gmehling, J. y Rasmussen, P. (1977). Vapor–Liquid Equilibria Using UNIFAC. A Group Contribution Model, Pp. 1116, 72 . Elsevier, Amsterdam. [ Links ]
Gmehling, J., Li, J. y Schiller, M. (1993). A modified UNIFAC model. 2. Present parameter matrix and results for different thermodynamic properties. Industrial and Engineering Chemistry Research 32, 178–193. [ Links ]
Gmehling, J., Menke, J., Krafczyk, J. y Fischer, K. (2004). Azeotropic Data, Part 1., P. 432. Wiley–VCH Verlag, Weinheim, Germany. [ Links ]
Gmehling, J. y Onken, U. (1986). Vapor–Liquid Equilibrium Data Collection, Vol. 1, Part 2, Pp. 543–547. Dechema, Frankfurt, Germany. [ Links ]
Hansen, H.K., Rasmussen, P., Fredenslund, A., Schiller, M. y Gmehling, J. (1991). Vapor–liquid equilibria by UNIFAC group–contribution. 5. Revision and extension. Industrial and Engineering Chemistry Research 30, 2355–2358. [ Links ]
Hayden, J.G. y O'Connell, J.P. (1975). A generalised method for predicting second virial coefficients. Industrial and Engineering Chemistry Process Design and Development 14, 209–216. [ Links ]
Holmes, M.J. y Vanwinkle, M. (1970). Prediction of ternary vapor–liquid. Equilibria from binary data. Industrial and Engineering Chemistry Research 62, 21–31. [ Links ]
Kojima, K. y Tochigi, K. (1979). Prediction of Vapor–Liquid Equilibria by the ASOG Method, Pp. 11–50. Kodansha Ltd., Tokyo, Japan. [ Links ]
Larsen, B.L., Rasmussen, P. y Fredenslund, A. (1987). A modified UNIFAC group–contribution model for prediction of phase equilibria and heats of mixing. Industrial and Engineering Chemistry Research 26, 2274–2286. [ Links ]
Nelder, J. y Mead, R. (1965). A Simplex Method for Function Minimization. Computer Journal 7,308–313. [ Links ]
Orchilles, A.V., Miguel, P.J., Verches, E. y Martínez–Andreu, A. (2007). Isobaric VLE for methylacetate+methanol+1–ethyl–3–methylmidazolium tricloruromethanesulfonate at 100 kPa. Journal ofChemical Engineering Data 52, 915–920. [ Links ]
Ortega, J., González, C., Peña, J. y Galván, S. (2000). Thermodynamic study on binary mixtures of propyl ethanoate and an alkan–1–ol (C2–C4). Isobaric vapor–liquid equilibria and excess properties. Fluid Phase Equilibria 170, 87–111. [ Links ]
Resa, J.M., González, C., Ortiz de Landaluce, S. y Lanz, J. (2001). Vapor–liquid equilibrium of binary mixtures containing methanol + propyl acetate, methanol + isopropyl acetate, vinyl acetate +propyl acetate, and vinyl acetate + isopropyl acetate at 101.3 kPa. Journal of Chemical Engineering Data 46, 1338–1343. [ Links ]
Riddick, J.A., Bunger, W.B. y Sakano, T.K. (1986). Organic Solvents, Pp. 79, 196, 400. Wiley–Interscience, New York. [ Links ]
Smirnova, N.A. (1959). Research onthe vapor–liquid equilibrium in the system n–propyl alcohol–water and n–propyl alcohol–propyl acetate. Vestnik Leningradskogo Universiteta Fizika Khimiya 14, 80–93. [ Links ]
Susial, P., Rios–Santana, R. y Sosa–Rosario, A. (2010a). VLE data of methyl acetate + methanol at 1.0, 3.0 and 7.0 bar with a new ebulliometer. Journal of Chemical Engineering of Japan 43, 650–656. [ Links ]
Susial, P., Rodríguez–Henríquez, J.J., Castillo, V.D., Estupiñan, E.J. y Apolinario, J.C. (2011). VLE measurements and vapor pressures of propyl acetate/ethanol and propyl acetate/2–propanol at 0.15 MPa. Iran Journal of Chemistry and Chemical Engineering (in press). [ Links ]
Susial, P., Sosa–Rosario, A. y Rios–Santana, R. (2010b), Vapor–liquid equilibria for ethyl acetate + methanol at (0.1, 0.5, and 0.7) MPa. Measurements with a new ebulliometer. Journal of Chemical Engineering Data 55, 5701–5706. [ Links ]
Van Ness, H.C., Byer, S.M. y Gibbs, R.E. (1973). Vapor–Liquid Equilibrium: I. An Appraisal of Data Reduction Methods. AIChE Journal 19, 238–244. [ Links ]
Yen, L.C. y Woods, S.S. (1966). A generalized equation for computer calculation of liquid densities. AIChE Journal 12, 95–99. [ Links ]














