Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.3 Ciudad de México dic. 2011
Ingeniería ambiental
Estudio del hinchamiento de hidrogeles acrílicos terpoliméricos en agua y en soluciones acuosas de ión plumboso
Study of acrylic terpolymeric hydrogels swelling in water and aqueous solutions containing lead (II) ions
E. Orozco–Guareño1*, S.L. Hernández1, S. Gómez–Salazar2, E. Mendizábal1 e I. Katime3
1 Departamento de Química del Centro Universitario de Ciencias Exactas e Ingenierías de la Universidad de Guadalajara. Blvd. Marcelino García Barragán 1451, Guadalajara, Jal. 44430, México. * Autor para la correspondencia. E–mail: euguareno@yahoo.com.mx Tel. (52)–(33)31–34–22–22 ext. 7768, 7540
2 Departamento de Ingeniería Química del Centro Universitario de Ciencias Exactas e Ingenierías de la Universidad de Guadalajara. Blvd. Marcelino García Barragán 1451, Guadalajara, Jal. 44430, México.
3 Grupo de Nuevos Materiales y Espectroscopia Supramolecular, Departamento de Química Física, Facultad de Ciencia y Tecnología, Universidad del País Vasco, Campus de Lejona, España.
Recibido 23 de Diciembre 2010.
Aceptado 5 de Septiembre 2011.
Resumen
Se prepararon hidrogeles terpoliméricos usando como monómeros el ácido acrílico, la acrilamida y el ácido 2–acrilamido–2–metil–1–propanosulfónico. Los hidrogeles se sintetizaron mediante polimerización en solución vía radicales libres, utilizando como par redox, soluciones acuosas de persulfato de potasio y de bisulfito de sodio. Como agente entrecruzante se uso el dimetacrilato de etilenglicol en proporciones de 1, 5 y 8% en peso. Se determino la capacidad de hinchamiento de los hidrogeles en agua y en soluciones acuosas con una concentración de 1000 mg L–1 de Pb+2 (a pH de 4.0y 5.0), son una fuerza iónica constante (I = 0.1 M).
Palabras clave: hidrogel, remoción, plomo, ácido acrílico, hinchamiento.
Abstract
Hydrogels were synthetized by radical polymerization using potassium persulfate and sodium bisulfiee as redox initiators, acrylic acid, acrylamide and 2–acrylamido–2–methyl propanesulfonic acid as the monomers, and ethylene glycol dimethacrylate as the crosslinksng agent. The swelling capacity of the hydrogels was determined in both water and aqueous solutions containing lead ions (1000 mg L–1 of Pb+2, at pH values of 4.0 and 5.0, constant ionic strength I= 0.1 M).
Keywords: hydrogel, uptake, lead, acrylic acid, swelling.
1 Introducción
Las actividades industriales generan efluentes que en muchas ocasiones son desechados a la naturaleza sin tratamiento adecuado por lo que, en caso de tener especies contaminantes, éstas pueden llegar hasta cuerpos de aguas naturales (tales como lagos, ríos o mares), afectando el equilibrio ecológico. Entre las especies contaminantes, se encuentran los metales pesados, los cuales en su mayoría son altamente tóxicos aun a bajas concentraciones debido a que pueden acumularse en los seres vivos, causando diversos desordenes y enfermedades. Ejemplos de éstos metales pesados encontrados en aguas, son el plomo, el cadmio y el zinc. Por lo anterior, es necesario el tratamiento de los efluentes que contengan metales pesados para evitar sean vertidos a los cuerpos de agua. La remoción de estos contaminantes metálicos puede ser realizada mediante técnicas convencionales como son: la precipitación química, electroflotación, intercambio iónico y osmosis inversa. Sin embargo, la mayoría de estas técnicas presentan limitaciones, las cuales varían desde baja eficiencia de remoción (e.g., precipitación química), requieren una gran cantidad de energía (e.g., electroflotación), hasta factibilidad de costos (e.g. intercambio iónico) (Kasgöz y col., 2006). En años recientes se han estado realizando estudios de la captación de iones de metales pesados en soluciones acuosas usando hidrogeles poliméricos (Orozco–Guareno y col., 2010; Li y col., 2005; Chauhan y col., 2008; Selva y col., 2009). Los hidrogeles son materiales que poseen características especiales, tales como su alta capacidad de hinchamiento, su permeabilidad al agua y a solutos de tamaño pequeño. Sus propiedades son dependientes de factores como la composición de su formulación (tipo de monomero, cantidad de entrecruzante) y, cuando se aplican en un medio acuoso, dependen del pH, la fuerza iónica y la temperatura. Es por estas razones, que si es ajustada la proporción de sus componentes en su formulación, es posible modificar la interacción del hidrogel con el medio [Allen y col., 1992; Peniche y col., 1994; Franklin y col., 1993; Cohn y col., 1992; Schott, 1992; Welz y col.,1992; Chatterj, 1990]. La interacción con algún soluto metálico es debida a que los hidrogeles poseen en su estructura grupos funcionales tales como: –NH2, –COOH, –OH, –CONH2, –SO3H, etc. [Orozco–Guareno y col., 2010; Quintana y col., 1999].
El objetivo de este trabajo, es reportar la síntesis de hidrogeles terpoliméricos y la caracterización del hinchamiento de estos materiales en soluciones acuosas (con y sin plomo) a valores de pH característicos de aguas de desecho industriales. Se sintetizaron hidrogeles a partir de 3 monómeros: ácido acrílico (AA), acrilamida (AM) y el ácido 2–acrilamido–2–metil–1–propanosulfónico (AMPS), los que proporcionan tres tipos de grupos funcionales; los polímeros fueron entrecruzados con el dimetacrilato del etilenglicol. Se estudió su cinética de hinchamiento por técnicas gravimétricas.
2 Metodología
2.1 Materiales y reactivos
Para la síntesis de los hidrogeles se emplearon como monómeros, acrilamida (AM) proveniente de Bio Rad con una pureza de 99.9%, ácido acrílico anhidro (AA) de Fluka con una pureza de 99% y el ácido 2–acrilamido–2–metil–1–propanosulfónico (AMPS) en solución acuosa al 50%, procedente de Sigma Aldrich. Como agente entrecruzante se utilizó el dimetacrilato del etilenglicol (EGDMA) con una pureza de 98% de marca Sigma–Aldrich. La iniciación se llevó a cabo utilizando una mezcla de compuestos redox, el persulfato de potasio (grado analítico) proveniente de Caledon y el bisulfito de amonio (grado analítico) de la compaña Fermont. Se utilizo hidróxido de potasio (KOH) grado industrial y agua bidestilada electropura. Para las mediciones de pH se utilizó un potenciómetro Hanna Instruments modelo HI 98128. Todas las reacciones de polimerización se llevaron a cabo en un baño de temperatura controlada marca LAUDA modelo E100. Para preparar la solución de plomo se utilizó sal de Nitrato de plomo [Pb(NO3)2] con una pureza mayor al 99% de Fluka.
2.2 Síntesis de los terpolímeros hidrofílicos
Se sintetizaron 6 hidrogeles de diferente composición usando los tres monómeros AA, AMPS y AM. La reacción fue iniciada con un par Redox. Las cantidades de entrecruzante utilizadas fueron de 1, 5 y 8% en peso en base a los monómeros. En la Tabla 1 se muestran la identificación y las composiciones de alimentación de los monómeros. Las muestras fueron clasificadas en 2 grupos identificados con las letras A y B, donde cada grupo tiene la misma relación de monómeros y solo se modifica la cantidad de agente entrecruzante. El grupo A tiene una mayor cantidad de moles de AM que AA y el grupo B tiene una mayor cantidad de moles de AA que AM; en ambos grupos la cantidad de AMPS se mantuvo constante.
Para la síntesis de los hidrogeles, primero se preparo una solución acuosa de los componentes, para ello se disolvieron el AA, el AMPS, la AM y el EGDMA en agua bidestilada. Una vez disueltos los componentes, la solución se neutralizo usando una solución acuosa al 50% en peso de KOH y se mantuvo en refrigeración durante 24 horas. Para llevar a cabo la reacción de polimerización, la mezcla de reacción se coloco en un baño de temperatura controlada a 40° C y luego se agregaron los iniciadores (1% en peso respecto de los monómeros) dejando reaccionar durante 120 minutos. El hidrogel resultante se cortó en cilindros de aproximadamente 0.8 cm de diámetro y 0.3 cm de espesor, los cuales se lavaron varias veces con agua bidestilada para eliminar el monómero y el KOH; la eliminación de éste último se consideró completa hasta que el pH de la solución de los lavados se mantuvo constante e igual al del pH inicial del agua. Después se secaron en una estufa (Lab–line modelo squaroid) a una temperatura de 40° C por 72 horas para obtener el hidrogel seco (xerogel).
2.3 Hinchamiento en agua
La cinética de hinchamiento de los hidrogeles se estudió mediante la técnica gravimétrica, que es la mas utilizada para la cuantificación del agua captada. El peso inicial del xerogel fue registrado y después el xerogel fue sumergido en recipientes conteniendo agua bidestilada a 25°C. A diferentes tiempos se removió el hidrogel del agua, se secó con papel absorbente para retirar el exceso de agua en su superficie y posteriormente se peso en una balanza analítica para determinar la ganancia en peso. Se regresó el hidrogel al recipiente y se repitió el mismo procedimiento. Se determinó la cantidad de agua absorbida por los hidrogeles expresada en porcentaje, usando la ecuación:

Donde:
W es el peso del hidrogel a diferentes tiempos.
W0 es el peso inicial del xerogel.
2.4 Hinchamiento en soluciones de ión Pb+2
La cinética de hinchamiento de los hidrogeles en la solución de ión plumboso se estudió usando el mismo procedimiento que el utilizado para el caso del hinchamiento en agua. Se prepararon soluciones de ión plumboso a partir de una sal de Pb(NO3)2 con una concentración de 1000 mg L–1 de Pb+2 ajustando el pH deseado para cada solución hasta obtener valores de pH de 4.0 y 5.0, estos valores fueron obtenidos agregando ácido nítrico concentrado gota a gota. Las soluciones fueron valoradas para verificar la concentración de plomo utilizando un equipo de absorción atómica marca Analytik–Jena (modelo contrAA 300). Las curvas de calibración se obtuvieron utilizando un estándar de plomo (II) certificado (Varian Instruments, Victoria, Australia).
2.5 Determinación de contenido de plomo
Para determinar la cantidad de plomo retenido por el hidrogel se tomó una muestra de la solución acuosa de plomo antes de introducir el hidrogel en ella y otra al final del proceso de hinchamiento. La cantidad adsorbida de plomo (q) se calculó mediante un balance de masa utilizando las concentraciones de plomo de los estados inicial y final, dado por la siguiente expresión:
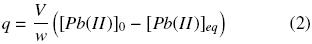
donde:
q = cantidad de plomo adsorbido por gramo de hidrogel en base seca (mg Pb g –1.)
V = volumen de la solución de plomo (L).
[Pb(II)]0 = concentración inicial de plomo en la solución (mg L–1).
[Pb(II)]eq = concentración remanente de plomo en equilibrio en la solución (mg L–1).
w = masa del xerogel (g).
3 Resultados y discusión
Las proporciones de los monómeros se modificaron para que los hidrogeles presenten diferente cantidad de grupos funcionales a lo largo de la cadena polimérica con el objetivo de proporcionar diferentes sitios activos que interactúen con el ion plumboso. De esta forma, el AA proporciona grupos C–OH, el AMPS el grupo –HSO3, mientras que la acrilamida (AM) el grupo –C–NH2. La Tabla 1 muestra las relaciones utilizadas de los monómeros. En esta tabla se puede observar que la proporción de moles de AMPS se mantuvo constante y que se prepararon hidrogeles, unos conteniendo mayor proporción de AM (serie A) y otros con mayor proporción de AA (serie B). Se reportan además la captación (q) del ion Pb+2 y las concentraciones finales de este ion en la solución remanente. Es posible observar que la captación aumenta con el pH. Este fenómeno se debe a que a un valor de pH cercano a la pKa del ácido acrílico (AA), se provoca su desprotonación y esto favorece la captación del ión. Además, con 1 % de entrecruzante los sitios activos a lo largo de la cadena del hidrogel están más expuestos para interaccionar con el Pb+2. En la Fig. 1 se muestra una imagen de los xerogeles los cuales se encuentran en forma de cilindros. Estos cilindros fueron utilizados para las pruebas de hinchamiento.
En la Fig. 2 (a–b) se observa que el hinchamiento máximo se alcanza en todos los casos alrededor de las 30 h y que en ambas series al aumentar la cantidad de agente entrecruzante la capacidad de hinchamiento disminuye, lo cual es de esperarse ya que se forma una red mas cerrada (Katime y col., 2001; Katime, 2004).

En la misma figura tambiín se muestra que al aumentar la proporción de AA (Fig. 2b) se incrementa la capacidad de retención de agua. Esto se debe a que una porción del ácido acrílico se disocia formando una estructura (ion carboxilato) que es mas hidrofílica que la AM. Los hinchamientos obtenidos con los hidrogeles sintetizados en este trabajo presentan un grado de hinchamiento mucho menor que los obtenidos por Orozco–Guareño y col. (2010) con hidrogeles de copolímeros de AA–AM con una composición de 75:25 por ciento en peso, entrecruzados con 1% de EGDMA, los cuales alcanzaron hinchamientos de hasta 70,000 % (Orozco–Guareño y col., 2010). La suma de los porcentajes en peso de AA y AMPS de la muestra B1 es 71.5% (valor cercano a 75%) y la cantidad de agente de entrecruzamiento es 1%, por lo que haciendo una comparación con los resultados de Orozco–Guareño, se obtiene que la substitución de parte del AA por AMPS da como resultado una menor capacidad de hinchamiento. En ese mismo, trabajo se demostró que la acrilamida proporciona al material un carácter menos hidrofílico, que se refleja en una disminución del hinchamiento al aumentar la proporción de AM. Las mismas tendencias de hinchamiento en los hidrogeles se obtuvieron en nuestro estudio.
Los resultados del hinchamiento en una solución acuosa de 1000 mg L–1 de ion Pb+2 como una función del pH, se muestran en las figs. 3 y 4. En estas figuras se observa que en todos los casos se obtiene un hinchamiento máximo mucho menor que el que se obtiene en agua pura. Esto se puede explicar considerando la interacción del ión plumboso con los sitios activos presentes a lo largo de la cadena del hidrogel. La esfera de coordinación del ión plumboso permite la captación del metal, el cual se asocia a los sitios activos (ión carboxilato, amida y sulfónico) de la cadena del hidrogel formando "entrecruzamientos" entre las cadenas, provocando una disminución del hinchamiento, esto es, el ión sirve como un compuesto de atracción que "engancha o ancla" las cadenas, impidiendo su movimiento libre debido a la formación de complejos entre el metal y el hidrogel (Loh y col., 2001;Siyam y col., 1997).


En las figs. 3 y 4 tambiín se observa que al aumentar el pH de la solución se obtiene un menor hinchamiento. Esto se explica ya que la cantidad de ión plomo que se adsorbe al aumentar el pH es mayor (Tabla 1) dando como resultado una mayor formación de complejos entre el metal y el hidrogel (entrecruzamientos). La mayor captación de metales al aumentar el pH es debido a que la cantidad ionizada del ácido carboxílico se incrementa.
Conclusiones
Se obtuvieron hidrogeles terpoliméricos conteniendo varios grupos funcionales usando como monómeros el ácido acrílico, el ácido 2–acrilamido–2–metil–1–propanosulfónico y la acrilamida. La capacidad de hinchamiento fue mayor cuando el AA se encontraba en mayor proporción debido a su carácter más hidrofílico que la AM. El hinchamiento máximo fue disminuido dramáticamente por la presencia del ion Pb+2 debido a la formación de complejos metal–hidrogel. Un aumento en el pH de la solución de plomo también da como resultado una mayor captación del ión plomo y la disminución del hinchamiento máximo. La presencia de grupos AMPS en muestras de hidrogeles provocan un menor hinchamiento en agua en comparación con los hidrogeles que contienen solamente AA/AM.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología por la beca otorgada registro 271977. Al Departamento de Química del CUCEI–Universidad de Guadalajara, por apoyo y financiamiento del proyecto.
Referencias
Allen P. E., Bennett D.J. & Williams, D. (1992). Water in methacrylates. 1. Sorption and desorption properties of Poly(2–hydroxyethyl Methacrylate–co–Glycol dimethacrylate) networks. European Polymer Journal 28, 347–352. [ Links ]
Chatterj Prabha.R. (1990). Interpenetrating hydrogel networks. I. The Gelatin–Polyacrylamide system. Journal of Applied Polymer Science 40, 401–410. [ Links ]
Chauhan Ghanshyam S., Chauhan S., Kumar S., Kumari A. (2008). A study in the adsorption of Fe+2 and NO–3 on Pine needles based hydrogels. Bioresource Technology 99, 6464–6470. [ Links ]
Cohn D., Aronhime M., Abdo B. (1992). Poly(Urethane)–cross–linked Poly(HEMA) Hydrogels. Journal of Macromolecular Science: Pure and Applied Chemistry A29, 841–851. [ Links ]
Franklin V.J., Bright A.M., Tighe B.J. (1993). Hydrogel polymers and ocular spolation processes. Trends Polymer Science 1, 9–16. [ Links ]
Kasgöz Hasine; Kasgöz Ahmet; Sahin Ülkü; Temelli T.Yelda, and Bayat Cuma. (2006). Hydrogels with acid groups for removal of Copper (II) and Lead (II) ions. Polymer–Plastics Technology and Engineering 45(1), 117 – 124. [ Links ]
Katime I., Rodríguez E. (2001). Absorption of metal ions and swelling properties of Poly(Acrylic acid–co–itaconic acid) hydrogels. Journal of Macromolecular Science A38 (5 & 6), 543–558. [ Links ]
Katime Amashta I. (2004). Los Materiales Inteligentes de este milenio: Los hidrogeles macromoleculares. Síntesis, Propiedades y Aplicaciones. Editorial Universidad del País Vasco, España. [ Links ]
Li N., Bai R. (2005). A novel amine–shielded surface cross–linking of Chitosan hydrogel beads for enhanced metal adsorption performance. Industrial and Engineering Chemistry Research 44, 6692–6700. [ Links ]
Loh X.J., Deen G.R., Gan Y.Y., Gan L.H. (2001). Water–sorption and metal–uptake behavior of pH–responsive poly (N–acryloyl–N'–methylpiperazine) gels . Journal of Applied Polymer Science 80 (2), 268–273. [ Links ]
Peniche C., Zaldivar D., Gallardo A., SanRoman J. (1994). Swelling behavior of Hydroxyethylmethacrylate hydrogels modified by copolymerization with furfyl acrylate. Journal of Applied Polymer Science 54, 959–968. [ Links ]
Orozco–Guareno E., Santiago–Gutierrez M.F., Moran J.L., Hernández, S.L., Soto V., De la Cruz W., Manriquez R., and Gomez–Salazar S. (2010). Removal of Cu(II) ions from aqueous streams using Poly(Acrylic acid–co–acrylamide) hydrogels. Journal of Colloid and Interface Science 349, 583–593. [ Links ]
Quintana J. R., Valderruten N. E., and Katime I. (1999). Synthesis and swelling kinetics of Poly(Dimethylaminoethyl acrylate methyl chloride Quaternary–co–Itaconic acid) hydrogels. Langmuir 15(14), 4728–4730. [ Links ]
Schott H.J. (1992). Kinetics of swelling of polymers and their gels. Journal of Pharmaceutical Sciences 81, 467–470. [ Links ]
Selva Cavus and Gulten Gurdag. (2009). Noncompetitive removal of heavy metal ions from aqueous solutions by Poly [2–(Acrylamide)–2–Methyl–1–Propanosulfonic acid–co–Itaconic acid] hydrogels. Industrial and Engineering Chemistry Research 48, 2652–2658. [ Links ]
Siyam T., Youssef H.A., ElNaggar I.M. (1997). Adsorption studies of copper sulfate on hydrogels of poly(amido–amines). Journal of Macromolecular Science–Pure and Applied Chemistry 34 (11), 2379–2388. [ Links ]
Welz M., Ofner C.M. (1992). Examination of self–crosslinked gelatin as a hydrogel for controlled release. Journal of Pharmaceutical Sciences 81, 85–90. [ Links ]














