Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.2 Ciudad de México Ago. 2011
Ingeniería de alimentos
Whiskers de celulosa a partir de residuos agroindustriales de banano: Obtención y caracterización
Cellulose whiskers from agro–industrial banana wastes: Isolation and characterization
G.I. Bolio–López 1*, A. Valadez–González1, L. Veleva2 y A. Andreeva3
1 Unidad de Materiales del CICY, Calle. 43 No.130. Chuburná de Hidalgo, 97200 Mérida, Yucatán, México. *Autora para la correspondencia. E–mail: ivettebl@cicy.mx
2 CINVESTAV–Mérida, Física Aplicada, Carr. Ant. a Progreso, Km.6, Cordemex, 97310 Mérida, Yucatán, México.
3 Sofia University, Faculty of Physics, Department of Physics of Semiconductors, 5 James A Boucher Blvd., SofÃa 1164, Bulgaria.
Recibido 31 de Marzo 2011.
Aceptado 20 de Mayo 2011.
Resumen
Debido al potencial que presentan los whiskers de celulosa (CW) como refuerzo en el diseño, procesamiento y producción de nanobiocompuestos, el objetivo de este estudio fue la obtención de whiskers a partir de residuos agroindustriales de banano (Musa cavendish). La metodología para la obtención de la celulosa incluyó procedimientos químicos, tales como hidrólisis ácida, cloración, extracción alcalina y blanqueamiento. Una doble hidrólisis ácida controlada, (4N HC1 y H2SO4 al 64%) y un proceso de sonificación fueron utilizados para su extracción. El producto final fue caracterizado por Espectroscopía de Infrarrojo (FTIR), Difracción de Rayos–X (XRD), Análisis Termogravimétrico (DTG), Polariscopio y Microscopía de Fuerza Atómica (AFM). Los patrones de difracción de Rayos–X indican una alta cristalinidad, debida a la manera eficiente de disolución de las regiones amorfas (lignina y hemicelulosa) por los tratamientos ácidos. Estos resultados fueron confirmados con los espectros de FTIR. Las micrografías de AFM permitieron evaluar las dimensiones características de los CW, longitud de 200 nm a 1.3μm y diámetro entre 7–70 nm, mostrando una alta relación de aspecto (l/d) para actuar como refuerzo en materiales compuestos, evidenciando el potencial de los desechos agroindustriales del banano como una fuente para la obtención de whiskers de celulosa.
Palabras clave: whiskers, celulosa, hidrólisis ácida, residuos agroindustriales, Musa cavendish.
Abstract
Due of the potential use of ceelulose whiskers (CW) as reinforcement in the design, processing and production of nanobioco mposites, the aim of this study was to obtain whiskers from agro–industrial waste banana (Musa cavendish). The methodology for obtaining cellulose includes conventional chemical methods such as acid hydrolysis, chlorination, alkaline extraction and bleaching. Double acid hydrolysis (4N HC1 and H2SO4 64%) and sonification process were applied for their extraction. The final product was characterized by Infrared Spectroscopy (FTIR), X –ray diffraction (XRD), Th ermal analysis (DTG), Polariscope and Atomic Force Microscopy (AFM). The patterns of X–ray diffraction indicate a high crystallinity, due to efficient dissolution of the amorphous regions (lignin and hemicellulose) by the acid treatments. These results were confirmed by the FTIR spectra. The AFM micrographs allowed to evaluate the characteristic dimensions of the CW, length of 200 nm up to 1.3 μm and diameter between 7 and 70 nm and, showing a high aspect ratio (l/d) to act as reinforcement in composite materials, making evident the potential of banana agro–waste as source for the production of cellulose whiskers (CW).
Keywords: whiskers, cellulose, acid hydrolysis, agro–industrial waste, Musa cavendish.
1 Introducción
La industria bananera produce grandes cantidades de residuos vegetales ya que de la planta solamente se aprovecha el fruto que constituye el 12 % en peso siendo desechado el resto (Zuluaga y col, 2007). Por ejemplo, la producción de banano en México es de aproximadamente 2 millones de toneladas métricas por año, la especie Musa cavendish representa el 75% del total, de ahí que existe un gran volumen de residuos de la industria platanera que podrían ser aprovechados si se los transforma para darles un valor agregado. Estudios previos han mostrado que es factible obtener fibras celulósicas de los residuos agroindustriales del banano (Canché y col, 2005), por lo tanto, estos desechos agrícolas son una atractiva fuente potencial para la obtención de whiskers de celulosa (CW). La celulosa es una cadena lineal con moléculas de anillos de glucosa (C6H10O5) ligada a través de un enlace covalente de oxígeno al Cl de un anillo de glucosa y al C4 del anillo adyacente (Azizi y col, 2005). Múltiples cadenas de celulosa están unidas entre sí por puentes de hidrógeno formando fibrillas de celulosa que tienen regiones desordenadas (amorfas) o altamente ordenadas (cristalinas). Las regiones amorfas de las fibrillas de celulosa pueden ser selectivamente hidrolizadas por ácido, dejando las regiones cristalinas (menos reactivas), de tamaño nanométrico llamados whiskers, nanocristales o nanofibras de celulosa (Beck–Candanedo y col, 2005). Sus módulos de tensión de 145 GPa (Sturcova y col., 2005), son mayores que el Kevlar® (130 GPa).
La hidrólisis ácida es un proceso usado para remover las regiones amorfas. Diversos estudios reportan la identificación y separación de CW de varias fuentes. Ranby (1952), reportó la preparación de whiskers de celulosa de microfibrillas usando hidrólisis ácida. Marchessault y col. (1961), estudiaron la hidrólisis de la quitina nativa mercerizada y celulosa bacterial, usando hidrólisis ácida reportando birrefringencia como patrón de comportamiento de los cristales. El resultado del aislamiento de los CW por hidrólisis con H2SO4 produce cristales con superficies negativamente cargadas, debido a la esterificación de grupos hidroxilos por iones sulfato, formando un sistema coloidal estable de celulosa (Marchessault y col., 1961; Faviery col, 1995; Arakiy col, 1998). Los CW son monocristales muy delgados que ofrecen muchas ventajas como partículas de refuerzo en compuestos de matrices poliméricas ya que tienen una alta relación de aspecto (I/d) (Dufresne, 2006). Poseen también alto grado de perfección cristalina, una alta rigidez y propiedades mecánicas que están en el rango de los materiales típicos de refuerzo y es por ello que tienen resistencias excepcionalmente elevadas. Además de que provienen de una fuente sustentable que es biodegradable y potencialmente ofrecen bajos riesgos ambientales (Lahiji y col., 2008). También tienen la ventaja de tener bajos costos de producción en relación con el metal, la cerámica y el carbón usados en los nanomateriales. Su superficie reactiva facilita los injertos de especies químicas para alcanzar diferentes propiedades de superficie (funcionalización de superficie) (Azizi y col., 2005). La habilidad para modificar químicamente las propiedades de superficie expande el potencial de aplicaciones, permitiendo la dispersión de los CW en un amplio rango de materiales como matrices Orts y col. (2005); Azizi y col. (2005).
En este estudio se explora la posibilidad de darle un valor agregado a los desechos agrícolas del banano, específicamente al raquis (eje del racimo de la planta) y al pseudotallo que constituyen la fracción fibrosa de la planta. Esta fuente residual es rica en celulosa y ha atraído gran interés, debido al uso potencial como componente de refuerzo mediante su conversión a CW en materiales compuestos de alto rendimiento como los nanobiomateriales (Gañan y col., 2004; Faria y col., 2006).
2 Metodología
El material biológico utilizado fue colectado en una finca bananera de la región de la Chontalpa, Tabasco. Posteriormente fue secado al sol y tratado con una solución acuosa de NaOH al 10%, con el objetivo de eliminar ceras, pectinas y resinas. El procedimiento utilizado se describe a continuación: los raquis y pseudotallos fueron cortados a una longitud de 30 cm, con 4 cortes longitudinales, para que la solución de NaOH al 10% penetrara perfectamente en las muestras y permanecieron en esta solución durante 20 minutos después de alcanzar la temperatura de ebullición. Al ser retirados de la solución, se dejaron enfriar y se lavaron con agua corriente, para después desfibrarlas manualmente. Se cortaron las fibras a 2 cm de largo y se secaron en una estufa a una temperatura de 60°C durante 12 horas.
2.1 Obtención de celulosa
La obtención de la celulosa se realizó usando la técnica de pulpeo (Cazaurang y col., 1990), que consta de cuatros pasos: (1) una hidrólisis ácida suave con H2SO4 al 0.4% por una hora, y un lavado posterior; (2) una cloración con NaClO al 3.5%, con agitación continua de la solución en un baño de agua a 30°C hasta alcanzar un pH 9.2, lavado con agua destilada hasta la neutralidad; (3) una extracción alcalina con NaOH al 20% en agitación por 1 hora, seguido por un proceso de lavado; (4) un blanqueo con una solución de NaClO al 0.5%, agitando continuamente por 1 hora y un lavado final hasta pH neutro. Seguidamente el material se desmenuzó y se colocó en una charola de aluminio durante 1 día a temperatura ambiente y posteriormente en una estufa durante 24 horas a 60°C. El material se pesó, para determinar el rendimiento y por último, la celulosa se pulverizó por medio de un molino Brabender, con una malla 0.67 mm.
2.2 Obtención de whiskers de celulosa
A 10 g de celulosa se añadieron 350 mi de una solución de HC1 4N, agitando continuamente durante 225 min a una temperatura de 80°C. Posteriormente se sometió a lavados repetidos con centrifugación (3800 rpm a 4°C por 5 min), hasta alcanzar un pH > 4 necesario para obtener un sobrenandante turbio (Araki y col., 1998), el sobrenandante fue colectado para darle un proceso posterior para la obtención de los CW. Posteriormente a 150 g de la suspensión obtenida en el paso anterior (0.8 % w/w) se le añadieron lentamente 500 mi de ácido sulfúrico al 64%, en un proceso de sonificación de 5 ciclos de 3 min para hacer un total de 15 min en sonificación y en baño de hielo, para evitar que la temperatura se elevara a más de 50°C. Al término de este proceso la suspensión fue diluida en una proporción 1:10, con la finalidad de detener la reacción. La suspensión fue lavada repetidamente con agua destilada y desionizada, y separada por centrifugación (12,500 rpm por 5 min a 4°C), hasta obtener un sobrenadante turbio blanquecino, que fue almacenado para posteriormente ser concentrado en un rotavapor, hasta alcanzar una suspensión coloidal. La suspensión fue almacenada en una cama de resina de intercambio iónico por 48 h y filtrada a través de papel filtro (Whatman 541) con tamaño de poro de 0.45μm y almacenada a 4°C (Edgar y Gray, 2003).
3 Métodos de caracterización
3.1 Espectroscopia de infrarrojo (FTIR)
La caracterización química de las muestras de celulosa y CW se llevó a cabo utilizando la técnica de espectroscopia de infrarrojo con transformada de Fourier (FTIR). Se utilizó un Espectrómetro de infrarrojo FTIR Nicolet Magna Protege 460 en el modo de transmisión, con una resolución de 4 cm–1 y 100 barridos. Las pastillas se prepararon con 1 mg de muestra en 100 mg de KBr.
3.2 Difracción de Rayos–X (XRD)
La determinación de la cristalinidad fue hecha usando difracción de rayos–X, método de polvos (PXRD), utilizando un equipo "Siemens D 5000 Difractometer", espectro de CuKα (α = 1.5418 Å y de energía 8.047 keV).
El porcentaje de cristalinidad de las muestras fue calculado en el análisis de rayos–X por el método desarrollado por Segal y col. (1959) Ec. (1):
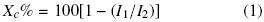
Donde: I1 es la intensidad del pico mínimo y I2 es la intensidad máxima del pico cristalino, respectivamente. El tamaño del cristal fue calculado usando la ecuación de Scherrer Cullity (1978) Ec. (2):

Donde: t es el tamaño de cristal, λ es la longitud de onda de la radiación utilizada (λCu), B es el ancho a la altura media del pico de difracción de la muestra, θ es la posición del pico de difracción y 0.9 es el factor de forma del cristal.
3.3 Microscopía de fuerza atómica (AFM)
La caracterización dimensional de los CW se realizó en un microscopio de fuerza atómica Anfatec Instruments AG, Germany, con una resolución de 0.45 nm en X, Y y 0.078 nm con un área de escaneo de 30 × 30 μm. Se usó una punta con un radio de la curvatura de 10 nm recubierta con nitrito de silicio. Las muestras fueron escaneadas en alrededor de 512 puntos en los ejes X y Y, en cada área de interés.
3.4 Análisis termogravimétrico (TGA)
La estabilidad térmica de las muestras de celulosa y CW fue investigada usando un equipo Perkin Elmer TGA7, USA. Las muestras fueron calentadas de temperatura ambiente hasta 500° C con una rampa de calentamiento de 10°C/min y flujo de nitrógeno de 100 ml/min. Se utilizaron tres muestras para caracterizar cada material.
4 Resultados y discusión
Del raquis y pseudotallo de Musa cavendish se obtuvo 66% de celulosa. Los rendimientos reportados en otros estudios para estos residuos agroindustriales son: 64% (Idicula y col., 2006) y 27% (Canché y col., 2005). En la Fig. 1 (a y b) se muestran fotografías tomadas en un polariscopio lineal para las suspensiones de celulosa y CW. La visualization de ultraestructura de cristalitos (Fig. 1b) puede dar indicios sobre el comportamiento de la suspensión y en suficientemente altas concentraciones es birrefringente, se observaron zonas de contraste en las fases de líquido: cristales ordenados (brillantes) (fase anisótropa) y zonas obscuras (agua) (fase isotrópica), mostrando un marcado flujo de birrefringencia por agitación a la luz del polariscopio, comportamiento similar para la suspensión de CW son reportados por Edgar y Gray (2003) y Araki y col. (1998). En reposo esta suspensión coloidal de CW es aparentemente turbia y estable. Este comportamiento no es observado en la suspensión de celulosa original (Fig. 1a), la cual no muestra los patrones de birrefringencia por agitación a la luz del polariscopio. La cristalografía de rayos–X fue usada para investigar la cristalinidad de las muestras después de los tratamientos. Los difractogramas de la celulosa y de los CW se muestran en las figs. 2 y 3. El porcentaje de cristalinidad de estas muestras fue calculado basado en los análisis de Rayos–X por la Ec. (1) para ambos materiales, donde L se encuentra entre 2θ = 18° y 19° y I2 entre 2θ = 22° y 23°. El pico observado cercano a 2θ = 22.4° es de celulosa Wang y col. (2007), así como los picos a 2θ = 15.4°, 16.2° y 34.6° que son los 4 picos característicos correspondientes a la estructura de la celulosa I (Visakh y col, 2010; Isogai y col., 1989). Para la celulosa la cristalinidad es de 72% debido a que pudiese contener algunos residuos de hemicelulosa que contribuyen ligeramente a una menor cristalinidad que los CW. El tamaño promedio de los cristales de la celulosa obtenidos con la Ec. (2) fue de 4.46 nm (44.6 Å), similar a lo reportado por Chen y Yokochi (2000) para la celulosa extraída del algodón con un tamaño promedio de cristales de 52 Å con un rango de entre 42 y 61 Å. El difractograma de los CW (Fig. 3) muestra una mayor cristalinidad (87.1%) y un tamaño promedio de cristal de 5.21 nm (52.1 Å), la cristalinidad de los CW, es un poco mayor a la reportada por Wang y col. (2007) (81%), pues se observa un pico estrecho característico a 2θ = 22.7°, que puede ser atribuido a los cristales de celulosa, este pico máximo del plano de nanocristales de celulosa se agudiza, indicando una mayor perfección de la red cristalina que la de la celulosa original, tal y como lo reportan Lu y Hsie (2010). La relativa cristalinidad de las muestras se incrementa después de los tratamientos químicos. De acuerdo con las pruebas de rayos–X sobre celulosa, ésta no está formada solo por cristales perfectos. Las moléculas desordenadas de celulosa así como hemicelulosa y lignina son localizadas entre las microfibrillas. Las hemicelulosas se consideran amorfas aunque aparentemente están orientadas en la misma dirección de las fibrillas de celulosa. La lignina es amorfa e isotrópica. Se cree que los cristalitos están conectados uno a otro por zonas amorfas desorientadas (Wang y col., 2007). La naturaleza cristalina de los CW no sólo está influenciada por la conformación de las cadenas sino también por el empaquetamiento de las cadenas adyacentes. Los CW son cadenas de celulosa pura con arreglos de las cadenas de glucosa que difieren a los de la celulosa. Como se puede observar la cristalinidad relativa a las muestras de CW se incrementó después del tratamiento ácido de las fibras de celulosa. El tamaño de los cristales puede aumentar o disminuir por el efecto de los factores que afectan la cristalinidad (fuente, método de extracción y tratamientos posteriores a su extracción). Los cristales de celulosa de acuerdo a varios autores (Alexander 1969; Cullity, 1978), poseen una forma monoclínica, como ya se mencionó. En las muestras analizadas en este estudio se observó un patrón correspondiente a celulosa tipo I, comúnmente encontrada en las fibras vegetales naturales (Isogai y col., 1989), específicamente celulosa tipo Iβ estable con cristales monoclínicos. La Fig. 4 muestra el espectro de infrarrojo de celulosa y CW (celulosa tratada). El espectro correspondiente a la celulosa muestra un pico a 3384 cm–1, el cual es debido a vibraciones de estiramiento característicos de los grupos O–H presentes en la celulosa (Brandrup y col., 1999; Coates, 2000). La intensidad de la banda a 2900 cm–1 es atribuida a vibraciones de estiramiento de los enlaces C–H (Lu y Hsieh, 2010; Asfanas'ev y col., 2007). El pico a 1731 cm–1 se relaciona con los enlaces C = O de cetonas no conjugadas presentes en la hemicelulosa (Morán y col., 2008; Asfanas'ev y col., 2007; Pandey, 1999), mientras los picos en 1631 son asignados a flexión del enlace O–H del agua adsorbida (Dai y Fan, 2010), también pueden identificarse en el estudio de FTIR, bandas cercanas a 3270 cm–1 y 710 cm–1 correspondientes a contribuciones de celulosa Iβ como señalan Boisset y col. (1999) y Lu y Hsieh (2010), que pertenecen a las bandas de estiramiento del enlace O–H y a las flexiones fuera del plano respectivamente. En lo que respecta a los CW se puede observar una disminución en los picos 1631 cm–1 que son asignados al agua adsorbida (H2O). Así mismo, el pico en 1731 cm–1, correspondiente a hemicelulosa desaparece totalmente en la curva de CW, demostrando así que se ha eliminado la hemicelulosa. Un pico débil en 800 cm–1 corresponde tentativamente al estiramiento de los enlaces C–O–S de los CW (Chaidedgumjorn, 2002; Petropavvlovskii y Vasil'eva, 1967) típico de la obtención de CW por hidrólisis con H2S04.




La Fig. 5 nos muestra los termogramas de DTGA (análisis térmico diferencial) para las muestras de celulosa obtenida a partir de residuos agroindustriales de banano y de los CW obtenidos de esta celulosa. La descomposición de la celulosa sigue dos comportamientos: a bajas temperaturas en las que se presenta una descomposición del enlace glucosídico para formar residuos carbonosos y a altas temperaturas en las que se presenta una despolimerización, dando lugar a productos volátiles, comportamiento similar es reportado por Andrade y col. (1998). Los termogramas de celulosa y CW (Fig. 5), se muestran muy diferentes, en el caso de la celulosa se observa una pérdida inicial de peso de aproximadamente 3% a 100°C y esta es atribuida a la pérdida de agua intramolecular, absorbida por estas muestras obtenidas de residuos de banano. Esta pérdida resultó un poco más baja en comparación con la reportada por otros autores, tales como 4.2% (Arceo y col., 2005) para celulosa de Leguminosa unguiculata y 6% (Andrade y col., 1998) para celulosa de fibra de henequén. Una descomposición inicial, en el rango de temperaturas entre 290°C y 370°C, que conlleva a una pérdida de masa de entre el 10 y el 74%, es muy similar a la reportada para la celulosa de henequén Andrade y col. (1998), para celulosa de Leguminosa unguiculata (Arceo y col., 2005); celulosa de algodón (Khattab y col., 1994); celulosa de madera (Nishioska y col., 1998) y para celulosa de lino (Baiardo y col., 2002). Posteriormente se tiene una descomposición más lenta a 400°C, obteniéndose una masa residual de 3.5% a 600°C. La temperatura de descomposición máxima de las muestras de celulosa de este estudio es de 350°C.

La descomposición de los CW de residuos de banano inicia a baja temperatura y muestra dos bien marcados procesos de pirolisis. La suspensión fue lavada hasta la neutralidad y una pequeña cantidad de grupos sulfatos permanece todavía sobre la superficie, tal y como lo reporta Dong y col. (1997) y por lo tanto, la descomposición inicia a bajas temperaturas bajo la acción de los grupos sulfato (Wang y col., 2007). Los whiskers de celulosa son degradados en 2 pasos como se puede observar en la Fig. 5: una descomposición inicial en el rango de temperaturas entre 128oC y 390°C con una pérdida de masa de entre el 12 y el 60%, respectivamente. El rango inicial de descomposición de 128oC de los whiskers de celulosa estudiados es un poco menor de 190oC reportado por Wang y col. (2007), quién obtuvo los whiskers de celulosa a partir de celulosa microcristalina por hidrólisis con una mezcla de ácidos sulfúrico e hidroclorhídrico. Esto puede ser atribuido al proceso final de hidrólisis con H2SO4 con que fueron tratados los whiskers en este estudio y por consiguiente mayor cantidad de grupos sulfato quedaron adheridos a su superficie. Como consecuencia la temperatura inicial de descomposición es menor que las reportadas por los investigadores ya mencionados y obtenidas por otros procesos.
En las Fig. 6 se observa la micrografía de AFM de los CW en suspensión. En ella se observan los diámetros de las fibras entre 7 y 70 nm, con un diámetro promedio de 30.9 nm similar al estimado por Tanaka y Fukui (2004), mientras que el rango de longitudes va de 200 nm a 1.3μm, longitudes similares reportadas por Angles y Dufresne (2000). Estas dimensiones son típicas de muestras de celulosa tratadas con ácidos fuertes (Zuluaga y col., 2007; Azizi y col., 2005; Lai–Kee–Him y col., 2002). Estos parámetros nos permiten inferir que debido a la relación de aspecto (l/d), los CW obtenidos posean potencialmente el efecto de refuerzo en materiales compuestos.

Conclusiones
El aprovechamiento de los desechos agroindustriales del banano Musa cavendish es perfectamente viable para la producción de CW, mediante un tratamiento químico de doble hidrólisis ácida (clorhídrica y sulfúrica) aplicada a las fibras de celulosa. Las características de los CW obtenidos, representan una fuente promisoria en la producción de nanobiomateriales.
Agradecimientos
Dra. Marina Burova, Universidad de Sofia, por su gran apoyo en las pruebas de AFM tan importantes para la determinación de dimensiones en CW.
QFB. Ligia Guadalupe Brito Argáez por su colaboración en la liofilización de los CW.
M.M.P. Javier Iván Cauich Cupul. CICY, por su colaboración en el análisis de Birrefringencia a través del Polariscopio.
M.C. Daniel Aguilar Treviño. CINVESTAV, por su apoyo en el estudio e interpretación de los difractogramas en el análisis XRD.
M.M.P. Verónica Moreno Chulim. CICY, por su asesoría en el uso y manejo del FTIR.
Referencias
Alexander, I.F.E. (1969). X–Ray Diffraction Methods in Polymer Science. John Wiley & sons, Inc. New York, E. U. pp. 198–215, 262–268, 508. [ Links ]
Andrade, C. (1998). Efecto de las condiciones del proceso de obtención de la celulosa sobre sus propiedades fisicoquímicas. Tesis de Licenciatura. Facultad de Ingeniería Química. UADY Mérida, Yucatán México. [ Links ]
Angles, M. y Dufresne, A.(2000). Plasticized starch/tunicin whiskers nanocomposites. Structural analysis. Macromolecules 33, 8344–8353. [ Links ]
Araki J., Wada, M., Kuga, S., Okano, T. (1998). Flow properties of microcrystalline suspension prepared by acid treatment of native cellulose. Colloids and Surfaces A: Physicochemical and Engineering Aspects 142, 75–82. [ Links ]
Arceo, E. (2006). Extracción y caracterización física de celulosa a partir de vainas de la leguminosa Vigna unguiculata L. Walp. Tesis de Maestría. Facultad de Ingeniería Química. Universidad Autónoma de Yucatán. México. [ Links ]
Asfanas'ev, N.I., Prokshin, G. F, Lichutina, T. F, Gusakova, M. A., Vishnyakova, A. P, Surkhov, D. A. y Derkacheva, O. Yu. (2007). Effect of residual lignin on the supramolecular structure of sulfate hardwood cellulose: a Fourier IR study. Macromolecular Chemistry and Polymeric Materials 80(10), 1695–1698. [ Links ]
Azizi Samir, MAS., Alloin, F., Dufresne, A. (2005). Review of recent research into cellulosic whiskers, their properties and their application in nanocomposite field. Biomacromolecules 37, 4313–4313. [ Links ]
Baiardo, M., Frisoni, G. Scandola, M. y Licciardello, A. (2002). Surface chemical modification of natural cellulose fiber. Journal of Applied Polymer Science 83, 38–45. [ Links ]
Beck–Candanedo, M. Roman y D. G. Gray. (2005). Effect of reaction conditions on the properties and behavior of wood cellulose nanocrystal suspensions. Biomacromolecules 6, 1048–1054. [ Links ]
Boisset, C., Chanzy, H., Henrissat, B., Lamed, R, Shohams, J. and Bayer, E. (1999). Digestion of crystallene cellulose substrates by the Clostridium Thermocellum cellulosome: Structural and morphological aspects. Great Britain. Biochemistry Journal 340, 829–835. [ Links ]
Brandup, J. y Immergut, J. (1975). Polymer Handbook. Vol. 1. 4a Ed. John Wiley & Sons. New York, USA pp. 136–144. [ Links ]
Canché, G., De los Santos, J. M., Andrade, S., Gómez, R.. (2005). Production of cellulose from banana plant agricultural waste. Informaciòn Tecnològica 16(1), 83–88. [ Links ]
Cazaurang, M., Peraza, S., Cruz, R. C. A. (1990). Dissolving grade pulps from henequen fiber. Cellulose Chemistry and Technology 24, 629–638. [ Links ]
Chaidedgumjorn, A., Toyoda, H., Rhan, Woo E., Bok, Lee K., Shink, Kim Y.,Toida, T. e Imanari, T. (2002). Effect of (1  3)– and (1
3)– and (1  4)–linkages of fully sulfated polysaccharides on their anticoagulant activity. Carbohydrate Research 337, 925–933. [ Links ]
4)–linkages of fully sulfated polysaccharides on their anticoagulant activity. Carbohydrate Research 337, 925–933. [ Links ]
Chen, H. L. y Yokochi, A. (2000). X–Ray diffractometric study of mycrocrystallite size of naturally colored cotton. Journal of Applied Polymer Science 76, 1466–1471. [ Links ]
Coates, John. (2000). Interpretation of infrared spectra, a practical approach. Encyclopedia of Analytical Chemistry. R. A. Meyers (Ed.) John Wiley & Sons Ltd, Chichester pp. 10815–10837. [ Links ]
Cullity, B.D. (1978). Elements of X–Ray Diffraction, second edition, Addison–Wesley, New York. [ Links ]
Dai, D. y Fan, M. (2010). Characteristic and performance of elementary hemp fiber. Materials Sciences and Applications 1, 336–342. [ Links ]
Dong, X. M., Gray, D. G. (1997). Effect of counterions on ordered phase formation in suspension of charged rodlike cellulose crystallites. Langmuir 13, 2404–2409. [ Links ]
Dufresne, A. (2006). Comparing the mechanical properties of high performances polymer nanocomposites from biological sources. Journal of Nanosciences & Nanotechnology 6, 322–330. [ Links ]
Edgar, C. D. y Gray, D. G. (2003). Smooth model cellulose I surfaces from nanocristal suspensions. Cellulose 10, 299–306. [ Links ]
Faria, H., Cordeiro, N., Belgacem, M.N. y Dufresne, A. (2006) Dwarf Cavendish as a source of natural fibers in poly(propylene)–based composites. Macromolecular Materials and Engineering 291, 16–26. [ Links ]
Favier, V., Chanzy, H. y Cavaillé, J.Y. (1995). Polymer nanocomposites reinforced by cellulose whiskers. Macromolecules 28, 6365 –6367. [ Links ]
Gañán, P., Cruz, J., Garbizu, S., Arbelaiz, A. y Mondragon, I. (2004). Stem and bunch banana fibers from cultivation wastes: Effect of treatments on physicochemical behavior. Journal of Applied Polymer Science 94, 1489–1495 [ Links ]
Idicula, M., Boudenne, A., Umadevi, L., Ibos, L., Candau, Y. y Thomas, S. (2006). Thermophysical properties of natural fiber reinforced polyester composites. Composites Science and Technology 66, 2719–2725. [ Links ]
Isogai, A., Makoto, U., Kato, T., Uryu, T. y Atalla, R. (1989). Solid–state CO/MAS 13C NMR study of cellulose polymorphs. Macromolecules 22, 3168–3172. [ Links ]
Khattab, M.A., Gad, A.M. y Elsamanoudi, A. H. (1994). Effect of ammonium sulphate on the pirolysis and flammability of cotton fabric. Journal of Applied Polymer Science: Applied Polymer Symposium 55, 87–96. [ Links ]
Lahiji, R. R., Reinfenberger, R., Raman, A., Rudie, A. y Moon. R. J. (2008). Characterization of cellulose nanocrystal surfaces by SPM. NSTI–Nanotechnology 2, 704–707. [ Links ]
Lai–Kee–Him, Chanzy, H., Muller, M., Putaux, J.L., Imai, T y Bulone, V. (2002). In vitro versus in vitro cellulose microfibris front plant primary wall synthases: structural differences. Journal of Biological Chemistry 40, 36931–36939. [ Links ]
Lu, P. y Hsieh, Y.L. (2010). Preparation and properties of cellulose nanocrystals: Rod, spheres, and network. Carbohydrate Polymers 82, 329–336. [ Links ]
Marchessault, R. H., Morehead, F. F., Koch, M. J. (1961). Some hydrodynamic properties of neutral suspensions of cellulose crystallites as related to size and shape. Journal of Colloid Science 16, 327–344. [ Links ]
Morán, J. I., Vera, A., Cyras, V.P. y Vázquez, A. (2008). Extraction of cellulose and preparation of nanocellulose from sisal fibers. Cellulose 15, 149–159. [ Links ]
Nishioska, N., Hamabe, S., Murakami, T. y Kitagawa, T. (1998). Thermal decomposition behavior of miscible cellulose/synthetic polymer blend. Journal of Polymer Science 69, 2133–2137. [ Links ]
Orts, W. J., Shey, J., Imam, S.H., Glenn, G. M., Buttman, M. y Revol, J. F. (2005). Application of cellulose microfibrils in polymer nanocomposites. Journal of Polymer and the Environment 13, 301–306. [ Links ]
Pandey, K. K. (1999). A study of chemical structure of soft and hardwood and wood and polymers by FTIR spectroscopy. Journal of Applied Polymer Science 71, 1969–1975. [ Links ]
Petropavvlovskii, G. y Vasil'eva, Q. A. (1967). Characteristics of cellulose sulfates with low degrees of substitution based on infrared spectra in the stretching vibration range of the hydroxyl groups. Zhurnal Prikladnoi Spektroskopii 7(2), 240–243. [ Links ]
Ranby, B.G. (1952) Physico–chemical investigations on bacterial cellulose. Ark. Kemi 4, 249 –257. [ Links ]
Segal, L., Creely, J., Martin, A. y Conrad, C. (1959). An empirical method for estimating the degree of crystallinity of native cellulose using the X–ray diffractometer. Textile Research Journal 29, 786–794. [ Links ]
Sturcova, A., Davies, G. R. y Eichhorn, S. J. (2005). The elastic modulus and stress–transfer properties of tunicate cellulose whiskers. Biomacromolecules 6, 1055–1061. [ Links ]
Tanaka, F. y Fukui, N. (2004). The behavior of cellulose molecules in aqueous environments. Cellulose 11, 33–38. [ Links ]
Visakh, P. M. y Thomas, S. (2010). Preparation of bionanomaterials and their polymer nanocomposites from waste and biomass. Waste Biomass Valor 1, 121–134. [ Links ]
Wang, B., Sain M. y Oskman, K.. (2007). Study of structural morphology of hemp fiber from the micro to the nanoscale. Applied Composite Materials 14, 89–103. [ Links ]
Zuluaga, R., Putaux, J–L., Restrepo, A., Mondragón, I. y Gañán, P. (2007). Cellulose microfibrils from banana farming residues: isolation and characterization. Cellulose 14(6), 585–592. [ Links ]














